ANTECEDENTES
La alergia alimentaria es una reacción patológica del sistema inmunológico provocada por la ingestión de algún antígeno proteico alimentario que el organismo reconoce como "extraño", y desencadena distintos síntomas clínicos de manera reproducible. Las manifestaciones son heterogéneas, pues dependen del órgano afectado, y su gravedad varía de leve a potencialmente mortal.1
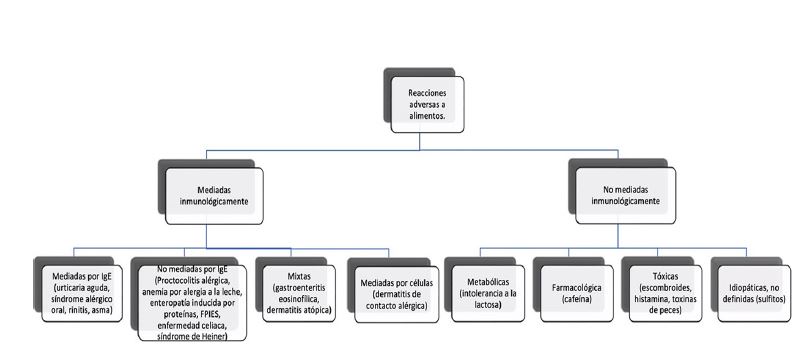
La alergia alimentaria se clasifica de acuerdo con los mecanismos inmunológicos que se activan por la exposición al alérgeno alimentario: 1) mediadas por IgE, 2) no mediadas por IgE y 3) mixtas.1,2 Es importante distinguir la alergia alimentaria de la intolerancia alimentaria, pues la primera es una reacción no inmunológica que puede surgir de alguna alteración metabólica, malabsorción, déficit enzimático, farmacológico o de mecanismo indefinido.3 Figura 1
La alergia alimentaria mediada por IgE provoca síntomas inmediatos ante la exposición. Se origina por la desgranulación de la célula cebada causada por el puenteo de receptores FCCRI sobre su superficie. Esto desencadena la liberación de aminas vasodilatadoras y cascadas proinflamatorias, que pueden afectar cualquier órgano o sistema.2
Los síntomas de la alergia alimentaria no mediada por IgE son subagudos y crónicos. El estudio EuroPrevall, realizado en 2015, incluyó el seguimiento por 18 meses de 12,049 recién nacidos en toda Europa. La incidencia estimada de alergia alimentaria no-IgE a la leche de vaca, comprobada por reto, fue de 0.54%4 y la incidencia ajustada varió del 0.13 al 0.72%.5 No se obtuvieron datos para otros alimentos.4,5
Aún con los avances en el reconocimiento de la alergia alimentaria no mediada por IgE, permanece incierta su prevalencia y fisiopatología. Por tanto, el objetivo de este estudio fue: Revisar la bibliografía actualizada de los cuadros gastrointestinales por alergia alimentaria no mediada por IgE, que resuma la incidencia, fisiopatología, cuadro clínico, diagnóstico y tratamiento.
MÉTODOS
Se realizó una búsqueda en las bases de datos Medline, EMBASE, Scielo, Google Académico y RIMA, empleando las palabras clave: Alergia alimentaria no mediada por IgE (AA no-IgE), protocolitis/proctitis alérgica inducida por proteínas alimentarias (FPIAP); anemia por deficiencia de hierro (ADH); enteropatía inducida por proteínas alimentarias (FPE); síndrome de enterocolitis inducida por proteínas alimentarias (FPIES); enfermedad celíaca (EC) y síndrome de Heiner (SH). La búsqueda se limitó a artículos publicados en inglés y español de enero 2015 a mayo 2024. Se revisaron 92 artículos por los autores, incluyéndose 61. Cada segmento se escribió por un autor y todos los segmentos fueron revisados por cada uno de los autores.
Alergia alimentaria no mediada por IgE
Este grupo incluye procesos inflamatorios subagudos o crónicos que pueden afectar la piel y los pulmones, pero dañan primordialmente el intestino, originando: proctocolitis/proctitis alérgica inducida por proteínas alimentarias (FPIAP); anemia por deficiencia de hierro (ADH); enteropatía inducida por proteínas alimentarias (FPE); síndrome de enterocolitis inducida por proteínas alimentarias (FPIES); enfermedad celíaca (EC) y síndrome de Heiner (SH). Estas afecciones comparten manifestaciones clínicas y hallazgos histológicos con las enfermedades eosinofílicas que conforman la alergia alimentaria mixta.3
La alergia alimentaria no mediada por IgE incluye trastornos por dismotilidad (tránsito muy rápido, muy lento, alterado, retrógrado), asociados con incremento de IL-4 y TNF-α: enfermedad por reflujo gastroesofágico (ERGE), vómito, vaciamiento gástrico retardado, diarrea, intestino irritable y constipación. Otros síntomas inespecíficos asociados son distensión y flatulencia.5-7 El ERGE por alergia alimentaria no responde a los tratamientos antirreflujo, pero sí a la supresión alimentaria. El estreñimiento aparece en el 45% de los pacientes con alergia alimentaria no mediada por IgE, y en la biopsia rectal se visualizan eosinófilos y células cebadas.6
La inmunidad celular e innata intervienen en la patogénesis de la alergia alimentaria no mediada por IgE. El diagnóstico se establece por las manifestaciones clínicas; la endoscopia y la biopsia no se practican de manera rutinaria, pues no modifican el tratamiento. El pronóstico es favorable, porque remiten en la mayoría de los pacientes durante la infancia.8
Proctocolitis-proctitis inducida por proteínas alimentarias
La proctocolitis/proctitis alérgica inducida por proteínas alimentarias es una alergia alimentaria no mediada por IgE que afecta el recto sigmoide, principalmente de lactantes menores de 6 meses alimentados con seno materno o fórmulas lácteas.8
Prevalencia
Un estudio prospectivo que incluyó a 13,019 recién nacidos reportó una prevalencia de 1.6 por cada 1000 niños.9 La incidencia en niños que recibieron seno materno fue del 0.5-1%.8,10
Fisiopatología
Se origina por colitis focal del recto sigmoide, con edema de mucosa, eritema e infiltrado denso de eosinófilos en el epitelio y la lámina propia, que forman abscesos en las criptas (>20-60 eosinófilos/HPF [High-Power Field–magnificación 400×]) y degranulan, erosionando la mucosa superficial, lo que ocasiona sangrado.11 La inflamación favorece la hipertrofia nodular linfoide. Existe actividad reducida del TGF-β en las células epiteliales, e incremento en TNF-α en la lámina propia, lo que debilita el efecto de barrera de la mucosa intestinal, promoviendo la hematoquecia y producción de moco.7,9 Figura 2
La microbiota intestinal en las heces de neonatos con proctocolitis/proctitis alérgica inducida por proteínas alimentarias muestra reducción de IgA secretora, Bacteroides fragilis y Escherichia coli, con abundancia de Klebsiella sp.12 También se ha encontrado incremento de calprotectina y por ultrasonido se ha detectado engrosamiento de la pared del colon sigmoide y aumento de la vascularización, que desaparecen con la dieta de supresión.10
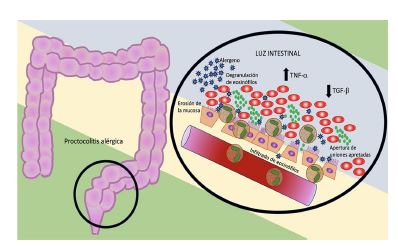
Figura 2 Fisiopatología de la proctocolitis alérgica. La infiltración y degranulación de eosinófilos en el recto sigmoides, estimulada por el alergeno alimentario, favorece la erosión de la mucosa y sangrado hacia la luz intestinal. El incremento en la permeabilidad se debe al aumento de TNF-a y reducción de TGF-b
Cuadro clínico
Se caracteriza por sangre visible en heces (hematoquecia) intermitente, evacuaciones con moco y diarrea en el 30% de los casos. Afecta a lactantes con crecimiento normal que reciben seno materno, fórmula hidrolizada o de soya.9 Los neonatos pueden tener reacciones con alérgenos de la leche materna, leche de vaca, soya, huevo, maíz o trigo. Los síntomas inician entre la primera y octava semanas de vida.10
Diagnóstico
La única prueba diagnóstica es la supresión y reto, que incluye la desaparición de los síntomas al eliminar la ingesta de lácteos o el alérgeno sospechoso en el seno materno (±72 horas) y recaída al reintroducirlo.9 Las pruebas de parche y cutánea no son útiles para el diagnóstico; la colonoscopía se reserva para cuadros graves o persistentes.11 Si la madre suprime el consumo de lácteos, debe recibir suplementos de calcio.9 La reintroducción del alimento por la madre debe realizarse entre cuatro a ocho meses de la eliminación, en casa, llevando un diario minucioso de alimentos.9,10,12 Cuadro 1
Cuadro 1 Criterios diagnósticos para síndrome de enterocolitis inducido por proteínas alimentarias
| Agudo: Requiere un criterio mayor y tres o más menores |
| Criterio mayor: Vómito entre 1 a 4 horas después de la ingesta del alérgeno alimentario |
| Criterios menores: |
| _Segundo episodio de vómitos repetitivos después de la ingesta del alimento desencadenante |
| _Vómitos repetidos entre 1 y 4 h después de ingerir un alimento diferente |
| _Letargo extremo ante cualquier sospecha de reacción |
| _Necesidad de atención en el servicio de Urgencias por cualquier sospecha de reacción |
| _Requerimiento de líquidos por vía intravenosa por cualquier sospecha de reacción |
| _Diarrea por 24 horas |
| _Hipotensión |
| _Hipotermia |
| Crónico: vómitos intermitentes con potencial de provocar vómitos progresivos, con diarrea acuosa debido a la exposición repetida al alérgeno alimentario |
Diagnóstico diferencial
Se ha reportado que sólo el 18% de casos de hematoquecia se asocian con proctocolitis-procritis alérgica inducida por proteínas alimentarias,9 por lo que debe llevarse a cabo la prueba de supresión y reto y establecer el diagnóstico diferencial minucioso con: deglución de sangre materna en el parto, gastroenteritis infecciosa por virus, bacterias o parásitos (GEI); enterocolitis necrosante, intususcepción o invaginación, vólvulo, fisuras anales, deficiencia de vitamina K, trastornos de la coagulación, enfermedad de Hirschprung, sepsis, entre otras.8,10
Tratamiento
Deben restringirse todos los lácteos en la madre que amamanta, y esto será suficiente para tratar la proctocolitis del recién nacido. Si la hematoquecia persiste puede indicarse fórmula extensamente hidrolizada o fórmula elemental.9
Enteropatía inducida por proteínas alimentarias
La enteropatía inducida por proteínas alimentarias es una alergia alimentaria no mediada por IgE que afecta el intestino delgado. Se manifiesta durante la lactancia, es transitoria y desaparece entre 1 y 2 años.13,14 Los lactantes con FPE son asintomáticos mientras reciben seno materno exclusivo.9
Prevalencia
La enteropatía inducida por proteínas alimentarias es poco frecuente; se relaciona con la introducción de fórmulas y alimentos en lactantes. Se encuentra en el 2.2% de los pacientes con alergia a las proteínas de la leche de vaca (APLV), incluso en el 20-40% de niños atópicos.13 La prevalencia se ha reducido con el desarrollo de fórmulas "humanizadas" de leche de vaca y soya. Sin embargo, no se dispone de cifras actuales.15-18
Las proteínas de leche de vaca son los alérgenos causantes, aunque puede relacionarse con soya (11%), trigo (37%), arroz, avena, pescado, carne, huevo y plátano.14,16
Fisiopatología
En la enteropatía inducida por proteínas alimentarias, el yeyuno se infiltra con eosinófilos y células T específicas a alimentos (principalmente la leche de vaca), T CD8+ y γδ-TCR+ intraepiteliales (>25/100 células/HPF), atraídos por moléculas de adhesión del endotelio, que ocasionan daño estructural de la mucosa y atrofia de las vellosidades yeyunales, hiperplasia e inflamación de las criptas, y alteración de la relación vellosidades-criptas,13 que originan malabsorción y retraso en el crecimiento.16,18 La producción local de IgE en la mucosa puede estar implicada en la patogénesis.14,16
Cuadro Clínico
Los síntomas gastrointestinales son variados y se manifiestan en los primeros 9 meses de vida, poco después de introducir alimentos al lactante.15 Aparecen gradualmente y se superponen, pudiendo imitar una gastroenteritis infecciosa complicada por diarrea prolongada, intolerancia a la lactosa, anorexia, vómito, distensión abdominal, edema moderado, dolor abdominal y malabsorción, que origina hipoalbuminemia, deficiencia de vitamina D, esteatorrea, azúcar en heces y deficiencia de vitamina K, llevando a anemia por deficiencia de hierro e hipoproteinemia.13,17,19 La mayoría de los neonatos tiene retraso en el crecimiento.15,17
Diagnóstico
No existen criterios diagnósticos aceptados. El examen físico debe enfocarse en la evaluación de la vía respiratoria y la piel, en busca de otras enfermedades alérgicas. Se analiza la relación temporal con la ingesta del alimento, la gravedad y la historia natural.9,18 La β-lactoglobulina está ausente en la leche humana; por lo tanto, si se detecta indica un origen dietético a través de la ingestión materna de leche de vaca, cabra u oveja.19
El diagnóstico requiere la eliminación estricta de la leche de vaca durante 2 a 4 semanas, seguida de la prueba de reto oral abierto (por sus siglas en inglés OFC), que ocasiona recaída.8,19 Se detecta sangre oculta en heces y se recomienda medir calprotectina fecal para descartar la enfermedad inflamatoria intestinal.18 Las pruebas cutáneas y la determinación de IgE específica en suero resultan negativas y no están justificadas. No existe eosinofilia en sangre periférica ni elevación de IgE total. La endoscopia y la biopsia confirman el diagnóstico. La prueba del parche no está estandarizada, su interpretación es subjetiva y tiene baja sensibilidad.19
El diagnóstico preciso y la orientación nutricional adecuada son fundamentales, pues tanto la exposición como la supresión innecesaria provocan deficiencia de micronutrientes indispensables, como vitamina D, calcio, zinc y selenio.17 El retraso en el tratamiento origina desnutrición proteico-energética y problemas de crecimiento.17,19
Diagnóstico diferencial
Si los síntomas no desaparecen con la dieta de eliminación estricta, se descartarán: enfermedad inflamatoria intestinal, deficiencia congénita de disacaridasa, trastornos metabólicos, inmunodeficiencia primaria, enfermedad renal crónica, negligencia, intolerancia secundaria a la lactosa, síndrome de enterocolitis inducido por proteínas alimentarias crónico, enteropatías autoinmunes, síndromes de displasia epitelial, fibrosis quística, infección crónica, enfermedad celíaca, gastroenteropatías eosinofílicas y sepsis.8,13,17
Tratamiento
Con la dieta de eliminación, los síntomas desaparecen entre 1 y 4 semanas. La reparación de las vellosidades y restitución de las disacaridasas puede tardar, incluso, 18 meses.15,17 Si la leche de vaca es el desencadenante, se ofrecerá una fórmula a base de leche de vaca extensamente hidrolizada o alguna fórmula de arroz hidrolizado; si no existe tolerancia podrá ofrecerse fórmula elemental de aminoácidos.19 La fórmula de soya es una opción, siempre y cuando no haya reacción cruzada con la leche de vaca. Esto ocurre en el 10-30% de los pacientes.19 Si los síntomas persisten, deberá considerarse la eliminación de la soya, el huevo y trigo, con la supervisión de un nutriólogo9. Los lactantes con manifestaciones graves pueden requerir nutrición parenteral parcial.8
La inducción de tolerancia oral se indica como prevención y tratamiento de la alergia alimentaria. La introducción temprana de alimentos alergénicos (huevo y maní) se recomienda a los 6 meses de edad.8,18 La inmunoterapia oral favorece la tolerancia, pero no está estandarizada.19
El reto oral abierto se realiza después de 6 meses de supresión para evaluar si existe tolerancia. Puede llevarse a cabo en casa y documentarse con un diario de síntomas.8,15-19 Además, debe valorarse si existen trastornos en la dinámica familiar: sobreprotección, estrés y ansiedad.17
Anemia por deficiencia de hierro, provocada por alergia a las proteínas de la leche de vaca
Una de las principales causas de anemia en neonatos y niños de 1 a 3 años en Estados Unidos es la deficiencia de hierro, que puede originarse por sangrado crónico intestinal, generalmente imperceptible, debido a la alergia a las proteínas de la leche de vaca.20
Prevalencia
La prevalencia de anemia por deficiencia de hierro varía del 0.9 al 4.4%, dependiendo la raza-etnia y el nivel socioeconómico, pues la ingesta inadecuada de hierro es un factor importante en niños menores de dos años.21
Fisiopatología
Dentro de los mecanismos identificados para padecer anemia por deficiencia de hierro provocada por la leche de vaca se encuentran: bajo contenido de hierro en la leche de vaca, sangre oculta en heces asociada con el consumo de leche de vaca e inhibición de la absorción de hierro no hemo por el calcio y la caseína de la leche de vaca.22 Aunque la anemia por deficiencia de hierro provocada por alergia a las proteínas de la leche de vaca es una manifestación de alergia alimentaria no mediada por IgE, algunos pacientes resultan con pruebas cutáneas positivas, lo que indica alergia alimentaria mixta.5,21
Cuadro Clínico
En la anemia por deficiencia de hierro debida a la alergia a las proteínas de la leche de vaca, el inicio de los síntomas es tardío, por ejemplo: de 5 meses a 3.6 años. El sangrado puede ser evidente (rectocolitis-proctitis inducida por proteínas alimentarias) o crónico, e imperceptible (sangre oculta en heces), por lo que puede tardar semanas en manifestarse.8,22
La enteropatía inducida por proteínas alimentarias, el síndrome de enterocolitis inducido por proteínas alimentarias y el síndrome de Heiner pueden originar síntomas y signos gastrointestinales inespecíficos: regurgitaciones frecuentes, cólicos, diarrea con o sin hematoquezia, estreñimiento, vómito, distensión abdominal, retraso en el crecimiento y edema general.8,23–25 El síndrome de Heiner cursa con síntomas extradigestivos, como hemoptisis, insuficiencia respiratoria y anemia clínica.24,25 También se ha descrito anemia ferropénica resistente a la suplementación por vía oral de hierro como única manifestación.20
Diagnóstico
Se establece con la identificación de anemia microcítica hipocrómica por sangrado crónico en niños con alergia a las proteínas de la leche de vaca. Deben identificarse síntomas respiratorios o cutáneos concurrentes.5 Los pacientes pueden tener hipoalbuminemia, sangre oculta en heces y eosinofilia periférica.20 La respuesta a la supresión de la leche de vaca es lenta. El diagnóstico se confirma, según se requiera, con panendoscopia o colonoscopia, mediante la obtención de múltiples biopsias, que demuestran gastritis y colitis erosiva hemorrágica e hiperplasia linfoide prominente en el íleon terminal y/o colon.5
Tratamiento
Consiste en la supresión absoluta de la ingesta de leche de vaca y sus derivados, tanto en el paciente como en la madre que amamanta; lo que evita complicaciones: hipoventilación alveolar, hemoptisis y anemia severa, garantizando un buen pronóstico.8,23–25 Se prescribe suplemento de hierro (5 mg/kg/día) durante 7 meses.5
En pacientes con edema grave se recomienda infusión de albúmina, y con anemia severa transfusión sanguínea. Las madres que excluyan de su dieta la leche de vaca deberán recibir suplementación con calcio (1 g/d) y vitamina D (400 UI/d).22
Pronóstico
Después de desaparecer el sangrado microscópico y crónico con la dieta de supresión, la sangre oculta en heces resultará negativa. La anemia desaparece en un lapso de 7 meses.5
Síndrome de enterocolitis inducido por proteínas alimentarias
El síndrome de enterocolitis inducido por proteínas alimentarias es una alergia no mediada por IgE. Aparece en pacientes de cualquier edad, con vómitos incoercibles después de 1–4 horas de la ingesta; letargia, palidez, diarrea y deshidratación, que puede resultar en choque. La fisiopatología se desconoce y no existen biomarcadores validados; por tanto, el diagnóstico es clínico.26
Prevalencia
Los datos epidemiológicos acerca del síndrome de enterocolitis inducido por proteínas alimentarias son escasos, debido a la heterogeneidad de los síntomas, la ausencia de biomarcadores y el desconocimiento del mecanismo patogénico.27 La prevalencia mundial varía del 0.006 al 0.51%.28–31 La incidencia acumulada se estima entre el 0.015 y 0.7%.32 En Estados Unidos se ha estimado una prevalencia del 0.51% en niños y 0.22% en adultos.33,34 Los pacientes con síndrome de enterocolitis inducido por proteínas alimentarias tienen mayor riesgo de comorbilidad atópica.30
Etiología
Los alimentos desencadenantes dependen de la región. La leche de vaca es el más común, seguido del huevo. El pescado es frecuente en Europa; mientras que los vegetales y las frutas predominan en Inglaterra, Alemania y Chile.35,36 El 65–80% de los pacientes reaccionan a un solo alimento;30 y 5% hasta a 6 alimentos.35 Los niños con síndrome de enterocolitis inducido por proteínas alimentarias provocado por pescados toleran diferentes especies, lo que sugiere sensibilidad específica;33 mientras que los jóvenes tienen reacción cruzada con frutas y verduras.34 Los niños con respuesta al huevo y la leche de vaca toleran las formas horneadas y fermentadas. No se relaciona la introducción temprana de huevo y cacahuate con el incremento en la incidencia de síndrome de enterocolitis inducido por proteínas alimentarias.34,35
En pacientes con síndrome de enterocolitis inducido por proteínas alimentarias crónico, los alimentos implicados son leche de vaca, soya, leche materna, vegetales, frutas, pescado, huevo, carne y frutos secos.31–33
Fisiopatología
La respuesta es antígeno específico e inicia con la activación de células T. Las concentraciones de IL-6, IL-8, IL-17A, IL-17C, IL-22, TNF-α y CCL-20 se elevan durante la manifestación de los síntomas, incluso 4 horas después. El TNF-α incrementa la permeabilidad gastrointestinal. La activación del sistema inmune innato determina la activación de neutrófilos, eosinófilos, monocitos y células natural killers (NK).5 En el reto, se incrementan las concentraciones de proteína C reactiva, procalcitonina y metabolitos de la vía de las purinas en sangre.33 La adenosina induce la liberación de serotonina de las células enterocromafines del tejido gástrico y duodenal, que activa al nervio vago, ocasionando vómito profuso.5 Los niños que superan el síndrome de enterocolitis inducido por proteínas alimentarias para leche de vaca tienen mayor cantidad de Treg CD4+CD25+ antígeno-específico para proteínas de la leche de vaca.28,29 Figura 3
En pacientes con síndrome de enterocolitis inducido por proteínas alimentarias crónico existe neutrofilia en sangre e infiltración de polimorfonucleares, linfocitos y células plasmáticas en el recto.28,32 En las biopsias de duodeno suele identificarse la expresión de la proteína básica mayor y de la molécula de adhesión celular-1 (VCAM-1) en la lámina propia.35
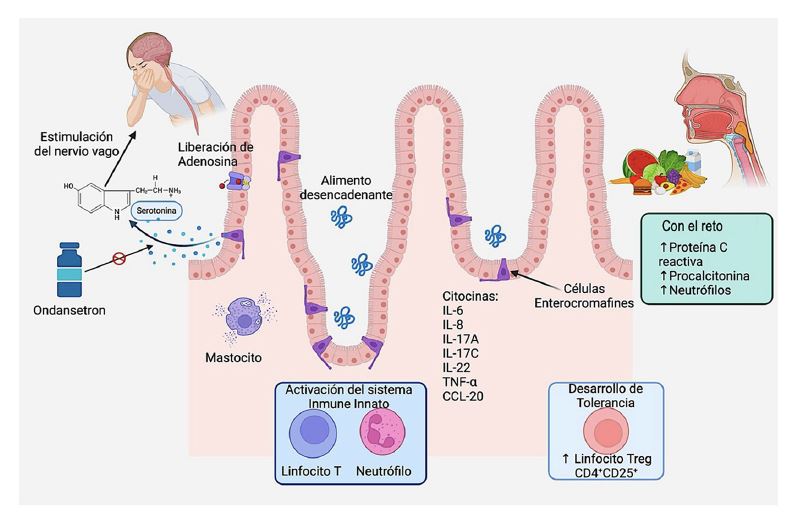
Figura 3 Fisiopatología del síndrome de enterocolitis inducido por proteínas alimentarias. La activación de las células enterocromafines por el alimento desencadenante produce liberación de adenosina y ésta a su vez, de serotonina, que provocan la estimulación del nervio vago para inducir vómito, mecanismo que puede bloquearse con la prescripción de ondansetrón. La prueba de reto por vía oral puede aumentar la concentración de proteína C reactiva, procalcitonina y neutrófilos
Cuadro clínico
Las Guías del Consenso Internacional del 2017 establecieron criterios específicos para el diagnóstico de síndrome de enterocolitis inducido por proteínas alimentarias agudo y crónico; 27 y describieron subtipos adicionales basados en: 1) edad de aparición (temprano y tardío); 2) gravedad (leve a moderado); y 3) coexistencia de IgE (clásico y atípico). 28
La mayoría de los casos padece vómito y diarrea profusos e intermitentes, que pueden conducir a deshidratación, falla en el crecimiento, hipoalbuminemia, metahemoglobinemia y acidosis. 34-36
Síndrome de enterocolitis inducido por proteínas alimentarias crónico en niños
Se caracteriza por vómito crónico y diarrea acuosa debido a la exposición repetida al alérgeno causal, con el potencial de provocar desnutrición y falla en el crecimiento. 28
Síndrome de enterocolitis inducido por proteínas alimentarias neonatal de aparición temprana
Se desconoce su prevalencia. El desencadenante es la leche de vaca y raramente se asocia con el consumo de leche materna. 37 Aparece a las 2 semanas de vida, y tardíamente en neonatos prematuros. 38 Puesto que ocasiona hematoquecia, puede confundirse con enterocolitis necrosante. También puede manifestarse con neumatosis intestinal. 39,40 En cuanto a la fisiopatología, puede haber eosinofilia en la sangre del cordón umbilical, y eosinofilia temprana (<10 días). 41
Síndrome de enterocolitis inducido por proteínas alimentarias agudo en el adulto
La prevalencia en Estados Unidos es del 0.22%, con una tasa de comorbilidades alérgicas del 18.7 al 42.5% para alergia alimentaria mediada por IgE; del 7.1 al 28.1% para dermatitis atópica; 5 al 37.4% para asma, y 31.1 al 64.5% para rinitis alérgica. 32 Los alimentos desencadenantes son: mariscos, huevo, leche de vaca, trigo, vegetales, frutas, cacahuate, frutos secos, avena, picantes y carne. La edad promedio de aparición varía entre los 20 y 40 años. 34 Ocasiona dolor abdominal, diarrea, vómito, palidez, letargia, hipotensión, distensión abdominal y fiebre. 35
Diagnóstico
El diagnóstico de síndrome de enterocolitis inducido por proteínas alimentarias agudo requiere la manifestación de vómito entre 1 a 4 horas después de la ingestión del alérgeno, seguido de 3 o más criterios menores: 1) un segundo episodio de vómitos repetidos después de ingerir el mismo alimento, 2) vómitos repetidos 1 a 4 h después de ingerir algún alimento diferente, 3) letargo extremo, 4) necesidad de acudir al servicio de Urgencias, 5) requerimiento de líquidos por vía intravenosa, 6) diarrea en 24 h, 7) hipotensión, 8) hipotermia. En el síndrome de enterocolitis inducido por proteínas alimentarias atípico, los pacientes tienen sensibilización por IgE al alérgeno alimentario desencadenante en las pruebas cutáneas o en sangre.28,34 El síndrome de enterocolitis inducido por proteínas alimentarias crónico se diagnostica cuando el paciente mejora, con la eliminación del alimento desencadenante, y los síntomas aparecen luego de la reintroducción del alimento.34
Tratamiento
La historia clínica minuciosa identifica el alimento desencadenante. Con la exclusión, el cuadro remite en las primeras 24 horas. Si el alimento implicado es la leche de vaca, se recomiendán fórmulas extensamente hidrolizadas o fórmulas de aminoácidos.27 En pacientes con síndrome de enterocolitis inducido por proteínas alimentarias agudo es primordial la restitución de líquidos y electrolitos por vía endovenosa, con cargas rápidas, vigilando el equilibrio ácido-base. El tratamiento con antagonista del receptor de serotonina 5-HT3, ondansetrón, elimina el vómito incoercible.34 En pacientes con síndrome de enterocolitis inducido por proteínas alimentarias crónico el cuadro tarda más de 10 días en remitir. Deben restituirse las deficiencias alimentarias con un aporte nutricional íntegro.28,30
Pronóstico
La mayoría de los niños, cuyo agente desencadenante es la leche, huevo, soya, arroz, trigo, cacahuate y avena, adquiere tolerancia a los 2-3 años.32 En Polonia se demostró elevada prevalencia de adquisición temprana de tolerancia a la leche de vaca, del 62% al primer año de vida; 87% a los 2 años y 89% a los 3 años;37 mientras que en Estados Unidos se registró el 28% a los 2 años, 53% a los 3, 65% a los 4 y 72% a los 5 años.32 Un estudio en adultos españoles reportó tolerancia en el 16.8%, en promedio a los 6.2 años.35
Enfermedad celiaca
La enfermedad celíaca, o enteropatía por gluten,42 es una enfermedad autoinmune multisistémica, caracterizada por inflamación crónica del intestino delgado, en individuos genéticamente predispuestos, que se exponen al gluten.44,45 El gluten es una proteína del trigo, la cebada y el centeno. Representa el 80-85% de la proteína total del trigo.44
Prevalencia
La enfermedad celíaca puede manifestarse a cualquier edad; sin embargo se ha encontrado mayor prevalencia antes de los 10 años. En Europa y Oriente medio la prevalencia varía de 1:70 a 1:300 casos,43-45 con predominio en mujeres (3:1).43 Se consideran dos picos importantes: en los primeros dos años de vida y en la tercera década de la vida.46-50 Existe un incremento del 1% anual de personas afectadas en todo el mundo.44
La prevalencia de enfermedad celíaca en México se estima del 0.5 al 0.7%, en 800,000 a 1,000,000 de pacientes,42 con seroprevalencia de anticuerpos anti-transglutaminasa tisular (anti-tTG) y anticuerpos antiendomisio (EMA) de 0.59%, asociadas principalmente con HLA-DQ8: lo que resulta similar a la cifra mundial.43 En pacientes con enfermedad celíaca, las células T CD4 específicas para gluten pueden desencadenar otras enfermedades autoinmunes, por ejemplo: diabetes mellitus tipo 1 (6% de niños y 9% de adultos), infertilidad (3.5% de mujeres), colon irritable (3%) y síndrome de Williams-Beuren (23% de niños); incluso se ha informado artritis idiopática juvenil, hepatopatías autoinmunes, hemosiderosis pulmonar, psoriasis, dermatitis herpetiforme, entre otras. La enfermedad celíaca también aparece en familiares de primero y segundo grados.51,52
La susceptibilidad genética por HLA-DQ2 (heterodimero DQA1*0501/DQB1*201) se expresa en el 95% de los casos y el HLA-DQ8 (heterodimero HLA-DQB1*0302) en el 5%.45 Sin embargo, estos alelos pueden identificarse en el 40% de la población sana.47
Fisiopatología
El gluten contiene dos proteínas: la gliadina (prolamina) y glutenina; las prolaminas en la cebada son hordelnas; en el centeno: secalinas, y en avena: aveninas.47-55
Estos péptidos, con abundante concentración en prolaminas, se acumulan en el intestino delgado.49,54 Al degradarse forman péptidos inmunogénicos que atraviesan el epitelio, y son reconocidos por linfocitos T CD4+ anti-gliadina (anti TGI), en el contexto de las células presentadoras de antígeno (CPA) con HLA-DQ2 o HLA-DQ8.52-55 Y posteriormente se activa la respuesta inmune adaptativa por CD4+Th1 y innata por linfocitos intraepiteliales.53-55 Se liberan citocinas proinflamatorias (INF-γ), metaloproteinasas y otros mediadores que inducen hiperplasia de las criptas, atrofia de las vellosidades, infiltración de células inflamatorias en la lámina propia y el epitelio (Figura 4).52-54 El incremento de IL-15 en los enterocitos activa a los linfocitos intraepiteliales tipo NK, con acción citotóxica,53 que destruye las células epiteliales intestinales y aumenta la permeabilidad, lo que provoca diarrea, distensión, y dolor abdominal.54
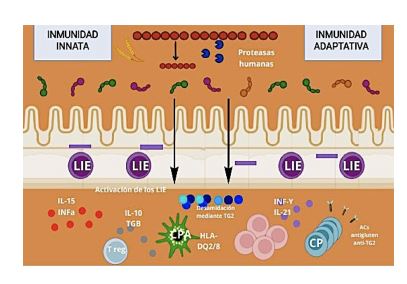
Figura 4 Fisiopatología de la enfermedad celíaca. En pacientes con enfermedad celiaca existen alteraciones de la respuesta inmune innata y adaptativa. Inmunidad Innata: IL15 activa linfocitos intraepiteliales (LIE) y las células NK; Inmunidad tardía: CD4+ expresa citocinas pro-inflamatorias e INF-y; CPA: célula presentadora de antígeno; CP: célula plasmática. Adaptado: Revista Microbiota y Enfermedad Celíaca.
Cuadro clínico
Los síntomas en pacientes con enfermedad celiaca varían de uno a otro caso.49 La manifestación puede ser intestinal, extraintestinal, o combinada.55
La forma intestinal es más frecuente en niños. En menores de tres años provoca diarrea, pérdida de apetito, distensión abdominal y retraso en el crecimiento.50 Los niños mayores y los adultos manifiestan diarrea, inflamación, estreñimiento, dolor abdominal y pérdida de peso.51
Cuadros extraintestinales
Aparecen en el 40% de los casos, con anemia microcítica por deficiencia de hierro y malabsorción; o anemia macrocítica por deficiencia de ácido fólico y/o vitamina B12.50 La osteopenia u osteoporosis afectan al 70%, y se originan por malabsorción de calcio y vitamina D3.51 En los niños existe retraso del crecimiento, defectos del esmalte dental, estomatitis aftosa (20%)50 e hipertransaminasemia (40-50%) por translocación de antígenos bacterianos al hígado, derivados del aumento de la permeabilidad intestinal.51 Puede ocurrir menarquía tardía, amenorrea, aborto espontáneo recurrente, parto prematuro, menopausia temprana y cambios en la concentración y movilidad de los espermatozoides.52 Los síntomas neurológicos incluyen: migraña, parestesia, neuroinflamación, ansiedad y depresión. La ataxia del gluten es una idiopática, relacionada con serología celíaca positiva, que disminuye con la dieta libre de gluten.46,51
Enfermedad celíaca resistente al tratamiento
Se diagnostica en pacientes mayores de 50 años, y rara vez en jóvenes. La incidencia varía del 0.04 a 1.5%. Provoca síntomas persistentes y malabsorción, aun con la dieta libre de gluten durante 12 meses o más.55
Diagnóstico
Debe llevarse a cabo la anamnesis minuciosa, con exploración física completa. Se sugiere el algoritmo diagnóstico (Figura 5) mediante la determinación de antitTG IgA, y en niños menores de dos años determinar la concentración de anticuerpos IgG antigliadina deaminada (anti DGP) y anticuerpos antiendomisio (EMA).51 Las pruebas séricas pueden dar un resultado falso negativo en: deficiencia selectiva de IgA, dieta libre de gluten y consumo de inmunosupresores; por tanto, no debe suspenderse la ingesta de gluten mínimo cuatro semanas antes de llevar a cabo los estudios de laboratorio. En caso de tener un familiar afectado, se sugiere realizar el tamizaje.51 La deficiencia selectiva de IgA incrementa 10 a 20 veces la probabilidad de padecer enfermedad celiaca.53 Las guías de enfermedad celiaca de 2020 para niños indican que la determinación de IgA-tTG con títulos 10 veces mayores del límite superior normal, e IgA-EMA positivo, confirman el diagnóstico de la enfermedad.50
La endoscopia con obtención de biopsia intestinal está indicada o existen títulos de IgA-tTG 10 veces por arriba del límite superior normal. No se recomienda la endoscopia de control después de iniciar la dieta libre de gluten.49
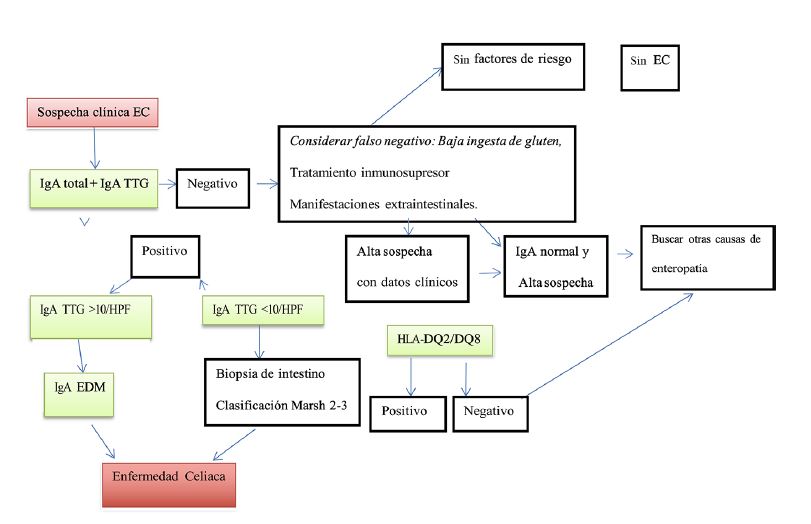
Figura 5 Algoritmo diagnóstico para enfermedad celiaca en niños, adolescentes y adultos. EC: enfermedad celíaca; IgA tTG: anticuerpo IgA anti-transglutaminasa tisular; IgA EDM: anticuerpos IgA vs endomisio. Modificado de: Husby S, et al. J Pediatr Gastroenterol Nutr. 2020;70 (1):141-56.47
Enfermedad celíaca del adulto
El diagnóstico de enfermedad celiaca en pacientes adultos requiere cuatro criterios: 1) manifestación de los síntomas, 2) identificación de HLA DQ2/DQ8, 3) serología positiva y 4) características histológicas de las biopsias duodenales (clasificación de Marsh).54,55 La malabsorción con diarrea crónica, pérdida de peso y astenia son excepcionales, pero pueden provocar caquexia, sarcopenia, hipoalbuminemia y alteraciones electrolíticas.53
Tratamiento
El tratamiento y seguimiento se llevan a cabo con un equipo multidisciplinario, e incluye vigilancia de los síntomas extraintestinales y determinación de los valores de hemoglobina, aminotransferasas, hierro, vitaminas D y B12 y perfil tiroideo.53 El nutriólogo deberá diseñar la dieta libre de gluten. En pacientes con apego al tratamiento disminuyen los síntomas luego de seis meses y reportan resultados negativos de anticuerpos a los dos años.39,54 La contaminación de alimentos con gluten es frecuente. Los productos empaquetados libres de gluten deben contener menos de 20 ppm.43 Pueden requerirse suplementos con multivitamínicos, además de hierro libre de gluten.44 También puede haber intolerancia a la lactosa por atrofia de las vellosidades en forma transitoria. En pacientes con distensión abdominal o diarrea, aun con la dieta libre de gluten estricta, se sugiere indicar una dieta sin lactosa mientras desaparecen los síntomas.46
Los corticosteroides (budesonida o prednisona) se prescriben en pacientes con enfermedad celiaca resistente al tratamiento convencional.43 En los casos graves deberá considerarse el ingreso hospitalario, hidratación por vía intravenosa, corrección electrolítica y dieta libre de gluten.55
Pronóstico
Dependerá del apego a la dieta libre de gluten, que se favorece con el empoderamiento del paciente. Esto incluye: definir qué es el gluten y conocimiento de la enfermedad celíaca, qué alimentos y empacados lo contienen, adecuada lectura y compresión de etiquetas, identificar gluten oculto y contaminación cruzada, y apego al tratamiento. La enfermedad celíaca es incurable, y el apego al tratamiento será de por vida.49
Síndrome de Heiner
El síndrome de Heiner, o hemosiderosis pulmonar inducida por la leche de vaca, es una alergia alimentaria no mediada por IgE que afecta el tejido linfoide asociado con los bronquios de neonatos y niños pequeños, causando disfunción crónica del conducto respiratorio.24 Esta enfermedad fue definida por Heiner, quien evaluó siete pacientes con cuadro clínico de tos crónica, taquipnea, sibilancias, estertores, fiebre recurrente, retraso en el crecimiento, antecedentes familiares de alergia a las proteínas de la leche de vaca,24,25 hemoptisis por hemorragia pulmonar y anemia por deficiencia de hierro.56,57
Etiología
El síndrome de Heiner puede originarse por leche de vaca homogeneizada, en neonatos alimentados con fórmula; o por otras proteínas alimentarias en niños mayores (soya, huevo, cerdo, trigo y maní).24,58
Fisiopatología
El mecanismo inmunológico se desconoce. Es factible que participe la hipersensibilidad tipo III y IV;24,59 aunque también la aspiración de leche en pacientes con algún mecanismo de deglución descoordinado o con reflujo gastroesofágico puede tener un papel concurrente.60
Se ha propuesto que el exceso de antígeno en las proteínas de leche de vaca provoca la formación de complejos inmunes IgG, lo que permite la fijación del complemento, formando depósitos visibles por inmunofluorescencia.59 Los complejos circulantes se alojan en las vénulas poscapilares del pulmón, formando infiltrados irregulares que generan vasculitis, atrayendo linfocitos y monocitos a la zona.60 Aunque el síndrome de Heiner constituye una alergia alimentaria no mediada por IgE, puede exacerbarse por hipersensibilidad tipo I concomitante (alergia alimentaria mixta).5
En aspirados bronquiales o lavados gástricos pueden identificarse macrófagos con alta cantidad de hierro (teñidos con azul de Prusia) y acumulación anormal de hemosiderina en las biopsias de pulmón.24
Cuadro clínico
El inicio ocurre entre el primero y los 48 meses de edad (rango 5 días a 5 años). Los pacientes suelen tener antecedentes familiares de atopia. La historia médica es inespecífica. Los síntomas respiratorios incluyen: tos persistente, disnea, taquipnea, sibilancias, producción de esputo y estertores.60 Se ha reportado neumonía resistente a los antibióticos.24 Puede haber fiebre intermitente, anorexia progresiva y retraso en el crecimiento.57 En 50% de los casos hay vómito o diarrea, hipertrofia del tejido linfoide con hepatomegalia, esplenomegalia y crecimiento de adenoides.61 Es raro encontrar rinitis crónica, otitis media recurrente, hemoptisis episódicas, y síntomas gastrointestinales. Los exámenes de laboratorio informan anemia grave por deficiencia de hierro, eosinofilia y marcadores inflamatorios elevados.60
La enfermedad puede complicarse con afectación cardiopulmonar: hipoventilación alveolar, hemorragia pulmonar aguda masiva, hipertensión pulmonar y cor pulmonale; o con problemas nefrológicos como glomerulonefritis semilunar.60 La hemoptisis episódica, por hemorragia pulmonar con episodios repetidos de sangrado intraalveolar, evoluciona a fibrosis pulmonar y anemia severa.61 En las radiografías de tórax se observan áreas de atelectasia, consolidación, opacidades reticulares, engrosamiento pleural y/o linfadenopatía hiliar.24
Diagnóstico
Se establece con tres criterios para conclusión convincente. El diagnóstico de síndrome de Heiner es similar al de pacientes con: A) síntomas pulmonares e infiltrados en la radiografía de tórax o hemosiderosis pulmonar; B) curación después del retiro de la leche; y C) recurrencia después de la reintroducción de leche. Por tanto, se habla de enfermedad probable si existe (A) + (B), y enfermedad convincente con (A) + (B) + (C).60
La mayoría de los pacientes con síndrome de Heiner tiene precipitinas positivas en la leche,59 pero debido a que se identifican en el 1% de los niños sanos y en el 4 al 6% de niños con trastornos crónicos, por ejemplo: enfermedad celíaca, síndrome de Down, fibrosis quística, síndrome de Wiskott-Aldrich, deficiencia de IgA y síndrome de Hurler, no se consideran en los nuevos criterios diagnósticos.60
Diagnóstico diferencial
El síndrome de Heiner provoca síntomas y signos de enfermedad respiratoria crónica; por tanto, debe establecerse el diagnóstico diferencial con neumonía por aspiración, infecciones agudas y crónicas de la vía respiratoria inferior, micosis, inmunodeficiencias, fibrosis quística, tuberculosis, asma, aspiración crónica, neumonitis por hipersensibilidad y HPI.58 Tanto la HPI como el síndrome de Heiner pueden ocasionar anemia, tos, disnea, retraso del crecimiento y episodios recurrentes de hemoptisis.61
Tratamiento
El cuadro remite al suspender el consumo de leche de vaca. El diagnóstico temprano previene las secuelas (fibrosis pulmonar) y aumenta la tasa de supervivencia.60
El tratamiento incluye la eliminación de la leche de vaca por completo y medidas de apoyo: transfusiones de sangre y soporte respiratorio. En la mayoría de los casos, la eliminación de la leche de vaca disminuirá los síntomas.24 Algunos niños muestran tolerancia espontánea a la leche pasteurizada o hervida.60 La mayoría se cura del síndrome de Heiner en pocos años, pero quienes muestran resistencia al tratamiento requieren la prescripción de corticosteroides9 e inmunomoduladores (rituximab).60
CONCLUSIONES
La alergia alimentaria no mediada por IgE incluye un amplio espectro de enfermedades con síntomas, fisiopatología y métodos diagnósticos variados. Puesto que carecen de biomarcadores, se requiere un alto índice de sospecha para identificarlas. La historia clínica, semiología de los síntomas y cuadro clínico son decisivos para establecer el diagnóstico certero. Los pacientes con este tipo de enfermedades requieren la suspensión del alérgeno alimentario causal, con la intención de curar la hipersensibilidad. El diagnóstico oportuno y adecuado evitará las secuelas y el pronóstico será favorable, lográndose una buena calidad de vida en la mayoría de los pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)