Introducción
La candidiasis mucocutánea crónica (CMC), asociada con autoinmunidad o displasia ectodérmica (APECED, autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy), también conocida como síndrome poliglandular autoinmune tipo 1, es una enfermedad monogénica autosómica recesiva originada por variantes patogénicas bialélicas en el gen regulador de autoinmunidad (AIRE, autoimmune regulator). Su asociación con APECED se describió en cinco pacientes en 1997.1,2
Se encuentra tanto en el grupo IVb como en el grupo X de la clasificación de los errores innatos de la inmunidad (EII) y está caracterizada por la triada de CMC, hipoparatiroidismo crónico e insuficiencia suprarrenal.3 Los síntomas suelen iniciar en la infancia, el diagnóstico se establece con la presencia de dos de los tres componentes clásicos (CMC, hipoparatiroidismo e insuficiencia suprarrenal), incluso la presencia de uno de ellos es suficiente para el diagnóstico, cuando un hermano está afectado previamente.4
El 80 a 90 % de casos de APECED se han descrito en Finlandia, Cerdeña y judíos iraníes. Predomina en mujeres (relación mujer/hombre 1.5-2.4:1), la edad de inicio de síntomas es entre los 8-14 años, se diagnostica de los 17-20 años y la consanguidad se demuestra en 25 a 50 % de los casos. La CMC se presenta en 80 a 90 % de casos, el hipoparatiroidismo en 70 a 80 % y la insuficiencia suprarrenal en 50 a 60 .5,6 La diversidad en las manifestaciones clínicas está mediada por la presencia de autoanticuerpos contra diferentes órganos endocrinos y no endocrinos por lo que los pacientes pueden cursar con hipogonadismo hipergonadotrópico, diabetes tipo 1, tiroiditis autoinmune o disfunción hipofisiaria. Existen manifestaciones menores como: gastritis crónica, hepatitis autoinmune, hipoplasia del esmalte (85.7 %), vitíligo (37.1 %), queratoconjuntivitis (28.6 %), distrofia ungueal (17.1 %), hipertensión arterial de inicio temprano (17.1 %), asplenia (8.6 %) y nefritis tubulointersticial (5.7 %), menos frecuententemente alopecia (17.1 %) y urticaria, neumonitis y disfunción intestinal en 5 a 20 %.7,8,9,10,11,12,13
Presentamos el primer caso de una paciente pediátrica con APECED detectada a través de las tecnologías de secuenciación de nueva generación en México.
Reporte de caso
Niña de 7 años, hija de padres de ascendencia rumana, en quienes se documentó consanguinedad; tiene dos hermanas de uno y nueve años de edad aparentemente sanas y dos tíos paternos con espondilitis anquilosante.
De cinco a siete eventos por año, presentó infecciones respiratorias recurrentes febriles los dos primeros años de vida, y un absceso ungueal recurrente de mano derecha a los dos, tres y cuatro años. Además, candidiasis oral recurrente, úlceras orales y lengua geográfica en uno a dos episodios por año desde los dos años hasta hoy, mejora mientras recibe nistatina oral. Hasta entonces, es talla normal y con peso dentro del percentil de 5 a 10 para la edad.
A los siete años, presentó candidiasis oral, disentería, deshidratación grave y choque hipovolémico. Se documentó neutropenia. Se aisló Shigella spp., Giardia lamblia e Hymenolepis nana. Se trató con cefotaxima, metronidazol y nistatina. Por persistir con evacuaciones con sangre macroscópica, se buscó y detectó cinco días después toxina A y B de Clostridium difficile; a través de una colonoscopia, se observó colitis pseudomembranosa y la mucosa colónica ulcerada, en los estudios histopatológicos se observó fusión de criptas, ausencia focal de células caliciformes, infiltración de neutrófilos con destrucción del epitelio glandular, infiltrado linfoplasmocitario (Figura 1). Recibió tratamiento con vancomicina por 7 días con resolución de la sintomatología.
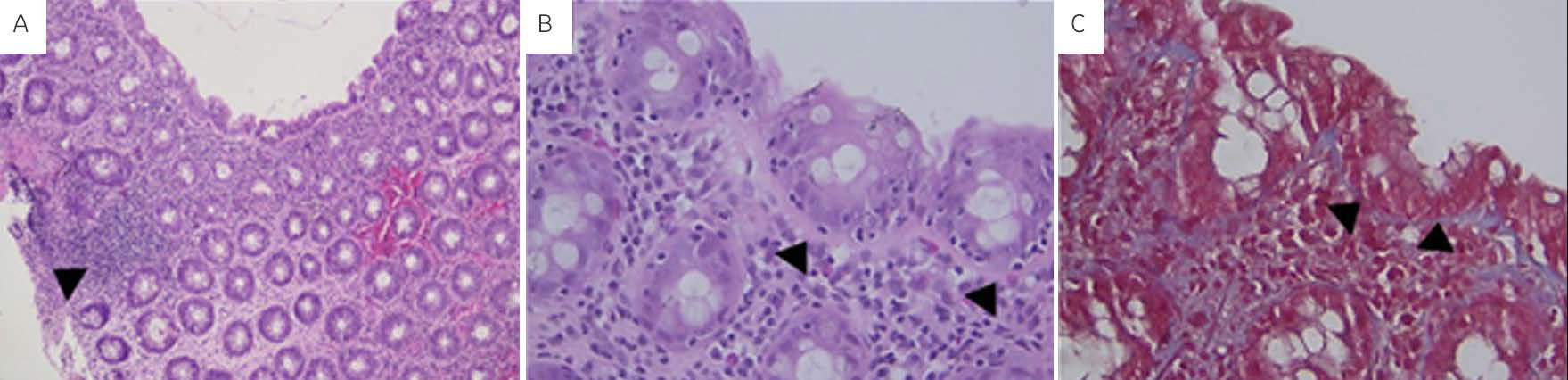
Figura 1 Diferentes cortes histológicos de colon. A) Fotomicrografía que muestra infiltrado inflamatorio interglandular de tipo crónico (aumento 4×). B) Fotomicrografía que muestra la presencia de membrana basal (puntas de flecha) menor de 10 micras (aumento 40x). C) Fotomicrografía (aumento 40×) que muestra tinción de Masson que hace evidente la membrana basal (punta de la flecha).
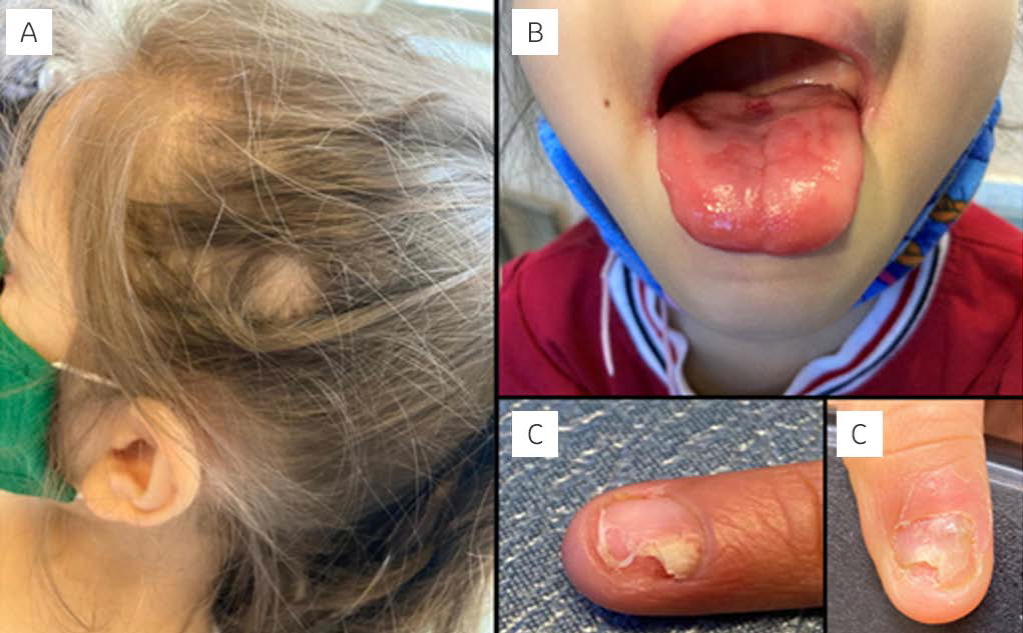
Cinco meses después presentó palidez generalizada, ataque al estado general y fiebre durante dos días; al haber estado en contacto con su madre, quien padeció de la COVID-19, recibió tratamiento a base de azitromicina e ivermectina, con adecuada respuesta. Cuatro semanas después ingresó a urgencias por cefalea, astenia y adinamia; la exploración física mostró alopecia areata (Figura 2A), lengua geográfica (Figura 2B), distrofia ungueal (Figura 2C), úlcera oral y perianal. La biometría hemática resultó con pancitopenia (anemia macrocítica, neutropenia y trombocitopenia), sin embargo, el aspirado de médula ósea fue normal.
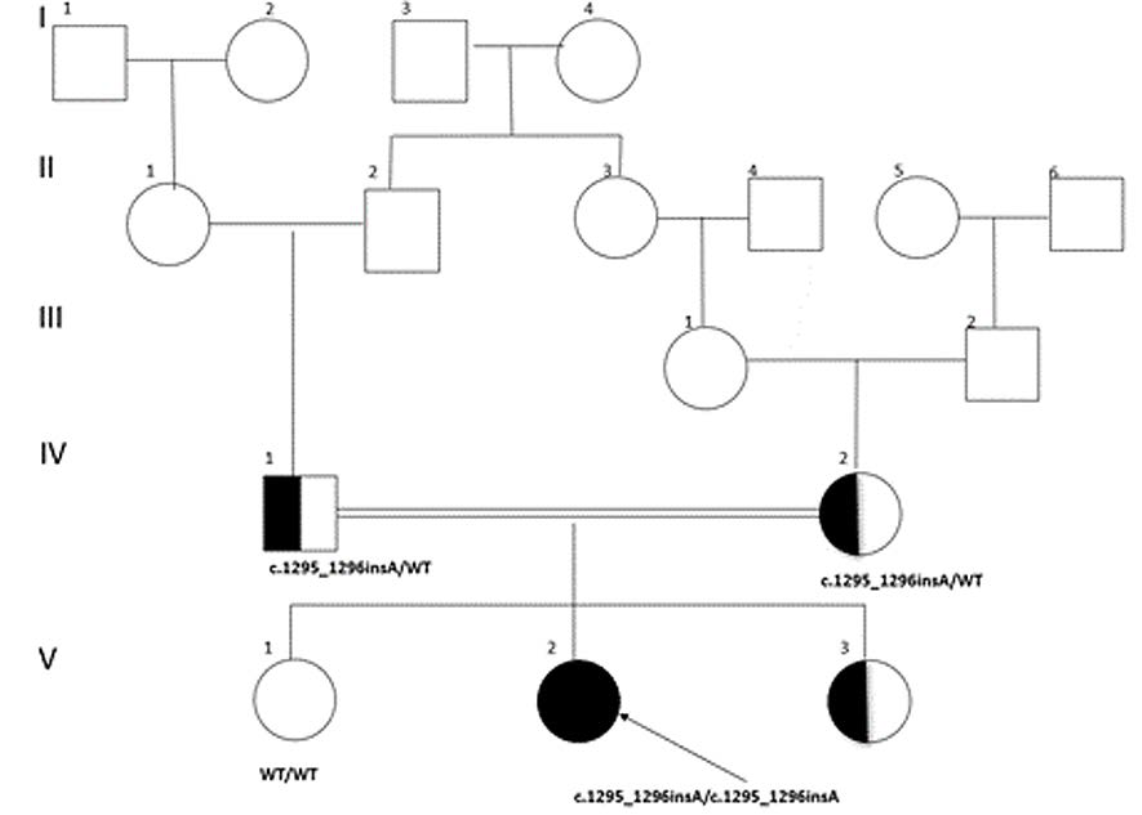
Por las diferentes infecciones recurrentes y graves, se sospechó de una inmunodeficiencia primaria (IDP) o secundaria, se reportó detección de VIH, perfil TORCH y VEB negativos; niveles de inmunoglobulinas séricas, complemento y subpoblaciones de linfocitos normales. Ante estos resultados solicitamos una nueva herramienta de diagnóstico genético basada en las tecnologías de secuenciación de nueva generación, específicamente un panel de secuenciación de 407 genes causantes de IDP o EII. Se tomó muestra de saliva y envió para obtención de ADN y secuenciación de genes candidatos. Dos semanas después, el estudio genético reportó variante patogénica homocigótica identificada en el gen AIRE (p.Arg433Alafs*71), con lo que se confirmó el diagnóstico de APECED. Se amplió el abordaje complementario para APECED, se obtuvo positividad para anticuerpos contra el factor intrínseco y niveles de vitamina B12 bajos (Cuadro 1). Se inició tratamiento con vitamina B12, nistatina oral y terbinafina tópica ungueal. Se valoró por oftalmología, otorrinolaringología, estomatología, endocrinología, nefrología y oncología sin evidencia de alteraciones asociadas con APECED en estos sistemas. Ambos padres y la hermana menor resultaron ser portadores heterocigotos de la variante patogénica p.Arg433Alafs*71 en AIRE (Figura 3).
Cuadro 1 Hallazgos clínicos y estudios complementarios
| Tríada APECED |
| Endocrinopatía autoinmune: anemia perniciosa. |
| CMC: candidiasis oral recurrente. |
| Displasia ectodérmica: distrofia ungueal (cultivo y frotis sin aislamiento). |
| Alteraciones no endocrinas |
| Alopecia areata. |
| Choque séptico de foco abdominal. |
| Colitis pseudomembranosa (Clostridium difficile). |
| Parasitosis (Giardia lamblia, Hymenolepis nana, Blastocystis hominis). |
| Neutropenia y trombocitopenia transitorias. |
| COVID-19 síntomas leves (serología IgM negativa, IgG positiva a SARS-CoV-2). |
| Estudios endocrinológicos |
| Anemia perniciosa: anticuerpos anti-factor intrínseco > 200 UR/mL (< 20), folatos > 20 ng/mL (3-20), vitamina B12 < 50 pg/mL (184-1000) (anemia megaloblástica). |
| Estudios complementarios |
| Hemoglobina 11.5 g/dL (12-16), hematocrito 33.4 %, volumen corpuscular medio 102 fL (80-100), hemoglobina por glóbulo rojo 34.8 g/dL (32-36), leucocitos 5.900 × 103/μL (4.5-10), neutrófilos 3.150 × 103/μL (1.5-6), linfocitos 2.200 × 103/μL (1.5-6), monocitos 420 × 103/μL (0.1-0.9), eosinófilos 140 × 103/μL (0.04-0.4), basófilos 30 × 103/μL (0.01-0.1), plaquetas 411 × 103/μL (150-450), proteína C reactiva 29 mg/dL (< 0.5), procalcitonina 33.1 ng/mL (< 0.1). |
| ㅤ |
| VIH (-), C3 138 mg/dL (88-155), C4 14.6 mg/dL (13-32), IgG 748 mg/dL (633-1.280), IgA 78 mg/dL (33-202), IgM 156 mg/dL (48-207), IgE 2.16 UI/L (< 50), coombs directo (-), anticuerpos antinucleares (-), factor reumatoide (-). |
| Subpoblaciones de linfocitos: linfocitos totales 1809, CD3+ de 71 % con 1281 totales (690-2540), CD4+ de 39 % con 706 totales (410-1590), CD8+ de 29 % con 522 totales (190-1140), CD19+ de 26.48 % con 479 totales (220-1100) CD16/56+ de 2 % con 46 totales (90-590). |
| Anticuerpos anti-transglutaminasa IgA e IgG (-). Anticuerpos anti gliadina IgG e IgA (-). T3L 3.14 pg/mL, T4L 1.27 ng/dL, TSH 2.87 mU/mL. FSH 0.782 mUI/mL, LH 0.414 mUI/mL, HbA1c 6 % (4.5-6.3 %). |
| Anticuerpos anti parietales 8.2 U/mL (< 10), ACTH 20.14 pg/mL (0-46), Cortisol 15.18 mg/dL (5-25), aldosterona 6.53 ng/dL (1.76-23.2). |
| Defecto genético |
| p.Arg433Alafs*71 |
| Familiares afectados |
| Madre, padre y hermana menor (p.Arg433Alafs*71) portadores |
Discusión
Los EII son un grupo heterogéneo de enfermedades genéticas que afectan uno o más componentes del sistema inmune, provocando defectos cualitativos o funcionales caracterizados por infecciones recurrentes, enfermedades autoinmunes, inflamatorias, alérgicas o predisposición a cáncer.14 A pesar de los importantes avances en los últimos 20 años en la caracterización clínica y molecular de los EII, existen signos de advertencia que se asocian fuertemente con el diagnóstico de EII, como la historia familiar/consanguinidad, uso frecuente de antibióticos intravenosos y retraso en el crecimiento.15
Hasta ahora, están descritos más de 430 defectos monogénicos por la IUIS actualizada en 2019, englobados en 10 grupos, donde el grupo IVb y X comprenden enfermedades que pueden presentar desórdenes autoinmunes debido a mutaciones monogénicas (gen AIRE) o por la presencia de autoanticuerpos (anti interleucina [IL] 17 o IL-22), grupo llamado fenocopias, como el caso APECED.3
La tríada clásica en APECED, se presenta en 25 % de los casos a los 10 años e incrementa de 75 a 99 % a los 50 años. La variante patogénica del gen AIRE se reporta en 80 a 95 % de los casos, mientras que los otros 5 % corresponden a fenocopias.5,7,13
Esta entidad ha permitido esclarecer procesos fundamentales del sistema inmune, en el establecimiento y mantenimiento de la auto tolerancia, variantes patogénicas en el gen AIRE se traducen en pérdida del control en los fenómenos autoinmunes. Las diversas hipótesis de la participación normal de AIRE incluyen: determinación en la organización del estroma tímico, control de la auto tolerancia en los timocitos, regulación de las respuestas de linfocitos B y T a estímulos antigénicos, inducción de apoptosis de las células parenquimatosas con la potenciación de la presentación cruzada de sus antígenos e inducción de la diferenciación de linfocitos T reguladores.16 La pérdida de la función de AIRE se traduce en una pérdida de la tolerancia inmunitaria central que conduce a la imposibilidad de eliminar linfocitos T autorreactivos en el timo y permite su escape a la periferia.17
Las manifestaciones clínicas dependen de la presencia de autoanticuerpos contra diferentes tejidos endocrinos y no endocrinos, además existen otras manifestaciones autoinmunes menos frecuentes como polineuropatía desmielinizante inflamatoria crónica, síndrome de Sjögren, artritis reumatoide, vasculitis cutánea, anemia hemolítica autoinmune, esclerodermia, esclerosis lateral amiotrófica y enfermedad celiaca.8
A pesar de las diversas manifestaciones clínicas, el diagnóstico puede ser difícil por la baja sospecha clínica, además de que suelen aparecer en diferente orden cronológico.
La secuenciación de nueva generación describe una serie de tecnologías de secuenciación moderna, que permiten la secuenciación de millones de pequeños fragmentos de ADN en paralelo, con análisis bioinformáticos que reconstruyen los fragmentos mapeando lecturas individuales en el genoma humano de una forma rápida y económica. Cada uno de los millones de pares de bases del genoma humano se secuencian varias veces, proporcionando a profundidad datos precisos y una visión de la variación inesperada del ADN, logrando secuenciar el genoma completo (22 000 genes codificadores) o áreas de interés específicas con un pequeño número de genes individuales. Es un procedimiento no selectivo y permite descubrir variantes patogénicas completamente nuevas, ayudando a desentrañar la base genética de síndromes inexplicables, o determinar genes causantes de enfermedad con información fenotípica detallada.18,19
En los EII, muchos pacientes con evidencia clínica y con estudios inmunológicos ampliados no obtienen un diagnóstico genético específico y la secuenciación de nueva generación es una nueva herramienta que se ha implementado para identificar los genes que causan enfermedad, además de evidenciar la heterogeneidad del fenotipo de variantes patogénicas en un mismo gen (ganancia o pérdida de función, enfermedades autosómicas dominantes con penetrancia variable y mutaciones de novo).20,21
En el caso que presentamos, la historia familiar y los hallazgos clínicos nos orientaron hacia un EII que no se pudo identificar con los estudios inmunológicos accesibles, sin embargo, por medio de secuenciación de nueva generación se logró confirmar el diagnóstico genético que explicaba la clínica de un síndrome descrito previamente.
Conclusión
El número de EII se ha incrementado en los últimos años. A pesar de que el diagnóstico es clínico y apoyado en estudios inmunológicos, el uso de estudios genéticos ayuda a comprender la función inmunológica afectada, así como la identificación del gen mutado puede sugerir la modalidad del tratamiento o terapias dirigidas.











 nueva página del texto (beta)
nueva página del texto (beta)