INTRODUCCIÓN
En áreas tropicales de México y Centro América, la economía doméstica de los granjeros pobres se basa en el cultivo del maíz y cría de rumiantes. El grano de maíz es usado como alimento humano, y los animales son alimentados con rastrojo de maíz principalmente. Los nutrientes del rastrojo son marginales para rumiantes en mantenimiento (NRC, 2007; NASEM, 2016), además, la proteína cruda y minerales como P, Mg, Co, Cu y Zn son bajos (Zinn et al., 1996). Está documentado que la cerdaza fresca y la pollinaza pueden ser incluidos como fuentes de nitrógeno para rumiantes (Jayathilakan et al., 2012; Bórquez et al., 2018), pero al mismo tiempo, pueden ser fuentes de minerales debido a su alto contenido de ceniza. Las excretas pecuarias contaminan el ambiente con patógenos y malos olores (Pell, 1997; Schiffman, 1998); pero el proceso de fermentación anaerobia (ensilaje) elimina malos olores y disminuye considerablemente la carga de patógenos (López-Garrido et al., 2014), y por consiguiente pueden ser usados para alimentación de rumiantes (Denton et al., 2005; Seok et al., 2016) en forma de ensilado (Bórquez et al. 2010). El proceso de ensilaje requiere de carbohidratos solubles para iniciar y mantener la fermentación (González-Muñoz et al., 2022). La melaza de caña tiene alta concentración de carbohidratos (So et al., 2020) y minerales (ppm): Mn (18), Zn (34), Cu (4.9), Bo (3), Co (0.6) y Fe (115) (NASEM, 2016; Senthilkumar et al., 2016; Tendonkeng et al., 2018). La melaza de caña (Trujillo et al., 2014) y los subproductos de panadería pueden ser usados como fuente carbohidratos rápidamente fermentables en ensilados (França et al., 2012; Mahmoud et al., 2017; Salama et al., 2019).
En México, las regulaciones sobre los residuos de origen pecuario se acotan al manejo de las descargas en cuerpos de agua y sobre bienes nacionales (Pinos-Rodríguez et al., 2012), así como a la sanidad e inocuidad agroalimentaria de productos agrícolas (Acevedo et al., 2017). No obstante, no existen regulaciones sobre la utilización de excretas de especies pecuarias en la alimentación de rumiantes.
Por lo tanto, se postuló que los ensilados de rastrojo de maíz con excretas pecuarias combinadas con subproductos altos en carbohidratos solubles pueden ser una fuente de minerales para rumiantes. Por lo tanto, el objetivo de esta investigación fue determinar el contenido de Ca, P, Na, Mg, K, Co, Cu, Mn Fe y Zn en ensilados a base de rastrojo de maíz con pollinaza deshidratada, cerdaza fresca y urea agrícola mezclados con melaza de caña o subproducto de panadería.
MATERIAL Y MÉTODOS
Localización del experimento
Esta investigación se realizó en la Unidad de Investigación y Docencia en Producción Animal, y en el Laboratorio de Bromatología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma del Estado de México (FMVZ-UAEMex), ubicada en Toluca, México a 19º16`W y 2745 m de altitud.
Ingredientes y elaboración de microensilados
La cerdaza fresca (heces y orina; CF) se obtuvo de cerdos en engorda de la granja experimental de la FMVZ-UAEMex. Los insumos como la pollinaza deshidratada (PO), urea agrícola (UA), melaza de caña (MC), subproducto de panadería (SPP) y rastrojo de maíz se obtuvieron de vendedores comerciales. Se obtuvieron muestras de los insumos, se almacenaron en frascos de vidrio y se mantuvieron en condiciones de oscuridad hasta su análisis químico proximal. Las fuentes de nitrógeno (UA, PO y CF) y fuentes de carbohidratos (MC y SPP) se mezclaron para preparar seis microensilados (tratamientos; Cuadro 1) basados en rastrojo de maíz y agua: UA+MC (control), UA+SPP (control), PO+MC, PO+SPP, CF+MC y CF+SPP. Las proporciones de los ingredientes de los ensilados se basó en los tratamientos probados por Trujillo et al (2014). Los microsilos con diez repeticiones por tratamiento se elaboraron con tubos de PVC (10 cm diámetro y 20 cm largo). En cada tubo se colocó 2.5 kg de material mezclado con agua corriente (±60 %) (Cobos et al.,1997), y este se compactó para expulsar el oxígeno. Después los microsilos se sellaron con una película plástica para prevenir el deterioro por oxígeno. El período de fermentación duró 30 d a temperatura ambiente bajo sombra.
Cuadro 1 Composición y proporciones de inclusión de ingredientes (% MS) de los tratamientos previo al ensilaje
| Tratamientos* | ||||||
| UA | PO | CF | ||||
| Ingredientes | MC | SPP | MC | SPP | MC | SPP |
| Rastrojo de maíz | 63 | 63 | 38 | 38 | 30 | 30 |
| Urea agrícola | 3 | 3 | 0 | 0 | 0 | 0 |
| Pollinaza deshidratada | 0 | 0 | 39 | 39 | 0 | 0 |
| Cerdaza fresca | 0 | 0 | 0 | 0 | 53 | 53 |
| Melaza de caña de azúcar | 34 | 0 | 23 | 0 | 17 | 0 |
| Subproducto de panadería | 0 | 34 | 0 | 23 | 0 | 17 |
*Todos los tratamientos fueron inoculados con Sil-All 4x4 (10 mg kg MS-1) que contiene una mezcla de Lactobacillus plantarum, Pediococcus acidilactii, Enterococcus faecium y Lactobacillus salivarius. UA, urea agrícola; PO, pollinaza deshidratada; CF, cerdaza fresca. MC, melaza de caña de azúcar; SPP, subproducto de panadería.
Los niveles de ingredientes utilizados en los ensilados fueron sugeridos por Bórquez et al. (2010) y Mejía et al. (2013).
Composición química y determinación de minerales
Una vez completado el periodo de fermentación, los microsilos se abrieron y se tomaron 100 g por cada repetición para obtener una muestra compuesta de 1000 g por tratamiento. Las muestras por tratamiento se dividieron en dos submuestras de 500 g. La primera se colocó en un frasco Erlenmeyer de 1000 mL con 500 mL de agua destilada y se agregaron 4 gotas de timol, esta se selló con plástico y se guardó durante 24 h. Al día siguiente, se midió pH con potenciómetro portátil (Hanna H198130; Hanna Instruments Italy). La segunda se secó en estufa de aire forzado a 65ºC por 72 h (AOAC, 1990) para determinar materia seca (MS) y se molió en Molino Wiley (Malla 1 mm; Model 4 Thomas Scientific Swedes, NJ). Se determinó proteína cruda (Kjeldjhal, N×6.25) y materia orgánica según la AOAC (1990). La fibra detergente neutro, fibra detergente ácido y lignina detergente ácido de acuerdo con Van Soest et al. (1991) y método ANKOM. Para el análisis de minerales se usaron 2 g MS de cada tratamiento con seis repeticiones, las cuales se digirieron en 8 mL de ácido tricloroacético al 10 %, estas se centrifugaron y con el sobrenadante se determinó P en espectrofotómetro (Génesis 20) con luz ultravioleta visible (Harris & Popat, 1954). Los minerales Ca, Mg, Cu, Fe, Zn, Mn, y Co se determinaron con espectrofotómetro de absorción atómica (Perkin Elmer 3110) (Fick et al., 1976). El Na y K se analizaron por flamometría (Corning 410). El Cuadro 2 muestra el contenido mineral previo al ensilaje de los ingredientes usados en los microensilados.
Cuadro 2 Contenido mineral (% MS) de ingredientes usados para preparar los microensilados
| Ingredientes1 | |||||
| Mineral | Rastrojo de maíz | Subproducto de panadería | Melaza de caña de azúcar | Pollinaza deshidratada | Cerdaza fresca |
| Calcio, % | 0.30 | 0.15 | 0.65 | 2.15 | 2.61 |
| Fósforo, % | 0.07 | 0.19 | 0.07 | 0.28 | 0.18 |
| Magnesio, % | 0.10 | 0.10 | 0.36 | 2.15 | 2.61 |
| Potasio, % | 1.10 | 0.35 | 3.70 | 1.95 | 3.16 |
| Sodio, % | 0.06 | 0.72 | 0.18 | 0.21 | 1.38 |
| Cobalto, mg/kg | Nd | Nd | Nd | 3.32 | 2.90 |
| Cobre, mg/kg | 4.00 | 5.0 | 15.0 | 86.2 | 93.8 |
| Manganeso, mg/kg | 37.0 | 10.0 | 20.0 | 299.7 | 342.7 |
| Hierro, mg/kg | 180.0 | 20.0 | 180.0 | 2417.6 | 1449.9 |
| Zinc, mg/kg | 16.0 | 16.0 | 19.0 | 585.9 | 305.6 |
1Los valores se determinaron en laboratorio utilizando seis repeticiones por ingrediente. Nd, no detectado.
Diseño experimental y análisis estadístico
Se utilizó un Diseño Completamente al Azar con un arreglo factorial de tratamientos 3×2 con seis repeticiones por tratamiento. El análisis estadístico se realizó con PROC MIXED (SAS Institute Inc., 2004) y la comparación de medias con la prueba de Tukey (P≤0.05). La muestra compuesta de cada tratamiento se consideró sujeto aleatorio y los tratamientos como efectos fijos con método de estimación TYPE3. Las figuras se realizaron con R-project versión 4.1.0 (R Core Team, 2022). El modelo matemático fue: yijk= µ + ai + bj + a*b(ij) + eijk , donde: yijkl= variable de respuesta, µ= media general, a¡= efecto de la fuente de nitrógeno (UA, PO, CF), bj= efecto de la fuente de carbohidratos (MC, SPP), a*b(ij)= efecto de la interacción de nitrógeno×carbohidratos, eijk= error experimental, eij ~ N (0, σ2). Para determinar el efecto de los factores principales fuente de nitrógeno, fuente de carbohidratos e interacción, se utilizó la opción SOLUTION de MODEL (SAS Institute Inc., 2004).
RESULTADOS
Macrominerales
La composición química de los ensilados (Cuadro 3), y el efecto de NS y CS sobre la concentración de minerales se presentan en el Cuadro 4. La Figura 1 muestra la interacción NS×CS de los tratamientos para los macrominerales. Las soluciones de los estimados de los parámetros del modelo muestran que la suma de los efectos principales e interacciones resultan en el efecto total de las variables independientes sobre la variable dependiente. De esta forma, la interacción es explicada como, una parte de los efectos de la fuente de nitrógeno dependen del efecto de la fuente de carbohidratos y viceversa.
Cuadro 3 Composición química (% MS) de ensilados a base de rastrojo de maíz después de 30 d de fermentación
| Tratamientos | ||||||
| UA | PO | CF | ||||
| Ingredientes | MC | SPP | MC | SPP | MC | SPP |
| Materia seca, % | 42.20 | 33.80 | 43.10 | 41.60 | 36.9 | 34.20 |
| Proteína cruda, % | 12.62 | 14.30 | 12.42 | 13.57 | 13.71 | 14.56 |
| EM, Mcal/kg | 2.05 | 2.29 | 2.16 | 2.30 | 2.16 | 2.27 |
| Fibra detergente neutro, % | 38.30 | 44.40 | 42.50 | 38.50 | 35.10 | 37.00 |
| Fibra detergente ácido, % | 23.70 | 25.00 | 29.00 | 21.40 | 20.10 | 19.80 |
| Lignina detergente ácido, % | 4.80 | 5.20 | 6.10 | 6.00 | 4.40 | 4.40 |
| Cenizas | 7.30 | 9.10 | 11.00 | 11.10 | 9.60 | 7.70 |
| pH | 4.20 | 4.20 | 4.00 | 4.10 | 4.10 | 4.20 |
UA, urea agrícola; PO, pollinaza deshidratada; CF, cerdaza fresca. MC, melaza de caña de azúcar; SPP, subproducto de panadería. EM, energía metabolizable, calculado de valores publicados de los ingredientes (NRC, 2007; NASEM, 2016).
Cuadro 4 Resultados del efecto de las fuentes de nitrógeno y carbohidratos sobre la concentración mineral de microensilados de rastrojo de maíz
| Tratamientos | ||||||||||
| UA | UA | CF | Efectos principales | |||||||
| Mineral | MC | SPP | MC | SPP | MC | SPP | EEM | NS | CS | NS x CS |
| Macrominerales, % MS | ||||||||||
| Ca | 0.154e | 0.378d | 1.151a | 1.143a | 0.779b | 0.682c | 0.009 | < 0.01 | < 0.01 | < 0.01 |
| P | 0.004d | 0.027c | 0.105a | 0.075b | 0.112a | 0.116a | 0.004 | < 0.01 | 0.71 | < 0.01 |
| Na | 0.561b | 0.452c | 0.928a | 0.574b | 0.362d | 0.062e | 0.018 | < 0.01 | < 0.01 | < 0.01 |
| Mg | 0.168d | 0.330c | 0.499a | 0.411b | 0.477a | 0.405b | 0.005 | < 0.01 | 0.91 | < 0.01 |
| K | 0.859d | 2.746a | 2.839a | 1.770c | 2.267b | 0.980d | 0.079 | < 0.01 | 0.02 | < 0.01 |
| Microminerales, mg/kg MS | ||||||||||
| Co | 1.426c | 0.391d | 3.171a | 2.242b | 2.216b | 1.916b | 0.083 | < 0.01 | < 0.01 | < 0.01 |
| Cu | 0.77e | 6.15d | 18.23b | 14.07c | 25.60a | 25.69a | 0.805 | < 0.01 | 0.69 | < 0.01 |
| Mn | 128.00d | 103.30e | 214.95a | 219.48a | 178.37b | 160.71c | 2.65 | < 0.01 | < 0.01 | < 0.01 |
| Fe | 517.60d | 660.33c | 740.65c | 1102.97a | 898.21b | 994.19ab | 27.33 | < 0.01 | < 0.01 | < 0.01 |
| Zn | 20.24e | 79.91d | 116.11c | 120.30c | 169.86b | 198.07a | 5.61 | < 0.01 | < 0.01 | < 0.01 |
UA, urea agrícola; PO, pollinaza deshidratada; CF, cerdaza fresca. MC, melaza de caña de azúcar; SPP, subproducto de panadería. EEM, error estándar de la media. NS, efecto de la fuente de nitrógeno; CS, efecto de la fuente de carbohidratos. a-eMedias con distinta literal en el mismo renglón son diferentes (P<0.01).
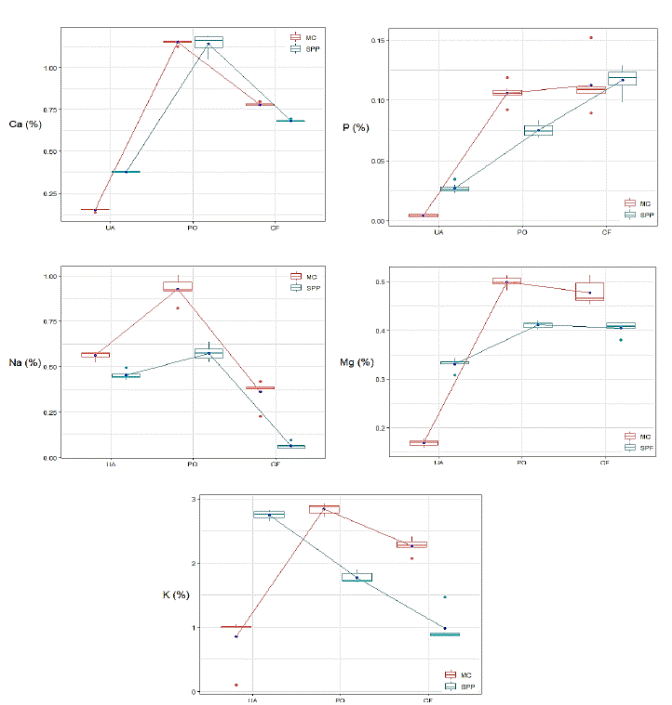
Figura 1 Fuentes de nitrógeno: UA, urea agrícola; PO, pollinaza deshidratada; CF, cerdaza fresca. Fuentes de carbohidratos: MC, melaza de caña de azúcar; SPP, subproducto de panadería.
El mayor (P<0.01) contenido de Ca fue observado en los tratamientos a base de PO. Se observó un efecto positivo de PO×MC y CF×MC, las cuales generaron un efecto adicional de 0.23% y 0.32% en Ca (P<0.01), respectivamente (Figura 1).
En relación al fósforo (P), su contenido fue afectado (P<0.01) por la fuente de nitrógeno. Se observó un aumento de 0.04% de P cuando se usó PO en vez de UA; de la misma forma, cuando se usó CF en vez de UA se produjo 0.08% Ca. La interacción CF×MC produjo mayor contenido de P (> 0.01%), y este efecto fue mayor en PO×MC (≥ 0.05% P) vs PO×SPP. En la Figura 1 se observa que los tratamientos con UA fueron menores en P, y este efecto fue más evidente en el ensilado a base de MC. Además, hubo un incremento lineal de P con el uso de excretas en los ensilados. Respecto, a la concentración de sodio (Na), esta fue mayor (P<0.01) en PO×MC que el resto (Cuadro 4). Además, se observó efecto de interacción (P<0.01) de NS×CS. El efecto de interacción sobre la concentración de Na de PO×MC y CF×MC adicionalmente produjo 0.24% y 0.19% respectivamente (P<0.01). El gráfico de interacción (Figura 1) muestra que la combinación de MC o SPP con pollinaza deshidratada aumentó el contenido de Na de los ensilados, pero cuando se combinaron con cerdaza fresca hubo un efecto negativo.
La mayor (P<0.01) acumulación de magnesio (Mg) fue en ensilados a base de MC con excretas. Se observó efecto de la fuente de N sobre este mineral. Este efecto fue evidente al comparar UA vs PO, lo cual mostró mayor contenido de Mg (0.08%) en este último. Pero cuando se utilizó CF en vez de UA, hubo un incremento de Mg de 0.07%. El efecto de NS×CS mostró un efecto aditivo (P<0.01) en PO×MC (+0.25% Mg) vs PO×SPP y CF×MC (+0.23% Mg) vs CF×SPP, respectivamente; esto causó mayor acumulación de Mg (Figura 1).
Microminerales
La concentración (mg/kg MS) de todos los microminerales resultó del efecto de la interacción NS×CS (Cuadro 4 y Figura 2). La concentración de cobalto (Co) fue mayor (P<0.01) en el ensilado PO×MC. El efecto de la fuente de nitrógeno mostró que usando PO en lugar de urea agrícola se producen más de 1.85 mg/kg de Co en los ensilados. En forma similar, usando CF en lugar de UA aumentó el contenido de Co en 1.52 mg/kg. Además, el uso de MC en vez de SSP aumentó la concentración de Co en los ensilados en 1.03 mg/kg. El contenido de cobre (Cu) fue mayor (P<0.01) en ensilados con CF. Se observó que en los tratamientos control (UA), la adición de MC al ensilado tuvo efecto negativo (-5.38 mg/kg de Cu) comparado con SPP; pero en el resto de los tratamientos la fuente de carbohidratos no tuvo efecto (P=0.69) por sí solo, sobre la concentración de Cu. Los efectos de PO×MC y CF×MC produjeron 9.54 mg/kg y 5.29 mg/kg de Cu, respectivamente; que la contribución de la fuente de nitrógeno y la fuente de carbohidratos por separado. Esto permitió mayor concentración de Cu para MC en comparación con SPP cuando se mezcló con PO; sin embargo, los ensilajes a base de CF combinados con ambas fuentes de carbohidratos fueron similares (Figura 2).
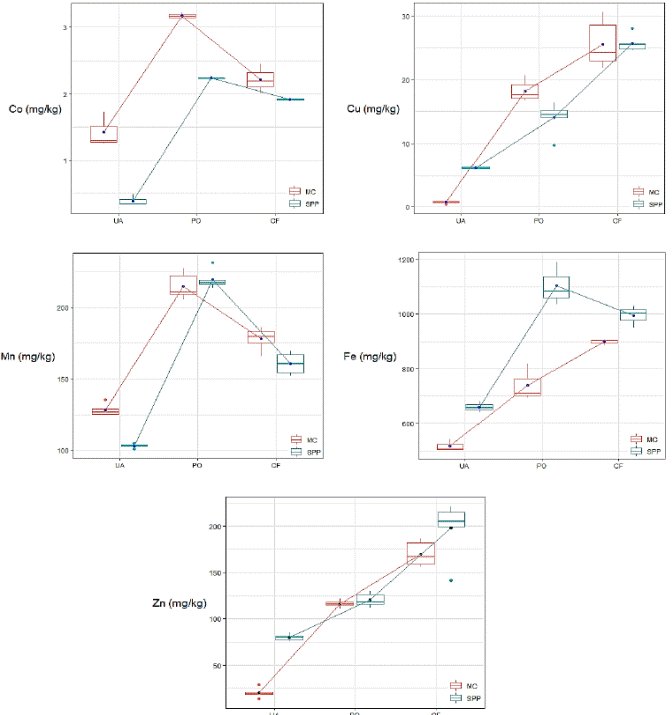
Figura 2 Efecto de interacción de las fuentes de nitrógeno y carbohidratos sobre el contenido de micro minerales. Fuentes de nitrógeno: UA, urea agrícola; PO, pollinaza deshidratada; CF, cerdaza fresca. Fuentes de carbohidratos: MC, melaza de caña de azúcar; SPP, subproducto de panadería.
La concentración de manganeso (Mn) fue mayor (P<0.01) en ensilados a base de PO debido al efecto de NS×CS (Cuadro 4, Figura 2). En cuanto al efecto de fuente de nitrógeno, los ensilados a base PO fueron mayores que los ensilados control (UA) en 116.18 mg/kg de Mn, asimismo CF fue mayor que UA en 57.41 mg/kg de Mn. Además, hubo un efecto positivo de la adición de MC al ensilado, lo cual resultó en una mayor acumulación (24.70 mg/kg de Mn) comparado con el efecto de la inclusión de SPP. En el gráfico de interacción (Figura 2) se observa un patrón similar en los ensilados con ambas fuentes de carbohidratos solubles. El contenido de hierro (Fe) fue mayor (P<0.01) en el ensilado PO×SPP. El uso de PO en vez de UA tuvo un efecto benéfico al incrementar 442.64 mg/kg la concentración de Fe en los ensilados. En forma similar cuando se usó CF en lugar de UA, hubo un incremento de 333.85 mg/kg de Fe. El efecto de la interacción de PO×MC disminuyó (P<0.01) la concentración (-219.59 mg/kg) de Fe en comparación con PO×SPP. Pero cuando interaccionaron CF×MC, el Fe aumentó 46.75 mg/kg. No obstante, este efecto no fue suficiente para igualar el contenido de Fe de la interacción CF×SPP (Figura 2).
Finalmente, la concentración de zinc (Zn) fue mayor (P<0.01) en el ensilado con SPP. Se observó que con MC bajó el contenido de Zn cuando se combinó con UA (-59.67 mg/kg), pero cuando se mezcló con PO o CF hubo un efecto aditivo (Figura 2). Al respecto, el uso de PO en lugar de UA aumentó la concentración de Zn en 40.38 mg/kg, y la interacción PO×MC adicionalmente produjo 55.48 mg/kg. Asimismo, cuando se comparó UA vs CF este último produjo más de 118.16 mg/kg de Zn, y cuando se mezcló CF con MC se produjo una cantidad adicional ≥ 31.45 mg/kg de Zn. Por lo tanto, el efecto positivo de estos componentes en los ensilados fue suficiente para igualar la concentración de Zn (198.07 mg/kg) de la combinación CF×SPP.
DISCUSIÓN
De acuerdo con los resultados, el proceso de la fermentación ácido-láctica afectó el contenido mineral de los ensilados, debido a los efectos de interacción de las excretas combinados con melaza de caña o subproducto de panadería. Además, los ensilados a base de excretas con melaza de caña mostraron mayor contenido de macrominerales. En la mayoría de los tratamientos se observó efecto de la fuente de carbohidratos, excepto para Mg y Cu. No fue sorpresa que PO incrementara el contenido de minerales (Ca, P, Na, Mg, K, Co, Mn y Fe) en los ensilados, debido a su alto contenido de cenizas (Kwak, 2006). La contribución de CF a altos contenidos de P, Mg, Cu y Zn de los ensilados también se esperaba, debido a que el CuSO4 es frecuentemente usado como agente antimicrobiano en dietas de cerdos (Shannon & Hill, 2019), y el ZnO es usado para disminuir los síntomas de diarrea (Zhou et al., 2017); mientras que, el ZnSO4 tiene efecto antimicrobiano. Asimismo, una alta concentración de Ca, K, Cu, Mn, y Fe se esperaba como consecuencia del uso de MC en los ensilados debido a su alto contenido de estos minerales en los residuos del jugo de caña extraído y de su contaminación con residuos de suelo (Senthilkumar et al., 2016; Tendonkeng et al., 2018) durante su manejo.
En esta investigación todos los tratamientos fueron inoculados con Lactobacillus plantarum, Pediococcus acidilactii, Enterococcus faecium y Lactobacillus salivarius; lo cual produjo ensilados de buena calidad (Trujillo et al., 2014) con pH entre 4.1 - 4.2. El valor de pH es un factor importante para determinar la calidad del proceso de fermentación en los ensilados (Cañeque & Sancha, 1998); sus valores fueron alrededor de 4.1 y se consideran apropiados para ensilados de maíz con suficiente grano (Basso et al., 2014). Pero valores altos de pH pueden indicar insuficiente cantidad de carbohidratos solubles. La interacción NS×CS se observó en todos los tratamientos; esto es relevante ya que en medios de cultivo con suficiente concentración de azúcares (glucosa >1%) se induce la expresión de la enzima fitasa (Palacios et al., 2005). En el cultivo y crecimiento de bacterias ácido lácticas (LAB), los elementos minerales esenciales son Mg2+, Mn2+, Ca2+, Fe2+, Na+, y K+ (Saeed & Salam, 2013); otros elementos como Hg2+, Cu2+, Ni2+, Zn2+ y Co2+ optimizan y controlan su actividad enzimática.
Efecto del ensilaje sobre el contenido de macro y microminerales
En las fases iniciales del proceso de fermentación, la rápida colonización de ingredientes depende de la disponibilidad de carbohidratos solubles fermentables (Wood, 1998). De esta forma, el consumo y disminución del oxígeno en el ensilado depende de los mecanismos bacterianos que reducen las condiciones aeróbicas. En el establecimiento de las condiciones anaeróbicas de la fermentación, las LAB en el ensilado con pH <4 han desarrollado mecanismos alternativos al de la enzima catalasa para eliminar radicales de oxígeno altamente reactivos. Entre estos están a) defensa enzimática por superóxido dismutasa y b) capacidad para acumular Mn (Mn II) que evita el efecto endógeno de oxígeno tóxico (0 - + 2H+ + Mn2+ H 0 + Mn2+) (Pahlow et al., 2003). En el metabolismo de las LAB, el Mn2+ es un efector (Vos et al., 2009) en la estructura y activación de numerosas enzimas. En esta investigación el contenido inicial de Mn en la mezcla de ingredientes antes del proceso de ensilaje fue bajo para los tratamientos basados en UA (26-30 mg/kg) y PO (133-135 mg/kg), pero alto con CF antes y después del ensilaje (194- 196 mg/kg). Sin embargo, se observó un incremento en la concentración de Mn en ensilados basados en UA y PO, pero niveles estables con CF antes y después del ensilaje. Esto se pudo deber a una mayor respuesta protectora de las LAB en presencia de oxígeno. Al respecto, la adición de fuentes de nitrógeno (UA o PO) pudo mejorar la estabilidad anaerobia de los ensilados debido al efecto buffer de las enterobacterias en las fase iníciales del ensilaje a través de: a) reducción de la fuentes de nitrógeno a amoníaco (capacidad buffer), efecto temporal benéfico para las especies LAB (Pahlow et al., 2003), y b) inhibición de concentración de clostridios, debido a la reducción del amoniaco (NH3) a NO y NO2 en cantidades no tóxicas; este efecto se pudo haber extendido hasta su inhibición con pH<4. Las enterobacterias son especies epifitas presentes hasta 100 veces más que las LAB, clostridios, levaduras y hongos (Behrendt et al., 1997) en forrajes secos y senescentes. En granos de cereales, el Mg y otros cationes divalentes pueden ser quelatados por efecto del ácido fítico (Serna-Saldivar, 2010). Las LAB han demostrado tener actividad de fosfatasa ácida (APs). López et al. (2000) mostraron que Ln. Mesenteroides S38 tiene actividad de APs, la cual disminuye la actividad del ácido fítico a medida que incrementa la producción de ácido láctico. De la misma manera, se observó mayor solubilidad del Ca y Mg en harina entera de trigo como medio de cultivo por la expresión de APs.
El magnesio (Mg2+) es un elemento esencial en el crecimiento y metabolismo de las LAB (Vos et al., 2009). En la vía de la glucolisis, la primera reacción en la ruta es la formación de un complejo entre el catión Mg2+, ATP y glucosa, la cual liga a la hexoquinasa (Miesfeld & McEvoy, 2017). La importancia de este metabolismo es obtener piruvato y lactato bajo condiciones anaeróbicas (Wood, 1998) a partir de fermentación láctica (Madigan et al., 2022) y a través de la enzima lactato deshidrogenasa (Mozzi et al., 2010). En esta investigación, el contenido inicial de Mg fue mayor en MC que en SPP. Sin embargo, la fuente de carbohidratos no tuvo efecto significativo por sí misma, pero hubo efecto de interacción de NS×CS que produjo mayores concentraciones de Mg en los ensilados a base de MC con PO o CF, por lo que estas combinaciones de ingredientes promovieron mayor crecimiento de LAB durante la fermentación; esto se reflejó en los valores de pH de ambos tratamientos (Cuadro 3). Es interesante mencionar que los tratamientos basados en CF contenían mayores cantidades de Mg antes del ensilaje, pero esta tendencia cambio durante el proceso de fermentación debido al efecto del N disponible para las LAB en la excreta.
El fósforo (P) es un elemento necesario en el metabolismo de las bacterias ácido lácticas. La vía Embden-Meyerhof-Parnas (glucolisis) requiere de la hidrolisis de ATP para generar la energía libre necesaria para activar la hexocinasa, fosofofructocinasa-1 y fosfoglicerato cinasa (Miesfeld & McEvoy, 2017); también en la etapa de la fosforilación del fosfoenolpiruvato a piruvato. En las excretas del ganado, el 80% del P está contenido en forma de ácido fítico (mioinositol hexakisfofato), principalmente en monogástricos con dietas altas en granos (Leytem & Maguire, 2007). Antes del ensilaje, los tratamientos a base de UA (MC y SPP) contenían mayores cantidades de P (0.068 y 0.109 % MS), pero después de 30 d de fermentación láctica la concentración cambio (0.004 y 0.027 % MS, respectivamente), No obstante, los ensilados basados en estiércol mantuvieron constante la cantidad de P antes y después del proceso de ensilaje. Esto se pudo deber al uso y agotamiento del P disponible por las LAB en los ensilados a base de UA, mientras que, en los tratamientos a base de excretas hubo liberación de P a través de la actividad de fitasas. Además, la expresión de la enzima fosfatasa ácida en LAB (Lactobacillus plantarum) puede estimularse con la presencia de Ca2+, Mg2+, Mn2+, y Cu2+ (Saeed & Salam, 2013) y así incrementar la disponibilidad de P de 29 a 34% (López et al., 2000); en la misma forma Pediococcus acidilactici ha expresado extracelular e intracelularmente la actividad de fitasas (Cizeikiene et al., 2015). Por lo tanto, el incremento en solubilidad y disponibilidad de P en los ensilados de excretas y el contenido mineral en los tratamientos confirmó este comportamiento. Sin embargo, la fosfatasa acida puede disminuir su efecto por el Co2+ y ser inhibida por Fe2+ (Palacios et al., 2005); en ensilados a base de UA hubo un incremento en la disponibilidad de estos elementos después del proceso de ensilaje.
La fermentación láctica (pH 3.6 a 3.8) con LAB (cepas de Streptococcus lactis y Lactobacillus) más la adición de 10 a 50 mg de fitasa aumentaron la disponibilidad (>200 %) del Fe de la harina de maíz y sorgo (Svanberg et al., 1993). En Lactobacillus pentosus CECT 4023, se ha observado un efecto estimulante del Co2+ y un efecto inhibitorio del Ca2+ en la actividad enzimática de APs (65% de homologación con APs de Lactobacillus plantarum); sin embargo, esto no se ha observado en otras LAB (Palacios et al., 2005). La presencia y abundancia de bacterias acido lácticas tales como Lactobacillus plantarum mostró correlación significativa (rxy=0.25) con la concentración de Na en agua de bebida (Minervini et al., 2019); en todos los tratamientos se observó un incremento de Na después del ensilaje. En agua de bebida, la presencia y abundancia Lactobacillus plantarum tiene una correlación de rxy=0.86 con la concentración de K (Minervini et al., 2019). El Zn2+ (ZnCl2) y Hg2+ (HgCl2) son fuertes inhibidores de la APs en Lactobacillus curvatus (Abdallah et al., 1999). En Lactobacillus sanfranciscenis CB1, Hg2+ y Fe2+ son inhibidores de la enzima fitasa; además, el incremento de NaCl en el medio tuvo efecto negativo en la actividad de la enzima (De Angelis et al., 2003). Esto sostiene que la disponibilidad de los elementos minerales en el ensilado basado en excretas pecuarias de esta investigación puede estar influida por la inoculación de bacterias ácido lácticas y por la interacción de las fuentes de nitrógeno y de carbohidratos solubles. Finalmente, lo anterior implica que, el proceso de ensilaje y la reutilización de nutrientes de excretas de monogástricos en dietas para ovinos de engorda, puede suplir los requerimientos de minerales con el fin de disminuir los costos de alimentación. Desde el punto de vista bioético, el reciclaje de nutrientes de excretas mediante el proceso de ensilaje permite dotar de un insumo inocuo a la alimentación de rumiantes; disminuyendo los problemas sanitarios que pueden originar estos sin un tratamiento previo. Pero a pesar de su utilización de manera rutinaria y necesaria en la alimentación animal, no se han establecido regulaciones al respecto.
CONCLUSIÓN
Los resultados sugieren que los ensilados de rastrojo de maíz con pollinaza deshidratada o cerdaza fresca en combinación con melaza de caña o subproducto de panadería cambian la concentración de los minerales de la mezcla. El ensilado a base de PO con MC tuvo el mayor contenido de macrominerales y algunos microminerales, por lo tanto, puede ser una fuente de suministro para rumiantes.











 texto en
texto en 



