INTRODUCCIÓN
El SEC es un sistema neuromodulador del metabolismo(1), que se compone de receptores a cannabinoides (CB o RCB), endocannabinoides también llamados ligandos, así como enzimas de recaptación, proteínas de biosíntesis, transporte y degradación (2), los cuales serán abordados a detalle a continuación.
Se entiende por endocannabinoide a cualquier molécula lipídica perteneciente al grupo de los terpenofenoles y producida de manera constitutiva en el organismo, principalmente por la remodelación de la membrana celular y el metabolismo de los lípidos (3). De éstos, se han descrito potentes ligandos de SEC provenientes de fitoestructuras como lo es la cannabis (cannabis sativa), la cual comenzó a estudiarse en los años 60 y que en la actualidad se postula tiene una relación de regulación homeostática en la ingesta y el metabolismo energético (4). En años posteriores, la clonación de los CB en células de mamífero permitió la identificación de sus ligandos endógenos, siendo la araquidonoiletanolamida (N-araquidonil etanolamina o AEA o anandamida) el primer ligando de los CB identificado (5), seguido de 2-araquidonoil glicerol (2-AG) (6).
Estos endocannabinoides se derivan del ácido araquidónico y a través de múltiples vías se liberan fuera de las células después de su producción, para activaralos CB, locual puede generar como respuesta una elevación en los niveles de calcio intracelular (Ca2+) o la activación de receptores metabotrópicos (2). Los ligandos a CB tienen la particularidad de regular varios aspectos en las funciones del cerebro como lo es la memoria, el aprendizaje, transmisión sináptica y diferentes formas de la plasticidad a corto y largo plazo, además de influir en procesos de desarrollo y crecimiento, tales como la sinapsis y neurogénesis (7). Otras funciones biológicas moduladas por los endocannabinoides incluyen la ansiedad, elapetito(8), inflamación(9) y el dolor(10).
Los endocannabinoides son diferentes de los neurotransmisores clásicos, ya que no se almacenan en vesículas, una vez liberados permanecen unidos a la membrana debido a su lipofilia, por lo que pueden llevarse de vuelta al interior celular a través de un complejo mecanismo de transporte de membrana con alta afinidad (11). En la Figura 1, se muestra la estructura de los endocannabinoides endógenos más estudiados, los cuales son la AEA y el 2-AG. Dentro de los fitocannabinoides se encuentra la Δ-9-tetrahidrocannabinol, cannabinodiol (CDB) y ácido ajulémico. Estos compuestos actúan como ligandos agonistas del CB tipo 1 (RCB1 o CB1) y el CB tipo 2 (RCB2 o CB2) en el sistema nervioso central (SNC) , así como en órganos con inervación nerviosa periférica(12,13). En lo que se refiere a su síntesis, uno de sus principales promotores es la concentración iónica de Ca2+ extracelular, ya que la N-acetiltransferasa y la fosfolipasa D hidrolizante de N-acil-fosfatidiletanolamina (NAPE-PLD) son enzimas dependientes de Ca2+. De manera paralela, las enzimas diacilglicerol lipasa y la fosfolipasa C son las principales responsables de la síntesis de 2-AG (14). Es importante mencionar que, en condiciones fisiológicas AEA y 2-AG son sintetizados a “demanda” durante la remodelación de la membrana celular (Figura 2) y se degradan rápidamente al tener un efecto localizado y transitorio (2).
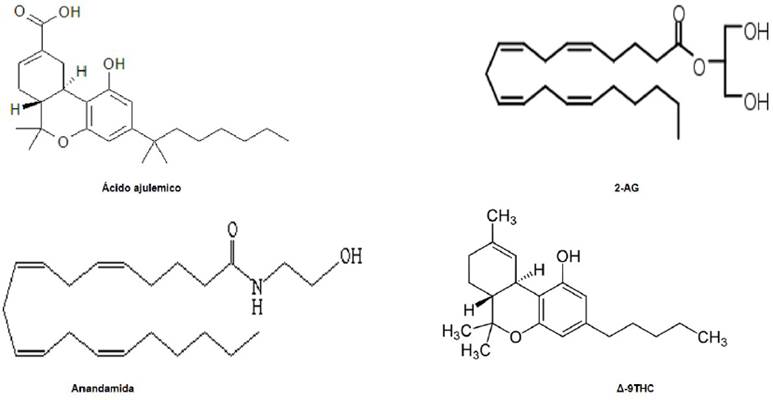
Figura 1 Estructura de los principales endocannabinoides. 2-AG: ácido araquidonil-glicerol; Δ-9THC: cannabis. Fuente: Pacher et al. [2006].
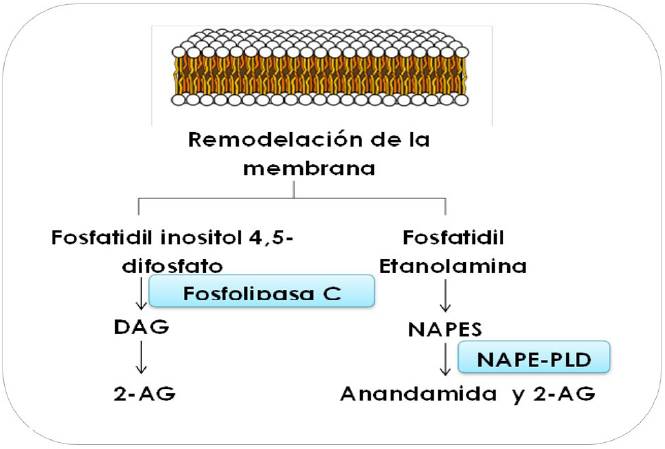
Figura 2 Síntesis y metabolismo de los principales endocannabinoides. NAPES: N-acil-fosfatidiletanolaminas; N-araquidonil fosfatidiletanolamina (NAPE-PLD) miembro de la fosfolipasa D, origina la familia de araquidonil glicerol etanolaminas. Fuente: Valenzuela et al. [2014].
Por otro lado, los CB que se han descrito para el SEC son los receptores activados por proliferador de peroxisoma de tipo alfa y gamma (PPARα y PPARγ), el receptor de potencial transitorio tipo V1(TVPR1), los receptores de N-araquidonilglicina (GPR18 y GPR55), CB1 y CB2, siendo estos dos últimos los más estudiados (15). Se sabe que el CB1 está ampliamente distribuido en el cerebro, teniendo grandes concentraciones en el hipotálamo, hipocampo, corteza frontal y amígdala, a diferencia del CB2, el cual tiene una mayor presencia en el tejido glial, principalmente en la microglia (1), como se muestra en la Figura 3. En cuanto a su estructura, se sabe que el CB1 y CB2 son receptores transmembranales acoplados a una proteína de tipo G /G . Es importante mencionar que la señalización de estos receptores es compleja y, dependiendo del tipo de célula, puede implicar la inhibición (también la activación en ciertos casos) de la actividad de la adenilato ciclasa y activación de diversas proteínas cinasas activadas por mitógenos (MAPK), las proteínas cinasas A y C, además de la modulación de diversos canales de Ca2+ y potasio (K+) (16). Como se muestra en la Figura 4, cada receptor posee siete dominios, a pesar de que sólo comparten un 44% de homología en su estructura, se ha visto que tienen una amplia similitud en sus perfiles de ligandos y antagonistas; así también, se ha descrito que existe una similitud del 99.8% entre los CB1 de los roedores y el humano (17).
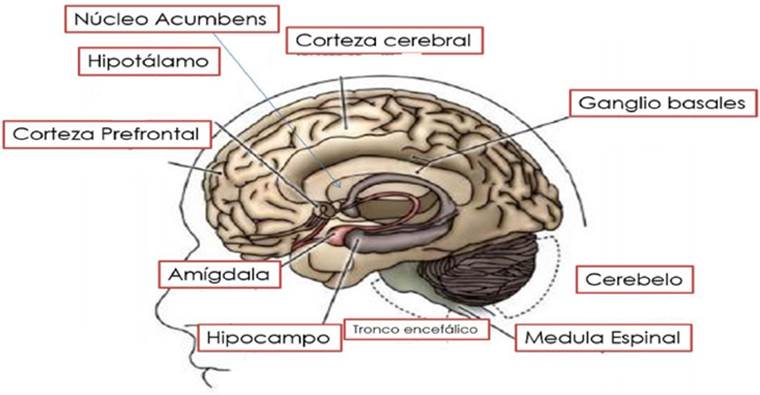
Figura 3 Regiones cerebrales que expresan los receptores a cannabinoides de tipo 1 y 2. Las áreas nombradas en el corte sagital corresponden a las áreas de expresión de ambos receptores. Fuente: Heinbockel et al. [2014].
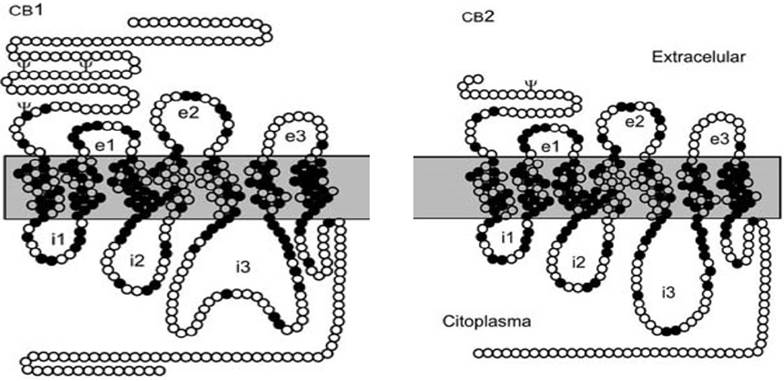
Figura 4 Estructura de los receptores cannabinoides tipo 1 y 2. CB1: receptor cannabinoides tipo 1; CB2: receptor cannabi-noides tipo 2. Fuente: Abdood et al. [1996].
El CB1 es el receptor acoplado a proteína G más abundante en las terminaciones nerviosas excitadoras e inhibitorias pre-sinápticas del cerebro de los mamíferos (18), además se expresa en muchos otros tejidos periféricos, tales como el tejido adiposo (19), hígado (20), el músculo esquelético (21), riñón (22), corazón (23), piel (24) y las células-β del páncreas (25). En contraste, el receptor CB2 se expresa principalmente en las células de los sistemas inmunitario así como el hematopoyético, y en menor medida en órganos, como el hígado, y en células tipo osteoblastos y microglia (26-28).
SEC y el control de la homeostasis de los ácidos grasos. Cota et al. [2003] demostraron que los ratones deficientes de CB1 (knockout CB1 o CB1-/-) exhiben un menor peso corporal que los compañeros de camada de tipo silvestre (29). Esta disminución se acompaña de una disminución de la masa grasa y un incremento correspondiente de la magra. Dado que los ratones CB1-/- y de tipo silvestre mostraron variaciones circadianas similares en la temperatura corporal además de la actividad locomotora y sólo una tendencia más alta hacia el gasto energético (que corresponde a la combustión de energía y la oxidación de grasa e hidratos de carbono), la pérdida de peso observada en los ratones CB1-/- es directamente atribuible a la ausencia de los CB1, por lo que su papel no solamente tiene que ver con el comportamiento de la ingestión, sino también en la acumulación de masa grasa y de la síntesis de ácidos grasos. En este mismo estudio, se denotó que el bloqueo del CB1 durante 40 días con el tratamiento de rimonabant (SR141716A), reduce el peso corporal de manera dependiente de la dosis y este efecto se acompaña de una disminución del tejido blanco adiposo epididimal, así como en el tejido conectivo presente en el área lumbar y perirenal (29).
Regulación a nivel neuroendocrino. Es bien conocido que el hipotálamo mantiene una fuerte comunicación aferente y eferente con el hígado, lo que da como resultado la modulación del metabolismo hepático (30,31). Los seres humanos alimentados con una dieta alta en carbohidratos exhiben una mayor cantidad de receptores hepáticos para la captación de nutrientes, que indican una participación más significativa durante la lipogénesis de novo y la producción de triglicéridos fomentada por el tejido adiposo (32). Dentro de las moléculas participantes en este proceso, se encuentra la AMPK, cuyas acciones desencadenan la modulación nerviosa de varias funciones en el núcleo ventromedial del hipotálamo (VMH), dando como resultado final la inhibición de síntesis de lípidos y un aumento en la oxidación de lípidos en el hepatocito (33,34).
Diversos estudios apoyan la acción crucial del hipotálamo en el metabolismo de los lípidos, independientemente de la función ejercida por la medula adrenal. Kumon [1976], indica que la estimulación eléctrica del VMH en conejos, causa un aumento en la concentración de glicerol en plasma, sugiriendo un aumento de la síntesis de ácidos grasos saturados (35). Shimazu [1981] , demostró que, al hacer una adrenalectomía bilateral, se mantenía la respuesta lipogénica (proporción o síntesis de ácidos grasos) inducida por la estimulación eléctrica en el VMH, concluyendo de manera contundente que el hipotálamo tiene un efecto dominante para la movilización de grasa (30). En el hígado, la activación de laAMPK inhibe la síntesis de la glucosa y lípidos, además de incrementar la β-oxidación de ésta (36); por lo que de manera colectiva (a nivel central y periférico), la AMPK genera una protección contra el desarrollo del hígado graso al disminuir la síntesis de triglicéridos y su posterior acumulación de la grasa a través de la homeostasis de glucosa, glucogenólisis, gluconeogénesis y síntesis de lípidos de novo(37). Debido a que la leptina modula la actividad de la AMPK y la homeostasis de ácidos grasos (38), es interesante observar como niveles altos de endocannabinoides se relacionan con la deficiencia en la síntesis o uso de la leptina en varios modelos murinos. Tal es el caso de los ratones db/db (expresan un receptor de leptina deficiente), los cuales presentan hiperfagia y obesidad congénita acompañada de elevados niveles hipotalámicos de endocannabinoides que pueden normalizarse con la administración exógena de leptina (39).
También, se ha demostrado que, en ratas privadas de alimento durante un corto período, los niveles de endocannabinoides hipotalámicos se incrementan al igual que los niveles de leptina en plasma y estos últimos tienden a disminuir durante la ingesta de alimentos. Lo anterior sugeriría que los altos niveles de endocannabinoides son causantes de los altos niveles plasmáticos de leptina y que posiblemente regulan de manera positiva o negativa los efectos hipotalámicos conocidos de esta hormona (40- 42). Por otro lado, se ha demostrado que los endocannabinoides pueden regular la homeostasis de ácidos grasos en el cuerpo por otros mecanismos independientes de la leptina. Osei-Hyiaman et al. [2005] han sugerido una participación directa de la activación de los receptores CB1 en la estimulación de la enzima lipogénica sintasa de ácido grasos (FAS) en el hipotálamo, lo cual genera la estimulación de la producción de ácidos grasos libres de manera sistémica y aumenta la ingesta de alimentos. Lo anterior se demostró a través de la administración oral de SR141716A (antagonista de CB1), lo que redujo tanto la ingesta, así como la expresión en el hipotálamo de la proteína de unión al elemento regulador del esterol (SREBP-1c) y FAS, bajo condiciones de ayuno durante 24 horas, seguida de una realimentación a libre demanda con una dieta alta en carbohidratos (19,20).
Otro estudio llevado a cabo a nivel hipotalámico en ratas, ha propuesto una interacción entre los CB y el AMPK, la cual estimula la oxidación de ácidos grasos de acuerdo con el estado hormonal y nutricional del cuerpo (43). Por ejemplo, cuando se presenta un aumento en la fosforilación de AMPK en los tejidos periféricos tales como el músculo esquelético y el adiposo, regulado por la leptina y las adiponectinas, disminuye la síntesis de ácidos grasos y aumenta la oxidación de éstos, aumenta la biogénesis mitocondrial, además de incrementar la absorción de glucosa y su posterior oxidación. (44).
Kola et al. [2005] demostraron que los cannabinoides modulan la activación del AMPK tanto a nivel central (cerebro) como a nivel periférico (en órganos y tejidos), lo cual explica los efectos orexigénicos de los cannabinoides en el hipotálamo de ratas, así como sus efectos lipogénicos en los tejidos periféricos, debido a que la administración de 2-AG en ratas aumenta la actividad global de AMPK fosforilado en el hipotálamo; así mismo después de la activación de AMPK, la fosforilación de la acetil-CoA carboxilasa de tipo 1 (ACC1) y de tipo 2 (ACC2) parecían incrementarse en el VMH después de la inyección de los cannabinoides (45). La inactivación de las dos isoformas de ACC daría lugar a una inhibición de la síntesis de ácidos grasos y la estimulación de la oxidación de éstos en el hipotálamo, por lo cual, fue sugerido que los cannabinoides podrían potencialmente aumentar el apetito por estimulación central de la AMPK o facilitando las acciones de reparación de AMPK en el hipotálamo (percepción de la privación energética).
En otro estudio, se probó que una inyección directa de anandamida en el VMH induce significativamente la hiperfagia, la cual puede disminuirse con el tratamiento previo de SR141716A (46). Se sabe que en el núcleo paraventricular del hipotálamo (PVN), los glucocorticoides generan una rápida y aguda retroalimentación sobre las aferencias glutamatérgicas que estimulan la liberación de varios péptidos que, a su vez, está mediada por acciones retrógradas de los endocannabinoides, así como la liberación del glutamato (47). Este proceso implica una rápida estimulación de la síntesis de los endocannabinoides a través de una vía Gsα-AMPc-PKA que estimula la membrana plasmática del receptor de glucocorticoides. Esta síntesis y liberación de endocannabinoides es contrarrestado por la hormona leptina a través de la estimulación de la fosfodiesterasa-3B y, a su vez, una disminución en los niveles de monofosfato cíclico de adenosina (AMPc) (48). Este mecanismo en parte podría explicar por qué la señalización defectuosa de la leptina está asociada con niveles hipotalámicos elevados de endocannabinoides en modelos obesos de ratón db/db, ob/ob y ratas Zucker.
En cuanto a la hormona adrenocorticotropa (ACTH) y los glucocorticoides, se ha demostrado que la activación del CB1 aumenta sus niveles en plasma y los niveles de RNA mensajero (RNAm) en el hipotálamo de la proopiomelanocortina (POMC) y de la hormona liberadora de la corticotropina (CRH) (49) y que el efecto de Δ9-THC en los niveles de glucocorticoide es contrarrestado por SR141716A (50), lo que indica que los endocannabinoides intervienen en la regulación de la ingesta a través de varias vías neuronales que se correlacionan con AMPK, el cual es un integrador de señales hormonales y regulador de la energía en muchos mamíferos. En los ratones CB1 -/-, ocurre una desregulación generalizada del eje hipotalámico-hipofisario-adrenal (HPA). Estos animales exhiben un aumento de los niveles de corticosterona en el pico circadiano y aumento de la expresión del RNAm de la CRH en el PVN, así como la sobre activación en la liberación de ACTH y la fosfoserina hipofisaria, lo cual también explicaría la resistencia a cortisol presente en algunos pacientes con diabetes y obesidad (47,50). También se ha demostrado que el SR141716A estimula los niveles de corticosterona circulantes basales y la actividad del eje HPA en ratas obesas privadas de alimento (51).
La ghrelina y Δ9-THC pueden suprimir fuertemente a AMPK en los tejidos adiposos y en el hígado, a diferencia de la estimulación que se genera en el hipotálamo (45). Es decir, la activación de los CB por Δ9-THC suprime tanto la captación como la oxidación de la glucosa en el hígado y, en paralelo, inhibe la liberación de enzimas que controlan la gluconeogénesis. Aunque el rol de CB1 no era investigado por los autores, este mecanismo podría explicar por qué la AEA reduce la tolerancia a la glucosa in vivo en ratas (52). Curiosamente, esta dicotomía periférica versus efectos centrales también existe para la leptina, la cual inhibe la actividad de AMPK en el hipotálamo y la activa en los tejidos periféricos (53).
A pesar de que no se conocen con exactitud los mecanismos para explicar este fenómeno, una idea interesante es la presunta heterodimerización entre los CB1 y los receptores de ghrelina, así como de leptina (54). El CB1 y los receptores para péptidos orexigénicos, tales como el receptor de orexina-1, pueden formar un heterodímero que resultaría en una eficiente entidad funcional factible a la desensibilización cruzada entre ligandos (55). Tales heterodímeros entre los receptores de ghrelina/ leptina/CB1 pueden, por lo tanto, coexistir en el hipotálamo, pero no en la periferia, lo que explicaría el control central frente al efecto opuesto que se genera en los tejidos periféricos por parte de la ghrelina, la leptina y los endocannabinoides.
Control del metabolismo lipídico a nivel hepático por el SEC. Aunque la evidencia indica que el SEC desempeña un papel clave en la patogénesis de muchas enfermedades hepáticas, el informe inicial sobre la presencia e importancia de la función que desempeña este sistema en el hígado fue completamente inesperado (20). De hecho, durante muchos años se estudió la función de los CB1 estudiando el papel que tendría el hígado en su regulación negativa (56). Normalmente, la expresión de CB1 y CB2 en este órgano es bastante baja (20,57,58), pero durante las patologías hepáticas se manifiesta un incremento en la expresión de dichos receptores (15,59).
Los CB1 se expresan en los hepatocitos (60), las células estrelladas (61), miofibroblastos hepáticos (62) y en células del endotelio vascular (63). Mientras que CB2 se expresan en las células de Kupffer y miofibroblastos hepáticos (62), pero en los hepatocitos de animales jóvenes y en aquellos que poseen un buen estado de salud, estos receptores no son expresados (64). En el hígado sano, los endocannabinoides están presentes en niveles que son comparables a los encontrados en el cerebro (20,65). Mientras que la creciente evidencia sugiere que el sistema endocannabinoide está involucrado en varias patologías del hígado, como la fibrosis hepática, cáncer, cirrosis y el síndrome de isquemia-reperfusión hepática.
Función de CB1 en la lipogénesis de novo hepática. Es ampliamente reconocido que el consumo de energía y la utilización de las grasas están reguladas en una forma organizada y que la estimulación de CB1 en adipocitos afecta al metabolismo de los lípidos a través de la desregulación de la síntesis de adiponectina (66), el aumento de la actividad de la lipoproteína lipasa (29), así como también un aumento de la oxidación de lípidos y el estrés oxidativo (67). Sin embargo, el papel del tejido adiposo en la lipogénesis es menos significativo en comparación con la del hígado, ya que el tejido adiposo solamente se encarga de aportar del 20 al 30% de los ácidos grasos circulantes en la sangre, los cuales deben metabolizarse por el hígado (32). Recientemente, pruebas clínicas indican que la obesidad inducida por una dieta alta en grasa (HFD) se asocia con un aumento de la lipogénesis de novo hepática a pesar de la mayor disponibilidad que presenta la grasa dietaria (68). La posibilidad de que el SEC esté implicado en la regulación de la lipogénesis hepática de novo es tema de estudio en muchas investigaciones recientes.
Osei-Hyiaman et al. [2005] proporcionaron la evidencia inicial para la participación del CB1 en la lipogénesis, mediante el uso de un modelo CB1-/-, el cual no presentó respuesta lipogénica hepática al ser estimulado con un agonista farmacológico de CB. Asimismo, en los ratones silvestres de esta cepa que fueron tratados con un antagonista del CB1, se observó una inhibición de la lipogénesis hepática (20). Los ratones referidos también mostraron una resistencia completa de la esteatosis hepática inducida por HFD, mientras que los animales silvestres con la misma dieta, desarrollaron esteatosis hepática severa (20). La inyección intrahepática con HU-210 (agonista de CB1) en dosis de 120 mg/kg aumenta los niveles de expresión hepática de SREBP-1c y sus genes diana: ACC1, FAS y estearoil-CoA desaturasa-1(SCD1), los cuales son necesarios para la síntesis de ácidos grasos en el hígado, efecto que está ausente en los ratones con deficiencia sistémica del CB1 (20).
Otros estudios también han demostrado que el bloqueo farmacológico del receptor CB1 causa una disminución en la expresión de genes relacionados con la lipogénesis (SREBP-1c, FAS y glucocinasa) en el hígado de ratones adultos con dieta hipercalórica (58). Este efecto es semejante al que se reporta por la acción de AM251 (fármaco antagonista del CB1) en el modelo de pez cebra desde los siete a 15 días posteriores a la fertilización (69).
En humanos, se ha demostrado que el aumento en la concentración hepática de 2-AG, así como la producción esplácnica de triglicéridos que contienen ácidos grasos saturados se correlacionan positivamente con el contenido de grasa en el hígado (70). Estos datos sugieren que los CB1/2 presentes en el hígado se activan por 2-AG, lo que produce un exceso en la lipogénesis de novo, aumento en el contenido de triglicéridos, ácidos grasos saturados, que lleva consigo al desarrollo de esteatosis hepática. En ratones obesos inducidos por HFD, los niveles hepáticos de AEA y la expresión de CB1 se incrementan en comparación con los animales alimentados con una dieta estándar (19,58). Este hallazgo sugiere que la ingesta de HFD activa al SEC a nivel hepático, lo que podría contribuir a una mayor lipogénesis de novo hepática. A pesar de que los niveles hepáticos de AEA eran mayores durante el consumo de HFD, la tasa de biosíntesis de la EAE se mantuvo sin cambios. Por otra parte, la tasa de catabolismo AEA se redujo debido a la disminución de la actividad de la enzima amida hidrolasa de ácidos grasos (FAAH), enzima que participa de manera principal en el catabolismo de la AEA (20). Esto podría explicar por qué una HFD específicamente aumenta los niveles de AEA y no los niveles de 2-AG.
Estos hallazgos sugieren que los lípidos presentes en órganos periféricos inhiben la actividad de FAAH (71), y que una HFD puede inducir la generación de inhibidores endógenos de FAAH que permitan la activación del SEC. Demizieux et al. [2016] demostraron que la activación de CB1 en el hígado, promueve la síntesis de ácidos grasos monoinsaturados (MUFAs) mediante el aumento de la actividad de SCD1. Los MUFAs producidos endógenamente podrían actuar como potentes inhibidores de FAAH y, por lo tanto, ser responsables del aumento de los niveles hepáticos de AEA en ratones obesos inducidos por HFD (72). Además, a diferencia de los ratones silvestres, los animales deficientes de SCD1 son resistentes a la correspondiente disminución en la actividad de FAAH, inducida por HFD y el aumento de AEA hepático. Por lo consiguiente, es de esperar que se presenta una atenuación en las alteraciones metabólicas cuando se inhibe SCD1 (73). Tomados en conjunto, estos datos revelan un bucle de retroalimentación positiva entre el hígado y el SEC dirigido principalmente por CB1 y SCD1, los cuales contribuyen al aumento de la lipogénesis hepática de novo en la obesidad.
Utilizando un enfoque químico para analizar los efectos del aumento de la señalización de endocannabinoides a nivel hepático, Blankman et al. [2007] inhibieron la degradación de 2-AG mediante la inhibición de la enzima monoacilglicerol lipasa (MAGL) en ratones, encontrando que los niveles elevados de 2-AG dan como respuesta el aumento de expresión de SREBP-1c y FAS a nivel hepático, así como un incremento en la acumulación de triglicéridos y la depleción de las apolipoproteínas de tipo E (apoE), las cuales se encargan principalmente de retirar los triglicéridos en el plasma (74). Por lo que, de manera global, estos antecedentes implican una hiperactivación de los ligandos del SEC y los CB como la causa de la lipogénesis de novo hepática. Conjuntamente, la evidencia reciente sugiere que el bloqueo de CB1 reduce la lipogénesis de novo hepática, ya que en ratones que reciben una HFD y SR141716A, se reduce notablemente la velocidad de síntesis hepática de ácidos grasos (20). Shi et al. [2014] demostraron que la activación de CB1 está correlacionada positivamente con la expresión de SREBP-1c, al mismo tiempo que libera las cascadas de señalización para ACC1 y FAS en células HepG2 expuestas a concentraciones elevadas de ácidos grasos saturados e insaturados para simular in vitro los mecanismos celulares presentes en el hígado graso no alcohólico, cabe resaltar que dichos efectos pueden inhibirse por completo cuando las células reciben conjuntamente SR141716A y ácidos grasos saturados (75).
Efecto del bloqueo de CB1 en el metabolismo lipídico. El mecanismo por el cual el bloqueo de CB1 con SR141716A disminuye la lipogénesis de novo hepática descrito por Wu et al. [2011], se puede resumir de la siguiente manera: el SR141716A disminuye la lipogénesis a través de AMPK, el cual utiliza la vía dependiente del eje proteína cinasa A- cinasa B1 (PKA/LKB1) del hígado y la inhibición (Gαi/0) posterior de esta vía utilizando AMPc (76). AMPK, a su vez, inactiva al receptor hepático X alfa (LXRα), el cual funciona como sensor de los lípidos y estimula la síntesis de ácidos grasos y la acumulación de triglicéridos en los hepatocitos (77). Con base en lo anterior, probablemente la estimulación de CB1 y G αi/0 se hace a través de un mecanismo similar, pero con efectos opuestos. En ratones a los cuales se les indujo hígado graso, se observó un incremento en el nivel de expresión hepática de CB1 y la cantidad de 2-AG en las células estrelladas del hígado. Estos resultados sugieren un mecanismo paracrino mediante el cual, el 2-AG derivado de las células estrelladas hepáticas activa a CB1 en los hepatocitos adyacentes para estimular la lipogénesis de novo hepática (60). De hecho, la exposición de etanol aumenta la expresión hepática de SREBP-1c y FAS, un efecto que se denota ausente en ratones con deficiencia generalizada de CB1 y en ratones con deleción de CB1 específica en los hepatocitos (LCB1 -/-)(78).
Por otro lado, el bloqueo de CB1 con SR141716A y con JD5037 revierte la exacerbada translocación de ácidos grasos causada por CD36, que ocurre comúnmente al recibir una HFD (79), lo que ha sugerido que la deleción especifica de CB1 en adipocitos, protege a los ratones de la esteatosis hepática inducida por una HFD (80). Además, se observó que los ratones CB1-/- no desarrollaban obesidad a pesar de ser alimentados con una HFD, también presentaban una disminución en la actividad de FAAH, en comparación con los controles silvestres, los cuales tenían niveles hepáticos elevados de CB1 y de ADA, acompañada de una estimulación sostenida de la síntesis de ácidos grasos en el hígado (19).
De manera semejante los ratones LCB1-/- alimentados con HFD, no presentan esteatosis, ni dislipidemia, así como tampoco resistencia a la insulina; demostrando que la activación de CB1 a nivel hepático contribuye al desarrollo de esteatosis inducida por la dieta (81). En este mismo estudio, se observó que el bloqueo de CB1 también reduce la oxidación de ácidos grasos y evita la liberación de las lipoproteínas de muy baja densidad (VLDL) ricas en triglicéridos. Por lo cual, todos los hallazgos descritos anteriormente sugieren un papel crucial de los CB1 hepáticos en la lipogénesis, contribuyendo así a la acumulación de grasa en el hígado (Figura 5). Sin embargo, los resultados no descartan la posibilidad de que este efecto también sea atribuible a una influencia extrahepática de la activación de los CB1.
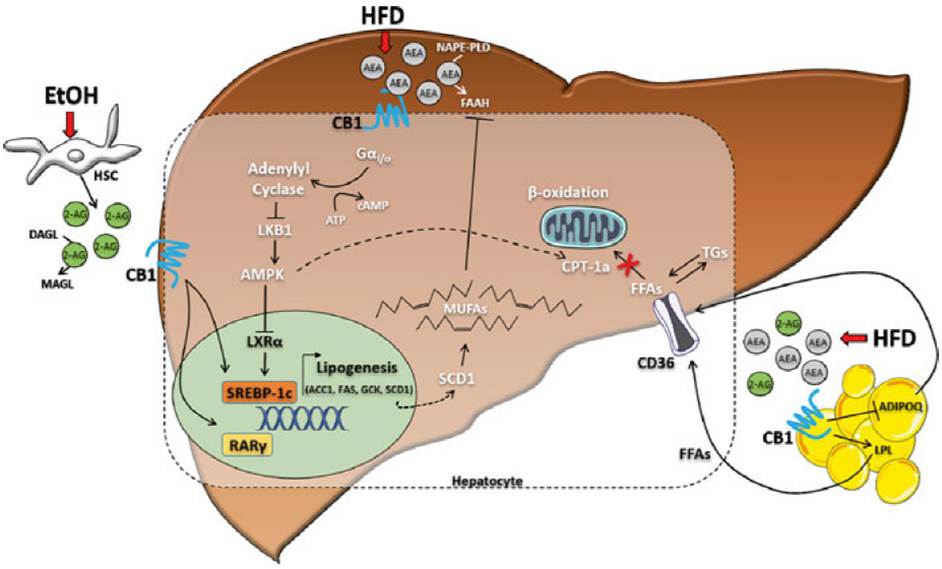
Figura 5 Papel de los receptores CB1 en la lipogénesis hepática. HFD: dieta alta en grasas, AMPc: adenosina monofosfato cíclico, LKB1: Serina/treonina cinasa B1 del hígado, AMPK: proteína cinasa activada por mitógenos, LXR α:receptor X del hígado, SREBP-1c: proteína de unión al elemento regulador del esterol, ACC1: acetil-CoA carboxilasa-1, FAS: ácido graso sin- tasa, SCD1: estearoil-CoA desaturasa-1, GCK: glucocinasa, RARγ: receptor-gamma del ácido retinoico, DAGL: diacilglicerol lipasa, MAGL: monoacilglicerol lipasa, FAAH: hidrolasa de amida de ácido graso, NAPE-PLD: Los ácidos grasos libres N-acil fosfatidiletanolamina fosfolipasa D, ácidos grasos libres, TGS: triglicéridos, LPL: lipoproteína lipasa, ADIPOQ: adiponectina, CPT: carnitina palmitoil transferasa-1 alfa, AEA: anandamida, 2-AG:2 araquidonilglicerol.
CB2 y su implicación en la lipogénesis. En contraste al receptor CB1, la función de CB2 en la regulación de la lipogénesis hepática no está completamente elucidada. La expresión de CB2 en condiciones fisiológicas durante la edad adulta es casi indetectable en el hígado, contrario a lo que ocurre durante el desarrollo embriogénico (82), en la regeneración hepática (62) y algunas patologías como lo es el hígado graso no alcohólico (59), fibrosis hepática (83), y carcinoma hepatocelular (84). La participación de CB2 en el metabolismo de los lípidos se sustenta en el incremento de la expresión de este receptor reportado en roedores ob/ob y en ratones inducidos a obesidad por una HFD.(59). Puesto que los ratones que son deficientes del CB2, presentan una resistencia al desarrollo de esteatosis hepática inducida por HFD y la administración de agonistas del CB2 aumenta la acumulación de triglicéridos en el hígado en ratones silvestres alimentados con una HFD (85).
También se sabe que los ratones deficientes de CB2 (CB2 -/-) presentan una resistencia a la esteatosis hepática inducida por una HFD en comparación con los correspondientes ratones silvestres, a pesar de que ambos grupos tenían igual consumo de alimento. En este mismo sentido, otros estudios refuerzan el posible papel de CB2 en la acumulación de lípidos, para tal caso se ha visto que al aplicar un tratamiento con AM1241 (agonista de CB2) en células HepG2 presenta un aumento de la expresión de FAS, lo que desencadenaría un incremento en la acumulación de lípidos (86). Cabe mencionar que, debido a que la expresión del CB1 es también regulada positivamente por AM1241, puede existir una regulación recíproca entre los CB1 y CB2, la cual gobernaría el efecto de lipogénesis.
Así mismo, en otro estudio donde se utilizaron ratas Wistar, a las cuales se les indujo cirrosis y se les trató con un agonista del CB2, la expresión proteica del receptor estuvo positivamente relacionada con CD68 y la apoptosis en miofibroblastos, además de una disminución del contenido de fibras de colágeno en el hígado (87). Acciones semejantes se han descrito en pacientes diagnosticados con hígado graso no alcohólico, al mismo tiempo que se ha indicado una correlación positiva entre el daño del hepatocito y la mayor expresión de CB2 en hepatocitos y colangiocitos (59). A pesar de la evidencia antes mencionada, hacen falta más estudios para delinear de manera puntual el papel esteatogénico específico de los CB2.
Papel terapeútico del bloqueo de los CB. El papel central del SEC en la patogénesis de la diabetes mellitus tipo 2 (DM2) se apoya por los niveles elevados de endocannabinoides en los pacientes diabéticos, ya que éstos presentan niveles séricos y subcutáneos de AEA y 2-AG más altos que en individuos sanos (88). Es interesante que ratones obesos con señalización defectuosa de leptina (ratones ob/ob y db/db) muestran niveles hipotalámicos elevados de endocannabinoides (ADA y 2-AG), indicando que los niveles hipotalámicos de endocannabinoides están inversamente correlacionados con los niveles sanguíneos de la hormona leptina (39). Debido a lo anterior, se podría inferir que la sobreestimulación de los CB comenzaría por desencadenar una resistencia a nivel hipotalámica de la leptina y un aumento en la vía de señalización de la lipogénesis hepática (SREBP-1c, FAS y ACC1) que, con el tiempo se convertirían en factores primarios para el desarrollo de DM2, debido a que estas proteínas regulan de manera indirecta la glucemia (20).
El bloqueo de CB1 con SR141716A ha sido prometedor en los ensayos clínicos, lo que lleva a la pérdida de peso y la mejora de varios factores de riesgo metabólicos que no pueden explicarse únicamente por la pérdida de peso observada, tal como un aumento en los niveles de las lipoproteínas de alta densidad y disminución de los niveles de triglicéridos. El estudio clínico “SERENDANE”, el cual tenía el objetivo de aclarar la eficacia y seguridad del fármaco SR141716A en pacientes con sobrepeso y obesos que además padecieran DM2, y que hubieran tenido un inadecuado control glucémico con metformina o sulfonilureas. En el mencionado estudio se observó que, al recibir el tratamiento con SR141716A, los sujetos mostraban una mayor pérdida de peso, reducción de circunferencia de la cintura, niveles de hemoglobina A1c y menores concentraciones de glucosa en ayuno, así como una mejora significativa en las lipoproteínas de alta densidad, colesterol, triglicéridos, lipoproteínas de baja densidad y presión sistólica en comparación con el grupo placebo (89).
De igual forma en el estudio “ARPEGGIO”, se evaluó la eficacia y seguridad del uso de SR141716A en pacientes con DM2 que tuvieran un tratamiento habitual con insulina, sin excluir a los que presentaban antecedentes de enfermedad psiquiátrica. Sin embargo, a pesar de la mejoría glicémica y disminución en los factores de riesgo metabólicos, se tuvo que detener el ensayo debido a la presencia de ideación suicida, indicios de depresión y psicosis asociados al uso del medicamento(90). Finalmente en el estudio “CRESENDO”, destinado a evaluar el efecto de SR141716A sobre enfermedades cardiovasculares y su seguridad enfocada a la aparición de síntomas psiquiátricos, tuvo que interrumpirse a los tres meses de su comienzo, debido a la aparición de signos asociados a un estado mental anormal, entre lo que destacaba comportamiento depresivo (91). Por lo que, a pesar de que el bloqueo de los CB con SR141716A puede tener efectos cardioprotectores, también presenta la desventaja de generar alteraciones neuronales que ponen en riesgo la integridad personal de quien lo consuma, en consecuencia, su uso en humanos fue prohibido por la Agencia de Administración de Alimentos y Medicamentos de los Estados Unidos (FDA por sus siglas en inglés) y actualmente se siguen buscado alternativas más inocuas para la regulación de los CB.
Mangiferina y lipogénesis. El término “alimento funcional” se utilizó por primera vez en Japón, en el año de 1980, para la designación de productos alimenticios fortificados con constituyentes especiales que poseen efectos fisiológicos benéficos para la salud (92). Es importante mencionar que solamente puede considerarse funcional sí además de tener un impacto nutricional básico (aporta macro y micro nutrientes), tiene efectos benéficos en una o más funciones del organismo humano, mejorando así las condiciones físicas, al disminuir el riesgo de desarrollar alguna enfermedad (93). Los polifenoles en las plantas abarcan una amplia variedad de compuestos entre los que se encuentran los ácidos fenólicos (ácido cinámico, ácido benzoico y sus derivados), fenilpropanoides, glucósidos feniletanoides, flavonoides, estilbenos y xantonas (94).
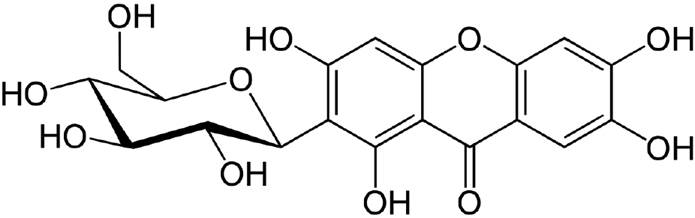
El compuesto fitoquímico representativo del mango es la mangiferina (MGF) o 1,3,6,7-tetrahidroxi- 2-[3,4,5-trihidroxi-6-(hidroximetil) oxan-2-il] xantin-9-ona (Figura 6)(95), como resultado de la biosíntesis entre el ácido shikímico y aminoácidos aromáticos, tales como la fenilalanina o la tirosina (96). La MGF se encuentra mayoritariamente en la pulpa, la cáscara así como en la semilla (97), aunque ésta se puede encontrar en menor concentración en otros frutos y partes de otras plantas (Cuadro 1) (98).
Cuadro 1 Fuentes vegetales de mangiferina
| Fuente | Especie | Familia | Órgano de la planta | Contenido de Mangiferina (% de masa seca) |
|---|---|---|---|---|
| Mango | Mangifera Indica y otras especies (M. pajang, M. odorata,M. persiciformis, M. zeylanica) | Anacardiaceae | Corteza, hojas y fruto |
Hojas: 3.7-10.8 Corteza: 1.2-1.8 Cáscara: 0.15 |
| Plantas florales | Aphloia theiformis | Aphloiaceae | Hojas | 2.0-9.0 |
| Plantas Agavóideas | Anemarrhena asphodeloides | Asparagacee | raíz | 1.0-5.2 |
| Plantas florales de Argentina | Arrabidaea samydoides, A. patellifera, |
Bignoniaceae | Hojas | >0.1 |
| Ayurvédica | Salacia reticulata, S. chinensis, S. obonga | Celastraceae | Raíz |
S. chinensis: 1.6 S. reticulata: 1.4 |
| Planta parásita | Cuscuta reflexa Cuscutaceae Cyclopia genistoides, C. intermedia, C. subternata, C. maculata | Fabaceae | Hojas | 1.6-3.6 |
| Planta floral | Hedysarum flavescens, H. alpinum, H. obscurum Fabaceae | Fabaceae | Partes aéreas |
H. alpinum: 1.9 H. Flavescens: 1.2 |
| Planta de manzanilla | Tripterospermum japonicum Canscora | Gentianaceae | Partes aéreas | > 0.17 |
| Hierba | Canscora decussata Gentiana | Gentianaceae | Planta completa | 2.3 |
| Hierba de San Ladislao | Gentiana sp., (G. lutea, G. punctata, G. rhodanta, Gentianella acuta). | Gentianaceae | Raíz, planta completa, hojas y flores | Hojas de G. Lutea: 3.9 Flores:1.0 |
| Ofelia | Swertia sp. | Gentianaceae | Partes aéreas |
S. mussotii: 4.4 S. franchetiana: 0.6 |
| Planta floral | Hypericum sp. (26 espeies) | Hypericaceae | Partes aéreas | > 0.21 |
| Planta Fanerógama | Cyclopia Genistoides | Fabaceae | Planta completa | 7.9-9.9 |
| Planta Fanerógama | Cratoxylum cochinchinense Iris | Hypericaceae | Hojas | 0.23 |
| Lirio leopardo | Iris domestica (Belamcanda chinensis) | Iridaceae | raíz | 0.31-3.60 |
| Planta floral | Iris sp. | Iridaceae | Raíz y hojas | > 0.73 |
| Algodonero rojo | Bombax malabaricum | Malvaceae | Hojas | 98 mg aislados de 500 g |
| Café | Polygala hongkongensis Coffea | Polygalaceae | Partes aéreas | > 0.4 |
| Café | Coffea pseudozanguebariae | Rubiaceae | Hojas | > 6.0 |
| Café | Coffea arábica | Pseudozanguebariade | Grano | 8.6-11.39 |
| Arbusto | Phaleria cumingii | Thymelaceae | Hojas | > 0.46 |
| Hierba | Aquilaria sinensis | Thymelaceae | hojas | > 0.01 |
| Helecho | Davallia subsolida Trichomanes | Davalliaceae | Raíz | > 0.0038 |
| Curcumina (raíz) | Curcuma amada | --- | --- | 41µg/mL |
(Tomado de Matkowski et al., 2013)
Paralelamente, algunos estudios recientes se han concentrado en demostrar las acciones antioxidantes (99), inmunomoduladoras (100), antitumorales (101), cardioprotectoras de la MGF (102), así como en dilucidar la participación de la MGF en el metabolismo de los lípidos entre los que destaca su acción de regulación a través del glicerol fosfato y la biosíntesis de sales biliares(103). De igual manera, la administración de MGF regula negativamente algunas proteínas consideradas como críticas para el proceso de lipogénesis, entre las que se encuentran los genes que regulan la expresión de ACC1 y SCD-1, y promueve una regulación positiva en las proteínas necesarias para la biogénesis energética por parte de la mitocondria, las cuales controlan de manera indirecta algunos de los procesos de lipogénesis de novo y previenen la adiposidad (104).
La MGF también promueve la oxidación de la glucosa en músculo de ratones alimentados con HFD, sin alterar el ritmo fisiológico de la oxidación de los ácidos grasos. En otro estudio se observó que la administración de MGF (50-150mg/kg de peso) en hámsteres con HFD, produjo una disminución de los niveles totales de ácidos grasos libres y triglicéridos en suero, así como una disminución en el peso y la grasa visceral (105). También se ha reportado que el tratamiento con MGF (50, 100, 150 mg/kg) durante seis semanas disminuye la cantidad de ácidos grasos libres en el hígado de ratones hiperlipidémicos e incrementa marcadamente la β-oxidación (106).
Existe una amplia cantidad de estudios que valoran la actividad hipolipidémica de este compuesto, algunos de ellos se enlistan en el Cuadro 2. De la misma manera se ha descrito que el tratamiento con MGF restaura los niveles séricos de colesterol total, triglicéridos y lipoproteínas de baja densidad (LDL) en roedores hiperlipidémicos a causa de una HFD o de diabetes (107). De la misma manera, el tratamiento con MGF reduce la concentración de ácidos grasos libres en el hígado de ratas alimentadas con HFD, a través de la activación de la lipasa mediante la vía de AMPK y la inhibición de la ACC (108).
Cuadro 2 Efectos de la mangiferina en el metabolismo de los lípidos
| Modelo | Dosis | Acciones | Referencia |
|---|---|---|---|
| In vitro | |||
| Células HepG2 | 25-400 µM de MGF/ml de medio. | Disminuye la acumulación de triglicéridos y aumenta la expresión de SREBP-1c, ChRE- BP, FAS y SCD1. | (111) |
| In vivo | |||
| Ratones C57BL/6 y KKAy | 100-200mg de MGF/kg de peso. | Inhibe la acumulación de lípidos totales en el hígado y TAG a través de la fosforilación de AMPK, LKB1, CaMKK y la activación de SREBP-1c. | (112) |
| Ratones C57BL6/J | 0.5 g MGF/g alimento | Disminuye la expresión y activación de va- rias proteínas relacionadas con la lipogénesis de novo en el hígado tales como SREBP-1c, PPARγ, OGDH y proteína DHTKD1, ACC y SCD1. | (104) |
| Ratones Kunming | 60mg MGF/Kg de peso | Disminuye el contenido de colesterol total, TAG en hígado y suero, así como la glucemia. Aumenta la activación del complejo PI3K/ AKT. | (113) |
| Ratas Wistar-Kyoto | 15mg MGF/Kg de peso | Disminuye la esteatosis hepática a través de una menor expresión de CD36 en el musculo e hígado. | (114) |
| Sub-clínicos | |||
| Sujetos obesos con hi- pertrigliceridemia | 150 mg/día | Disminución de TAG, y AFF, incremento de HDL, L-carnitina y HOMA-IR | (115) |
MGF: mangiferina; SIRT-1; sirtuina-1; AMPK: proteínas cinasas activadas por mitógenos;TAG: triglicéridos; AFF: proteína de fusión celular aff-1; HDL: lipoproteína de alta densidad; HOMA-IR: índice de resistencia a la insulina HOMA; PPARγ: receptor activado por el proliferador de peroxisoma de tipo alfa; OGDH: oxoglutarato deshidrogenasa; DHTKD1: deshidrogenasa E1 y transcetolasa con un dominio; ACC: acetil- CoA carboxilasa; SCD1: estearoil-CoA desaturasa-1. LKB1: Serina/treonina cinasa B1 del hígado, CaMKK: calcio calmodulina cinasa II; PI3K/AKT: Fosfatidilinositol 3- cinasa/ proteína cinasa B.
Recientemente Lim et al. [2014] proporcionó información sobre los mecanismos a nivel molecular por los cuales la MGF ejerce sus efectos hipolipidémicos en el hígado, planteando principalmente estas acciones a través de la disminución en la expresión de ACC y SCD1. Los autores referidos reportan que al, disminuir la expresión y por lo tanto, la acción de ACC en la carboxilación del acetil-CoA y producción de malonil-CoA, se favorece que la carnitina-acil-transferasa I (CAT I) incremente la entrada de grupos acilo en la mitocondria, lo que generará un aumento en la degradación de ácidos grasos (109), al mismo tiempo que es capaz de suprimir al regulador transcripcional maestro de la lipogénesis (SREBP) (104). También se ha reportado como un agente para la prevención de enfermedades cardiovasculares principalmente por sus efectos anti-hiperlipidémicos en parte porque es capaz de aumentar la oxidación de ácidos grasos (110). Estos datos plantean de manera sólida que la MGF promovería la lipolisis a través de una regulación negativa de las proteínas que utiliza el SEC para la lipogénesis en el hígado.
CONCLUSIÓN
Existe evidencia científica preliminar para inferir que la MGF podría ser un excelente compuesto bioactivo para el control del metabolismo de los lípidos a nivel hepático, así como para ejercer una disminución en la activación de algunos de los receptores del SEC, en particular del CB1. Sin embargo, hacen falta más estudios enfocados a corroborar que el bloqueo de los receptores del SEC por parte de la MGF permite mejorar la regulación del metabolismo lipídico. Lo anterior deberá abordarse en las nuevas investigaciones al respecto.











 nueva página del texto (beta)
nueva página del texto (beta)