Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista bio ciencias
versión On-line ISSN 2007-3380
Revista bio ciencias vol.7 Tepic 2020 Epub 28-Abr-2021
https://doi.org/10.15741/revbio.07.e955
Artículos de revisión
Farmacología y Epidemiología de Opioides
1Unidad Académica de Ciencias Químicas, Universidad Autónoma de Zacatecas “Francisco García Salinas”, Carretera Zacatecas-Guadalajara Km 6, Ejido la Escondida C.P 98160, Zacatecas, Zacatecas, México.
2Pharmacy School, Medical College of Wisconsin, 8701 Watertown Plank Rd. Milwaukee, WI 53226. Milwaukee, Estados Unidos de America.
Desde hace muchos años, los opioides son los analgésicos más utilizados y efectivos para el tratamiento del dolor. Este trabajo da a conocer la clasificación farmacológica, usos terapéuticos, riesgos a la salud y reacciones adversas de los opioides como medicamentos, planteando el paradigma del usar este tipo de fármacos para el control del dolor. Sin embargo, su uso se ha convertido en un problema de salud en distintos países ya que en ciertas circunstancias tienen un alto potencial de causar adicción. Además de su uso contra el dolor, los opioides son utilizados como antidiarreicos, antitusivos y para el tratamiento de diversas sintomatologías. A pesar de los efectos adversos, del mal uso y abuso de los opioides, se consideran imprescindibles en la terapia contra el dolor. Actualmente las investigaciones farmacéuticas trabajan en la búsqueda constante de nuevos fármacos con efectos menos severos y con potencia analgésica.
Palabras clave: Dolor; Opioide; Adicción; Epidemia
Opioids have been used for many years as the most effective analgesics for pain management. This work discloses the pharmacological classification, therapeutic uses, health risks and adverse reactions of opioids as medicines, setting out the paradigm of using this type of drug to control pain. However, they have become a health problem in distinct countries, as they have a high addictive potential under certain circumstances. In addition to their use against pain, opioids are also employed as antidiarrheal, antitussive and for the treatment of diverse symptomatology. Despite the adverse effects, misuse and abuse of opioids, they are still considered as indispensable in pain therapy. Currently pharmaceutical research is working on the constant development for new drugs with less severe effects and a high analgesic potency.
Key words: Pain; Opioid; Addiction; Epidemic
Introducción
El dolor es un síntoma de la mayoría de los procesos patológicos clínico crónico, siendo los opioides ampliamente utilizados en la última década para su tratamiento (Cooper et al., 2017; Raub & Vettese, 2017). El término opioide se refiere a los compuestos con relación estructural a productos encontrados en el opio, a la fecha se han descrito más de 80 alcaloides de este tipo, la mayoría de ellos con propiedades terapéuticas. Al respecto, la morfina es uno de los alcaloides opiáceos más utilizados para el tratamiento del dolor, y presente en mayor proporción (4-21 %) en el jugo de la amapola real en comparación con otros alcaloides como noscapina, codeína, tebaína, papaverina y narceína (Khademi et al., 2016; Mesa-Vanegas, 2017).
El término opiáceo se utiliza para referirse a los compuestos procedentes del opio, mientras que un opioide es una sustancia endógena o exógena que tiene un efecto análogo al de la morfina. Debido a que desde hace 50 años, es posible obtener sustancias completamente sintéticas (Figura 1), casi sin relación química con la morfina pero con efectos similares a esta. Los fármacos opioides constituyen un grupo de fármacos que se caracterizan por poseer afinidad selectiva por los receptores opioides centrales y periféricos, inhibiendo la transmisión de entrada nociceptiva y la percepción del dolor (Pedrero-Pérez et al., 2020).
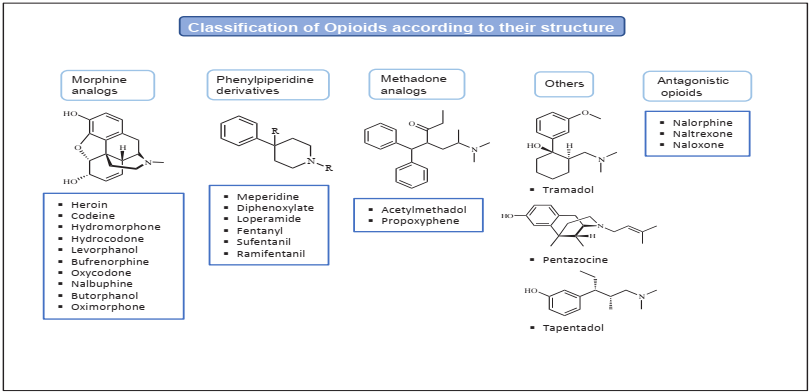
(Modificado de Devereaux et al., 2018).
Figura 1 Clasificación de los principales opioides de interés clínico en función a su estructura química.
El efecto analgésico de los opioides se debe a la unión de agonistas a receptores específicos acoplados a proteína G, localizados en el cerebro y la médula espinal. Investigaciones sobre el estudio de los receptores opioides señalan a estos como una buena opción para el tratamiento de dolor crónico y neuropático, así como también para depresión y ansiedad (Van Rijn et al., 2013). Otros trabajos reportan que receptores opioides están relacionados en la progresión del cáncer, como la expresión del receptor mu (MOR) asociados a carcinoma hepatocelular (Chen et al., 2018).
Receptores opioides
Existen tres clases principales de receptores de opioides, descritos en la Tabla 1, los cuales se encuentran en diversos sitios del sistema nervioso central (CNS) y otros tejidos, todos son miembros de la familia de receptores acoplados a la proteína G y muestran homología significativa de secuencias de aminoácidos. De las tres clases existentes los opioides se dirigen principalmente a los receptores MOR (Galligan & Sternini, 2016). Los diversos efectos farmacológicos de los opioides se deben a que estos pueden actuar con diferentes potencias como agonista, agonista parcial o antagonista en más de una clase de subtipo de receptor (Álvarez & Farré, 2005).
Table 1 Function and location of opioid receptor subtypes
| Receptor | Function | Location of opioid receptors |
|---|---|---|
| Μu (MOR) μ | Spinal, supra-spinal analgesia, sedation, inhibition of respiration, decreased intestinal transit rate, regulation of hormone and neurotransmitter secretion. | Brain: (Thalamus, caudate, amygdala, raphe nuclei, gray matter, hippocampus), dorsal horn, peripheral terminals, small intestine. |
| Delta (DOR) δ | Supra-spinal and spinal analgesia; regulation of the secretion of hormones and neurotransmitters | Brain (cortex, amygdala, hypothalamus, midbrain), spinal cord |
| Κappa (ΚOR) Κ | Supra-spinal and spinal analgesia; psychotomimetic effects; decreased gastrointestinal transit | Brain (cortex, thalamus, hypothalamus, gray matter, black matter, caudate, and putamen) |
(Modificado de Galligan & Sternini, 2016).
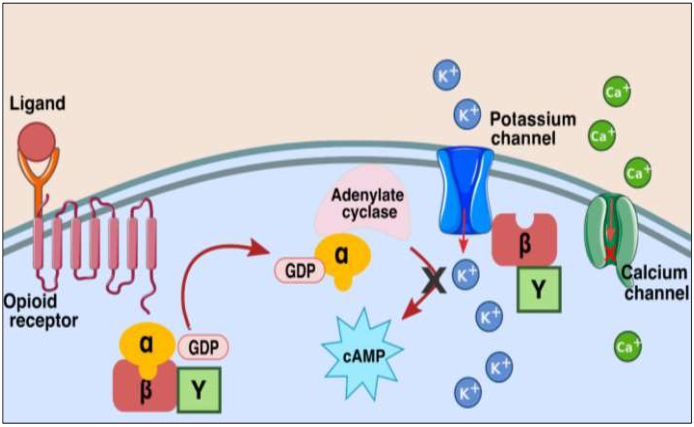
Cuando un receptor opioide resulta activado por su ligando, se inicia la cascada de pasos relacionados con su proteína G. Inicialmente, el receptor cambia de forma e interactúa con la proteína G en el lado intracelular. Luego, la subunidad “α” de la proteína G intercambia una molécula de GDP (guanosín difosfato) por una de GTP (guanosín trifosfato), lo cual provoca su separación de las subunidades “β” y “γ”. Después, la subunidad “α” se difunde a través de la membrana hasta encontrar su blanco. Esto puede conllevar a la unión con la enzima adenilatociclasa, con la consecuente inhibición de la producción del segundo mensajero AMPc (adenosín monofosfato-cíclico) y la afectación de una serie de cascadas de señalización que promueven la excitabilidad neuronal, que regulan la actividad de genes y la actividad de fosfatasas y quinasas.
De igual manera, la subunidad “α” de la proteína G puede cambiar la función de un canal iónico, por ejemplo, incrementando la conductancia del canal de potasio (generando hiperpolarización y disminución de la duración del potencial de acción) o disminuyendo la entrada de calcio a través de canales voltaje-dependientes, reduciendo así la liberación de neurotransmisores, en la Figura 2 se ilustran de manera esquemática esos efectos. Vistas en conjunto todas estas acciones conllevan a una reducción de la excitabilidad neuronal, con la consecuente disminución del tráfico de información nociceptiva en la vía del dolor y el respectivo logro de analgesia. Luego de un tiempo, el GTP es convertido en GDP, con lo cual el sistema retorna a su estado inicial de inactivación, con la reasociación de las tres subunidades de la proteína G.
Neuroanatomía de la adicción
Los receptores opioides están ampliamente distribuidos a través del cuerpo y expresados en diferentes tipos de células, incluyendo el CNS y periférico, células del sistema inmune, médula suprarrenal y las gónadas. Lo cual explica la amplia gama de efectos secundarios y su capacidad de modular diferentes procesos tanto fisiológicos como psicológicos (Kibaly et al., 2019).
Como se mencionó en la sección anterior, el efecto analgésico de los opioides es mediado por los receptores MOR, en específico el receptor para opioides mu/delta, lo cual resulta relevante desde el punto de vista neuroanatómico debido a que las regiones cerebrales que regulan la percepción del dolor (sustancia gris periacueductal, tálamo, corteza cingulada, ínsula) y la región de respuestas emocionales inducidas por el dolor (amígdala) contiene altos niveles de estos receptores. Además, otra de las regiones con una alta expresión de MORs son aquellas relacionadas con la experiencia del placer o recompensa a la hora de consumir opioides como el área tegmental ventral y el núcleo accumbens.
Los opioides también producen cambios a nivel del cerebro en las regiones asociadas a funciones cognitivas como el hipocampo, corteza temporal y parietal, que conducen a un déficit de atención, memoria, y alteraciones en el comportamiento, estos trastornos neuronales pueden afectar la adherencia a los tratamientos farmacológicos (D’Souza, 2019). Finalmente, los MORs se localizan también en el bulbo ventrolateral, lo cual explica por qué los opioides son capaces de ocasionar depresión respiratoria (Volkow et al., 2018). En la Figura 3 se ejemplifican la distribución de los receptores MOR en las diferentes regiones del cerebro.
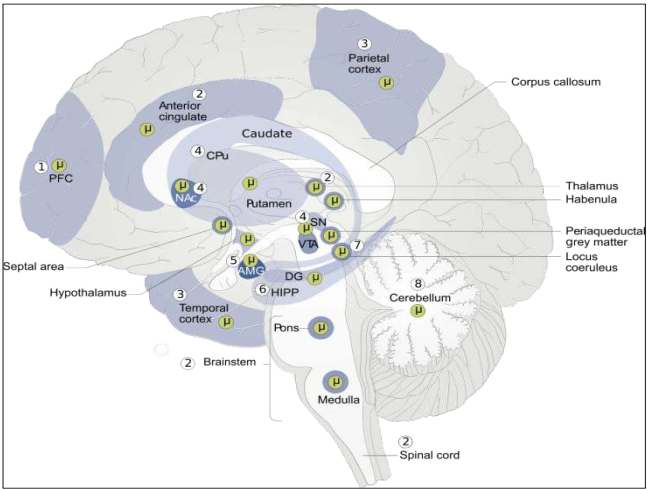
1) el control en la ingesta de alimentos y medicamentos esta regulado por MORs ubicados en la corteza prefrontal (CPF); 2) La activación de MOR en el cingulado anterior, el tálamo, tronco encefálico y médula espinal pueden inducir analgesia, respiración lenta y relajación; 3) La percepción sensorial puede verse influenciada por MOR en los lóbulos parietal y temporal; 4) La motivación, el deseo y el aprendizaje disociativo implican la estimulación de MOR en el núcleo accumbens (NAc), núcleo caudado, putamen caudado (PC), área tegmental ventral (ATV) y sustancia negra (SN); 5) la amígdala (AMIG) se requiere para el aprendizaje condicionado y la respuesta emocional; 6) La activación de MOR en el hipocampo (HIP) puede alterar el aprendizaje y neurogénesis; 7,8) MOR está presente tanto en el locus coeruleus como en el cerebelo, estructuras importantes en el estrés y la abstinencia de drogas (modificado de Kibaly et al., 2019).
Figura 3 Distribución de los receptores MOR en la corteza cerebral. Los opioides activan receptores ubicados en la corteza cerebral como los receptores μ (MOR), que desempeñan una variedad de funciones.
Analgesia y efectos secundarios
La activación de los receptores opioides produce una analgesia profunda mediada por un efecto presináptico y postsináptico combinados. Presinápticamente, los analgésicos opiáceos actúan sobre aferentes nociceptivas primarias (inhibición de los canales de calcio), dando como resultado la liberación reducida de neurotransmisores tales como la sustancia P y el glutamato implicados en la transmisión nociceptiva. Postsinápticamente, los analgésicos opiáceos inhiben directamente la actividad neuronal al hiperpolarizar las membranas celulares a través de la apertura de los canales de potasio (Galligan & Sternini, 2016). El tipo de interacción con estos receptores (excitación o inhibición) determina las distintas acciones de los fármacos opioides y sus efectos adversos.
Tomando en cuenta lo anterior, probablemente cada individuo tenga diferentes cantidades y subtipos de receptor. Además de la analgesia los opiáceos tienen otros usos terapéuticos prácticos como antitusivo y antidiarreico, debido a la reducción de la motilidad del tracto gastrointestinal por la acción de agonistas opioides exógenos en el sistema nervioso entérico (Farmer et al., 2019; Lee & Hasler, 2016).
Debido a la amplia distribución de receptores opiáceos tanto dentro como fuera del sistema nervioso, los analgésicos opioides también producen un amplio espectro de efectos adversos que incluyen euforia, disforia, sedación, depresión respiratoria, estreñimiento, supresión de sistemas endocrinos, trastornos cardiovasculares como prolongación del intervalo QT, convulsiones, náuseas, vómitos, prurito, miosis y boca seca; aunque el alcance de estos efectos adversos puede diferir entre los opiáceos individuales según la dosis o en combinación con benzodiacepinas o antidepresivos (Soleimanpour et al., 2016). Al respecto, resulta especialmente peligrosa la combinación con benzoadiacepinas debido a que hay evidencias que las últimas pueden potenciar el efecto de depresión respiratoria causado por los opioides, en USA se calcula que en el 30 % de las muertes relacionadas con la sobredosis de opioides existe una comorbilidad con el uso de benzodiacepinas (Sun et al., 2017).
Otro efecto secundario del uso crónico de los analgésicos opioides es un desbalance en la acción hormonal fisiológica o endocrinopatía, lo que puede traer como consecuencia el desarrollo de hipogonadismo en ambos sexos, contribuyendo al deterioro de la función sexual, mediante la disminución del libido y ocasionando infertilidad (Gudin et al., 2015). Además del efecto de los opioides en sus receptores afines y en las cascadas de señalización, estos compuestos también inducen múltiples adaptaciones a nivel celular y de comportamiento, las cuales se abordan en las siguientes secciones.
Desarrollo de tolerancia y adicción
La tolerancia a una droga específica es una respuesta fisiológica reversible a la persistencia y presencia de agonistas en varios receptores dentro del CNS, la mayoría de las veces como resultado del uso de opioides, benzodiacepinas o alcohol (Gil-Martín et al., 2014). El término tolerancia denota adaptación a los efectos de un medicamento que conduce a una disminución de sus efectos a pesar de consumir una dosis o concentración constante. La tolerancia es una consecuencia esperada por terapias de largo plazo, particularmente a altas dosis, donde el heterómero MO-DOR está implicado en mediar la tolerancia en humanos (Portoghese et al., 2017). Es importante distinguir la tolerancia a corto plazo o “aguda” que se desarrolla en cuestión de minutos o varias horas, por el contrario, una exposición larga a altas concentraciones de opioides producirá una mayor tolerancia que la exposición intermitente (Morgan & Christie, 2011). Todo individuo expuesto durante algún período a los opioides muestra cierto grado de tolerancia, y si el fármaco se retira en forma súbita, aparecen síntomas de abstinencia, cuya gravedad depende de la dosis y duración de la exposición al mismo, tal situación no implica por sí misma un estado de adicción. La Sociedad Americana de Medicina de la Adicción (ASAM, por sus siglas en inglés) señala que la adicción a los opioides se caracteriza por una pérdida de control sobre el consumo de drogas pudiendo ser el causante el factor social ambiental (Juurlink & Dhalla, 2012), otros factores involucrados son variaciones genéticas y/o alteraciones epigenéticas (Hancock et al., 2018). A nivel genético los riesgos de adicción a los opioides están asociado a alteraciones en los genes de canales de potasio (KCNC1 y KCNG2), a una proteína auxiliar del receptor glutamato (CNIH3), así como una variante del gen del receptor de opioides (OPRM1), que es el gen más estudiado para entender la adicción a opiáceos que codifica para el receptor μ (OPRM1) que sirve de unión a los opioides (Berrettini, 2017).
Componente fisiológico
La administración crónica de opioides conducirá al desarrollo de un estado de dependencia, condición en la cual el cese del uso de opioides o la administración de un antagonista del receptor opioide (naloxona, naltrexona), dará como resultado la aparición de los síntomas del síndrome de abstinencia. Debido a que los opioides son una señal inhibitoria para la célula, estas aumentarán la señalización para compensar y regresar a la función normal. La eliminación de la señal inhibitoria dará como resultado una sobreactivación de las vías celulares afectadas que conduce a una variedad de síntomas causados por la sobreactivación de la corteza somatomotora y del sistema nervioso autónomo (Schaefer et al., 2017).
Al nivel de sistemas orgánicos, el síndrome de abstinencia se manifiesta por un incremento en los estímulos autónomos como agitación, hiperalgesia, hipertermia, hipertensión, diarrea y dilatación pupilar, a nivel de síntomas afectivos la abstinencia ocasiona disforia, ansiedad, y depresión. Tales fenómenos se consideran muy agresivos y motivan a la persona que consume el fármaco a realizar mayor esfuerzos para evitar la abstinencia.
La estimulación suprafisiológica repetida del sistema dopaminérgico, producida por el consumo continuo de opioides, puede inducir cambios en la plasticidad del cerebro lo cual resulta en una disminución del control inhibitorio sobre la conducta de búsqueda y consumo de sustancias, que puede llegar a ser compulsiva. Al respecto a nivel cerebral la expresión de miRNAs juega un papel importante en la regulación de memoria y del comportamiento agresivo e impulsivo, donde se ha demostrado una disminución de la expresión de miR-190b, miR-28a, miR-340, miR-219a, y miR-491 en la amígdala, lo cual se asocia a una conducta impulsiva (Quinn et al., 2018).
Componente social y de comportamiento
Los efectos positivos de recompensa de los opioides se consideran el componente fundamental para el inicio de su uso recreativo. Cuando el estímulo para adquirir la droga ocasiona conductas de búsqueda de la sustancia que ocurre a pesar de los daños físicos, emocionales, y sociales del fármaco dependiente, entonces la obsesión o compulsión para adquirir y utilizar la droga se considera un reflejo de un estado de adicción. Sobre las razones de por qué algunas personas desarrollan adicción y otras no, algunos estudios indican que es una combinación de predisposición genética y factores ambientales y sociales (Eitan et al., 2017). El dilema de los analgésicos opioides es que son medicamentos imprescindibles para aliviar determinados tipos de dolor crónicos, pero al mismo tiempo pueden llegar a causar un gran sufrimiento a las personas que desarrollan adicción y/o sobredosis.
Las personas adictas a un medicamento opioide que dejan de consumir la droga pueden experimentar síntomas graves de abstinencia que comienzan apenas unas pocas horas después de haber consumido la droga por última vez. Estos síntomas incluyen: dolores en músculos y huesos, problemas para dormir, diarrea y vómitos, escalofríos, movimientos incontrolables de las piernas y deseos intensos de consumir la droga (Sandí-Brenes & Sandí-Esquivel, 2016).
Consumo de opioides en Estados Unidos
USA sufre actualmente de una epidemia de sobredosis de opioides, más de 33,000 muertes son atribuidas al consumo ilícito y lícito de estos fármacos (Manchikanti et al., 2018). En el año 2015, 40.5 millones de personas eran dependientes de opioides de forma legal prescritos o ilegal, con una defunción diaria de 91 personas por sobredosis (Degenhardt et al., 2019). Se estima que durante el periodo de 1999-2015 ocurrieron 15,000 muertes debido al abuso de estas sustancias y en el 2016 se reportaron más de 64,000 decesos por sobredosis, que incluyen 15,000 por heroína y más de 20,000 por opioides sintéticos como el fentanilo. Como lo indican las cifras anteriores el aumento de muertes por sobredosis se ha acelerado en los últimos años e incluso podría ocasionar una reducción de la expectativa de vida de la población (Guardia-Serecigni, 2018; Volkow et al., 2018).
La causa principal de la epidemia en el uso de opioides se debe a que en USA se consumen más medicamentos narcóticos que cualquier otra nación del mundo. La Junta Internacional de Fiscalización de Estupefacientes (INCB), una división de la organización de las naciones unidas (UN), estima que las empresas farmacéuticas en 2011 produjeron más de 75 toneladas al año de oxicodona, en comparación con las 11.5 toneladas producidas en 1999, de los cuales más del 80 % se consume en los USA (Milani & Scholten, 2011).
En el caso específico de USA, el Centro de Prevención y Control de Enfermedades (CDC, por sus siglas en inglés) afirma que un 20 % de las personas que reciben una prescripción inicial para 10 días de analgésicos opioides, seguirá tomando los fármacos más allá de un año o incluso de por vida. Además reconocen que el consumo simultáneo de analgésicos opioides y benzodiacepinas cuadruplica el riesgo de muerte por sobredosis, en comparación con el consumo solo de opioides (Becker et al., 2008).
El volumen de opioides recetados alcanzó su punto máximo en 2011 con 240 mil millones de miligramos de equivalentes de morfina y ha disminuido en un 29 % a 171 mil millones en 2017, en respuesta a mayores regulaciones, conciencia, educación y a la prescripción responsable de opioides. Esta tendencia contrasta, con el aumento correspondiente de la estrategia adoptada de tratamiento mediante terapias asistidas por medicamentos para la dependencia del uso de opioides, en la cual se observa que del 2015 al 2017 casi se ha duplicado de 44,000 a 82,000 tratamientos por mes (IQVIA, 2018). Datos recientes muestran que 62 % de muertes esta relacionados con el consumo de drogas ilícitas y el 38 % de muertes relacionados con medicamentos prescritos (Jozef Š & Henrieta Š, 2019).
Debido a este problema, desde hace algunos años el gobierno y las instituciones de salud han buscado estrategias para poner fin a esta epidemia de consumo y abuso de opioides, obligándoles a reevaluar y revisar las políticas que restringen la terapia con opioides a los pacientes en función de umbrales arbitrarios; e incentivar el compromiso de los médicos y personal de salud para comprometerse a ayudar a todos los pacientes a acceder a la atención basada en evidencia para el dolor y los trastornos por uso de sustancias, mediante terapias asistidas por medicamentos. La FDA ha incentivado el tratamiento médico asistido, lo que ha derivado en los primeros pasos hacia el combate del uso indebido de opioides (Urman et al, 2019), se reporta que la terapia con opioides disminuyó en 2.9 millones de tratamientos por mes a fines de 2017, mientras que los tratamientos con asistencia médica aumentaron drásticamente (IQVIA, 2018).
La Asociación Americana Médica (AMA, por sus siglas en inglés) continúa instando a los médicos a tomar decisiones de prescripción juiciosas e informadas para reducir el riesgo de daños relacionados con los opioides, pero reconoce que, para algunos pacientes, la terapia con opioides, incluso cuando se prescribe a dosis superiores a las recomendadas por algunas entidades, puede ser médicamente necesaria y apropiada (AMA, 2019). Aunque la crisis de opioides está muy relacionada con el uso de estas sustancias con motivos terapéuticos, a partir del 2013 se incrementó el uso de opioides sintéticos obtenidos a través del mercado ilegal, principalmente el fentanilo y sus diferentes tipos de análogos. Lo anterior resulta muy importante en el contexto mexicano por lo cual se discutirá más adelante.
Uso y abuso de opioides en México
Afortunadamente el consumo del opio y de sus subproductos no ha sido cuantitativamente importante en la sociedad mexicana, a pesar de que la producción de amapola nunca se ha detenido en México. La zona más afectada corresponde a la franja fronteriza del norte del país, en donde el flujo de heroína no se detiene nunca y el consumo ocurre principalmente entre las poblaciones marginalizadas de esa zona geográfica, aunque es importante mencionar que esta circunstancia podría cambiar en los próximos años incrementándose el consumo de estas sustancias entre la población general, la modernidad del uso de redes sociales ayuda al aumento en el consumo de drogas entre los usuarios, una mayor intención conductual para imitar comportamientos de salud riesgosos.
Dada la localización geográfica de México y siendo un país de tránsito de población de Centro y Sudamérica hacia USA, se esperaría una tendencia semejante en el consumo de opioides a la presentada en USA, principalmente en los estados conlindantes con ese país. Un estudio llevado a cabo entre la población en ambos lados de la frontera, muestra un aumento en la prevalencia sobre el uso de drogas en la población migrante (Borges et al., 2016). Sin embargo, en la población general de México, a diferencia de USA y Canadá, el uso médico de opioides es bajo y se estima que la cobertura solo satisface el 36 % de la población que necesita este tipo de analgésicos (Ling et al., 2011).
A pesar del bajo porcentaje de consumo de opioides comparado con otras drogas ilegales (0.1 %) (ENCODAT, 2017), se aprecia una tendencia ascendente, la cual podría incrementarse en los próximos años debido a una serie de factores como un mayor movimiento demográfico entre USA y México, el aumento de enfermedades que demandan un tratamiento más eficaz del dolor, la inclusión de opioides en los sistemas y seguros de salud, el cambio en las leyes con respectos al uso médico de opioides y a la producción ilegal de opioides sintéticos (WHO, 2017; Armenian et al; 2018).
Respecto a la inclusión de los opioides a los sistemas de salud pública mexicanos, a partir del 2014 ha habido algunas modificaciones en los requisitos para su prescripción en cuidado paliativo del dolor, por lo que en la Secretaría de Salud se han autorizado tratamientos con buprenorfina, morfina, oxicodona y tramadol, los cuales se encuentran en el cuadro básico de medicamentos para analgesia en el catálogo universal de servicios de salud del 2019 (CNPSS, 2019). Aunado a lo anterior, la FDA, solicitó retirar de su lista de medicamentos al clorhidrato de oximorfona, un derivado de la morfina utilizado como sedante antes de cirugías y como un auxiliar en el tratamiento de ansiedad (FDA, 2017), por lo que su introducción en los países latinoamericanos podría estar en la mira de las farmacéuticas.
Otro factor importante a tomar en cuenta es el abuso de opioides sintéticos, aunque a la fecha todavía su uso es menor comparado con otras drogas ilegales. Al respecto en México se produce de manera ilegal una gran cantidad de fentanilo, el cual está destinado principalmente a los USA, además de que organizaciones criminales establecidas en México facilitan la introducción de fentanilo producido en China a USA a través de la frontera noroeste de nuestro país (Armenian et al., 2018). Por lo anterior, en un futuro cercano podría esperarse un repunte en el consumo ilegal de fentanilo y otros análogos en México, que aunado a la inclusión de opioides en el cuadro básico del sistema de salud podría llevar a una epidemia similar a la que viven actualmente en USA.
Farmacoterapia en la adicción de opioides
La crisis prevaleciente de opiáceos ha requerido la necesidad de comprender los principales tratamientos de la dependencia de opiodes y desintoxificacion a nivel quimico y neuromolecular (Kaski et al., 2019). La heroína se metaboliza enzimática y espontáneamente por una hidrólisis/deacetilación in vivo a 3-acetilmorfina (3-AM) y 6-acetilmorfina (6-AM) luego ambos compuestos a morfina (Figura 4), siendo estos los metabolitos activos, ya que presentan una mayor afinidad a los receptores MOR; estos conocimientos químicos nos permiten utilizar 6-AM como un biomarcador de la identificación de heroína en el organismo debido a que la heroína tiene un tiempo de vida muy corto (aproximadamente 2-4 min). La codeína, es transformada por la enzima citocromo P450, a morfína (Meyer et al., 2015; Dinis-Oliveira, 2019). Se estima que la eficacia de las farmacoterapias para controlar la adicción de opioides es de un 60-70 % (Crist et al., 2018). Los medicamentos mas utilizados son metadona, buprenorfina y naloxona o naltrexona, farmacoterapias dirigidas al receptor OPRM1 (Fonseca & Torrens, 2018).
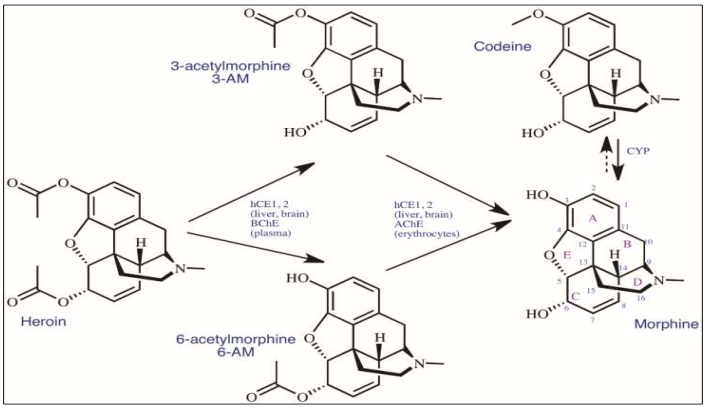
(Fuente: Propia)
Figura 4 Ruta metabólica de heroína, codeína y morfína. hCE - carboxilesterasa humana; BChE - butirilcolinesterasa; CYP - citocromo P450
La respuesta al tratamiento depende de los genes que regulan la síntesis, metabolismo y transporte de neurotransmisores involucrados en el comportamiento del consumo de opiaceos. Estudios farmacogenéticos demuestran que el aclaramiento de metadona puede ser regulado por variantes en el citocromo (CYP) CYP2B6 y CYP3A4*22, enzimas metabolizadoras de la metadona (Csajka et al., 2016); esto es una herramienta que ayudaría a dosificar adecuadamente la farmacoterapia de forma personalizada segura, eficaz, optimizada y dirigida, tomando en cuenta los factores etnicos, ambientales y polimorfismos genéticos (Berrettini, 2017; Eissenberg & Aurora, 2019). Otros estudios han demostrado que individuos con polimorfismo de OPRM1 A118G responden bien al tratamiento con naltrexona, estos hallazgos puede determinar que la respuesta a una farmacoterapia del paciente requiere de menor dosis de naltroxona para producir el efecto terapéutico deseado evitando la toxicidad relacionada con altas dosis de tratamiento e incluso la muerte en los peores casos (Taqi et al., 2019).
Conclusión
A pesar de la naturaleza adictiva de los opioides, son imprescindibles en la terapia contra el dolor, especialmente en el tratamiento de dolor moderado a severo, siendo hasta la fecha los analgésicos más efectivos y usados. Sin embargo, sus efectos psicotrópicos los hacen particularmente vulnerables al mal uso y abuso. En Estados Unidos se ha convertido en un problema de salud pública de tal magnitud que se ha catalogado como epidemia. En México, no estamos exentos de este problema pues existe el riesgo potencial de un incremento en el uso y abuso de opioides debido principalmente a 1) la constante movilidad de población entre México, Estados Unidos y Canadá; 2) la incorporación de estos fármacos en los sistemas de salud; 3) el uso ilegal de opioides sintéticos. Por lo que resulta fundamental la investigación científica para el desarrollo de nuevos fármacos con potencia analgésica, sin efectos adictivos y reacciones adversas menos severas. Sin embargo, también se debe trabajar en el desarrollo de estrategias que permitan afrontar los problemas que pudieran derivarse del aumento en el uso de opioides prescritos y no prescritos, como el caso de la farmacoterapia la cual ha mostrado buenos resultados para controlar la adicción de opioides.
Agradecimientos
A la Universidad Autónoma de Zacatecas por el apoyo para la publicación de este artículo. Al diseñador gráfico Jesús Juvencio Ramírez Espinoza por su ayuda en la edición de la Figura 3.
REFERENCIAS
Álvarez, Y. & Farré, M. (2005). Farmacología de los opioides. Adicciones. 17: 21-40. https://www.redalyc.org/pdf/2891/289122022016.pdf [ Links ]
American Medical Association [AMA]. (2019). Physicians’ progress toward ending the nation’s opioid epidemic. https://www.end-opioid-epidemic.org/wp-content/uploads/2019/06/AMA-Opioid-Task-Force-2019-Progress-Report-web-1.pdf [ Links ]
Armenian, P., Vo, K. T., Barr-Walker, J. and Lynch, K. L. (2018). Fentanyl, fentanyl analogs and novel synthetic opioids: A comprehensive review. Neuropharmacology, 134: 121-132. https://doi.org/10.1016/j.neuropharm.2017.10.016 [ Links ]
Becker, W. C., Sullivan, L. E., Tetrault, J. M., Desai, R. A. and Fiellin, D. A. (2008). Non-medical use, abuse and dependence on prescription opioids among U. S. adults: Psychiatric, medical and substance use correlates. Drug and Alcohol Dependence, 94: 38-47. https://doi.org/10.1016/j.drugalcdep.2007.09.018. [ Links ]
Berrettini, W. (2017). A brief review of the genetics and pharmacogenetics of opioid use disorders. Dialogues in clinical neuroscience, 19(3): 229-236. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5741106/ [ Links ]
Borges, G., Cherpitel, C. J., Orozco, R., Zemore, S. E., Wallisch, L., Medina-Mora, M. E. and Breslau, J. (2016). Substance use and cumulative exposure to American society: Findings from both sides of the US-Mexico border region. American Journal of Public Health, 106(1): 119-127. https://doi.org/10.2105/AJPH.2015.302871 [ Links ]
Chen, D. T., Pan, J. H., Chen, Y. H., Xing, W., Yan, Y., Yuan, Y. F. and Zeng, W. A. (2019). The mu-opioid receptor is a molecular marker for poor prognosis in hepatocellular carcinoma and represents a potential therapeutic target. British Journal of Anaesthesia, 122(6): e157-e167. https://doi.org/10.1016/J.BJA.2018.09.030 [ Links ]
Comisión Nacional de Protección Social en Salud [CNPSS]. (2019). Servicios de Salud y Medicamentos Comprendidos por el Sistema-2019 del Acuerdo de Coordinacion para la Ejecucion del Sistema de Proteccion Social en Salud (SPSS). Secretaría de Salud. http://www.documentos.seguro-popular.gob.mx/dgss/Anexo_I_2019_Publicación.pdf [Last Checked: January 15th 2020]. [ Links ]
Cooper, T. E., Fisher, E., Gray, A. L., Krane, E., Sethna, N., Van Tilburg, M. A. L., Zernikow, B. and Wiffen, P. J. (2017). Opioids for chronic non-cancer pain in children and adolescents. Cochrane Database of Systematic Reviews, 7: 1-23. https://doi.org/10.1002/14651858.CD012538.pub2 [ Links ]
Crist, R. C., Clarke, T. K. and Berrettini, W. H. (2018). Pharmacogenetics of Opioid Use Disorder Treatment. CNS Drugs, 32(4): 305-320. https://doi.org/10.1007/s40263-018-0513-9 [ Links ]
Csajka, C., Crettol, S., Guidi, M. and Eap, C. B. (2016) Population Genetic-Based Pharmacokinetic Modeling of Methadone and its Relationship with the QTc Interval in Opioid-Dependent Patients. Clinical Pharmacokinetics, 55: 1521- 1533. https://doi.org/10.1007/s40262-016-0415-2 [ Links ]
D’Souza, M. S. (2019) Brain and Cognition for Addiction Medicine: From Prevention to Recovery Neural Substrates for Treatment of Psychostimulant-Induced Cognitive Deficits. Front Psychiatry, 10: 509. https://doi.org/10.3389/fpsyt.2019.00509 [ Links ]
Degenhardt, L., Grebely, J., Stone, J., Hickman, M., Vickerman, P., Mashall, B. D. L., Bruneau, J., Altice, F. L., Handerson, G., Rahimi-Movaghar, A. and Larney, S. (2019). Global patterns of opioid use and dependence: harms to populations, interventions, and future action. Lancet, 394(10208): 1560-1579. https://doi.org/10.1016/S0140-6736(19)32229-9 [ Links ]
Devereaux, A. L., Mercer, S. L. and Cunningham, C. W. (2018). DARK Classics in Chemical Neuroscience: Morphine. ACS Chemical Neuroscience, 9: 2395-2407. https://doi.org/10.1021/acschemneuro.8b00150 [ Links ]
Dinis-Oliveira, R. J. (2019). Metabolism and metabolomics of opiates: A long way of forensic implications to unravel. Journal of Forensic and Legal Medicine, 61: 128-140. https://doi.org/10.1016/J.JFLM.2018.12.005 [ Links ]
Eissenberg, J. C. & Aurora, R. (2019). Pharmacogenomics: What the Doctor Ordered? Missouri medicine, 116(3): 217-225. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6690297/ [ Links ]
Eitan, S., Emery, M. A., Bates, M. L. S. and Horrax, C. (2017). Opioid addiction: Who are your real friends? Neuroscience & Biobehavioral Reviews, 83: 697-712. https://doi.org/10.1016/J.NEUBIOREV.2017.05.017 [ Links ]
Encuesta Nacional de Consumo de Drogas, Alcohol y Tabaco [ENCODAT]. (2017). Encuesta Nacional de Consumo de Drogas, Alcohol y Tabaco 2016-2017: Reporte de Drogas. Ciudad de México: Secretaría de Salud. https://drive.google.com/file/d/1zIPBiYB3625GBGIW5BX0TT_YQN73eWhR/view [ Links ]
Farmer, A. D., Drewes, A. M., Chiarioni, G., Giorgio, R., O’Brien, T., Morlion, B. and Tack, J. (2019). Pathophysiology and management of opioid-induced constipation: European expert consensus statement. United European Gastroenterology Journal, 7(1): 7-20. https://doi.org/10.1177/2050640618818305 [ Links ]
Food and Drug Administration [FDA]. (2017). FDA requests removal of Opana ER for risks related to abuse. https://www.fda.gov/news-events/press-announcements/fda-requests-removal-opana-er-risks-related-abuse [Last Checked: January 1st 2020]. [ Links ]
Fonseca, F. & Torrens, M. (2018). Pharmacogenetics of Methadone Response. Molecular diagnosis & therapy, 22(1): 57-78. https://doi.org/10.1007/s40291-017-0311-y [ Links ]
Galligan, J. & Sternini, C. (2017). Insights into the Role of Opioid Receptors in the GI Tract: Experimental Evidence and Therapeutic Relevance. In: Gastrointestinal Pharmacology, Springer Cham ed, 239: 363-378. https://doi.org/10.1007/164_2016_116 [ Links ]
Gil-Martín, A., Moreno García, M., Sánchez-Rubio-Fernández, J. and Molina-García, T. (2014). Hiperalgesia asociada al tratamiento con opioides. Revista de La Sociedad Española Del Dolor, 21(5): 259-269. https://doi.org/10.4321/s1134-80462014000500005 [ Links ]
Guardia-Serecigni, J. (2018). Overdose epidemic linked to the prescription of opioid analgesics in the United States. Adicciones, 30(2): 87-92. https://doi.org/10.20882/adicciones.936 [ Links ]
Gudin, J. A., Laitman, A. and Nalamachu, S. (2015). Opioid Related Endocrinopathy. Pain Medicine, 16: S9-S15. https://doi.org/10.1111/pme.12926. [ Links ]
Hancock, D. B., Markunas, C. A., Bierut, L. J. and Johnson, E. O. (2018). Human Genetics of Addiction: New Insights and Future Directions. Current psychiatry reports, 20(2): 8. https://doi.org/10.1007/s11920-018-0873-3 [ Links ]
IQVIA. Institute for Human Data Science (2018), Medicine Use and Spending in the U.S.: A Review of 2018 and Outlook to 2022. https://www.iqvia.com/-/media/iqvia/pdfs/institute-reports/medicine-use-and-spending-in-the-us-a-review-of-2017-and-outlook-to-2022.pdf?_=1585172972723 . [Last Checked: April 1st 2020]. [ Links ]
Jozef, Š & Henrieta, Š. (2019). Comparative study of fatal consequences of illicit and prescription drugs use/abuse in Bratislava and its vicinity. Soud Lek, 64(3): 35-38. http://www.cspatologie.cz/docs/1042-s-fulltext.pdf [ Links ]
Juurlink, D. N. & Dhalla, I. A. (2012). Dependence and Addiction During Chronic Opioid Therapy. Journal of Medical Toxicology, 8(4): 393-399. https://doi.org/10.1007/s13181-012-0269-4 [ Links ]
Kaski, S. W., Brooks, S., Wen, S., Haut, M. W., Siderovski, D. P., Berry, J. H., Lander, L. R. and Setola, V. (2019). Four single nucleotide polymorphisms in genes involved in neuronal signaling are associated with Opioid Use Disorder in West Virginia. Journal of opioid management, 15(2): 103-109. https://doi.org/10.5055/jom.2019.0491 [ Links ]
Khademi, H., Kamangar, F., Brennan, P. and Malekzadeh, R. (2016). Opioid therapy and its side effects: A review. Archives of Iranian Medicine, 19(12): 870-876. https://doi.org/0161912/aim.0010 [ Links ]
Kibaly, C., Xu, C., Cahill, C. M., Evans, C. J. and Ping-Yee, L. (2019). Non-nociceptive roles of opioids in the CNS: Opioids’ effects on neurogenesis, learning, memory and affect. Nature Reviews Neuroscience, 20(1): 5-18. https://doi.org/10.1038/s41583-018-0092-2 [ Links ]
Lee, A. A. & Hasler, W. L. (2016). Opioids and GI Motility-Friend or Foe?. Current Treatment Options in Gastroenterology, 14(4): 478-494. https://doi.org/10.1007/s11938-016-0112-0 [ Links ]
Ling, W., Mooney, L. and Hillhouse, M. (2011). Prescription opioid abuse, pain and addiction: Clinical issues and implications. Drug and Alcohol Review, 30(3): 300-305. https://doi.org/10.1111/j.1465-3362.2010.00271.x [ Links ]
Manchikanti, L., Sanapati, J., Benyamin, R. M., Atluri, S., Kaye, A. D. and Hirsch, J. A. (2018) Reframing the Prevention Strategies of the Opioid Crisis: Focusing on Prescription Opioids, Fentanyl, and Heroin Epidemic. Pain Physician, 21(4): 309-326. https://www.ncbi.nlm.nih.gov/pubmed/30045589 [ Links ]
Mesa-Vanegas, A. M. (2017). Una visión histórica en el desarrollo de fármacos a partir de productos naturales. Revista Mexicana de Ciencias Farmacéuticas, 48(3): 16-27. https://www.redalyc.org/pdf/579/57956616003.pdf [ Links ]
Meyer, M. R., Schütz, A. and Maurer, H. H. (2015). Contribution of human esterases to the metabolism of selected drugs of abuse. Toxicology Letters, 232(1): 159-166. https://doi.org/10.1016/j.toxlet.2014.10.026 [ Links ]
Milani, B. & Scholten, W. (2011). The world medicines situation 2011. Génova: WHO Publications. https://www.who.int/medicines/areas/policy/world_medicines_situation/WMS_ch19_wAccess.pdf [ Links ]
Morgan, M. M. & Christie, M. J. (2011). Analysis of opioid efficacy, tolerance, addiction and dependence from cell culture to human. British Journal of Pharmacology, 164(4): 1322-1334. https://doi.org/10.1111/j.1476-5381.2011.01335.x [ Links ]
Pedrero-Pérez, E., Morales-Alonso, S., Álvarez-Crespo, B. and Benítez-Robredo, M. (2020). Consumo de fármacos opiáceos en la ciudad de Madrid: factores sanitarios y sociodemográficos asociados. Adicciones, http://dx.doi.org/10.20882/adicciones.1335 [ Links ]
Portoghese, P. S., Akgün, E. and Lunzer, M. M. (2017). Heteromer Induction: An Approach to Unique Pharmacology?. ACS chemical neuroscience, 8(3): 426-428. https://doi.org/10.1021/acschemneuro.7b00002 [ Links ]
Quinn, R. K., James, M. H., Hawkins, G. E., Brown, A. L., Heathcote, A., Smith, D. W., Cairns, M. J. and Dayas, C. V.(2018). Temporally specific miRNA expression patterns in the dorsal and ventral striatum of addiction-prone rats. Addiction Biology, 23:631-42. https://doi.org/10.1111/adb.12520 [ Links ]
Raub, J. N. & Vettese, T. E. (2017). Acute Pain Management in Hospitalized Adult Patients with Opioid Dependence: A Narrative Review and Guide for Clinicians. Journal of Hospital Medicine, 12(5): 375-379. https://doi.org/10.12788/jhm.2733 [ Links ]
Sandí-Brenes, S. & Sandí-Esquivel, L. (2016). Dependencia a tabaco y su tratamiento. Revista Clínica Escuela de Medicina UCR-HSJD, 6(1): 87-92. https://doi.org/10.15517/rc_ucr-hsjd.v6i1.23068 [ Links ]
Schaefer, C. P., Tome, M. E. and Davis, T. P. (2017). The opioid epidemic: a central role for the blood brain barrier in opioid analgesia and abuse. Fluids and Barriers of the CNS, 14(32). https://doi.org/10.1186/s12987-017-0080-3 [ Links ]
Soleimanpour, H., Safari, S., Shahsavari Nia, K., Sanaie, S. and Alavian, S. M. (2016). Opioid Drugs in Patients with Liver Disease: A Systematic Review. Hepatitis Monthly, 16(4). https://doi.org/10.5812/hepatmon.32636 [ Links ]
Sun, E. C., Dixit, A., Humphreys, K., Darnall, B. D., Baker, L. C. and Mackey, S. (2017). Association between concurrent use of prescription opioids and benzodiazepines and overdose: Retrospective analysis. BMJ, j760. https://doi.org/10.1136/bmj.j760 [ Links ]
Taqi, M. M., Faisal, M. and Zaman, H. (2019). OPRM1 A118G Polymorphisms and Its Role in Opioid Addiction: Implication on Severity and Treatment Approaches. Pharmacogenomics and personalized medicine, 12: 361-368. https://doi.org/10.2147/PGPM.S198654 [ Links ]
Urman, R. D., Böing, E. A., Khangulov, V., Fain, R., Nathanson, B. H., Wan, G. J., Lovelace, B., Pham, A. T. and Cirillo, J. (2019). Analysis of predictors of opioid-free analgesia for management of acute post-surgical pain in the United States. Current Medical Research and Opinion, 35(2): 283-289. https://doi.org/10.1080/03007995.2018.1481376 [ Links ]
Van Rijn, R. M., DeFriel, J. N. and Whistler, J. L. (2013). Pharmacological traits of delta opioid receptors: pitfalls or opportunities? Psychopharmacology, 228(1): 1-18. https://doi.org/10.1007/s00213-013-3129-2 [ Links ]
Volkow, N., Benveniste, H. and McLellan, A. T. (2018). Use and Misuse of Opioids in Chronic Pain. Annual Review of Medicine, 69(1): 451-465. https://doi.org/10.1146/annurev-med-011817-044739 [ Links ]
World Health Organization [WHO]. (2017). Curbing prescription opioid dependency. Bulletin of the World Health Organization. 95: 318-319. https://doi.org/10.2471/BLT.17.020517 [ Links ]
Recibido: 04 de Marzo de 2020; Aprobado: 12 de Septiembre de 2020; Publicado: 09 de Octubre de 2020











 texto en
texto en