Introducción
Los mosquitos (Diptera: Culicidae) son un grupo importante de insectos debido a su capacidad de ser vectores de patógenos que afectan la salud humana y animal. La vigilancia entomológica que involucra especies de mosquitos cuya importancia médica es conocida, es esencial para los programas de salud pública (Silver, 2008). Actualmente se han descrito más de 3,500 especies de mosquitos en el mundo (Harbach, 2013); mientras que en México se han registrado más de 240 pertenecientes a 21 géneros (Hernández-Triana et al., 2021); en Chiapas se han reportado 139 especies agrupadas en 21 géneros (Hernández-Triana et al., 2021), de los cuales 8 son de importancia médica y veterinaria: Anopheles, Aedes, Haemagogus, Psorophora, Culex, Coquillettidia, Mansonia y Sabethes (Bond et al., 2014).
Existen pocos estudios de vigilancia entomológica que analicen la distribución de los mosquitos de importancia médica (Bond et al., 2014). Recientemente se identificaron los patrones de alimentación de algunas especies de mosquitos en algunas regiones de Chiapas (Hernández-Triana et al., 2021), pero la distribución de la mayoría de las especies de mosquitos de importancia médica en el estado sigue siendo desconocida. En el 2019 se reportaron en el estado de Chiapas 2,241 casos de dengue y 410 casos de paludismo, mientras que en 2020 se observaron 324 casos de dengue y 227 casos de paludismo, siendo un estado endémico para estas enfermedades (SS, 2021).
La emergencia y reemergencia de algunas enfermedades transmitidas por mosquitos (ETM) en algunos países como México indican la necesidad de reforzar algunas medidas operativas como la vigilancia entomológica (entomo-vigilancia), la detección de arbovirus y estudios de distribución de especies vectoras, lo cual es importante para estimar el riesgo de incidencia de las enfermedades transmitidas por vectores (Ruiz-Arrondo et al., 2019).
Los estudios de distribución de especies de mosquitos permite además predecir los riesgos de infección para algunas ETM como los virus del Zika y Chikungunya, causantes de enfermedades cuyos primeros casos en México se reportaron en el estado de Chiapas (Osório et al., 2014; Díaz-González et al., 2015; Guerbois et al., 2016) Zika virus (ZIKV). Adicionalmente, la intensa movilidad de personas provenientes de Centroamérica y otros países que se dirigen hacia otras entidades del país o en su paso hacia los Estados Unidos de Norteamérica aumenta el riesgo de infección para algunas ETM (Anguiano-Téllez, 2008). El objetivo de este estudio fue conocer la distribución, abundancia, riqueza y diversidad de mosquitos en comunidades asociadas a la frontera México-Guatemala y destacar su importancia en salud pública.
Materiales y métodos
La frontera de Chiapas-Guatemala se ubica en la región sur de México (fig. 1), tiene una extensión de 654 km (Ramos-Rojas, 2016) y comprende 18 municipios. Las condiciones climáticas a través de la frontera son predominantemente cálido húmedas y cálido subhúmedas con lluvia en verano, con una temperatura media anual de 18.5 °C a 26.8 °C y una precipitación total anual de 827 a 2,309 mm con predominio de las lluvias de mayo a octubre (INEGI, 2017).
Se recolectaron mosquitos hembra y machos adultos en comunidades rurales y semiurbanas durante los meses de octubre a noviembre del 2018. Las recolectas fueron realizadas en 12 municipios fronterizos de Chiapas: Amatenango de la Frontera, Benemérito de las Américas, Cacahuatán, Comitán, Frontera Comalapa, Frontera Hidalgo, La Trinitaria, Mazatán, Ocosingo, Palenque, Suchiate y Tuxtla Chico. En cada municipio se seleccionaron al azar 1-4 localidades de muestreo, siendo un total de 27 localidades (fig. 1) y en cada localidad se seleccionaron al azar 20 viviendas, donde se realizaron las recolectas en el intradomicilio y en el peridomicilio. En cada vivienda se aspiraron mosquitos en sus sitios de reposo empleando insectZookas (BioQuip Núm. 2888A) durante 20 minutos por vivienda.
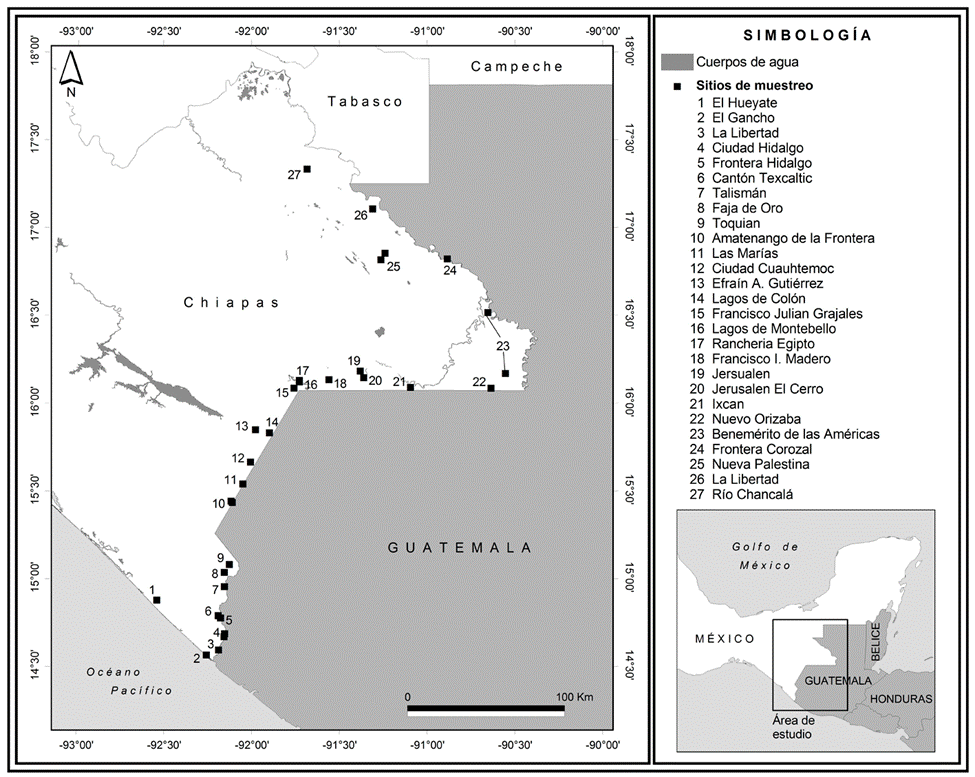
Figura 1 Municipios y número de localidades donde se realizaron las colectas. Mazatán (1), Suchiate (2,3,4), Frontera Hidalgo (5,6), Tuxtla Chico (7), Cacahoatán (8,9), Amatenango de la Frontera (10,11), Frontera Comalapa (12,13), La Trinitaria (14, 17, 18, 19), Comitán (16), Ocosingo (21, 22, 25, 26), Benemérito de las Américas (15, 23) y Palenque (24, 27).
Los mosquitos adultos fueron sacrificados con vapor de trietilamina. Todos los especímenes fueron transportados al Laboratorio de Parasitología de la Universidad Autónoma Agraria Antonio Narro, Unidad Laguna (UAAAN-UL) para su fijación, montaje e identificación.
La identificación morfológica de los especímenes se realizó con un microscopio estereoscópico (Discovery V8; Zeiss, Oberkochen, Germany) y con las claves taxonómicas de Arnell (1976), Clark-Gil y Darsie (1983), Wilkerson et al. (1990) y Darsie y Ward (2005). Los mosquitos fueron depositados en la Colección de Culicidae de la Universidad Autónoma Agraria Antonio Narro (UAAAN), Unidad Laguna, bajo el número de acceso 01231018-EG - 02041118-ZA.
Se calculó la abundancia total y relativa de cada especie recolectada (tabla 1). La jerarquización de las especies por sus abundancias y frecuencias de aparición se basó en la interpretación gráfica de la prueba de asociación de Olmstead-Tukey (Sokal y Rohlf, 1981). Además, se usaron diagramas de curvas de rango abundancia para visualizar y determinar la riqueza, estructura y composición de especies por municipio (Magurran, 2004). Para evaluar el esfuerzo de muestreo, se construyeron curvas de acumulación de especies con 1,000 aleatorizaciones sin reemplazo considerando todas las muestras y se evaluó con el estimador no paramétrico Chao1 en el programa EstimateS 9.1.0. (Colwell, 2013).
Tabla 1 Listado taxonómico de especies recolectadas por municipio, abundancia relativa, ordenamiento de Olmstead-Turkey y tipos de recolecta.
| Especies | Municipios | N | AR | OT | Tipo de colecta | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sc | Fh | Cc | Tc | Mz | Af | Fc | Lt | Cm | Oc | Ba | Pa | ID | PD | ||||
| A. pseudopunctipennis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 7 | 0 | 0 | 0 | 0 | 7 | 0.16% | F | 6 | 1 |
| A. albimanus | 2 | 0 | 0 | 0 | 2 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 5 | 0.11% | F | 2 | 3 |
| A. argirytarsis | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| A. guatemala | 0 | 0 | 12 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 12 | 0.27% | A | 5 | 7 |
| A. guerrero | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 62 | 0 | 0 | 0 | 62 | 1.40% | A | 0 | 62 |
| A. quadrivittatus | 0 | 0 | 0 | 0 | 0 | 143 | 0 | 0 | 0 | 0 | 0 | 0 | 143 | 3.22% | D | 0 | 143 |
| A. angustivittatus | 0 | 11 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 5 | 8 | 1 | 26 | 0.59% | D | 5 | 21 |
| A. euplocamus | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 3 | 0.07% | F | 3 | 0 |
| A. scapularis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 8 | 12 | 0.27% | D | 2 | 10 |
| A. taeniorhynchus | 8 | 0 | 0 | 0 | 1 | 0 | 0 | 4 | 0 | 0 | 0 | 0 | 13 | 0.29% | D | 0 | 13 |
| A. podographicus | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| A. aegypti | 116 | 20 | 0 | 12 | 7 | 118 | 76 | 8 | 0 | 123 | 38 | 47 | 565 | 12.73% | D | 551 | 14 |
| A. albopictus | 0 | 7 | 0 | 50 | 1 | 1 | 2 | 0 | 0 | 0 | 0 | 0 | 61 | 1.37% | D | 7 | 54 |
| H. equinus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| P. confinnis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 2 | 0.05% | R | 0 | 2 |
| P. albipes | 2 | 0 | 0 | 0 | 107 | 0 | 0 | 0 | 0 | 4 | 17 | 0 | 130 | 2.93% | D | 23 | 107 |
| P. ferox | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 | 0.05% | R | 1 | 1 |
| P. varipes | 0 | 0 | 0 | 0 | 186 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 187 | 4.21% | D | 0 | 187 |
| C. bihaicola | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 0 | 3 | 0.07% | R | 1 | 2 |
| C. interrogator | 0 | 16 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 17 | 0.38% | A | 0 | 17 |
| C. nigripalpus | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 3 | 0.07% | R | 3 | 0 |
| C. quinquefasciatus | 393 | 0 | 0 | 147 | 21 | 59 | 92 | 1,078 | 0 | 963 | 215 | 127 | 3,095 | 69.72% | D | 2,728 | 367 |
| C. conspirator | 0 | 0 | 0 | 0 | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 0.14% | R | 0 | 6 |
| C. elevator | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| C. erraticus | 1 | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0.11% | F | 1 | 4 |
| C. spissipes | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 0 | 0 | 0 | 0 | 6 | 0.14% | R | 0 | 6 |
| C. taeniopus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| C. corniger | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| C. venezuelensis | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 3 | 0.07% | R | 2 | 1 |
| M. dyari* | 0 | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0.11% | R | 0 | 5 |
| M. titillans | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 0.14% | F | 6 | 0 |
| L. asulleptus | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| L. durhamii | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| S. cyaneus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| S. chloropterus | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 2 | 0.05% | R | 0 | 2 |
| S. moralesi | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 1 | 0 | 0 | 0 | 0 | 5 | 0.11% | F | 0 | 5 |
| T. digitatum | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0.05% | R | 2 | 0 |
| W. abebela/melanopus | 0 | 0 | 0 | 0 | 1 | 2 | 0 | 25 | 1 | 0 | 0 | 0 | 29 | 0.65% | D | 0 | 29 |
| W. guatemala | 0 | 0 | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | 0.07% | R | 1 | 2 |
| W. mitchellii | 0 | 0 | 3 | 7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 10 | 0.23% | A | 0 | 10 |
| Abundancia total | 532 | 59 | 15 | 221 | 337 | 331 | 173 | 1143 | 63 | 1,099 | 283 | 183 | 4,439 | 100% | 3,353 | 1,086 | |
| Riqueza de especies | 18 | 6 | 3 | 8 | 11 | 10 | 7 | 22 | 2 | 14 | 12 | 7 | 40 | 22 | 32 | ||
* Nuevo registro estatal de especie para Chiapas. Sc (Suchiate), Fh (Frontera Hidalgo), Cc (Cacahoatán), Tc (Tuxtla Chico), Mz (Mazatán), Af (Amatenango de la Frontera), Fc (Frontera Comalapa), Lt (La Trinitaria), Cm (Comitán), Oc (Ocosingo), Ba (Benemérito de las Américas), Pa (Palenque). N (Total de individuos), AR (abundancia relativa). Categorización de Olmstead-Tukey (OT): R (raras), F (frecuentes), A (abundantes) y D (dominantes). ID, Intradomicilio; PD, peridomicilio.
Para comparar la riqueza de especies entre municipios se construyeron curvas de interpolación/extrapolación con relación al número de individuos con intervalos de confianza de 95% obtenidos con 1,000 aleatorizaciones usando el programa en línea iNEXT (Hsieh et al., 2016). Se estandarizó la riqueza con base al número de individuos de la muestra menor. No se consideraron los municipios Cacahoatán, Comitán y Frontera Hidalgo por presentar una abundancia baja y con pocas especies. Adicionalmente, se obtuvieron las coberturas de las muestras de cada municipio (Cm = proporción del número de individuos totales en la comunidad que pertenecen a las especies representadas en la muestra).
Para la caracterización ecológica (diversidad alfa) de las comunidades de culícidos, se estimó, por municipio y entre las recolectas intra y peridomicilio, la riqueza de especies (S), la abundancia total (N), los índices de diversidad de Shannon-Wiever (H’ = log pi), de equidad de Pielou (J’ = H/log S) y dominancia de Simpson (λ = 2) (Magurran, 2004).
La diversidad beta -a nivel de especies para los municipios y el tipo de recolecta (intra y peridomicilio)- se midió con la disimilitud basada en el índice de similitud de Jaccard (βJ = a / b + c - a) (Magurran, 2004), y para la visualización de los resultados se utilizaron análisis de ordenación no paramétrica nMDS (Nonmetric Multidimensional Scaling) y se utilizó el programa PRIMER versión 7 (Clarke y Gorley, 2015).
Resultados
Se recolectaron un total de 4,439 especímenes (2,420 hembras y 2,019 machos), de los cuales 3,353 se obtuvieron en el intradomicilio y 1,078 en el peridomicilio. Los mosquitos recolectados pertenecen a 2 subfamilias (Anophelinae y Culicinae), 4 tribus (Aedini, Culicini, Mansoniini, Sabethini), 12 géneros (Anopheles, Aedes, Haemagogus, Psorophora, Culex, Coquillettidia, Mansonia, Limatus, Sabethes, Shannoniana, Trichoprosopon y Wyeomyia), 18 subgéneros (Anopheles, Nyssorhynchus, Howardina, Ochlerotatus, Protomacleaya, Stegomyia, Haemagogus, Grabhamia, Janthinosoma, Carrolia, Culex, Melanoconion, Phenacomyia, Rhynchotaenia, Mansonia, Sabethes, Sabethoides y Wyeomyia) y 40 especies (tabla 1). Mansonia (Mansonia) dyari Belkin, Heinemann y Page, 1970 es un nuevo registro para Chiapas.
El municipio con mayor abundancia por sitio se registró en La Trinitaria con 25.7% (n = 1,143), seguido de Ocosingo con 24.8% (n = 1,099) y la menor abundancia se registró en Cacahoatán con 0.3% (n = 15). Los géneros con mayor abundancia y número de especies fueron Culex (n = 3,138 / S = 10), Aedes (n = 898 / S = 10), Psorophora (n = 321 / S = 4) y Wyeomyia (n = 42 / S = 3). Las especies más abundantes fueron Culex quinquefasciatus Say (69.72%) y Aedes aegypti (L.) (12.73%), estas especies también fueron las más representativas, reuniendo 82.45% de la abundancia total del inventario. Anopheles argyritarsis Robineau-Desvoidy, A. podographicus Dyar y Knab, Haemagogus equinus Theobald, C. elevator Dyar y Knab, C. taeniopus Dyar y Knab, C. corniger Theobald, Limatus asulleptus (Theobald), L. durhamii Theobald y Sabethes cyaneus (Fabricius) fueron recolectados únicamente en una localidad y con un solo individuo. La curva de rango-abundancia corroboró los resultados anteriores y evidenció una dominancia diferente entre las especies en los municipios de Cacahoatán (A. guatemala Berlin), Mazatán (P. varipes (Coquillett)) y Comitán (A. guerrero Berlin) con el resto de los municipios. Además, los municipios de Frontera Hidalgo, Amatenango de la Frontera, Frontera Comalapa y Palenque mostraron una uniformidad en sus especies por presentar una pendiente más suave e inclinada (fig. 2).
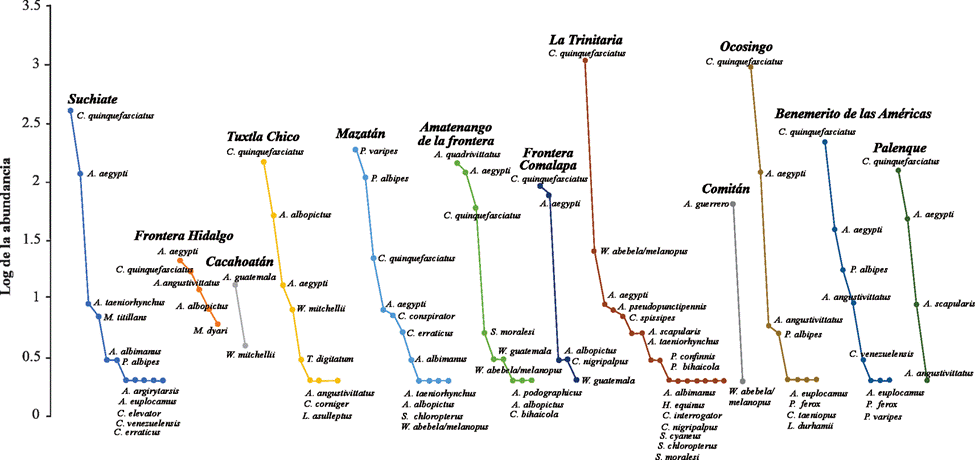
Figura 2 Curva rango abundancia. Muestra la abundancia de especies de mosquitos colectadas por municipio a lo largo de la frontera Chiapas-Guatemala.
El ordenamiento de Olmstead-Tukey permitió registrar 10 especies dominantes, 6 frecuentes, 4 abundantes y 20 raras (fig. 3A), donde Mazatán obtuvo la mayor cantidad de especies dominantes (n = 7), Cacahoatán el mayor número de especies abundantes (n = 2), Suchiate el mayor número de especies frecuentes (n = 4) y la Trinitaria el mayor número de especies raras (n = 7). Ambos tipos de colecta (intradomicilio y peridomicilio) mostraron tener más especies raras, seguidamente de especies dominantes (fig. 3B).
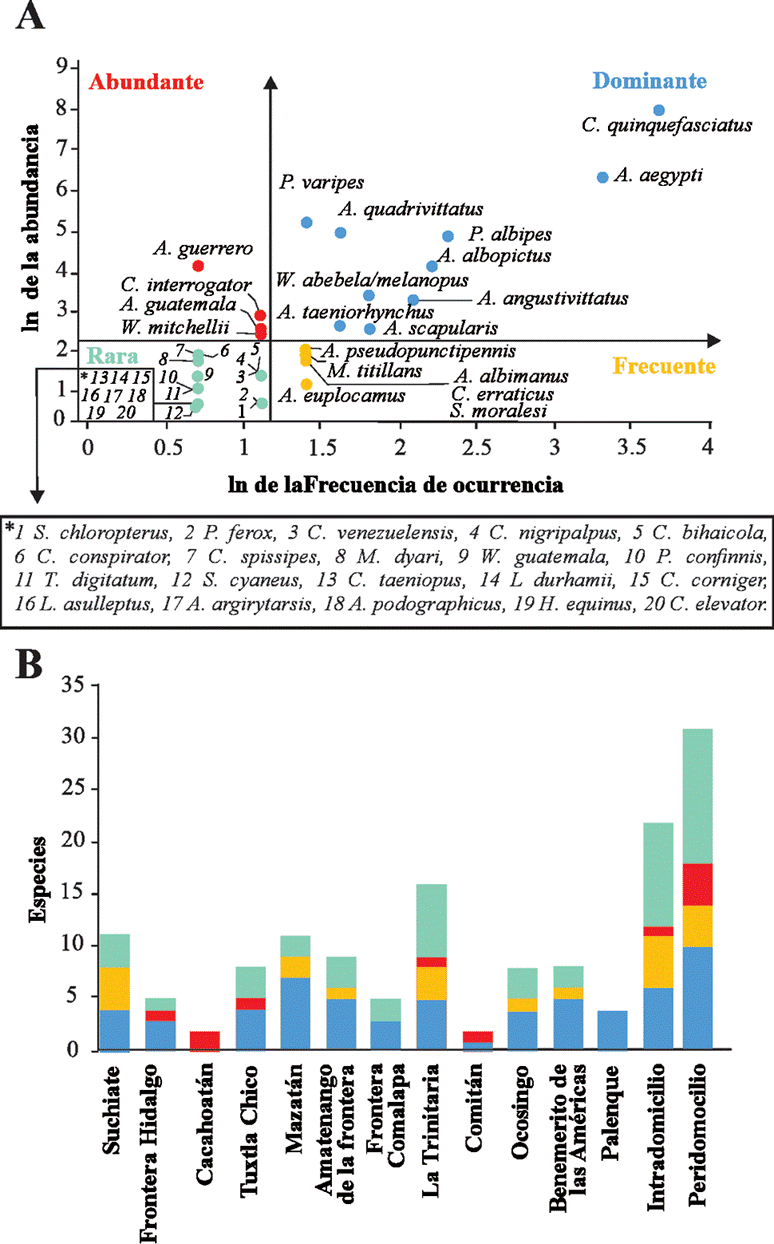
Figura 3 Gráfico de Olmstead-Tukey de los mosquitos colectados en el intra y peridomicilio de la frontera Chiapas-Guatemala.
El esfuerzo de muestreo de culícidos permitió registrar cerca de 80% de la riqueza estimada de Chao1 (n = 50 especies, fig. 4A) y en general, la cobertura obtenida para los 9 municipios y por el tipo de recolecta fue alta, representando un Cm > 83%, por lo que el inventario de especies se puede considerar completo. La mayor riqueza esperada lo presentó Mazatán (0D = 8.2), seguido de Amatenango de la Frontera (0D = 7.8) y Tuxtla chico (0D = 7.7), mientras que las riquezas esperadas respectivamente bajas fueron Palenque (0D = 4), Ocosingo (0D = 4), Frontera Comalapa (0D = 5). Para el caso del peridomicilio e intradomicilio, se observaron diferencias significativas, mostrando la mayor riqueza esperada el peridomicilio (0D = 32) (fig. 4B). Los valores altos de las riquezas esperadas mostraron ser estadísticamente diferente respecto a las riquezas esperadas bajas debido a que no traslapan sus intervalos de confianza (fig. 4C).
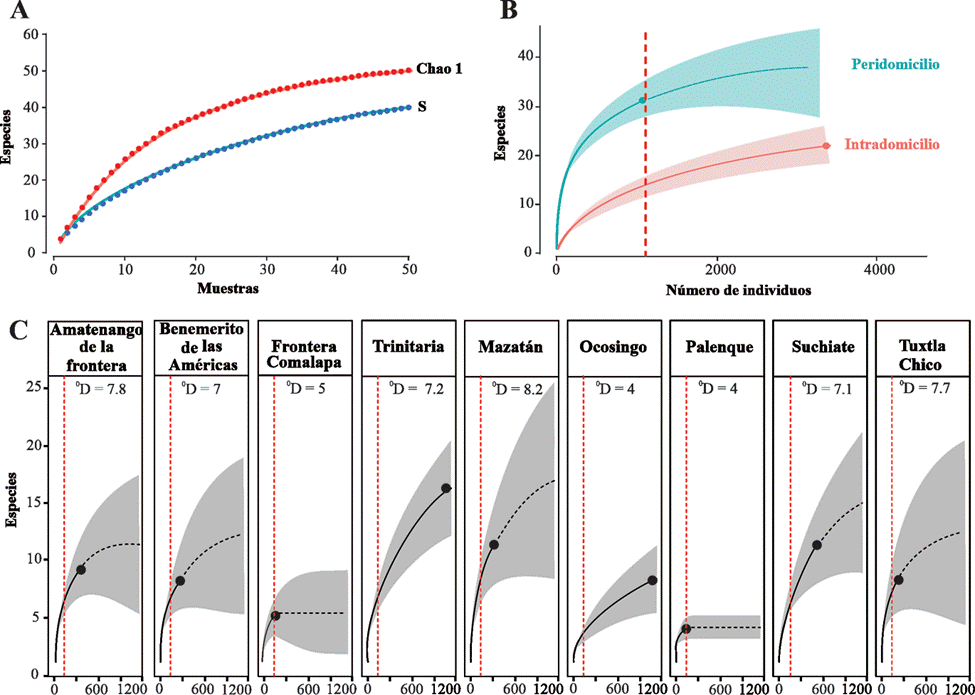
Figura 4 A, Evaluación del esfuerzo de muestreo con el estimador no paramétrico Chao1; B, curvas de acumulación de especies basados en individuos por tipo de colecta y C, por municipio.
El mayor número de especies se registró en los municipios de la Trinitaria (S = 16), Suchiate (S = 11) y Mazatán (S = 11), mientras que Cacahoatán y Comitán registraron solo 2 especies. En algunos casos, los municipios con mayor número de especies e individuos no fueron más diversos y equitativos, ya que los valores altos de la diversidad de Shannon y la equidad de Pielou se presentaron en los municipios de Frontera Hidalgo (H’ = 1.50, J’ = 0.93, S = 5), Amatenango de la Frontera (H’ = 1.21, J’ = 0.55, S = 9) y Mazatán (H’ = 1.17, J’ = 0.49, S = 11). Los valores de la dominancia de Simpson fueron mayores en los municipios de Comitán (λ = 0.97), la Trinitaria (λ = 0.89) y Ocosingo (λ = 0.78), donde los resultados de estos 2 últimos fueron influenciados por las altas abundancias de C. quinquefasciatus (fig. 5).
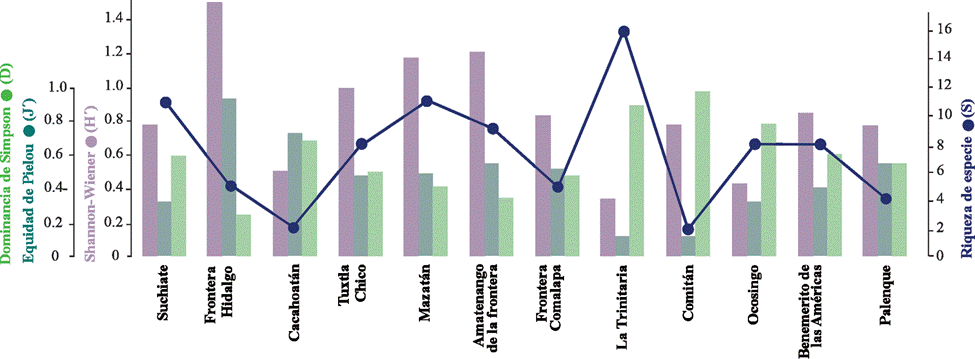
Figura 5 Diversidad estimada de la comunidad de mosquitos en los diferentes municipios fronterizos en Chiapas.
La disimilitud de especies promedio (1-βJ) entre pares de comunidades de culícidos (por municipio) fue de 83.86%. El resultado del análisis de ordenación mostró que las comunidades de culícidos de Suchiate, Mazatán, Ocosingo, Benemérito de las Américas son muy parecidas en su composición de especies, en tanto Palenque, Tuxtla Chico, Frontera Hidalgo, Frontera Comalapa y Amatenango de la Frontera conforman otro grupo diferente. La Trinitaria conformó un grupo independiente muy cercano a los 2 anteriores, ya que solo compartió 10 de sus 16 especies. Cacahoatán y Comitán son los municipios con mayor disimilitud con respecto a los antes mencionados, ya que no compartieron ninguna de sus 2 especies (fig. 6A). Para el caso del peridomicilio e intradomicilio, el valor de la disimilitud fue de 1-βJ = 65%, compartiendo solo 14 especies entre ellas (fig. 6B).
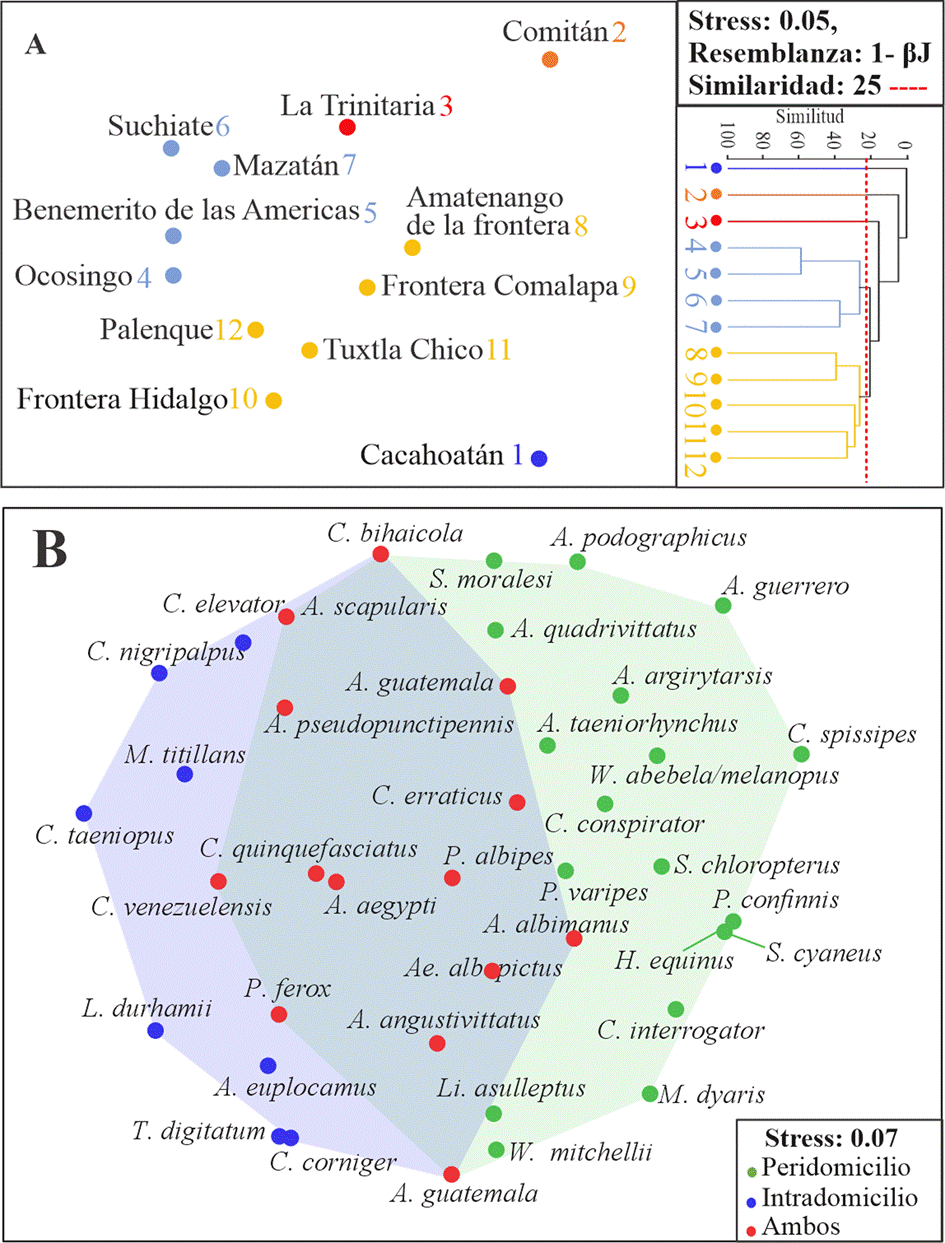
Figura 6 A, Representación gráfica (ordenación: nMDS y agrupación: cluster) de los valores de índice de similitud de Jaccard; B, ordenación de las especies (nMDS) por tipo el tipo de colecta.
En el ámbito de la salud pública, 21 de las 40 especies recolectadas son de importancia en la salud pública para la región y para México (tabla 2). La Trinitaria registró la mayor abundancia y número de especies de culícidos de importancia médica (S = 12, N = 1,114). Ocosingo obtuvo el segundo valor más alto en la abundancia (N = 1,093) con tan solo 5 especies, en comparación con Suchiate que obtuvieron el segundo valor más alto en riqueza (S = 8, N = 528). Por tipo de recolecta, el peridomicilio mostró tener más especies (n = 16) que el intradomicilio (n = 12), a diferencia de las abundancias, donde se obtuvo más individuos (n = 3,313) en el intradomicilio que el peridomicilio (n = 502). La dominancia, en ambos tipos de recolecta, estuvo representada por C. quinquefasciatus, sin embargo, se observó que A. aegypti muestra afinidad en ambientes del intradomicilio, siendo la segunda especie más abundante, a diferencia del peridomicilio donde A. albopictus (Skuse) se presentó como segunda especie más abundante.
Tabla 2 Mosquitos de importancia en salud pública recolectados en la frontera México-Guatemala.
| Especie | Importancia en salud pública | Referencias |
|---|---|---|
| A. pseudopunctipennis | Malaria | Villarreal-treviño et al., 2020 |
| A. albimanus | Malaria | Villarreal-treviño et al., 2020 |
| A. argyritarsis | Malaria | Beltrán-Aguilar et al., 2011 |
| A. angustivittatus | VEEV, ILHV | Arnell, 1976; Mesa et al., 2005 |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| A. scapularis | YFV | Davis et Shannon, 1929 |
| VEEV | Mesa et al., 2005 | |
| ILHV | Pauvolid-Corrêa et al., 2013 | |
| ROCV | Mitchell et al., 1986 | |
| A. taeniorhynchus | ZIKV | Ayres et al., 2019 |
| WNV | Eastwood et al., 2013 | |
| VEEV | Smith et al., 2008 | |
| EEEV | Turell et al., 1994 | |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| A. aegypti | DENV; YFV | Black IV et al., 2002 |
| CHIKV | Vega-Rua et al., 2014 | |
| ZIKV | Ayres et al., 2019 | |
| VEEV | Marcondes et Ximenes, 2016 | |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| WEEV | Wang et al., 2012 | |
| RVFV | Linthicum et al., 2016 | |
| MAYV | Pereira et al., 2020 | |
| A. albopictus | DENV, CHIKV, WNV, RVFV | Mitchell, 1995 |
| VEEV | Weaver et Reisen, 2010 | |
| SLEV | Mitchell, 1991 | |
| ZIKV | Fernandes et al., 2020 | |
| YFV | Kraemer et al., 2015 | |
| EEEV | Turell et al., 1994 | |
| USUV | Calzolari et al., 2010 | |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| WEEV | Wang et al., 2012 | |
| MAYV | Pereira et al., 2020 | |
| OROV | Mitchell, 1991 | |
| H. equinus | YFV | Rodaniche et al., 1957 |
| P. confinnis | VEEV | Ortiz et al., 2005 |
| P. ferox | VEEV | Chamberlain et al., 1956 |
| MAYV | Forattini, 1962 | |
| EEEV | Turell et al., 2008 | |
| ILHV | Turell et al., 2005 | |
| ROCV | Mitchell et al., 1986 | |
| RVFV | Linthicum et al., 2016 | |
| C. nigripalpus | EEEV | Mesa et al., 2005 |
| WNV | Mores et al., 2007 | |
| SLEV | Nayar et al., 2002 | |
| RVFV | Linthicum et al., 2016 | |
| C. quinquefasciatus | WNV | Sardelis et al., 2001 |
| USU | Cook et al., 2018 | |
| ZIKV | Ayres et al., 2019 | |
| SLEV | Diaz et al., 2006 | |
| Wuchereria bancrofti | Foster et Walker, 2019 | |
| MAYV | Pereira et al., 2020 | |
| WEEV | Wang et al., 2012 | |
| OROV | Segura et Castro, 2007 | |
| C. erraticus | VEEV | Mesa et al., 2005 |
| RVFV | Linthicum et al., 2016 | |
| C. spissipes | VEEV | Turell et al., 2005 |
| C. taeniopus | VEEV | Deardorff et Weaver, 2010 |
| C. venezuelensis | MAYV | Aitken, 1960 |
| OROV | Segura et Castro, 2007 | |
| M. dyari | RVFV | Linthicum et al., 2016 |
| M. titillans | VEEV | Turell et al., 2000 |
| SLEV | Beranek et al., 2018 | |
| S. cyaneus | ZIKV | Karna et al., 2018 |
| S. chloropterus | YFV | Rodaniche et al., 1957 |
| S. cyaneus | ZIKV | (Karna et al., 2018) |
| S. chloropterus | YFV | (Rodaniche et al., 1957) |
DENV: Virus dengue, CHICKV: virus chikungunya, ZIKV: virus Zika; YFV: virus de la fiebre amarilla; VEEV: virus encefalitis equina venezolana; RVFV: virus de la fiebre del valle de Rift; MAYV: virus Mayaro; EEEV: virus de encefalitis equina del este; WNV: virus del oeste del Nilo; USUV: virus Usutu; OROV: virus Oropuche; ILHV: virus Ilheus; ROCV: virus del Rocío; WEEV: virus encefalitis equina del oeste; SLEV: virus encefalitis de San Luis.
Discusión
El presente trabajo constituye el primer estudio longitudinal realizado en la frontera Chiapas-Guatemala para caracterizar la fauna de culícidos que ingresan a alimentarse en viviendas de comunidades indígenas rurales, semi urbanas y urbanas. Se identificaron un total de 40 especies, de las cuales M. dyari representa ser un nuevo registro para Chiapas, elevando el número especies a 140. En general, se observa una alta riqueza en especies de culicinos los cuales contrastan con la baja abundancia y número de especies de anofelinos capturados en este estudio, esto se debe a que los patrones de alimentación de los anofelinos son nocturnos (Cruz et al., 2004), mientras nuestras recolectas fueron en horario diurno y muchas de las especies de culicinos capturadas son diurnas.
De las 6 especies frecuentes, 4 son de importancia médica: A. pseudopunctipennis Theobald y A. albimanus Wiedemann son los principales vectores de Plasmosium sp. responsable de ocasionar la malaria en México (Villarreal-Treviño et al., 2020), A. aegypti, A. albopictus, A. angustivittatus Dyar y Knab, A. scapularis (Rondani), A. taeniorhynchus (Wiedemann) y C. quinquefasciatus tienen importancia por ser vectores de arbovirus como dengue, fiebre amarilla, chikungunya, zika, mayaro, encefalitis equina venezolana, encefalitis equina del oeste y fiebre del valle del Rift (Linthicum et al., 2016; Mitchell, 1995; Wang et al., 2012).
Los análisis en la composición de las especies evidenciaron una alta presencia de ejemplares pocos abundantes o frecuentes (raras) distribuidas en los diferentes municipios de estudio, esto puede deberse a la dinámica de variables climáticas, como la altitud en la que fueron recolectadas (A. guerrero y A. podographicus colectados solamente a 1,200 m snm) y el horario de muestreo. La riqueza de especies resultó ser diferente entre los municipios, concordando con las riquezas de la Trinitaria y Suchiate, en donde se visitaron más sitios y se registraron más especies. Sin embargo, en Mazatán, solo se visitó una localidad ubicada cerca de la costa, en donde fue uno de los 3 sitios con mayor número de especies. Algunos municipios con igual número de especies reportan valores muy diferentes en su diversidad (H’) y equidad (J’), llegando observar que el municipio más rico no fue el más diverso, a diferencias de los municipios con una riqueza ligeramente baja como Frontera Hidalgo (S = 5) que obtuvo una diversidad alta (H’ = 1.50). Este patrón de disminución de ambos índices se observó de igual forma con el ambiente del intradomicilio. Los índices H’ y J’ dependen no solo de la riqueza de especies, sino que son influenciados por la abundancia de los individuos que componen la muestra y sus valores se reducen cuando existe presencia de una o más especies dominantes. La evaluación de la dominancia con el índice λ mostró ser muy redundante respecto al índice J’ de forma inversa (R = -0.80, p < 0.001).
Son necesarios estudios adicionales que permitan abundar en el conocimiento de la distribución y abudancia de especies de mosquitos de importancia médica en comunidades tropicales de México, donde algunas ETM son endémicas, esta información es esencial para mejorar los programas de vigilancia entomológica en la frontera sur de México.











 nueva página del texto (beta)
nueva página del texto (beta)


