Introducción
Uno de los principales paradigmas en ecología es la relación entre los cambios en la abundancia de las especies con la variación en tiempo y espacio de los recursos y factores ambientales (Begon et al., 2006). Dentro de estos estudios, se deben de considerar los factores bióticos como la depredación o la competencia y abióticos como la variación estacional y heterogeneidad espacial, las cuales influyen en las fluctuaciones poblacionales a corto y largo plazo, pero pueden mantener un patrón continuo y predecible (Juliano, 2007; Semlitsch et al., 1996). Por lo tanto, para comprender la dinámica en los cambios en la abundancia en estado natural, es necesario identificar los mecanismos que rigen las interacciones entre las variables ambientales y distintos atributos de la población, principalmente en especies con distribución geográfica restringida (microendémicas) (Zylstra et al., 2015).
De forma general, las variables fisicoquímicas y la estructura del hábitat están relacionadas a respuestas fisiológicas, ecológicas y de conducta en anfibios influyendo en aspectos como la abundancia, distribución local y selección del hábitat (Clipp y Anderson, 2014; Cole et al., 2014; Peterman y Semlitsch, 2013, 2014; Semlitsch et al., 1996). Para ambistomátidos, se reporta que las variables fisicoquímicas y la heterogeneidad espacial están altamente relacionadas con su distribución y abundancia, las cuales están condicionadas principalmente por altas variaciones en temperatura, altos niveles de oxígeno, presencia de vegetación sumergida y áreas poco antropizadas (Escalera-Vázquez et al., 2018; Lemos-Espinal et al., 2016, 2017; Shaffer, 1989; Whiteman et al., 1994). El determinar dichas relaciones aportará información relevante sobre procesos biológicos, y permitirá generar estrategias de conservación en zonas con un alto porcentaje de especies microendémicas (Cushman, 2006).
Para los anfibios, tanto las variables fisicoquímicas como biológicas, están altamente relacionadas con la selección de áreas de desove, la sobrevivencia de huevos, el crecimiento y desarrollo de las larvas, así como con el consumo de presas y niveles de estrés (Chambers, 2011; Freda, 1986; Pierce, 1985; Portnoy, 1990). Por otro lado, la introducción de especies exóticas de peces, puede generar competencia por las presas y modificar el ambiente mediante la resuspensión de sedimentos, afectando poblaciones nativas de ambistomas (Zambrano et al., 2010).
La salamandra Ambystoma andersoni es una especie microendémica del lago de Zacapu, Michoacán, México y está catalogada en riesgo por normas nacionales (NOM-059-2010) e internacionales (UICN, 2015); ha sido modelo de estudio en la caracterización de respuestas morfológicas e inmunológicas a infecciones parasitarias (Álvarez-Silva et al., 2014; Gómez-Rodríguez, 2013). Sin embargo, es poca la información sobre su relación con las características de su hábitat y la respuesta de su abundancia a fluctuaciones ambientales y la heterogeneidad espacial.
Con base en lo anterior, el objetivo del presente estudio es evaluar los factores relacionados con la abundancia de A. andersoni, así como la proporción sexual y estado de madurez de los individuos considerando los cambios estacionales y la heterogeneidad espacial del lago de Zacapu, Michoacán, México. Los resultados presentados tienen el potencial de ser utilizados en la generación de planes de manejo y conservación de una especie de anfibio microendémica presente en una zona con alto impacto antrópico.
Materiales y métodos
El lago de Zacapu es un cuerpo de agua exorréico ubicado al norte de la ciudad homónima (ca. 76,829 habitantes; INEGI, 2020) a 1,980 m snm (19°49’26” - 19°49’40” N, 101°46’45” - 101°47’25” O; Fig. 1). Se encuentra en el Cinturón Volcánico Transmexicano y es parte de la subprovincia neovolcánica Tarasca, la cual se encuentra en la parte baja de la cuenca del río Lerma (Díaz-Argüero, 1997; RAMSAR, 2018). El espejo de agua presenta un área de 21,661 m2 y un volumen aproximado de 64,476.6 m3; una longitud de 634 m (dirección E-O) y un ancho de 414 m (dirección NO-SE); un perímetro de 2,173.68 m y una profundidad máxima de 16 m, con una media de 2.97 m. Las corrientes superficiales están altamente influenciadas por el manantial La Angostura, las cuales se dirigen hacia la zona este produciendo una circulación hacia la desembocadura en la zona noreste (Moncayo-Estrada, 1996). Por otro lado, las corrientes profundas presentan un desplazamiento hacia el este con una velocidad máxima de 13.6 cm s-1 y una mínima de 0.1 cm s-1 (Fernández y Miranda, 1998; Moncayo-Estrada, 1996). Este patrón en las corrientes también está relacionado con la morfología y con la ausencia de estratificación térmica, por lo que los movimientos hídricos del lago generan una tasa de renovación total de agua en aproximadamente 5 días (Ayala-Ramírez et al., 2007).
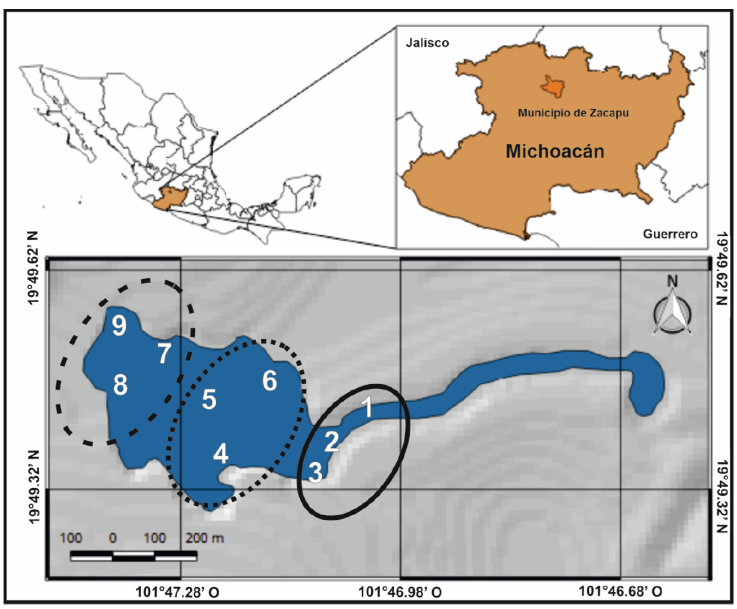
Figura 1 Ubicación geográfica del lago de Zacapu (obtenido de QGIS v. 2.18.16). Los números muestran los sitios de muestreo y la zonificación de los sitios de acuerdo con el movimiento de las corrientes superficiales y profundas; (zona este = línea continua, zona centro = línea punteada, zona oeste = línea segmentada).
Con el objetivo de promover la agricultura, en 1886-1907 se desecó ca. 99% del área total del lago, lo que generó un cambio en la dinámica hídrica (Fernández y Miranda, 1998; Guzmán-Ávila, 1985; Moncayo-Estrada, 1996). La vegetación riparia dominante comprende especies arbóreas, macrófitas flotantes, emergentes y subacuáticas, las cuales pueden servir como sitios de refugio y oviposición. También dominan zonas de cultivo en las orillas del lago utilizados principalmente para autoconsumo y mercado local (Gómez-Rodríguez, 2013). Los suelos están conformados principalmente por arcilla (38%), limo (32%) y arena fina (30%) (Moncayo-Estrada, 1996).
Actualmente, la ribera sur y sureste del lago presentan asentamientos urbanos (ca. 50% del total), y se realizan diferentes actividades antrópicas como agricultura, urbanización, turístico-recreativas e industriales (Díaz-Argüero, 1997; Moncayo-Estrada, 1996; RAMSAR, 2018).
Se realizaron recolectas con ayuda de los pescadores locales durante la época de lluvias (mayo-junio 2018) y secas (noviembre-diciembre 2018) en 9 sitios, los cuales por la ubicación geográfica dentro del lago, 3 se clasificaron en la zona oeste, 3 en zona centro y 3 en la zona este (Fig. 1). Los individuos de A. andersoni se capturaron con redes tipo agallera de 1.5 m de ancho × 50 m de largo y con una luz de malla de 5.08 cm; se utilizó una red por sitio a 2 - 5 m de la orilla durante 12 horas (19:00 - 7:00 horas). La abundancia de A. andersoni se obtuvo como el total obtenido por zona y se generó el promedio considerando cada uno de los muestreos. Una vez recolectados los organismos, se obtuvo la longitud hocico-cloaca (LHC), longitud de la cola (LC) y longitud total (LT), utilizando un vernier digital. Con base en la talla obtenida, los individuos se clasificaron como larva = LT < 3.35 cm; juvenil = LT > = 3.35 < 24.3 cm y adulto > = 24.3 cm, de acuerdo con Zambrano et al. (2015). La identificación de sexos se realizó de acuerdo con Krebs y Brandon (1984), utilizando el abultamiento de la región cloacal.
Simultáneamente al muestreo y captura de individuos, en cada uno de los sitios seleccionados se registraron -de 12:00-13:00 hr- las siguientes variables fisicoquímicas: conductividad específica (CE µS/cm), oxígeno disuelto (O2 mg/l), sólidos disueltos totales (SDT mg/l) y potencial hidrógeno (pH), utilizando una sonda multiparamétrica (YSI EXO2; YSI Inc., Yellow Springs, OH, EUA). La temperatura (°C) se obtuvo utilizando registradores de datos in situ tomando una lectura cada 30 minutos (HOBO Pendant® Temperature/Light 64K Data Logger). Cada una de estas variables se tomó en superficie (0.1-0.9 m) y profundidad (1.0-9.0 m) y la media de ambas mediciones se utilizó para realizar los análisis estadísticos. La profundidad máxima (PM) en cada sitio se obtuvo utilizando una cuerda graduada (cm).
Para la obtención de la heterogeneidad espacial, en cada sitio se consideró un área de 2,500 m2 (50 × 50 m), en la cual se utilizaron de manera alternada (cada 1 m2) cuadrantes de PVC de 1 m2, se registró in situ el tipo de vegetación dominante (riparia, emergente y subacuática), la presencia de refugios (raíces de árbol o rocas) y el tipo de sustrato no vegetal (azolve, roca, arena) utilizando una draga Ekman de 7 kg (BIRGE HYDRO BIOS; 5 muestras de sustrato por sitio). Para corroborar esta información, se tomaron 10 fotografías a cada cuadrante a una distancia en la que se obtuviera la totalidad del cuadrante (ca. 1.5 m) con una cámara réflex digital (Nikon D3200. Lente Nikkor AF-P 18-55mm f/3.5-5.6G VR) a un ángulo de 90° y posteriormente, los elementos presentes en cada fotografía fueron analizados en el programa ImageJ para obtener cada uno de los atributos estructurales (tipo de sustrato y vegetación dominante, presencia de refugios.) y el número total de éstos.
Para cada muestra y por sitio, se obtuvo el índice de heterogeneidad espacial (S), el cual se estimó basado en Winemiller et al. (2008) con la siguiente fórmula:
donde, S = heterogeneidad espacial; x i = cada uno de los atributos estructurales y N = número total de atributos estructurales. Los valores cercanos a 0 indican menor complejidad y cercanos a 1, mayor complejidad; se obtuvo el promedio de los valores de cada uno de los 3 sitios de cada zona.
Para evaluar diferencias significativas en las abundancias de A. andersoni entre zonas y temporadas, se consideró la clasificación por tallas (larva, juvenil, adulto) y sexo de los individuos, y se realizaron análisis de varianza (Anova), siguiendo los supuestos de normalidad (Shapiro-Wilk´s) y homocedasticidad (Bartlett) tomando como nivel de significancia p < 0.05. Para determinar diferencias en abundancia por zonas, se realizaron modelos lineales generalizados (MLG) con distribución Poisson utilizando la función log. En caso de obtener diferencias significativas, se realizaron comparaciones pareadas de acuerdo con Hothorn et al. (2008).
Para analizar las diferencias limnológicas y de heterogeneidad espacial entre zonas y temporadas, se realizaron pruebas de normalidad (Shapiro-Wilk´s) y homocedasticidad (Bartlett) y en caso de pasar dichas pruebas, se realizaron Anovas paramétricas tomando como nivel de significancia p < 0.05. En los Anovas que se encontraron diferencias significativas, se realizaron comparaciones pareadas entre zonas (Tukey-Kramer, Honestly significant difference; HSD).
Para determinar de manera exploratoria la dinámica ambiental del lago de Zacapu, se utilizaron las variables fisicoquímicas que presentaron diferencias significativas y el índice de heterogeneidad espacial obtenido (ver análisis anteriores). Con dichas variables se generó un análisis de correlación múltiple para evitar colinealidad en el análisis de componentes principales (ACP) que se generó posteriormente y determinar si existen agrupaciones de muestras entre zonas y entre temporadas, así como las variables con mayor porcentaje de explicación en este análisis de ordenamiento. Dicho análisis permite simplificar la complejidad de espacios muestrales multidimensionales sin perder información de las diferentes variables utilizadas (e.g., variables fisicoquímicas).
Finalmente, se realizó una regresión múltiple de Poisson paso-a-paso-hacia-adelante (“forward stepwise”) utilizando un MLG para determinar la relación entre la abundancia de A. andersoni y las variables fisicoquímicas significativamente diferentes entre zonas. Para la comparación de modelos se utilizó un análisis de chi-cuadrada. Los análisis se realizaron utilizando como herramienta el programa R (R Core Team, 2014) y las librerías Vegan (Oksanen et al., 2019), MASS (Venables y Ripley, 2002) y Multcomp (Hothorn et al., 2008).
Resultados
Considerando las 3 zonas muestreadas, se capturaron 136 individuos. El Anova de la abundancia de los individuos registrados mostró diferencias significativas en los machos en ambas temporadas (f = 6.63, p = 0.02) y en las hembras (f = 4.85, p = 0.04), mientras que los juveniles no mostraron diferencias significativas (f = 0.50, p = 0.48) (Tabla 1). Con base en el MLG, la abundancia de A. andersoni presentó diferencias significativas entre zonas (p < 0.005). Las comparaciones pareadas mostraron diferencias significativas entre la zona centro y oeste (p < 0.005), y oeste y este (p < 0.005), mientras que la zona centro y este no presentaron diferencias significativas (p = 0.73).
Tabla 1 Análisis de varianza (Anova) para la abundancia de los individuos registrados (machos, hembras, juveniles) por temporada (lluvias y secas). Valores en negritas representan diferencias significativas.
Durante la temporada de lluvias (mayo-junio) se obtuvo una proporción sexual de 1.42:1 (machos : hembras) y 5 juveniles; mientras que durante la temporada de secas (noviembre-diciembre) se obtuvieron 43 individuos con una proporción sexual de 1:1.2 y 5 juveniles. La zona oeste registró la mayor abundancia de individuos en ambas temporadas y en todas las zonas se obtuvo la presencia de al menos un juvenil durante alguna temporada (Fig. 2). Los datos morfométricos de machos y hembras en A. andersoni se ajustaron al modelo de distribución normal y homocedasticidad en ambas temporadas (Shapiro p < 0.05; Bartlett p < 0.05). Para la época de lluvias, el Anova no mostró diferencias significativas en LHC (f = 0.28, p = 0.59), machos: 115.29 ± 8.82 mm (N = 77) vs. hembras: 119.50 ± 11.76 mm (N = 54), ni en LT (f = 0.72, p = 0.87), machos: 221.68 ± 20.51 mm (N = 77) vs. hembras: 215.05 ± 22.40 mm (N = 54), pero cabe mencionar que la LHC en las hembras es mayor y la LT es mayor en los machos. Para la época de secas tampoco se obtuvieron diferencias significativas entre machos y hembras en LHC (f = 1.02, p = 0.32), machos: 119.22 ± 7.83 mm (N = 18) vs. hembras: 118.60 ± 6.4 mm (N = 23), ni en LT (f = 0.13, p = 0.71), machos: 226.3 ± 12.8 mm (N = 18) vs. hembras: 215.52 ± 11.7 mm (N = 23).
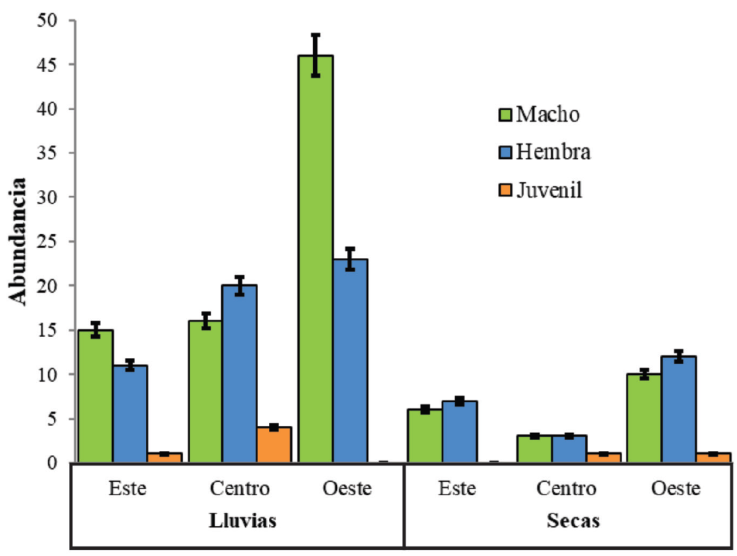
Figura 2 Abundancia de individuos de A. andersoni por zona (este, centro y oeste) y por temporadas (lluvias y secas), así como los estadios de desarrollo y el sexo de los individuos registrados; las barras de error representan la desviación estándar.
Los resultados de temperatura obtenidos por los registradores de datos no presentaron un ajuste al modelo de normalidad (Shapiro w = 0.84, p = 0.008), ni homocedasticidad (Bartlett k = 4.96, p = 0.02) y con base en un Anova no paramétrico, no se obtuvieron diferencias significativas entre las zonas ni entre temporada; zona este (f = 5.6, p = 0.25), zona centro (f = 033, p = 0.67), zona oeste (f = 1.74, p = 0.41). Por otro lado, en la prueba de normalidad (Shapiro) para las variables fisicoquímicas para ambas temporadas, se obtuvo una diferencia significativa con relación al modelo entre zonas y por temporadas (p < 0.05), por lo que se realizó un análisis de varianza no paramétrico para dichas variables. PM no mostró diferencias significativas (k = 0.10, p = 0.74) tanto en temporada de lluvias, como de secas, mientras que las demás variables mostraron diferencias significativas (p < 0.05). El Anova no paramétrico mostró diferencias significativas en la mayoría de las variables durante la temporada de secas (CE, SDT, O2 y pH), mientras que en temporada de lluvias, solamente las variables To y pH mostraron diferencias significativas (p < 0.05). Las comparaciones pareadas no mostraron diferencias significativas entre las zonas este y centro en ambas temporadas (Tabla 2). La heterogeneidad espacial presentó diferencias significativas (p > 0.005) y las comparaciones pareadas mostraron que la zona con mayor heterogeneidad fue la zona oeste (13 atributos presentes), la cual no presentó diferencias con la zona este (10 atributos presentes), pero sí con la zona centro (8 atributos presentes); la zona este y centro no presentaron diferencias significativas en las comparaciones pareadas (Tabla 3).
Tabla 2 Análisis de Varianza (Anova) de las variables fisicoquímicas To = temperatura (oC); CE = conductividad específica (µS/cm); O2 = oxígeno disuelto (mg/l); pH = potencial hidrógeno entre zonas (este, centro, oeste); temporadas (lluvias y secas) y comparaciones pareadas (Tukey-HSD). Variables en negritas representan diferencias significativas.
| Variables | Anova | TukeyHSD(p < 0.05) | ||||
|---|---|---|---|---|---|---|
| Df | Sum Sq | Mean Sq | F value | P Value | ||
| Lluvias | ||||||
| To | 2 | 41.7 | 20.861 | 6.156 | 0.002 | O-E |
| CE | 2 | 1120 | 559.8 | 0.319 | 0.727 | - |
| SDT | 2 | 517 | 258.7 | 0.349 | 0.705 | - |
| O2 | 2 | 33 | 16.40 | 0.492 | 0.612 | - |
| pH | 2 | 4.28 | 2.1410 | 4.151 | 0.017 | O-E |
| Secas | ||||||
| To | 2 | 6.5 | 3.271 | 0.602 | 0.549 | - |
| CE | 2 | 331.5 | 165.75 | 17.61 | < 0.001 | O-C; O-E |
| STD | 2 | 107.9 | 53.94 | 13.41 | < 0.001 | O-C; O-E |
| O2 | 2 | 53.5 | 26.747 | 4.619 | 0.0114 | O-C |
| pH | 2 | 1.038 | 0.5189 | 10.6 | < 0.001 | O-C; O-E |
Tabla 3 Índice de heterogeneidad por sitio basado en Winemiller (2008), mostrando la media (x) y la desviación estándar (DS) de cada zona. Las letras en superíndices denotan no-diferencia significativa.
| Zona | Sitio | Índice de heterogeneidad | x ± DS | |
|---|---|---|---|---|
| Este | 1 | S = 0.55 | S = 0.37 | ± 13.35 A,B |
| 2 | S = 0.22 | |||
| 3 | S = 0.33 | |||
| Centro | 4 | S = 0.22 | S = 0.26 | ± 0.17 B |
| 5 | S = 0.11 | |||
| 6 | S = 0.44 | |||
| Oeste | 7 | S = 0.55 | S = 0.51 | ± 0.06 A |
| 8 | S = 0.44 | |||
| 9 | S = 0.55 |
Con base en el ACP, se obtuvo una variación explicada acumulada de 81% en el segundo componente (CP2). El O2 fue la variable con mayor contribución en el CP1, mientras que la profundidad total y la heterogeneidad espacial fueron las variables con mayor aporte en el CP2. Sin embargo, con base en el agrupamiento, no se observa una diferencia entre zonas y temporadas considerando las variables fisicoquímicas (Fig. 3; Tabla 4).
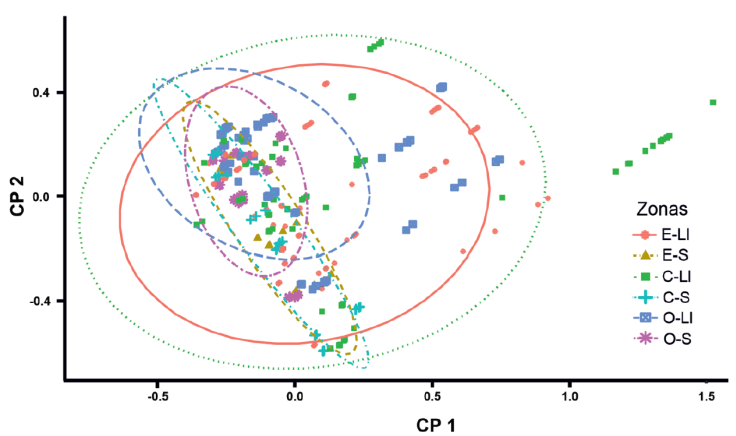
Figura 3 Análisis de componentes principales (ACP) con base en las variables fisicoquímicas y la heterogeneidad espacial durante ambas temporadas (Ll = lluvias y S = secas) en las 3 zonas de muestreo (E = este, C = centro y O = oeste).
Tabla 4 Se muestra el ACP con base en variables fisicoquímicas y la heterogeneidad, considerando las zonas de muestreo en ambas temporadas. Valores en negritas corresponden a las variables con mayor contribución en los 2 componentes principales (CP). Los acrónimos corresponden a los utilizados en la Tabla 2.
| Variables | CP1 | CP2 |
|---|---|---|
| PM | 0.40 | -0.64 |
| T° | -0.06 | -0.06 |
| CE | -0.01 | 0.0002 |
| O2 | -0.83 | -0.54 |
| pH | -0.05 | -0.05 |
| Heterogeneidad | -0.40 | 0.53 |
| Desviación estándar | 0.33 | 0.24 |
| Proporción de varianza | 0.52 | 0.30 |
| Proporción acumulada | 0.52 | 0.81 |
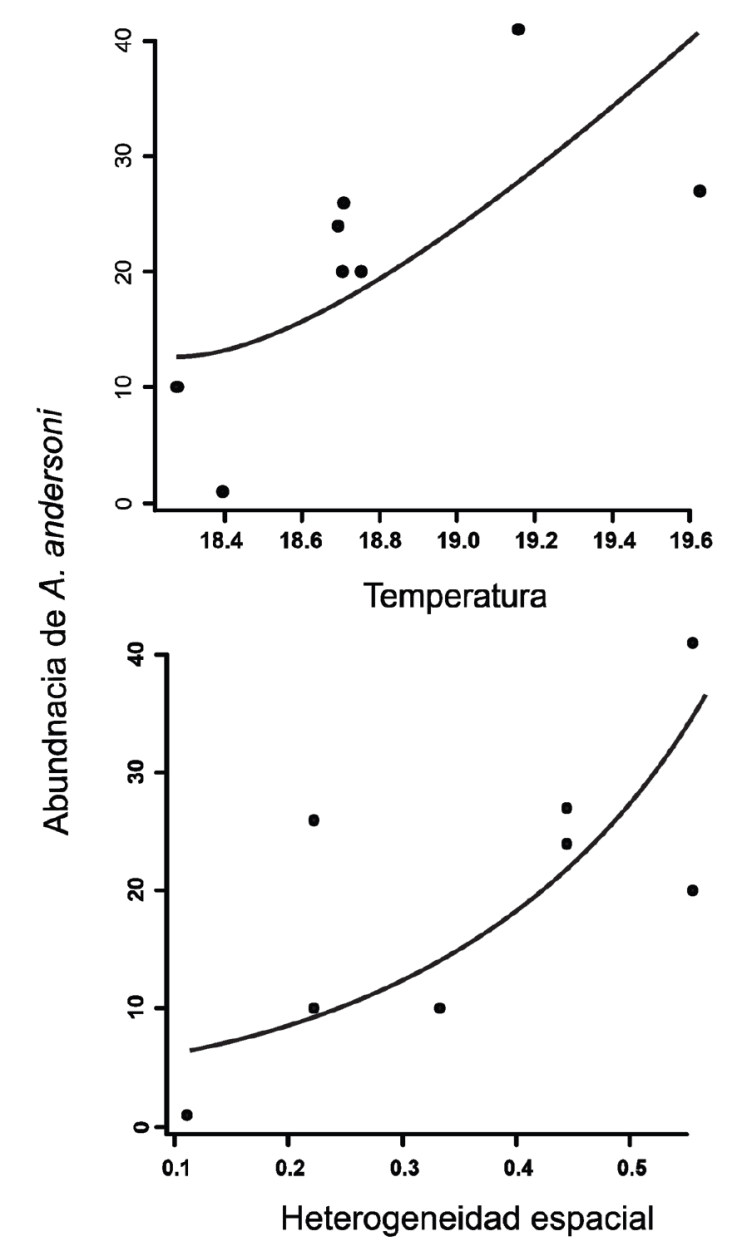
La regresión múltiple basada en el MLG con distribución Poisson para determinar la relación entre la abundancia de A. andersoni y las variables fisicoquímicas y la heterogeneidad espacial, mostró que el modelo que incluye todas las variables (AIC = 75.87) no fue significativamente diferente al modelo que solo incluye temperatura y heterogeneidad espacial (AIC = 75.33; p = 0.22). La relación obtenida fue positiva tanto para temperatura como para la heterogeneidad espacial (Fig. 4).
Discusión
El principal factor que influye en la distribución, presencia y abundancia de especies es la relación de los factores ambientales con la historia de vida de las especies (Acevedo et al., 2011; Díaz et al., 2012; Domitrovic et al., 2013; Escalera-Vázquez y Zambrano, 2010; Torruco-González et al., 2018). Particularmente, para los ambistomátidos la estacionalidad, morfología, tipo y características fisicoquímicas del cuerpo de agua, son factores altamente relacionados con la presencia y abundancia de individuos y especies de este grupo de salamandras (Escalera-Vázquez et al., 2018; Hernández-Guzmán et al., 2019; Shaffer, 1989).
Nuestros resultados muestran diferencias en la abundancia de A. andersoni por temporada y por zona dentro del lago de Zacapu, particularmente una mayor abundancia en la zona oeste durante la temporada de lluvias. De igual forma, se presenta una diferencia en el radio sexual entre la temporada de lluvias y la temporada de secas, lo que sugiere que hay zonas específicas de reproducción dentro del cuerpo de agua y que en época de lluvias se conglomeran los individuos para reproducirse. Esto coincide con la historia de vida de las especies de Norteamérica (A. jeffersonianum, A. maculatum, A. annulatum), las cuales presentan una sincronización entre la temporada de lluvias con el inicio de la época de reproducción (Douglas, 1979; Homan et al., 2018; Kirk et al., 2019; Semlitsch et al., 2014; Semlitsch y Anderson, 2016). Cabe mencionar que, a diferencia de la especie utilizada en el presente estudio, las especies mencionadas requieren de metamorfosis para completar su ciclo de vida, por lo que la sincronía con procesos reproductivos está altamente relacionada con la presencia de cuerpos de agua. Por otro lado, A. andersoni es neoténica y no requiere de metamorfosis para completar su ciclo de vida, por lo que los resultados obtenidos en el presente estudio y su similitud con los ciclos reproductivos de otras especies de Ambystoma, sugiere que A. andersoni requiere de cambios ambientales sutiles (e.g., en la temperatura por la influencia de lluvias) (Sexton et al., 1990). Estos cambios pueden estar asociados a la abundancia de presas en el lago de Zacapu y a que la época reproductiva de A. andersoni coincide con la época reproductiva de invertebrados (Moncayo-Estrada, 1996; Tapia-Alcantar, 2015). De igual forma, la abundancia de las especies neoténicas del género Ambystoma están asociadas a ambientes lénticos, que generalmente presentan barreras biogeográficas de dispersión relacionado a una poca abundancia en áreas pequeñas (Lemos-Espinal et al., 2016; Rodríguez-Amador et al., 2013). Con base en esto, la abundancia total de A. andersoni encontrada en el presente estudio es similar a la encontrada para A. mexicanum, la cual habita en el lago de Xochimilco (Zambrano-González et al., 2003).
El comportamiento fisicoquímico y biológico de un lago está influenciado por las características que presenta como forma, tamaño y profundidad, por lo que fenómenos como la circulación de nutrientes, estratificación térmica, productividad y eutrofización responden a procesos hidrológicos estacionales, modificando temporalmente factores como el pH, temperatura, oxígeno disuelto, y conductividad, los cuales influyen en abundancia de los individuos de Ambystoma (Contreras et al., 2009; Freda, 1986; Kiesecker, 1996; Kirk et al., 2019; Lemos-Espinal et al., 2016, 2017).
Nuestros resultados muestran que, de manera general, el lago de Zacapu presenta poca variación limnológica por zona y por temporada con base en las variables fisicoquímicas, lo que sugiere que en términos ambientales todo el lago se mantiene estable a lo largo del tiempo. Aun cuando obtuvimos diferencias significativas en To y pH, estas diferencias están relacionadas a la variación dentro de cada sitio, aumentando la probabilidad de tener diferencias entre las muestras y entre sitios. La estabilidad del lago de Zacapu se puede explicar por la dinámica de corrientes influenciadas por la presencia de manantiales que mantienen un recambio de agua constante, las cuales promueven una homogenización de todo el cuerpo de agua, y que está influenciada principalmente por la profundidad y morfología (Moncayo-Estrada, 1996). Por otro lado, la variación en SDT y CE está asociada principalmente a la temporada de lluvias, que en conjunto con las corrientes y el ingreso del agua pluvial proveniente de la zona urbana (principalmente en la zona oeste), ocasionan un ingreso y resuspensión de sedimento en el cuerpo de agua (Ayala-Ramírez et al., 2007; Bhattrai et al., 2017; Margalef, 1983; Roselli et al., 2009).
Con base en nuestros resultados, se obtuvo una diferencia significativa en la temperatura entre zonas en la época de lluvias y se obtuvo una mayor abundancia de machos en todos los sitios; ésto sugiere que los machos son los primeros en migrar a sitios de reproducción en respuesta a la disminución de la temperatura (Sexton et al., 1990). Cabe resaltar que, al considerar de manera general el comportamiento limnológico del lago de Zacapu (resultados obtenidos con los registradores in situ), éste presenta condiciones relativamente homogéneas y que los pequeños cambios en temperatura pueden ser activadores de migración a sitios con mayor heterogeneidad (e.g., a la zona oeste). Por otro lado, la menor abundancia de A. andersoni en el presente trabajo se obtuvo en la temporada de secas, por lo que nuestros resultados sugieren que puede haber una asociación de poca precipitación en dicha temporada, ya que se reduce el movimiento de las corrientes superficiales y de fondo, evitando que los individuos se agrupen para reproducirse, lo que promueve una menor probabilidad de captura, y por ende obtener una menor abundancia en zonas específicas (Douglas, 1979; Lemos-Espinal et al., 2016, 2017; Sexton et al., 1990).
Finalmente, la heterogeneidad espacial del hábitat promueve un incremento en la abundancia de diferentes especies del género Ambystoma (e.g., A. maculatum, A. rivulare, A. leorae, A. altamirani). Dicha heterogeneidad está altamente relacionada con la presencia de manantiales, cobertura vegetal, alta diversidad de especies vegetales subacuáticas y diversidad de sustrato (Contreras et al., 2009; Jenkins et al., 2006; Lemos-Espinal et al., 2016, 2017). Nuestros resultados mostraron una relación positiva entre la heterogeneidad espacial y la temperatura con la abundancia de A. andersoni. Este nivel de heterogeneidad espacial está relacionado principalmente a la presencia de vegetación sumergida y subacuática, lo que sugiere que estos sitios pueden estar relacionados a la presencia de recursos alimenticios, ser usados como sitios de refugio, reproducción y ovoposición; ya que los sitios espacialmente heterogéneos están relacionados con altas abundancias de ambystomátidos (Escalera-Vázquez et al., 2018; Huacuz-Elías, 2008; Montes-Calderón et al., 2011; Ruiz-Martínez et al., 2014; Shaffer, 1989). Lo anterior se demuestra en el presente estudio, ya que la mayor abundancia de individuos se obtuvo en la zona oeste, la cual presentó una heterogeneidad significativamente mayor en comparación con la zona centro y este, aunque esta última no presentó una diferencia estadísticamente diferente.
Los resultados presentados en esta investigación, muestran información relevante sobre la importancia de las características ambientales relacionadas a la presencia y abundancia de A. andersoni y generan información relevante, misma que puede ser utilizada para sugerir planes de manejo y conservación in situ. Un ejemplo de esto, es proponer zonas potenciales de conservación, calendarización de zonas pesca, así como técnicas de pesca de bajo impacto a la vegetación subacuática. Lo anterior, de manera directa promoverá el mantenimiento de especies de importancia comercial y cultural, así como los procesos ecológicos necesarios para mantener los servicios ecosistémicos y la biodiversidad acuática del lago de Zacapu.











 nueva página del texto (beta)
nueva página del texto (beta)