Introducción
México cuenta con una extraordinaria diversidad de bosques, abarcando 33 % de su territorio nacional. En el estado de Durango 46.56 % de su territorio son bosques, predominando los templados de coníferas y encinos, así como pequeños enclaves de bosque mesófilo (SEMARNAT, 2017) en estos ecosistemas existe una gran diversidad de organismos, entre ellos los artrópodos.
Los artrópodos son un grupo de organismos muy diversos y tienen una gran capacidad de adaptación, lo que hace que se encuentren prácticamente en casi todos los ecosistemas (Pinkus-Rendón, 2010). Debido a ello se han descrito alrededor de 1 302 809 especies en el mundo (Zhang, 2013), y en México se conocen cerca de 108 519 especies, de las cuales 54.74 % son artrópodos (Llorente-Bousquets y Ocegueda, 2008; CONABIO, 2020).
Los artrópodos juegan diferentes roles dentro de los ecosistemas al desempeñar diversas funciones, donde cada uno utiliza distintas fuentes de recursos como alimentos, agrupándose en gremios tróficos. (Chen y Wise, 1999; Moore et al., 2004). Dentro de los gremios tróficos están los depredadores, quienes en su mayoría son generalistas y no restringen su dieta a especies herbívoras, siendo el canibalismo un hábito alimenticio común dentro de este gremio, tal comportamiento puede llegar a ser un mecanismo de control poblacional efectivo, al disminuir el número de competidores intraespecíficos (Sabelis, 1992; Smith, 1996; Speight et al., 1999). Así mismo, están los fitófagos los cuales son fuente importante de alimento para depredadores y parasitoides, este gremio se alimenta de hojas, tallos y savia (Swift y Anderson, 1994; Speigth et al., 1999). Mientras que, los omnívoros son aquellos que se alimentan de dos o más niveles tróficos diferentes (Polis y Strong, 1996). Por último, l gremio de los descomponedores o detritívoros se alimentan de materia orgánica en descomposición, degradando componentes principales de las plantas (lignina y celulosa), además de materia de origen animal como cadáveres y excrementos (Galante y Marcos-García, 1997).
Actualmente muchos artrópodos son usados como bioindicadores al ser sensibles a cambios ambientales, particularmente los que son causados por las actividades antropogénicas (Rocha et al., 2010; Cameron y Leather, 2012; Niño-Maldonado y Sánchez-Reyes, 2017; Lucio-García et al., 2022). Estos organismos resultan útiles ya que, por su tamaño pequeño, corto ciclo de vida, las altas tasas reproductivas, la abundancia de muchas especies y además sus poblaciones se ajustan rápidamente a las condiciones los hace idóneos como herramienta para el monitoreo de la calidad ambiental, efectos del cambio a través del tiempo/espacio, y a su vez para distinguir modificaciones en el paisaje (Kremen et al., 1993; Schowalter, 2016).
Debido a la importancia de este grupo biológico, el principal objetivo de este trabajo es generar información al evaluar los gremios tróficos de artrópodos presentes en un bosque de pino encino en el municipio de Pueblo Nuevo, Durango, así como analizar la correlación de las abundancias de insectos con variables ambientales, como humedad, temperatura, precipitación, entre otras.
Materiales y métodos
Área de estudio
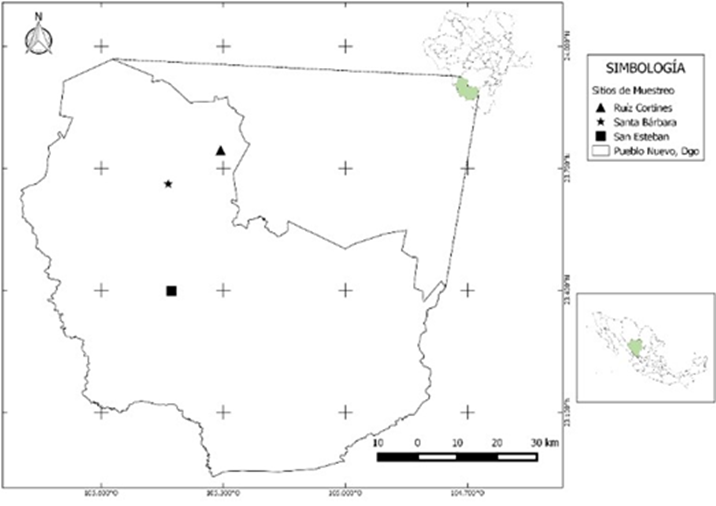
El trabajo se realizó al sur del Estado de Durango, en el municipio de Pueblo Nuevo, ubicado en la Sierra Madre Occidental, con una altitud que va de los 2500 a 2600 m. Presenta una precipitación media anual de 1300 milímetros cúbicos, con régimen de lluvias en los meses de junio-septiembre. Se eligieron tres localidades: Ejido Adolfo Ruiz Cortines (RC), Ejido San Esteban (SE) y la Reserva Ecológica de Santa Bárbara (SB) (Fig. 1).
Métodos de muestreo
Se realizaron muestreos de septiembre de 2017 a marzo de 2018. Los sitios de muestreo cuentan con características particulares de vegetación (Tabla 1), además, RC y SE cuentan con un manejo forestal mientras que, SB al ser una reserva protegida no hay aprovechamiento forestal.
Table 1 Characteristics and coordinates of the sampling sites.
| Sitio 1 (S1) | Sitio 2 (S2) | Sitio 3 (S3) | |
| Características | Adolfo Ruiz Cortines | San Esteban | Santa Bárbara |
| Coordenadas | 23° 44’ 39.82” N, 105° 18’ 23.99” O | 23°23’52.10” N 105° 25’ 38” O | 23° 39’ 39.12 “N, 105° 26’ 7.03” O |
| Altitud | 2 550 m snm | 2 400 m snm | 2 721 m snm |
| Tipo de Vegetación | Pinus spp Quercus spp | Pinus cooperi P. durangensis P. engelmannii P. leiophylla | Picea chihuahuana Abies durangensis Pseudotsuga menziesii |
Para la instalación y monitoreo de trampas se modificó la metodología propuesta por Márquez-Luna (2005) y Cheli y Corley (2010) de la siguiente manera: en cada sitio de muestreo se eligió una superficie de 500 m2 al azar instalándose un total de 30 trampas (Fig. 2) las cuales se fabricaron con contenedores plásticos (1000 mL) y contenedores de aluminio (355 mL).
Se colocaron las trampas de manera aleatoria, 20 trampas pitfall al ras de la superficie del suelo en dos transectos de 100 m (10 trampas por transecto), con una separación de 10 m entre cada trampa, como preservador se utilizaron 180 mL de anticongelante, se dejaron activas durante 15 días y fueron revisadas cada 7 días. Se colocaron 10 necrotrampas cebadas con calamar en dos transectos al azar de 50 m (5 trampas por transecto), con una separación de 10 m entre cada trampa, dejándose activas durante 7 días (Fig. 2).
Simultáneamente, se realizaron muestreos directos de suelo, utilizando el método descrito en el libro Tropical Soil Biology and Fertility (Anderson e Ingram, 1989) , el cual consistió en la elaboración de monolitos de 30 x 30 cm2 de área , de 10 a 30 cm de profundidad según la época del año correspondiente, puesto que a menor temperatura los organismos edáficos se encuentran a mayor profundidad, la hojarasca superficial del monolito fue retirada y revisada manualmente, de esta manera se colectaron los individuos epigeos, posteriormente la muestra de suelo colectada se trasladó al laboratorio para ser separada en charolas de plástico para su tamizado, se utilizó un tamiz con apertura de 2 mm, de esta manera con ayuda de lupas, pinceles, pinzas y lámparas se separaron manualmente los organismos encontrados en el sustrato (Anderson e Ingram, 1989).
Adicionalmente, se instalaron sensores automatizados tipo HOBO (Familia H8, Forestry Suppliers, Inc.) en cada sitio de muestreo, para registrar la temperatura ambiente (°C), temperatura de suelo y humedad. Con un pluviómetro automatizado Davis® S-RGC-M00 conectado a un sensor HOBO Event Onset, se cuantificó la cantidad diaria de precipitación pluvial (mm3) durante los meses de muestreo.
Por último, las muestras obtenidas fueron separadas y colocadas en frascos con alcohol al 70 % para su preservación, traslado y depósito en el laboratorio de Zoología del Instituto Tecnológico del Valle del Guadiana, en donde se llevó a cabo el tratamiento curatorial correspondiente, así como su identificación taxonómica a nivel familia, empleando para ello claves de identificación taxonómica especializadas (Arnett et al., 2002; Triplehorn y Johnson, 2005). Ya identificados los organismos fueron debidamente etiquetados y preservados en viales con alcohol al 70 %, posteriormente se definieron los gremios tróficos de acuerdo con Brown et al. (2001).
Resultados y discusion
En los tres sitios de muestreo se colectaron un total de 18,251 individuos en el periodo de septiembre del 2017 a marzo del 2018, agrupados en 20 órdenes y 67 familias, pertenecientes a ocho gremios tróficos. La composición de familias de invertebrados encontradas en el bosque de pino-encino descrita en la Tabla 2 coinciden con el estudio realizado por Brown et al. (2001), quienes realizaron una recopilación de trabajos realizados en Veracruz y otros estados, encontrando 20 órdenes, 107 familias y nueve gremios, de los cuales 13 órdenes, 27 familias y siete gremios tróficos coinciden con el presente estudio, los órdenes no encontrados fueron Isoptera, Homoptera, Isopoda, Diplura, Pseudoescorpion, Trochida y Julida. Es probable que la ausencia de estos órdenes se deba a la diferencia de ecosistemas de ambos trabajos, ya que el estudio de Brown et al. (2001) se realizó mayormente en diferentes ecosistemas en el sureste de México.
Table 2 Number of individuals collected by site, separated into orders and families.
| No. | Orden | No. | Familia | Sitio/ Número de individuos | ||
|---|---|---|---|---|---|---|
| RC | SE | SB | ||||
| 1 | Araneae | 1 | Amaurobiidae | 8 | 2 | 0 |
| 2 | Araneidae | 15 | 0 | 0 | ||
| 3 | Clubionidae | 0 | 17 | 47 | ||
| 4 | Ctenizidae | 3 | 1 | 2 | ||
| 5 | Dictynidae | 3 | 0 | 0 | ||
| 6 | Lycosidae | 127 | 62 | 6 | ||
| 7 | Pisauridae | 0 | 18 | 0 | ||
| 8 | Salticidae | 7 | 1 | 3 | ||
| 9 | Thomisidae | 14 | 7 | 2 | ||
| 2 | Archaeognatha | 10 | Meinertellidae | 48 | 4 | 8 |
| 3 | Blattodea | 11 | Blattidae | 233 | 117 | 46 |
| 4 | Coleoptera | 12 | Cantharidae | 1 | 0 | 1 |
| 13 | Carabidae | 84 | 202 | 196 | ||
| 14 | Curculionidae | 0 | 5 | 4 | ||
| 15 | Histeridae | 32 | 72 | 3 | ||
| 16 | Lampyridae | 1 | 0 | 0 | ||
| 17 | Scarabaeidae | 2,098 | 145 | 62 | ||
| 18 | Silphidae | 377 | 193 | 20 | ||
| 19 | Staphylinidae | 135 | 122 | 192 | ||
| 20 | Tenebrionidae | 12 | 6 | 0 | ||
| 21 | Trogidae | 6 | 8 | 15 | ||
| 5 | Collembola | 22 | Entomobryoidea | 673 | 1,391 | 893 |
| 23 | Hypogastruroidea | 1 | 0 | 2 | ||
| 24 | Isotomoidea | 3 | 0 | 0 | ||
| 25 | Onychiuroidea | 97 | 219 | 0 | ||
| 26 | Sminthuroidea | 20 | 18 | 42 | ||
| 6 | Dermaptera | 27 | Forficulidae | 0 | 0 | 5 |
| 7 | Diptera | 28 | Anthomyiidae | 0 | 0 | 16 |
| 29 | Calliphoridae | 146 | 53 | 100 | ||
| 30 | Dolichopodidae | 38 | 4 | 22 | ||
| 31 | Drosophilidae | 365 | 308 | 890 | ||
| 32 | Empididae | 0 | 3 | 0 | ||
| 33 | Heleomyzidae | 48 | 77 | 41 | ||
| 34 | Muscidae | 118 | 83 | 150 | ||
| 35 | Mycetophilidae | 68 | 130 | 862 | ||
| 36 | Otitidae | 7 | 0 | 0 | ||
| 37 | Phoridae | 25 | 179 | 78 | ||
| 38 | Sarcophagidae | 2 | 17 | 2 | ||
| 39 | Sciaridae | 2 | 231 | 51 | ||
| 40 | Tachinidae | 24 | 18 | 14 | ||
| 41 | Tipulidae | 0 | 0 | 24 | ||
| 8 | Hemiptera | 42 | Largidae | 34 | 2 | 5 |
| 43 | Lygaeidae | 17 | 1 | 19 | ||
| 44 | Miridae | 145 | 19 | 7 | ||
| 45 | Pentatomidae | 2 | 0 | 2 | ||
| 46 | Reduviidae | 49 | 0 | 47 | ||
| 9 | Hymenoptera | 47 | Apidae | 2 | 1 | 4 |
| 48 | Braconidae | 1 | 20 | 10 | ||
| 49 | Formicidae | 292 | 504 | 34 | ||
| 50 | Ichneumonidae | 19 | 13 | 23 | ||
| 51 | Pompilidae | 0 | 0 | 1 | ||
| 52 | Vespidae | 7 | 2 | 10 | ||
| 10 | Julida | 53 | Julidae | 1 | 3 | 69 |
| 11 | Lepidoptera | 54 | Geometridae | 9 | 6 | 5 |
| 55 | Noctuidae | 0 | 2 | 0 | ||
| 12 | Mesostigmata | 56 | Macrochelidae | 1,095 | 1,591 | 385 |
| 13 | Opiliones | 57 | Phalangiidae | 58 | 120 | 134 |
| 58 | Cosmetidae | 0 | 4 | 0 | ||
| 14 | Opisthopora | 59 | Lumbricidae | 92 | 29 | 232 |
| 15 | Orthoptera | 60 | Acrididae | 83 | 4 | 0 |
| 61 | Gryllidae | 71 | 252 | 1 | ||
| 62 | Tettigoniidae | 7 | 42 | 61 | ||
| 16 | Scolopendromorpha | 63 | Scolopendridae | 1 | 0 | 2 |
| 17 | Scorpiones | 64 | Vejovidae | 2 | 0 | 0 |
| 18 | Solifugae | 65 | Eremobatidae | 0 | 1 | 0 |
| 19 | Stylommatophora | 66 | Arionidae | 3 | 1 | 11 |
| 20 | Trombidiformes | 67 | Erythraeidae | 9 | 2 | 0 |
| *Larvas | 49 | 103 | 66 | |||
** RC= Ruiz Cortines // SE= San Sebastian // SB= Santa Barbara
En los tres sitios se encontraron ocho categorías tróficas, siendo los detritívoros el gremio más representado con 9,635 individuos (52.79 %), seguido por los depredadores con 2,836 (15.53 %) y coprófagos con 2,305 (12.62 %). Los 3,475 (19.06 %) organismos restantes estuvo conformado por gremios: fitófagos, necrófagos, nectarívoros, omnívoros y parasitoides (Tabla 2). El gremio de los detritívoros cumple una función de vital importancia en el suelo al degradar materia orgánica, dentro de este gremio las familias más abundantes pertenecen al Orden de los colémbolos y ácaros, siendo los grupos con mayor abundancia en la hojarasca y suelo, además su presencia se registra a lo largo de todo el año y no solo en algunas épocas (Varela et al., 2007). Así mismo, dentro de este gremio se encuentran las lombrices, quienes contribuyen a porcentajes altos de degradación y de acuerdo con Fragoso et al. (2001) estos organismos se encuentran presentes en ambientes húmedos y no tan perturbados, concordando con este trabajo donde la mayor abundancia de lombrices fue en SB, sitio con mayor humedad y menor perturbación al ser una Reserva Ecológica. Aunque en los otros sitios de muestreo la presencia de estos organismos se mostró en menor cantidad, probablemente esto se deba a factores como la baja cantidad de materia orgánica y compactación de suelo, este último factor es determinante para el desarrollo y mantenimiento de las comunidades de lombrices, es decir, entre más alto el porcentaje de compactación, hay una disminución en el tamaño de las poblaciones de lombrices (Domínguez et al., 2009).
Así mismo, el gremio de los depredadores obtuvo una alta abundancia de individuos y familias, que en su mayoría pertenecen al Orden Araneae y Coleoptera, los cuales cumplen funciones importantes en el ecosistema ya que pueden llegar a ser controladores biológicos de especies perjudiciales para el ecosistema, así como para regular las poblaciones presentes en el mismo (Urbaneja et al., 2005).
Los coprófagos (Coleoptera: Scarabaeida: Scarabaeinae) por su parte obtuvieron su mayor abundancia en el sitio RC, sus altas abundancias pudieran estar estrechamente relacionados a la existencia cercana de un área de manejo de ganado bovino, y de acuerdo con Favila y Díaz (1997) y Escobar (2000) estos escarabajos están asociados a este tipo de mamíferos, siendo el excremento su principal fuente de alimento y refugio. La presencia de este gremio trófico puede generar beneficios al ecosistema al participar activamente en el reciclaje de nutrientes en el suelo, incorporando la materia orgánica en descomposición e incrementando la fertilidad del suelo, acelerando la incorporación del estiércol al ciclo de nutrimentos edáficos (Basto-Estrella et al., 2012).
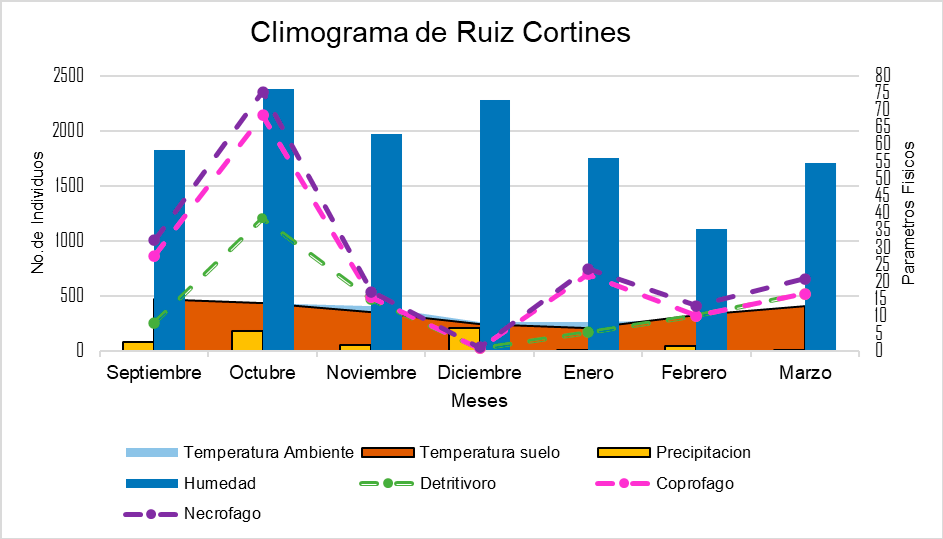
Los resultados mostrados en la Figura 3 corresponden al climograma del sitio RC, donde la temperatura ambiental y del suelo presentan valores similares, comparándolos con los individuos, la abundancia de estos disminuye en relación con las temperaturas más bajas presentadas en los meses de diciembre y enero, además, se observa que en el mes de febrero y marzo las temperaturas aumentan simultáneamente con la abundancia de los organismos. La presencia de organismos en el mes de octubre se relacionó con la precipitación y humedad relativa.
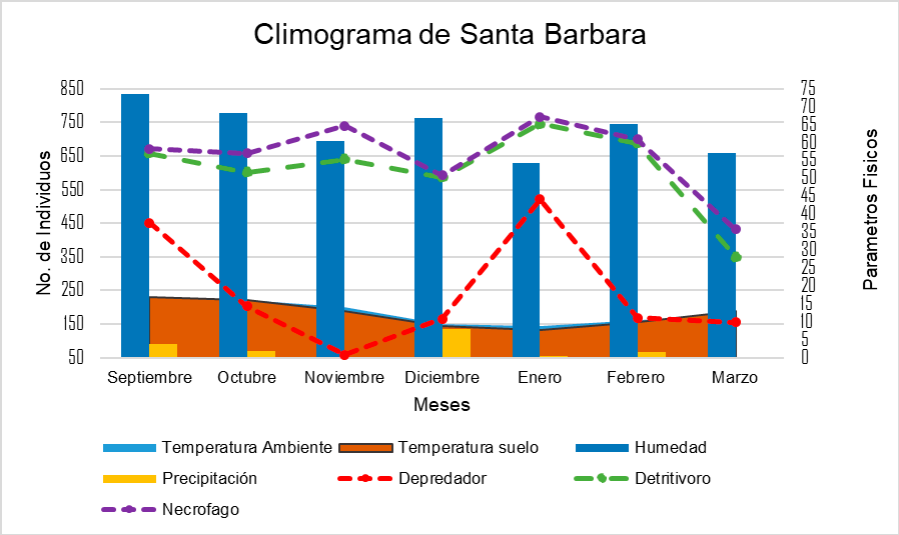
En la Figura 4 se describe el climograma de SE donde la temperatura de suelo fue más baja que la temperatura ambiente. Sin embargo, las temperaturas y la humedad fueron constantes, por lo que, la abundancia de los individuos fue más uniforme, en diciembre y enero se observó un declive en las temperaturas y organismos. El mes donde se encontraron más organismos fue en febrero con un total de 1,525 organismos.
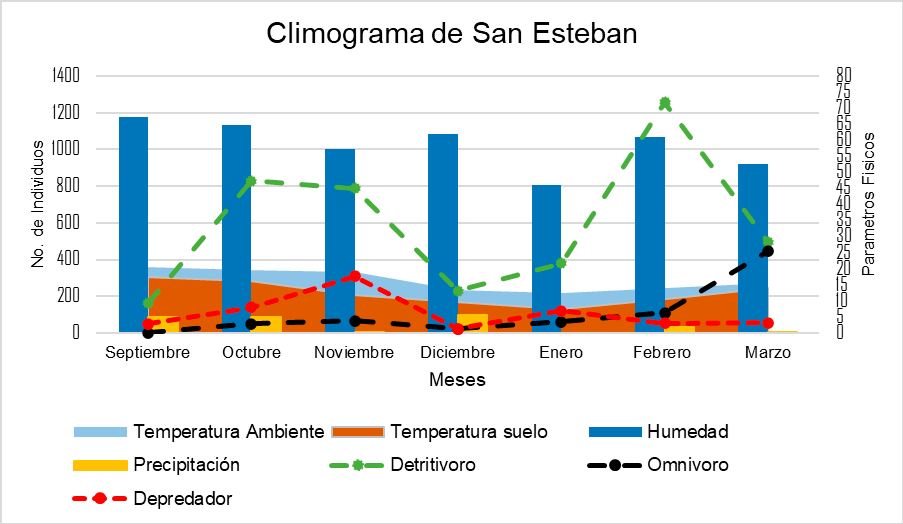
En el climograma de SB la temperatura de suelo y ambiente fueron similares, no obstante, este sitio mostró las temperaturas y abundancias más bajas en comparación al resto. El mes con mayor presencia de organismos fue noviembre y la menor abundancia en marzo. Pese a que en diciembre se presentó mayor precipitación, hubo un declive en el número de organismos debido a nevadas en el sitio, las cuales influyeron en las abundancias. Por último, la nula precipitación en el mes de marzo pudo afectar la presencia de organismos.
En los climogramas de los tres sitios se puede observar que los parámetros físicos (humedad, temperatura y precipitación) pueden estar relacionados con las abundancias de los organismos, ya que, en los meses con precipitación, temperatura mayor a los 12°C y humedad mayor al 60 %, las abundancias aumentaron, mientras que, en los meses en donde estos parámetros fueron menores a los ya mencionados las abundancias disminuyeron, lo que concuerda con Barraza et al. (2010) encontrando mayor abundancia en época de lluvias, esto puede deberse a que en esta época el suelo se encuentra menos compactado y les resulta más fácil emerger a los organismos, dado que la mayoría de individuos reportados tienen sus ciclo de vida mayormente en el suelo.
Tabla 3 Número de individuos colectados en los tres sitios, agrupados por gremios tróficos y separados por familias.
Table 3 Number of individuals collected at the three sites, grouped by trophic guilds and separated by families.
| Gremio | Familias | Total, de Individuos | |||
|---|---|---|---|---|---|
| Coprófago | Scarabaeidae | 2,305 | |||
| Detritívoro | Blattidae Entomobryidae Forficulidae Hypogastruridae Isotomidae | Julidae Lumbricidae Macrochelidae Meinertellidae Mycetophilidae Onychiuridae | Otitidae Phoridae Sciaridae Sminthuridae Staphylinidae Tenebrionidae | 9,417 | |
| Necrófago | Calliphoridae Histeridae Muscidae Sarcophagidae | Silphidae Trogidae Acrididae Anthomyiidae | Miridae Noctuidae | 1,397 | |
| Fitófago | Arionidae Curculionidae Geometridae Heleomyzidae | Lampyridae Largidae Lygaeidae Pentatomidae | Reduviidae Tettigoniidae | 775 | |
| Nectarívoro | Apidae | 7 | |||
| Omnívoros | Formicidae Gryllidae Amaurobiidae Araneidae | Cantharidae Empididae Eremobatidae Erythraeidae | Tipulidae Vespidae | 1,152 | |
| Depredador | Carabidae Clubionidae Cosmetidae | Dolichopodidae Braconidae Lycosidae | Pompilidae Salticidae Scolopendridae | ||
| Ctenizidae | Phalangiidae | Thomisidae | |||
| Dictynidae | Pisauridae | Drosophilidae Vaejovidae | 2,838 | ||
| Parasitoide | Ichneumonidae | Tachinidae | 142 | ||
| Total | 18,033 | ||||
| Larvas | 218 | ||||
| Total | 18,251 |
Por otra parte, en SE las abundancias pudieron verse afectadas ya que es un sitio con manejo forestal, además que, en el mes de septiembre las trampas fueron saqueadas, sin embargo, esto no sesgó los resultados, ya que solo se dio en dicho mes. En RC hubo mayor abundancia de coprófagos, ya que cerca del sitio de muestreo existe una zona de manejo bovino. Finalmente, en SB la abundancia y diversidad fue menor a pesar de ser una reserva y carecer de manejo forestal, sin embargo, es el sitio con mayor altitud.
Conclusiones
Durante el periodo de septiembre del 2017 a marzo del 2018, se recolectó un total de 18,251 individuos pertenecientes a 20 órdenes, 67 familias agrupados en ocho gremios tróficos.
El gremio detritívoro fue el que presentó mayor número de individuos, mientras que, nectarívoro fue el menos abundante, el sitio que presentó mayor número de familias y mayor abundancia fue RC. Las familias con mayor número de individuos fueron Macrochelidae, Entomobryidae y Scarabaeidae con 3071, 2957 y 2305 ejemplares, respectivamente.
La abundancia de organismos decrece o se incrementa debido a los factores ambientales que se presentan a lo largo del año, pues en los meses donde se presentó mayor humedad, precipitación y temperaturas altas los organismos fueron más abundantes, siendo estas variables un factor para efectos positivos o negativos sobre las poblaciones y diversos taxa.
Por último, es trascendental conocer el papel que desempeñan los artrópodos y las relaciones ecológicas que cada uno aporta en el ecosistema, ya que al entender las interacciones entre los diferentes gremios tróficos se generaría más información acerca del funcionamiento dentro del mismo. Es conveniente la realización de más estudios entomofaunísticos y de diversidad en zonas de bosques en el estado de Durango, al ser estos organismos bioindicadores ambientales se pudieran realizar en estudios futuros propuestas de manejo, monitoreo y conversación de estos ecosistemas.











 nueva página del texto (beta)
nueva página del texto (beta)