Introducción
La enfermedad cardiovascular (ECV) representa una de las primeras causas de morbimortalidad en pacientes que viven con obesidad1. Dentro del continuo cardiovascular metabólico y renal (cCMR) la adiposidad disfuncional destaca como causa fundamental desde etapas tempranas en el desarrollo de complicaciones renales, cognitivas, hepáticas y oncológicas; sin embargo, el mayor impacto en la sobrevida de los pacientes que viven con obesidad es por un incremento desproporcionado de ECV1. A modo de ejemplo, se ha propuesto la prevalencia de obesidad como causa del aumento de la incidencia de insuficiencia cardiaca hasta en un 56%2. Este problema constituye una verdadera urgencia en la salud pública.
Con el interés reciente derivado de los avances en el tratamiento farmacológico de la obesidad y su impacto significativo en la reducción de eventos cardiovasculares mayores, es necesario que el clínico identifique los mecanismos fisiopatológicos, las herramientas adecuadas para la estratificación de riesgo y el tratamiento óptimo que resulte en la reducción significativa del riesgo cardiovascular (RCV)3.
El propósito de la presente revisión es dotar al profesional de la salud de una visión integral de la información práctica necesaria y generar conciencia sobre la importancia de la ECV, la estratificación correcta del riesgo y las herramientas disponibles (farmacológicas y no farmacológicas) que pueden impactar en el pronóstico cardiovascular de los pacientes con índice de masa corporal (IMC) > 24.9 kg/m².
Relación entre obesidad y riesgo cardiovascular
Múltiples estudios epidemiológicos han identificado un IMC > 30 kg/m² como factor de riesgo para un conjunto cada vez mayor de enfermedades crónicas que incluyen ECV, diabetes tipo 2 (DT2), enfermedad renal crónica, muchos tipos de cáncer y una serie de trastornos musculoesqueléticos4.
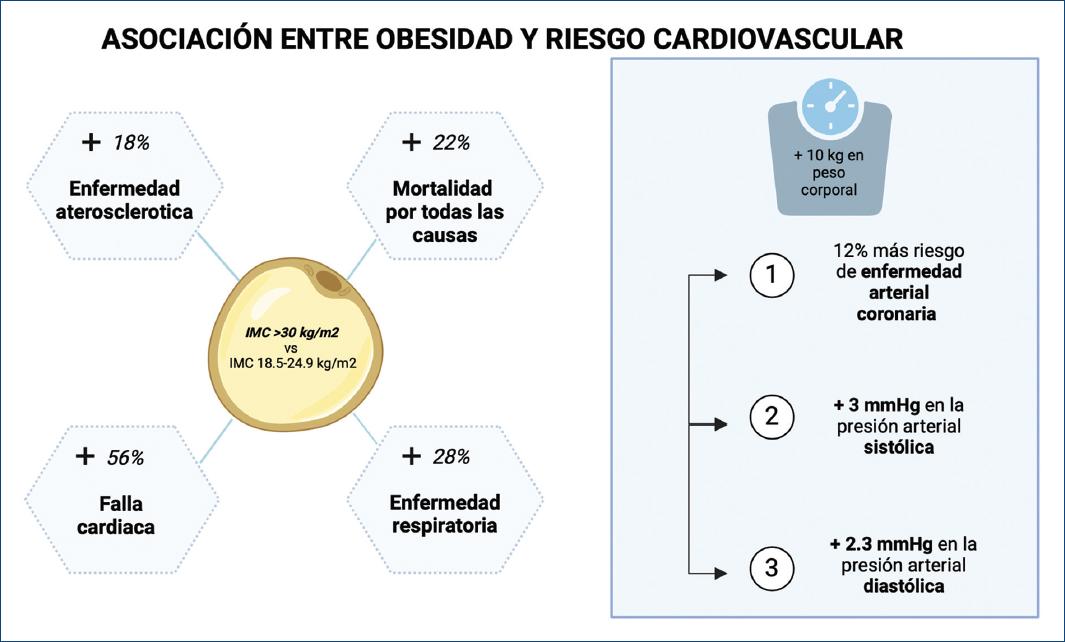
En 2021, los resultados de una cohorte prospectiva de 8,521 participantes del Reino Unido demostró que personas con obesidad sin otras comorbilidades tenían un riesgo sustancialmente mayor de DT2, enfermedad aterosclerótica, insuficiencia cardiaca, enfermedades respiratorias y mortalidad por todas las causas en comparación con las personas sin obesidad (hazard ratio [HR]: 1.22; intervalo de confianza del 95% [IC95%]: 1.14-1.31). En las personas que padecen obesidad, más de un tercio se volvió metabólicamente poco saludable en tres a cinco años y adquiriendo un riesgo aún mayor de enfermedad aterosclerótica5.
En México, los resultados de la Ensanut 2022 reportan una prevalencia mayor al 75% de personas con sobrepeso y obesidad; destaca además que la obesidad abdominal se asocia al doble de riesgo de ECV en comparación con pacientes sin obesidad abdominal6. Así mismo, en un estudio que incluyó 28,934 adultos sin diabetes u otra enfermedad crónica y sin tratamientos hipolipemiantes de Ciudad de México se compararon las asociaciones de marcadores de adiposidad general, abdominal y gluteofemoral con biomarcadores metabólicos medidos por resonancia magnética, demostrándose relación directa con un perfil metabólico de alto riesgo para DT2 y ECV7.
En cuanto al resto de Latinoamérica, se estima que el 55% de los adultos en Brasil (2019), el 57% en Colombia (2015), el 68% en Argentina (2019) y el 74% en Chile (2018) padecen obesidad. Aún más inquietante es que hasta el 39% de los niños y adolescentes de México (2022), el 30% en Brasil (2013), el 22% en Colombia (2015), el 41% en Argentina (2019), el 53% en Chile (2022), el 22% en Colombia (2015)8, el 41% en Argentina (2019) y el 53% en Chile (2022) padecen sobrepeso y obesidad8.
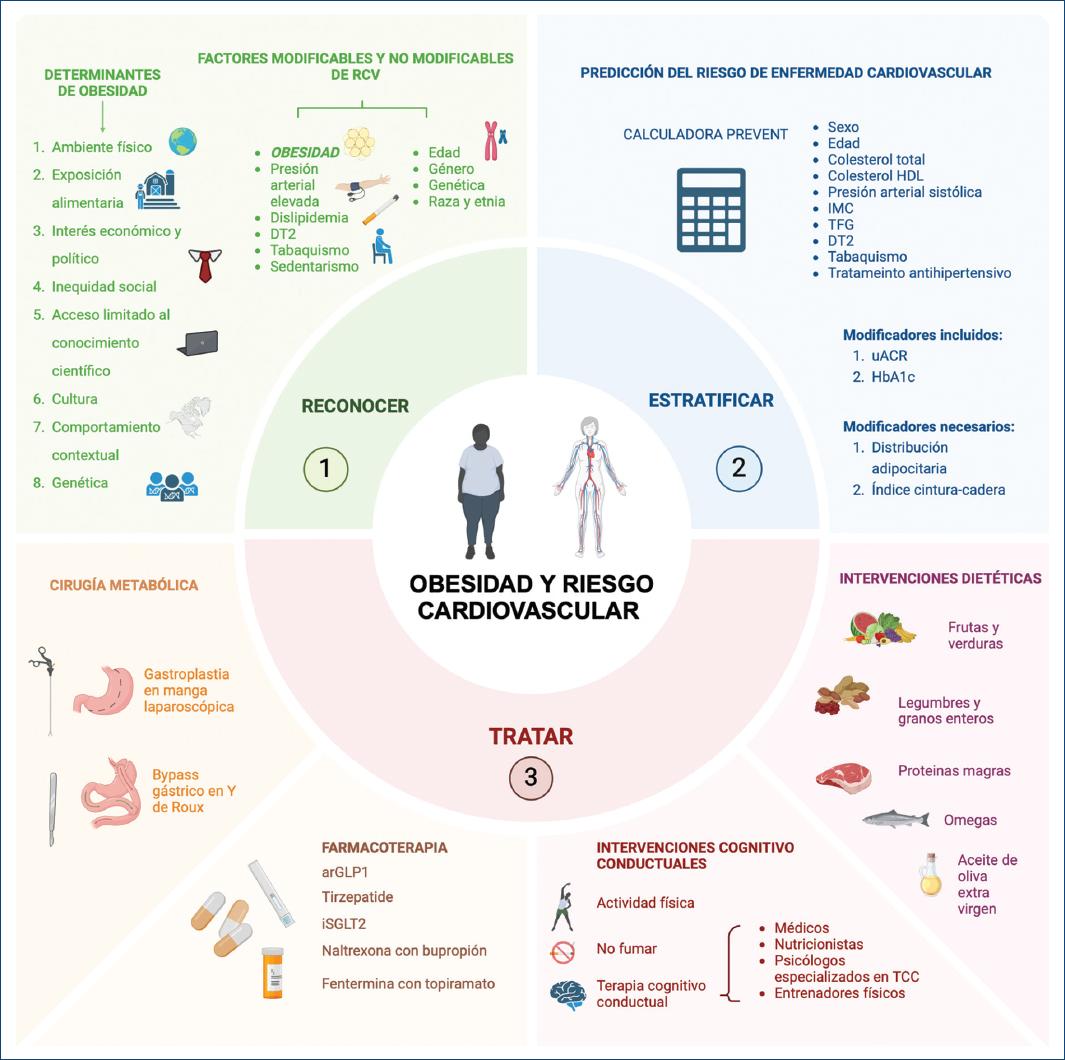
Existen ocho principales determinantes de obesidad en Latinoamérica: el ambiente físico, la exposición alimentaria, el interés económico y político, la inequidad social, el acceso limitado al conocimiento científico, la cultura, el comportamiento contextual y la genética. De acuerdo con el Atlas Mundial sobre Obesidad 2023, las proyecciones entre 2020 y 2035 muestran que la obesidad de niños y adolescentes en países de medianos y bajos ingresos va a incrementar, y la proyección para obesidad en niños de países de altos ingresos será particularmente alarmante8.
A nivel mundial, el 41% de las muertes estuvieron relacionadas con el IMC y el 34% de los años de vida ajustados por discapacidad relacionados con el IMC se debieron a ECV entre personas que padecen obesidad. Casi el 70% de las muertes relacionadas con un IMC alto se deben a ECV. Aun en la ausencia de otras comorbilidades como dislipidemia, DT2 o hipertensión (antes denominada «obesidad metabólicamente saludable», término que hoy se desaconseja por falta de homogeneidad diagnóstica), la obesidad se ha identificado como una importante causa no isquémica de mortalidad cardiovascular y cada incremento de 5 unidades en el IMC confiere un riesgo un 16% más alto de muerte cardiaca súbita9.
En México, un estudio prospectivo que incluyó a más de 115,000 pacientes con IMC > 25 kg/m2 y sin diabetes, hemoglobina glucosilada (HbA1c) > 7.0% u otras enfermedades crónicas, demostró que incluso arriba de 25 kg/m2 (a diferencia de los 30 kg/m2 citados a nivel mundial), cada incremento de 5 kg/m2 representa un aumento del 30% en la mortalidad por todas las causas (HR: 1,30; IC95%: 1.24-a 1.36), particularmente en personas de entre 40 y 60 años10.
Los pacientes que padecen obesidad son propensos a fibrosis y edema de miocardio asintomáticos. En los individuos no diabéticos con obesidad, el aumento del IMC se asocia de forma independiente con el deterioro del tejido miocárdico11. Los grandes estudios epidemiológicos sugieren que por cada unidad de incremento en el IMC existe un incremento de entre el 6 y 13% de riesgo relativo de una multitud de ECV que incluyen insuficiencia cardiaca, estenosis aórtica y cardiopatía isquémica, entre otras12 (Fig. 1).
Fisiopatología del daño cardiovascular en obesidad
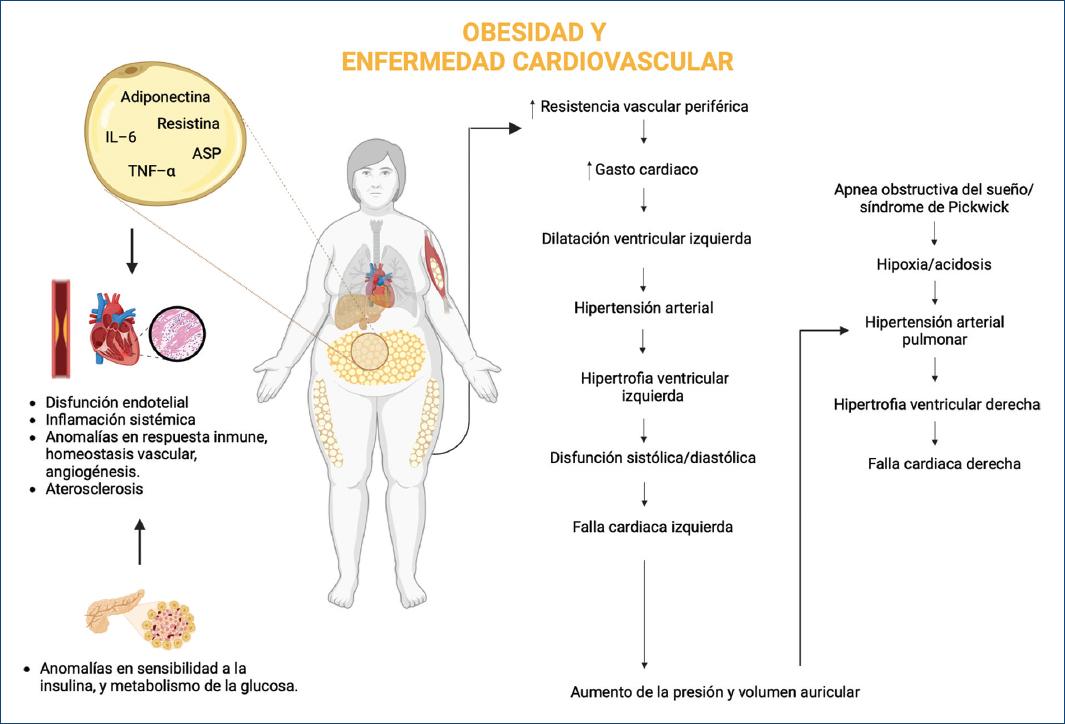
La obesidad mantiene una relación compleja con el sistema cardiovascular: se reconoce como una causa de aterosclerosis por medio de diferentes mecanismos que incluyen dislipidemia, hipertensión, síndrome de apnea obstructiva del sueño y DT2. Sin embargo, además de una clara asociación con dichas comorbilidades, el denominador común apunta hacia componentes más específicos del adipocito. Más recientemente, se ha destacado la relación entre la patogenia coronaria y la distribución del tejido adiposo, siendo el tejido adiposo visceral el de mayor impacto metabólico13 (Fig. 2).
El tejido adiposo es reconocido como un órgano endocrino activo, con la capacidad de sintetizar y liberar en la circulación una variedad de compuestos bioactivos, tales como hormonas, quimiocinas y citocinas, conocidas en conjunto como adipocinas. Este conjunto de adipocinas puede generar efectos nocivos en el sistema cardiovascular como disfunción endotelial, inflamación sistémica, anomalías en la respuesta inmunitaria, la homeostasis vascular, la angiogénesis, la sensibilidad a la insulina, y el metabolismo de la glucosa y los lípidos13.
El endotelio es un órgano complejo con funciones endocrinas importantes para el sistema cardiovascular. En caso de disfunción endotelial, se induce la quimiotaxis de las moléculas adherentes y la diferenciación de monocitos en macrófagos, un proceso crítico en la aterogénesis13. Por otro lado, se promueve la agregación plaquetaria y se reduce la disponibilidad del óxido nítrico, lo que favorece la trombosis debido a la disminución de la relación entre el inhibidor y el activador del plasminógeno 1. La inflamación se ha establecido como factor predictor y/o etiológico de ECV; la concentración elevada de proteína C reactiva (PCR) producida en el hígado se ha correlacionado significativamente con el aumento de interleucina 6 que produce el tejido adiposo y libera al torrente sanguíneo, propuesta no solamente como marcador de inflamación vascular, sino como inductor aterosclerótico13.
En consecuencia a los mecanismos antes mencionados, hoy se reconoce que la obesidad es causa de ECV y se asocia a un aumento del 5% en hombres y un 7% en mujeres por cada unidad de IMC14, así como mayor asociación entre un IMC más alto y el riesgo de insuficiencia cardiaca con fracción de eyección preservada. Específicamente, pacientes con sobrepeso y obesidad de clase 1 tenían un 38 y 56% más de riesgo, respectivamente, independientemente de otros factores de RCV15. La baja condición física se ha asociado con un riesgo significativamente mayor de insuficiencia cardiaca en todas las categorías de IMC hasta en un 50%16.
Abordaje práctico
La figura 3 (figura central) propone un marco de abordaje y tratamiento del RCV en pacientes que viven con obesidad. Se sugieren tres pasos: 1) reconocer - que la obesidad es una condición que se asocia a un mayor RCV; 2) estratificar - el riesgo individual e identificar los objetivos de tratamiento en cada paciente, y 3) tratar - tomando en cuenta un abordaje multidisciplinario incorporando terapia conductual, medidas del estilo de vida, fármacos y cirugía, según sea el caso.
Estratificación de riesgo cardiovascular en el paciente con obesidad
La Sociedad Europea de Cardiología recomienda la estimación del riesgo de ECV en cada encuentro con el sistema de salud17 con el objetivo de establecer objetivos individuales y estrategias multidisciplinarias en la reducción de riesgo de eventos cardiovasculares a futuro. La evaluación o cribado del RCV puede ser oportunista o sistemático. El cribado oportunista, es decir, sin una estrategia predefinida, se lleva a cabo cuando la persona acude a consulta por otro motivo. El cribado sistemático incluye el seguimiento a la población diana, incluyendo aquí a los pacientes que padecen sobrepeso u obesidad17.
Tanto el IMC como el perímetro de la cintura y el índice cintura-cadera mantienen relación con la ECV tras ser ajustados por los factores de riesgo convencionales17. Recientemente, la American Heart Association (AHA) publicó la calculadora PREVENT (Predicting Risk of Cardiovascular Disease EVENTS). Esta calculadora deriva del análisis de 25 bases de datos (N = 3,281,919) entre 1992 y 2017, en donde entre otros factores mayores de riesgo de ECV se incluyó presión arterial sistólica, colesterol total, colesterol unido a lipoproteínas de alta densidad, IMC y tasa de filtración glomerular estimada a un seguimiento mínimo a cinco años18.
La calculadora PREVENT de la AHA es una herramienta diseñada para evaluar el riesgo de eventos cardiovasculares en personas de entre 30 y 79 años sin antecedentes de ECV aterosclerótica, insuficiencia cardiaca o accidente cerebrovascular. Está enfocada en la prevención primaria, es decir, en individuos que aún no han desarrollado estas enfermedades. La calculadora incorpora, entre otros predictores para mayor personalización, el IMC y el índice de privación social, y pone sus resultados en el contexto del cCMR. Este síndrome, recientemente definido por la AHA, agrupa condiciones como la DT2 y la obesidad, que aumentan el RCV a medida que avanzan por sus diferentes etapas18.
Además, en el posicionamiento presidencial de la AHA sobre el cCMR, se recomienda tomar en cuenta el IMC y la obesidad como un factor causal de riesgo CV a futuro. Aún más, los autores de este posicionamiento recomiendan categorizar a los pacientes con sobrepeso y obesidad dentro del estadio I del cCMR, sabiendo que existen individuos con peso normal basado en IMC que podrían necesitar una clasificación más detallada1.
Finalmente, a partir del estudio MESA podemos sugerir que más allá del IMC, el índice cintura-cadera, el perímetro de la cintura y la evaluación de la adiposidad visceral mediante tomografía computarizada (TC) un 28% mayor de riesgo de cCMR por cada 100 cm2/m de área de adiposidad visceral. Los individuos con un IMC normal pero mayor adiposidad visceral tenían más glucosa (p < 0.0001), menos adiponectina (p < 0.0001), más PCR de alta sensibilidad (p = 0.02) y mayor insulina (p < 0.0001), un fenotipo bioquímico similar a personas que padecen sobrepeso/obesidad19.
Por otra parte, parece ser que la composición corporal también tiene una implicación en la progresión de ECV. En un estudio retrospectivo que incluyó a 1,015 sujetos sometidos a evaluación seriada de puntaje de calcio con al menos un año de diferencia, se documentó que la abundancia de adiposidad visceral en relación con la adiposidad subcutánea (> 30%) se asoció a un incremento sustancial en la progresión de enfermedad arterial coronaria (HR: 2.2; p < 0.01) y se mantuvo como un factor pronóstico independientemente del IMC o el perímetro de cintura20. Sin embargo, algunas limitaciones al incluir la composición corporal como factor aditivo de RCV incluyen gran variabilidad de métodos para medir la composición corporal (TC, densitometría ósea, bioimpedancia, resonancia magnética, etc.) y la falta de puntos de corte específicos y universales.
Estrategias de tratamiento
El objetivo principal del manejo de la obesidad debe centrarse en la pérdida de tejido adiposo visceral sostenida a base de dieta y actividad física más allá de una reducción en el IMC. Las pautas más recientes del American College of Cardiology/AHA y Sociedad Europea de Cardiología (ESC)/European Atherosclerosis Society (EAS) sobre la prevención primaria de las ECV reconocen específicamente las dietas basadas en plantas y mediterráneas, un mayor consumo de frutas, nueces, verduras, legumbres, aceites vegetales como los de oliva extra virgen, canola, etc., y proteínas animales o vegetales magras, y la ingesta regular de fibras vegetales solubles e insolubles inherentes, asociarse consistentemente con un menor riesgo de mortalidad por todas las causas.
Si bien los cambios en el estilo de vida se asocian a innumerables beneficios a la salud en general21, cuando hablamos de RCV y obesidad, la pérdida de peso solo se refleja en la modulación del metabolismo lipídico y reducción de marcadores inflamatorios cuando se alcanza una reducción superior al 5%, y una reducción de eventos cardiovasculares cuando se alcanza una reducción de más del 10% del peso corporal22. Es por ello que para incidir sobre el RCV en pacientes que viven con obesidad, las intervenciones multifactoriales que incluyen actividad física, terapia nutricional, psicológica, fármacos y cirugía constituyen las formas de actuar vigentes.
Intervenciones dietéticas
Las elecciones dietéticas son en gran medida responsables de la prevalencia de pacientes con obesidad. Es común pensar en una dieta hipocalórica como la solución al problema de la obesidad. Pero la realidad de esta relación directa es compleja y pasa por alto la importancia de la calidad más que la cantidad de las calorías23. La nutrición saludable tiene un impacto significativo en los factores de riesgo cardiometabólicos. Las guías de prevención recomiendan dietas ricas en frutas, verduras, legumbres, granos enteros y fuentes de proteínas magras, con una minimización de alimentos procesados, grasas trans y bebidas azucaradas24. Componentes específicos de estas dietas, como los ácidos grasos omega-3 en el pescado, el aceite de oliva extra virgen (AOVE) y los antioxidantes en frutas y verduras, han demostrado efectos beneficiosos en la reducción de la inflamación y la mejora de los perfiles lipídicos, factores clave en la prevención de ECV25.
Los estudios controlados han evidenciado los efectos positivos de estas dietas. Por ejemplo, el estudio PREDIMED (Prevención con Dieta Mediterránea) demostró que la adherencia a la dieta mediterránea, suplementada con aceite de oliva extra virgen o frutos secos, redujo significativamente la incidencia de infarto de miocardio, accidente cerebrovascular y mortalidad cardiovascular en un 30% en comparación con una dieta baja en grasas26. Ambas versiones de la dieta mediterránea (suplementada con AOVE o frutos secos) han mostrado mejoras significativas en factores de RCV tanto clásicos como emergentes, incluyendo la presión arterial, la sensibilidad a la insulina, los perfiles lipídicos, la inflamación, el estrés oxidativo y la aterosclerosis carotídea. En particular, la dieta mediterránea suplementada con AOVE redujo de manera significativa la incidencia de DT2 entre los participantes no diabéticos, en comparación con el grupo de control24.
Hallazgos recientes han identificado una firma metabólica de la dieta mediterránea que permite determinar objetivamente la adherencia dietética y predecir el riesgo de ECV. Patrones específicos del lipidoma, como las fosfatidilcolinas poliinsaturadas y los ésteres de colesterol, se asociaron inversamente con el riesgo de ECV, mientras que los monoacilglicéridos, diacilglicéridos y triacilglicéridos cortos se asociaron directamente con un mayor riesgo de ECV27.
Otro claro ejemplo del impacto de la calidad nutricional sobre el RCV es el estudio Lion-Heart. Este investigó el impacto de una dieta mediterránea suplementada con ácidos grasos poliinsaturados en la prevención secundaria de ECV. Este estudio tuvo como objetivo determinar si esta intervención dietética podría reducir la mortalidad y mejorar los resultados cardiovasculares en pacientes con ECV establecida28. El estudio Lion-Heart demostró una reducción significativa en la mortalidad por ECV (HR: 0.35; IC95%: 0.15-0.82) y la mortalidad total (HR: 0.44; IC95%: 0.21-0.92) durante un periodo de seguimiento de 46 meses para los pacientes que seguían una dieta mediterránea enriquecida con ácido alfa-linolénico. El estudio informó una reducción del 65-70% en los eventos de enfermedad coronaria, incluyendo tanto los resultados fatales como los no fatales, para los participantes que seguían la dieta mediterránea en comparación con aquellos que seguían una dieta prudente de tipo occidental29.
Un gran reto es traducir resultados de estos estudios a diferentes partes del mundo. Implementar el patrón de alimentación mediterráneo en diversas culturas globales, con un enfoque particular en Latinoamérica, puede lograrse adaptando sus principios fundamentales a los alimentos frescos y locales de cada región30. En Latinoamérica, esto implicaría el uso de frutas tropicales, legumbres autóctonas, verduras frescas, proteínas magras diversas y aceites vegetales como el de aguacate. Este enfoque promueve la salud cardiovascular respetando la diversidad cultural y la disponibilidad de productos locales, facilitando la adherencia a una dieta saludable y sostenible.
La Organización Panamericana de la Salud (OPS) reconoce la importancia crucial de la educación en salud y fisiopatología desde las primeras etapas de la vida; es fundamental intervenir durante el embarazo y la lactancia en mujeres, así como en niños, para modificar entornos que propicien la obesidad. Dichas intervenciones no solo apuntan a la pérdida de peso posparto, sino también a la prevención de la obesidad infantil, problemáticas que están estrechamente interrelacionadas31.
Intervención cognitivo-conductual
El ejercicio físico, independientemente de la pérdida de peso, proporciona numerosos beneficios para la salud, especialmente para personas con sobrepeso y obesidad en riesgo de padecer ECV o con ECV actuales16. Sin embargo, mundialmente el grado de éxito en la implementación de estilos de vida cardiosaludables es bajo y limitado. Aunque se han logrado avances en la última década, solo el 0.1% de los adultos mayores de 20 años presentan comportamientos de salud ideales, definidos como el cumplimiento de las recomendaciones en cuanto a actividad física, dieta, IMC y no fumar22.
La brecha intención-conducta representa la discrepancia entre las intenciones de una persona de adoptar comportamientos saludables y la implementación real de dichos comportamientos. Este fenómeno es de particular interés en la promoción de estilos de vida saludables, incluyendo una dieta cardiosaludable y la pérdida de peso23. A pesar de una clara intención de mejorar la salud, muchos individuos no logran traducir estas intenciones en acciones concretas, lo cual subraya la necesidad de intervenciones eficaces. Los factores que contribuyen a la brecha intención-conducta incluyen la falta de habilidades de autorregulación, la baja autoeficacia, la influencia de contextos sociales adversos, la percepción de barreras externas y la presencia de hábitos establecidos. Estos elementos dificultan la traducción de intenciones saludables en acciones concretas, subrayando la necesidad de intervenciones que aborden tanto los aspectos psicológicos como los contextuales12.
Las terapias cognitivas conductuales (TCC) se han demostrado eficaces para reducir pensamientos y conductas asociados a la brecha intención-conducta32. Estas intervenciones abordan patrones de pensamiento y comportamientos disfuncionales que impiden la adopción de hábitos saludables. Mediante técnicas como la reestructuración cognitiva, el establecimiento de metas específicas, el monitoreo del comportamiento y la gestión del estrés, la TCC ayuda a los pacientes a superar barreras psicológicas y a desarrollar habilidades prácticas para implementar y mantener cambios en el estilo de vida33.
Para maximizar la efectividad de estas intervenciones, es esencial un enfoque multidisciplinario donde se incluyan médicos, nutricionistas, psicólogos especializados en TCC, entrenadores físicos y educadores en salud. Esta aproximación ha mostrado un éxito relativo en estudios a la hora de incrementar adherencia a una intervención de modificación de estilo de vida en niños que padecen obesidad34. Abordar la brecha intención-conducta mediante intervenciones basadas en TCC, apoyadas por un equipo multidisciplinario, puede ofrecer asistencia en la implementación efectiva de un estilo de vida saludable, contribuyendo así a la optimización del RCV. Aunque debe decirse que no elimina todas las barreras sociales y económicas del individuo en la sociedad moderna.
Fármacos
Antes de considerar la farmacoterapia contra la obesidad, se debe realizar una evaluación exhaustiva centrada en la trayectoria de aumento de peso del paciente e intentos previos de pérdida de peso, además de una revisión objetiva con el fin de detectar cualquier comorbilidad y afección médica no diagnosticada relacionada con un aumento de peso o dificultad para su pérdida: esto incluiría hipotiroidismo, apnea obstructiva del sueño, síndrome de ovario poliquístico, hipogonadismo o la enfermedad de Cushing, entre otras35, mismas que podrían requerir un tratamiento individualizado.
En la actualidad, los fármacos recomendados para el descenso de peso según la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) de EE.UU. son los agonistas de receptor de péptido similar al glucagón tipo 1 (arGLP-1) liraglutida y semaglutida, un agonista dual de incretinas (tirzepatida), la combinación de naltrexona con bupropión y la combinación de fentermina y topiramato. Estos fármacos están aprobados para pacientes con un IMC ≥ 29.9 kg/m2 o con un IMC ≥ 27 kg/m2 que también tienen factores de riesgo o enfermedades concomitantes relacionados con la obesidad y para quienes modificaciones del estilo de vida no han tenido éxito34.
La liraglutida y la semaglutida son fármacos de la clase arGLP-1. El GLP-1 es una hormona de la familia de las incretinas, secretada principalmente por las células del intestino en respuesta a la ingesta de comida. Esta hormona estimula la secreción de insulina dependiente de glucosa, reduce la secreción de glucagón y aumenta la sensibilidad a la insulina en los tejidos periféricos. También regula el apetito y enlentece el vaciamiento gástrico, lo que incrementa la sensación de saciedad y de plenitud. Inicialmente los arGLP-1 se aprobaron para el tratamiento de la DT2. En la actualidad algunos se usan de manera exclusiva para este fin y otros, como la liraglutida y la semaglutida, pueden indicarse también para la pérdida de peso independientemente del diagnóstico de DT2 o no36.
Los arGLP-1 han demostrado una mejoría en el perfil de factores de RCV y metabólico que incluyen reducciones en la presión arterial, mejoría en el perfil de lípidos y reducción de la HbA1c37. En adición, han demostrado una reducción de peso que va del 6.0 al 8.0% en el programa de estudios clínicos fase IIIa en pacientes con obesidad (SCALE)38-42.
Es muy importante destacar que al momento de esta revisión, los arGLP-1, específicamente la semaglutida inyectable semanal, es el único fármaco que ha demostrado reducción de eventos cardiovasculares mayores en pacientes con obesidad en un estudio clínico aleatorizado doble ciego. A este respecto, el estudio más importante de reducción de eventos cardiovasculares en pacientes con obesidad y sin DT2 fue SELECT41. Este fue un estudio aleatorizado, multicéntrico y doble ciego que incluyó 17,604 pacientes; 8,803 recibieron semaglutida y 8,801 placebo, en pacientes con ECV preexistente y sobrepeso u obesidad sin DT2. La administración subcutánea semanal de semaglutida a una dosis de 2.4 mg fue superior al placebo para reducir la incidencia del compuesto primario de muerte por causas cardiovasculares, infarto al miocardio no fatal y EVC no fatal (HR: 0.80; IC95%: 0.72-0.90). En adición, durante un seguimiento medio de 39.8 meses, los pacientes tratados con semaglutida experimentaron una mayor y más marcada reducción de peso (9.39% al final del estudio) y del perímetro abdominal, y también de los valores de HbA1c, colesterol vinculado a lipoproteínas de baja densidad (c-LDL), triglicéridos y presión arterial43. Este estudio resultó un parteaguas en la evidencia científica. pues ha demostrado que el tratamiento de la obesidad con arGLP-1 se asocia no solo a pérdida de peso y reducciones en parámetros de RCV, sino a una reducción en eventos clínicos mayores.
La tirzepatida es un agonista del receptor del péptido 1 similar al glucagón (GLP-1) y del péptido insulinotrópico dependiente de la glucosa (GIP). En los estudios SURMOUNT III y IV demostró reducciones de peso de hasta un 24.5%, destacando seguimiento a dieta baja en calorías, ejercicio y sesiones de asesoramiento. Parámetros de RCV como colesterol total, c-LDL y colesterol vinculado a lipoproteínas de alta densidad (c-HDL) tuvieron reducciones significativas, del 13.7, 13.9 y 24.3% respectivamente44. En el estudio SURMOUNT I, que incluyó pacientes con sobrepeso y obesidad y sin diabetes, se demostró el impacto de la tirzepatida en la reducción de la progresión a DT2 en el 94% de los pacientes incluidos durante 72 semanas de seguimiento45. En el estudio SURPASS II, se comparó en 1,878 pacientes con DT2 y HbA1c 7.0-10.5% tirzepatida a dosis de 5, 10 y 15 mg frente a semaglutida 1 mg, demostrando la tirzepatida reducciones de peso corporal ≥ 5% más rápido que la semaglutida 1 mg (p < 0.006); en cuanto a control glucémico, el tiempo medio para alcanzar HbA1c ≤ 6.5% fue de 12.1 semanas para cada dosis de tirzepatida, en comparación con 15.7 semanas para semaglutida 1 mg46. Finalmente, en un estudio post hoc de SURMOUNT-1, la reducción de RCV fue mayor para los pacientes que recibieron tirzepatida vs. placebo en el seguimiento a 72 semanas (de 23.5 a 16.4%)47. Al momento de esta revisión se encuentra en desarrollo SURMOUNT MMO, un estudio en curso de fase III, aleatorizado, doble ciego y controlado con placebo con una muestra planeada de > 15,000 pacientes y con el objetivo primario de evaluar el tiempo hasta la primera ocurrencia de cualquier evento adverso mayor, incluida la muerte por cualquier causa, infarto de miocardio no fatal, accidente cerebrovascular no fatal, revascularización coronaria o eventos de insuficiencia cardiaca que resulten en hospitalización o visitas urgentes (NCT-05556512). Su fecha estimada de término es en 2027.
Por otro lado, los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT-2) han demostrado beneficios cardiovasculares en pacientes con DT2, con insuficiencia cardiaca en todo el rango de fracción de eyección del ventrículo izquierdo y en enfermedad renal crónica (con y sin DT2)48. Se recomiendan como terapia de primera línea en estos grupos y podrían tener efectos deseables, aunque modestos, en la reducción de peso corporal. Promueven la excreción urinaria de glucosa al inhibir la reabsorción de glucosa de la orina en el túbulo proximal del riñón (hasta aproximadamente el 50%), con una pérdida calórica que conduce a una pérdida de peso modesta48.
Es crucial destacar que, en términos de pérdida de kilogramos de peso promedio, los iSGLT-2 alcanzan entre 1.5 y 2 kg, los arGLP-1 entre 2 y 4 kg, y la combinación de ambos entre 3 y 5 kg. Entre los iSGLT-2, la canagliflozina a 100 mg ha mostrado el mayor impacto individual, logrando una reducción promedio de 2.8 kg en pacientes con obesidad sin diagnóstico de DT249. SELECT, con semaglutida inyectable, reportó que el promedio de pérdida de peso fue del 9.39%50. Por otro lado, DURATION-8 demostró que la pérdida media de peso corporal fue mayor con la combinación de exenatida (arGLP) una vez a la semana y dapagliflozina (iSGLT-2) una vez al día en pacientes con DT2, comparado con las monoterapias individuales50; estos fármacos pueden usarse de forma concomitante.
La naltrexona es un antagonista competitivo de los receptores opioides μ (mu), κ (kappa) y δ (delta). El bupropión es un inhibidor de la recaptación de dopamina y noradrenalina. Se postula que estos componentes presentan una acción sinérgica para la reducción de la ingesta de alimentos actuando en dos áreas cerebrales diferentes. Una de ellas es el hipotálamo (centro regulador del apetito) y la otra, el circuito dopaminérgico mesolímbico (sistema de recompensa)51. En el ensayo clínico aleatorizado multicéntrico COR-II (Contrave Obesity Research II) se evaluaron 1,472 pacientes con obesidad o sobrepeso a lo largo de 56 semanas, utilizando una dosis de 32 mg de naltrexona. Se observó una notable reducción en los parámetros de riesgo cardiometabólico, que incluyen la disminución de peso en un 6.1%, perímetro de la cintura, resistencia a la insulina, c-HDL, triglicéridos y presión arterial sistólica, con un valor de p < 0.0001 en todos los casos51. Una revisión sistemática que incluyó 70 estudios comparando eventos cardiovasculares en pacientes que recibieron naltrexona, bupropión, naltrexona + bupropión vs. otros comparadores sugiere que esta combinación es segura desde el punto de vista cardiovascular52.
Finalmente, la fentermina es una amina simpaticomimética que incrementa el estímulo de la liberación hipotalámica de noradrenalina sin efectos detectables en la serotonina. Los estudios clínicos en humanos sugieren que los agentes simpaticomiméticos incrementan el gasto de energía. En animales, los simpaticomiméticos incrementan este gasto por medio del incremento de la termogénesis53. El topiramato es un monosacárido sulfamato sustituido derivado de un azúcar natural, la d-fructosa anticonvulsivante por modificación de la excitación de los canales de sodio activados por voltaje y calcio, antagonizando los receptores del ácido alfa-amino-3-hidroxi-5-metil-4-isoxazol (AMPA) y aumentando las corrientes inhibitorias mediadas por el receptor del ácido gamma-aminobutírico. Tiene varios mecanismos potenciales implicados en la pérdida de peso al actuar en el sistema nervioso central, entre ellos, reducir las ansias de comer de forma compulsiva o adictiva, y con activación de los receptores gabaérgicos puede disminuir la alimentación inducida por la noche y privación de alimento53. En el estudio CONQUER, la combinación de fentermina-topiramato a dosis de 7.5/46 mg y 15/92 mg demostró reducciones de hasta 7.8 a 9.2% del peso corporal. Su perfil de efectos adversos (incluyendo boca seca, insomnio, ánimo depresivo, temblor y adormecimiento de extremidades) llevaron a la descontinuación al 12-19% de los pacientes. Es importante destacar además que se ha contraindicado el uso de fentermina topiramato en pacientes con ECV establecida54.
Cirugía metabólica y de control de peso
La cirugía metabólica busca corregir una comorbilidad, como la DT2 o la hipertensión arterial. Ante un IMC ≥ 40 kg/m2, la AHA/American College of Cardiology/The Obesity Society sugieren que los pacientes que están motivados a perder peso y que no han respondido al tratamiento conductual con o sin farmacoterapia, con una pérdida de peso suficiente para lograr los objetivos de resultados de salud específicos a largo plazo, pueden ser candidatos a cirugía metabólica para mejorar la salud55. Los dos procedimientos que se realizan con más frecuencia son la gastroplastia en manga laparoscópica y el bypass gástrico en Y de Roux. Los beneficios clínicos de la cirugía metabólica para lograr la pérdida de peso y aliviar las comorbilidades metabólicas se han atribuido en gran medida a cambios en las respuestas fisiológicas de las hormonas intestinales, el metabolismo de los ácidos biliares, la microbiota y el metabolismo del tejido adiposo55.
La pérdida de peso media a los dos o tres años después de un procedimiento quirúrgico oscila entre el 20 y el 34% del peso corporal inicial. En estudios controlados se ha informado de una mejora significativa en los resultados de ECV, así como el riesgo de padecerlas y la mortalidad56. Un estudio de cohorte retrospectivo que abarcó a 189,770 pacientes diagnosticados con obesidad u obesidad mórbida y sometidos a cirugía metabólica reveló una reducción significativa del 37% en el riesgo de mortalidad por todas las causas (HR: 0.63; IC95%: 0.60-0.66; p < 0.001) en comparación con el grupo de control. Además, se observó un riesgo un 54% menor de hospitalización por insuficiencia cardiaca de nueva aparición (IC95%: 0.44-0.49; p < 0.001), un riesgo un 37% inferior de infarto (IC95%: 0.59-0.68; p < 0.001) y un 29% menos de riesgo de accidente cerebrovascular isquémico (HR: 0.71; IC95%: 0.65-0.79; p < 0.001) en comparación con el grupo de control57.
En relación con la grasa ectópica cardiaca y la obesidad mórbida, la disminución de la masa del ventrículo izquierdo (12 ± 18%) está correlacionada con el porcentaje de pérdida de peso (r: 0.46; p = 0.03), pero no con la reducción de la presión arterial. No se encontró correlación entre el porcentaje de pérdida de grasa ectópica cardiaca y el porcentaje de IMC, ni con la pérdida de grasa subcutánea. Después de la cirugía, el tratamiento antihipertensivo podría interrumpirse para cinco de ocho pacientes con hipertensión. Además, se observó que los pacientes con apnea obstructiva del sueño tuvieron una menor reducción de grasa epicárdica en comparación con la grasa visceral58.
Es importante destacar que la evidencia científica de la cirugía metabólica y el RCV se fundamenta principalmente en extensas series observacionales, las cuales pueden estar sometidas a una amplia gama de confusores. Esto incluye factores específicos de apoyo mental, físico y social del paciente que podrían influir en la decisión de someterse o rechazar la cirugía bariátrica. Antes de proponer una cirugía de control metabólico, es necesario que los pacientes conozcan el cambio radical que implica en su alimentación y la necesidad de suplementación vitamínica, y por lo tanto, en el estilo de vida con esta opción terapéutica. Los cambios en el estilo de vida deben seguir siendo la columna vertebral de la terapia, incluyendo a aquellos pacientes sometidos a farmacoterapia, un dispositivo médico o cirugía metabólica.
Conclusiones
Nuestra revisión propone un marco de abordaje y tratamiento en tres pasos, incluyendo: 1) reconocer la relevancia del RCV en obesidad; 2) estratificar el RCV para identificar los objetivos individuales de tratamiento, y 3) tratar agresivamente la obesidad y las comorbilidades asociadas. Existen opciones terapéuticas que han demostrado reducción de marcadores de RCV (intervenciones dietéticas, fármacos) y reducción de eventos clínicos (fármacos [semaglutida] y cirugía de control metabólico) y que deben ser consideradas en el tratamiento activo del paciente con obesidad.











 nueva página del texto (beta)
nueva página del texto (beta)