Introducción
La población estimada en América Latina y el Caribe (LATAM) es de 667 millones de habitantes, lo que representa el 8% de la población mundial, y está compuesta principalmente por países de medianos ingresos, lo que trae aparejado una serie de limitaciones a nivel de la atención de la salud1.
En términos del manejo de los pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) la realidad es muy diversa, no solo entre países, sino entre distintas regiones de un mismo país. Globalmente y de acuerdo con reportes locales, los resultados son subóptimos, debido a la baja tasa de pacientes que reciben tratamiento de reperfusión, a tiempos a la reperfusión mayores a los recomendados por las guías clínicas, y a una mortalidad intrahospitalaria y a largo plazo elevadas comparadas con regiones de altos ingresos como Norte América y Europa2,3.
Las guías internacionales de práctica clínica contienen recomendaciones avaladas por los resultados de los ensayos clínicos y por la opinión de expertos4. Sin embargo, entendemos que la realidad de nuestra región puede requerir su adaptación local.
Este documento se desarrolló luego de una evaluación exhaustiva de la evidencia disponible y la experiencia clínica. Es un consenso generado por médicos de múltiples países de Latinoamérica avalado por tres entidades de referencia en la región como la Sociedad Interamericana de Cardiología (SIAC), la Iniciativa Stent-Save a Life! y la Sociedad Latinoamericana de Cardiología Intervencionista (SOLACI).
Elementos para la toma de decisiones en reperfusión
La evidencia demuestra que la angioplastia coronaria primaria (ATCp) es el tratamiento de reperfusión de elección, siempre y cuando sea realizada dentro de los tiempos recomendados y por operadores experimentados. En comparación con la fibrinólisis, restablece el flujo coronario de forma más completa y tiene un menor riesgo de sangrado intracraneal. Además permite una evaluación inmediata de la anatomía coronaria y de las variables hemodinámicas y se asocia a una reducción del tiempo de hospitalización5.
El metaanálisis de Keeley mostró beneficio de la ATCp sobre los fibrinolíticos (FBL) cuando la primera es realizada dentro de los 120 minutos del primer contacto médico (PCM). Si este tiempo se prolonga, los beneficios de la ATCp se pierden5.
En el ensayo Strategic Reperfusion Early After Myocardial Infarction (STREAM), los pacientes asignados al grupo de ATCp lograron una mediana de tiempo de PCM al dispositivo de 117 minutos, sin diferencias en los eventos cardiacos adversos mayores (MACE) en comparación con el grupo farmacoinvasivo que incluía la fibrinólisis prehospitalaria6. Estos hallazgos sugieren que la ATCp con un tiempo de PCM a dispositivo dentro de los 120 minutos para pacientes directamente diagnosticados en el campo es tan beneficiosa como la fibrinólisis prehospitalaria o temprana seguida de una estrategia farmacoinvasiva. Es por ello que cuando la ATCp no está disponible dentro los 120 minutos del PCM, la administración de FBL y la derivación sistemática para una angioplastia de rescate en caso de reperfusión negativa o para una cinecoronariografía seguida de eventual ATC en el caso de una reperfusión positiva es la mejor alternativa. Los pacientes deben ser derivados al centro para ATCp inmediatamente luego del inicio de la terapia FBL, sin esperar el resultado. El centro receptor definirá si el paciente requiere la ATC de rescate al arribo. En el caso de los pacientes con tiempo de isquemia prolongados (por ejemplo mayor a 6 h) podría considerarse la ATC de forma precoz teniendo en cuenta la baja tasa de éxito y la dificultad de la evaluación de la reperfusión por el electrocardiograma (ECG).
Una excepción a esta situación la constituyen los pacientes con más de 12 h de dolor, con choque cardiogénico o inestabilidad hemodinámica en donde la terapia con FBL ha visto reducido sus beneficios. En ellos, así como en los pacientes con contraindicación para FBL se sugiere el traslado a centros con ATCp aunque esto implique una demora mayor7.
Es importante reforzar el concepto de que los 120 minutos considerados para determinar el tratamiento de reperfusión son desde el PCM hasta la reperfusión, y no hasta la llegada al centro con ATCp. Es por ello que en el algoritmo propuesto por este grupo de trabajo (Fig. 1) para los pacientes que toman contacto con el sistema de salud por medio del servicio de emergencias médicas (SEM) o que consultan a un centro sin hemodinamia se ha jerarquizado la evaluación del tiempo de traslado en la toma de decisión. De esta forma, si se estima que el tiempo del traslado al centro con ATC es menor a 60 minutos, pudiendo realizarse la ATC dentro de los 120 minutos del PCM, el paciente tendría que ser derivado para ATCp, de lo contrario se debería administrar FBL en el marco de una estrategia farmacoinvasiva.
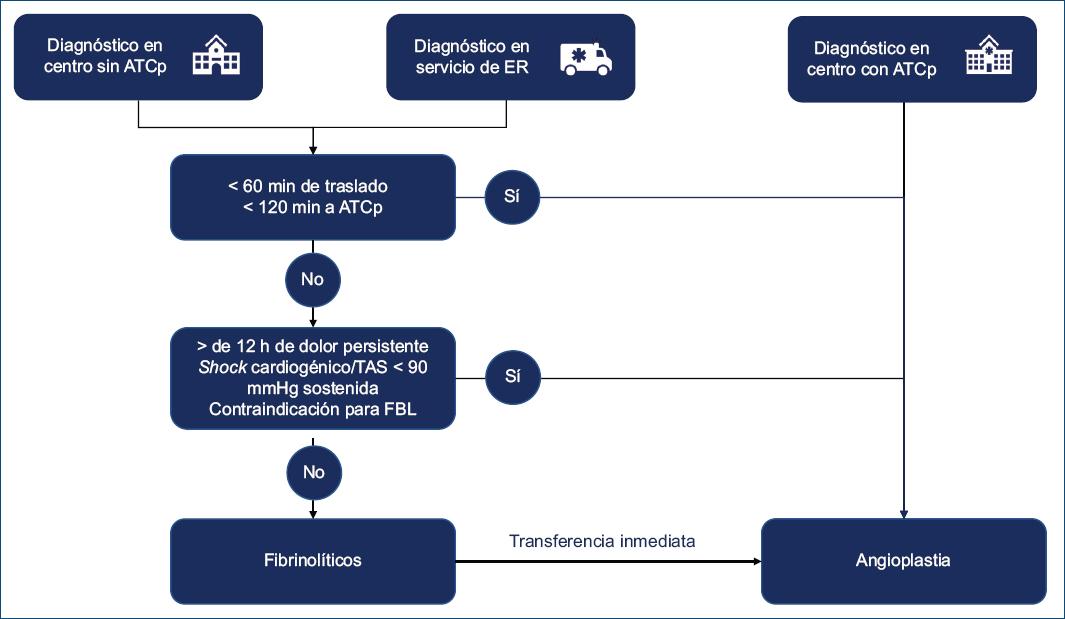
Figura 1 Algoritmo para la decisión de la terapia de reperfusión. ATCp: angioplastia coronaria primaria; ER: emergencias; FL: fibrinolíticos; TAS: tensión arterial sistémica.
La terapia fibrinolítica prehospitalaria, en la que los FBL son administrados en la ambulancia, mientras el paciente es trasladado al centro con ATC, es otra alternativa que ha demostrado reducir los tiempos al tratamiento cuando la ATCp no está disponible dentro de los 120 minutos8. Esta sistemática, que es aplicada en ciertos países de ingresos altos, puede ser implementada en zonas remotas, requiere de un nivel elevado de complejidad del SEM y disponibilidad de FBL fibrinoespecíficos que puedan administrarse en bolo como la tenecteplasa (TNK).
Con base en todo esto hemos desarrollado el algoritmo de la figura 1.
Descripción de los tiempos a la reperfusión
El tratamiento del IAMCEST es dependiente del tiempo, por lo que el mayor desafío que enfrentan los sistemas sanitarios es trabajar para reducir el tiempo total de isquemia (TIT), entendido como el tiempo desde el inicio de los síntomas a la reperfusión, ya sea con angioplastia o con FBL.
Medir los tiempos al tratamiento permite identificar las barreras de cada región y país que impiden una reperfusión dentro de los tiempos recomendados por las guías clínicas, y generar así acciones que permitan reducir al máximo el TIT e impactar positivamente en la sobrevida de los pacientes.
Todos los componentes del retraso del sistema influyen en la calidad de la atención y se recomienda medirlos como indicadores de calidad.
El TIT posee dos componentes principales (Tabla 1):
- Tiempo del paciente: desde el inicio de los síntomas al PCM. El PCM es el punto en el que el paciente toma contacto con el sistema de salud, con capacidad para realizar e interpretar un ECG. El paciente puede contactar con el sistema de salud llamando al SEM o concurrir espontáneamente a un centro de salud, con o sin disponibilidad de ATC. Independientemente de cuál sea el PCM, se deberá realizar un ECG dentro de los 10 minutos.
-
- Tiempo del sistema (TS): es el tiempo comprendido entre el PCM y la reperfusión, ya sea con ATCp o FBL. Sus componentes dependerán del PCM.
Si el PCM es el SEM, el TS comprende un tiempo prehospitalario y un tiempo hospitalario. El primero puede subdividirse en el tiempo en escena, en donde se debe realizar e interpretar el ECG y el tiempo de traslado al centro.
Si el PCM es en un centro con ATC, el TS será igual al tiempo puerta-balón (TPB).
Si el PCM es en un centro sin ATC, el TS estará compuesto por el tiempo en el primer hospital, tiempo de traslado al centro con ATC y el tiempo en el centro con ATC. El tiempo en el centro sin ATC, desde el ingreso del paciente hasta la salida al centro con ATC se denomina door-in-door-out (DIDO) y tiene que ser menor a 30 minutos.
Tabla 1 Tiempos recomendados en el tratamiento de pacientes con IAMCEST
| Tiempo | Objetivo |
|---|---|
| PCM al diagnóstico (ECG) | ≤ 10 min |
| Tiempo desde el llamado al SEM hasta la llegada del SEM | ≤ 15 min |
| Máxima demora prevista entre el diagnostico de IAMCEST y ATCp (paso de la guía) para elegir entre una estrategia de ATCp o fibrinólisis | ≤ 120 min |
| Considerar tiempo de traslado | ≤ 60 min |
| Para pacientes que tienen su PCM en SEM o en centros sin ATC, y van a ser trasladados para una estrategia de ATCp, el tiempo de traslado deberá ser | ≤ 60 min |
| Para pacientes que se presentan espontáneamente a un centro con hemodinamia, el tiempo desde el PCM a la cuerda | ≤ 90 min, ideal ≤ 60 min |
| Tiempo desde el ingreso a centro sin ATC hasta la salida al centro con ATC (DIDO) | ≤ 30 min |
| Tiempo máximo desde el PCM en centro sin ATCp y la administración de FBL | ≤ 10 min |
| Máxima demora desde el inicio de los FBL hasta la angiografía (si la FBL fue exitosa) | 2-24 h |
ATC: angioplastia coronaria; ATCp: angioplastia coronaria primaria; DIDO: door-in-door-out; ECG: electrocardiograma; FBL: fibrinolíticos; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; PCM: primer contacto médico; SEM: servicio de emergencias médicas.
Redes de infarto
Para que esta sistemática de actuación pueda implementarse, es necesaria la creación de redes de tratamiento, en las cuales centros de diversa complejidad son conectados por un SEM eficiente. La evidencia demuestra que el desarrollo de estas redes aumenta el número de pacientes reperfundidos dentro de los tiempos recomendados por la guías clínicas9-11.
En LATAM, si bien existen ejemplos de redes en la mayoría de los países, no es lo más frecuente de observar. México ha demostrado disminuir mortalidad en pacientes tratados dentro de la red10.
La ausencia de organización en redes hace que los centros trabajen de un modo no coordinado, derivando pacientes para ATCp en tiempos muy superiores a los recomendados, reflejado en tiempos de traslado muy prolongados.
Dado los beneficios demostrados con la creación de redes en el manejo de pacientes con IAMCEST, nuestra sugerencia es hacer un llamado a las sociedades científicas de LATAM para que comiencen a trabajar junto a las autoridades sanitarias locales en el desarrollo de redes a nivel regional y/o nacional.
A continuación detallamos los actores que forman parte de las redes de infarto, y las características ideales, funcionen o no dentro de una red.
Así mismo, compartimos una metodología descripta por la Iniciativa Stent-Save a Life! para el armado de redes.
Centros con angioplastia coronaria
Los centros con capacidad para realizar ATC que formen parte de una red tienen que estar activos 24/7 y tener una política de trabajo de «rechazo» cero.
Todos los esfuerzos del centro deberán estar concentrado en lograr un TPB < 90 minutos, con aspiraciones a < 60 minutos12.
Para lograrlo, el centro tiene que estar organizado puertas adentro, mediante un trabajo coordinado de todos los actores que participan de la atención de los pacientes.
Sugerimos tener presente las siguiente estrategias que han demostrado acortar el TPB (Fig. 2):
- Presencia de un cardiólogo en el centro13.
- Triaje de guardia que permita priorizar a los pacientes que ingresan por sus propios medios con dolor torácico para realizarles inmediatamente un ECG.
- Activación del equipo de hemodinamia con una única llamada14.
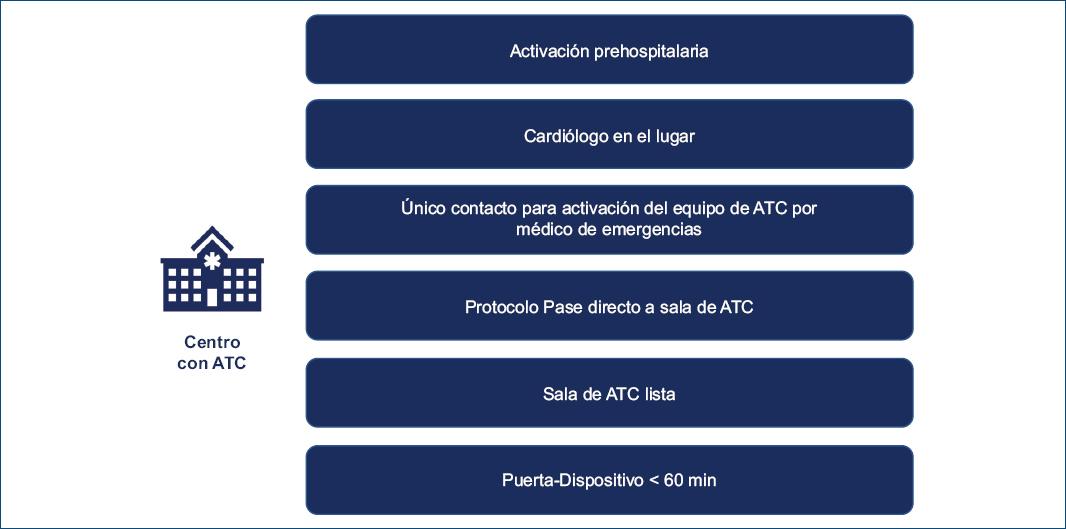
- Para los pacientes que ingresan en ambulancia, ya sea desde la comunidad o derivados de otro centro, es importante considerar tres estrategias. La primera es la preactivación hospitalaria, en la cual luego de realizado el diagnóstico en el momento prehospitalario, el personal del SEM notifica al centro con ATC el traslado del paciente y el tiempo estimado de llegada15. Esto permite preparar el centro para que cuando el paciente llegue esté todo organizado para reperfundirlo con rapidez. La segunda estrategia es el bypass o salteo de guardia, en la cual al llegar el paciente al centro con ATC es trasladado directamente a la sala de cateterismo, sin pasar por la guardia. La tercera es la sala de cateterismo lista, ya que es clave que la sala donde se realiza la ATCp pueda estar lista al momento que llega el paciente. Cuando esto ocurre durante las horas de trabajo habitual es importante tenerla libre cuanto antes para no demorar la angioplastia del paciente con IAMCEST. Cuando esto ocurre fuera del horario laboral habitual es importante que la sala se prepare lo antes posible. En los casos en los que se logra la preactivación esta preparación puede iniciarse apenas se conoce que el paciente está en camino. La preparación de la sala requiere del entrenamiento básico del personal que trabaja fuera de horas hábiles. En algunos centros la elaboración de kits con los elementos básicos para los operadores facilita el trabajo16.
Centros sin angioplastia coronaria
El tratamiento de reperfusión que reciban los pacientes que acudan a centros sin ATC dependerá de los recursos que posea y de la distancia a un centro con ATCp17.
Sugerimos dividirlos en tres tipos:
- Nivel 1: aquí incluimos consultorios médicos, centros de atención primaria y hospitales de baja complejidad que no dispongan de FBL. En este caso el personal a cargo deberá ser entrenado para reconocer los síntomas sugestivos de infarto y realizar un diagnóstico rápido. Dada la imposibilidad de implementar un tratamiento de reperfusión localmente, es imperioso que esté organizado de tal manera que pueda derivar a los pacientes a un centro que pueda implementar una estrategia de reperfusión. Si por alguna razón esto no es posible, las autoridades de los centros deberán realizar la gestión correspondiente para disponer de FBL.
- Nivel 2: son los centros que se encuentren a menos de 60 minutos de traslado de un centro con ATCp y que realizan una estrategia de ATCp. Deben entrenarse para realizar un rápido diagnóstico y estar organizados para trasladar al paciente con rapidez hacia el centro con ATC, con un tiempo DIDO ideal < 30 minutos.
- Nivel 3: son centros disponen de FBL y que se encuentran a más de 60 minutos de un centro con ATC o que no están conectados con estos centros. Deben organizarse para realizar un rápido ECG y administrar FBL lo más rápido posible, y deberán contar con un acuerdo formal con un centro con ATCp para el traslado sistemático del paciente (Fig. 3).
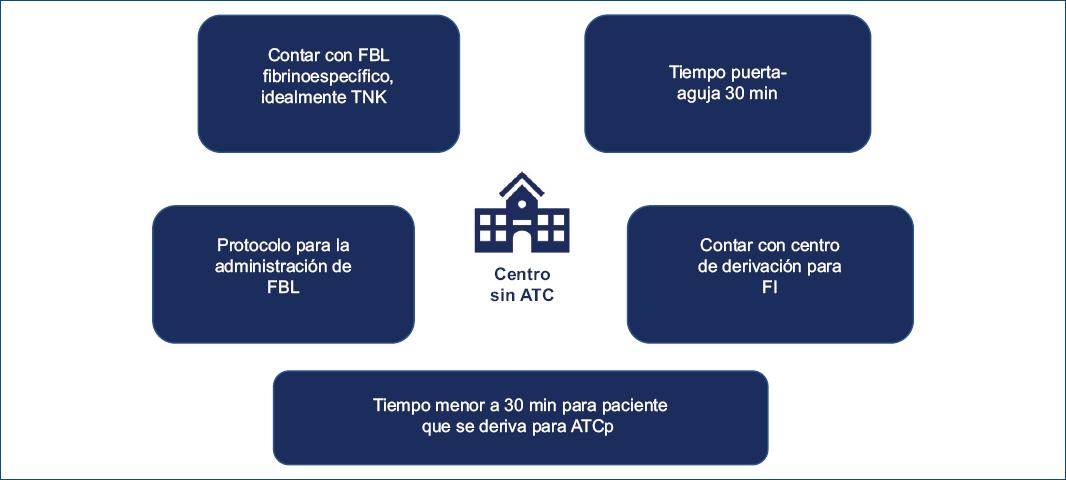
Figura 3 Características de los centros sin disponibilidad de angioplastia coronaria primaria (ATCp). FI: estrategia farmacoinvasiva; FBL: fibrinolíticos; TNK: tenecteplasa.
MANEJO DE LOS PACIENTES POSTADMINISTRACIÓN DE FIBRINOLÍTICOS
La estrategia farmacoinvasiva implica la derivación rápida de rutina a los centros con ATCp después de la administración de trombolíticos, con ATC inmediata para pacientes con reperfusión fallida y angiografía sistemática con o sin ATC dentro de las 24 horas posteriores a la fibrinólisis exitosa.
Los ensayos clínicos han definido la fibrinólisis fallida como la imposibilidad de lograr una resolución > 50% del segmento ST en la derivación del ECG con elevación máxima del ST y/o dolor torácico persistente o inestabilidad hemodinámica o eléctrica 90 minutos después de la finalización de la infusión de FBL. En estos casos se debe proceder con una angioplastia de rescate6,18.
La estrategia farmacoinvasiva se evaluó en 3,195 pacientes incluidos en ocho ensayos clínicos aleatorizados19,20 (ECA). En comparación con la atención habitual, esta estrategia se asoció con reducciones en los puntos finales compuestos de mortalidad por todas las causas a los 30 días, reinfarto o isquemia recurrente en la mayoría de estos ECA, aunque ninguno de estos ensayos tuvo el poder estadístico suficiente para detectar una reducción significativa en mortalidad. En general, la ATC temprana después de la fibrinólisis se asoció con una marcada reducción en el reinfarto a los 30 días (razón de momios [RM]: 0.62; intervalo de confianza del 95% [IC95%]: 0.42-0.90; p = 0.01), sin reducción en la mortalidad (RM: 0.87; IC95%: 0.59-1.30; p = 0.51) y sin aumento de accidentes cerebrovasculares (RM: 0.63; IC95%: 0.31-1.26; p = 0.21) o los sangrado mayores (RM: 0.93; IC95%: 0.67-1.34; p = 0.70). La estrategia farmacoinvasiva se asoció con una reducción significativa de la insuficiencia cardiaca en algunos estudios.
Varios estudios observacionales y un ECA también han sugerido que los resultados clínicos podrían ser similares con una estrategia farmacoinvasiva en comparación con la ATCp. El momento óptimo de la ATC dentro de las primeras 24 horas sigue siendo incierto. En algunos estudios farmacoinvasivos, la ATC se retrasó al menos 6 horas después de la fibrinólisis exitosa, mientras que en otros estudios se realizó sistemáticamente 2-3 horas después de la fibrinólisis19-22.
Es la opinión de este grupo que una estrategia farmacoinvasiva es la vía más factible y, por lo tanto, deseable para las redes IAMCEST en Latinoamérica.
El beneficio de la terapia fibrinolítica se ha observado en pacientes tratados hasta las 12 horas del inicio de los síntomas isquémicos, pero los efectos más beneficiosos se observan en aquellos que reciben el fármaco dentro de las 3 horas posteriores al inicio de los síntomas.
Se debe recordar que después de las 6 h desde el inicio del dolor, el éxito de la reperfusión con la terapia FBL tiene una disminución sustancial, así como la capacidad para estimar su éxito mediante criterios electrocardiográficos y clínicos.
La estreptoquinasa es aún el agente más utilizado debido al costo en los países de bajos y moderados ingresos. Sin embargo, es significativamente menos efectiva que los agentes más nuevos, fibrinoespecíficos como la alteplasa o la TNK. La mejora en los resultados y la facilidad de administración (inyección en bolo único en comparación con infusión prolongada) de los agentes más modernos puede ser razón suficiente para que los gobiernos consideren seriamente realizar los esfuerzos necesarios para contar con TNK17 (Fig. 4).
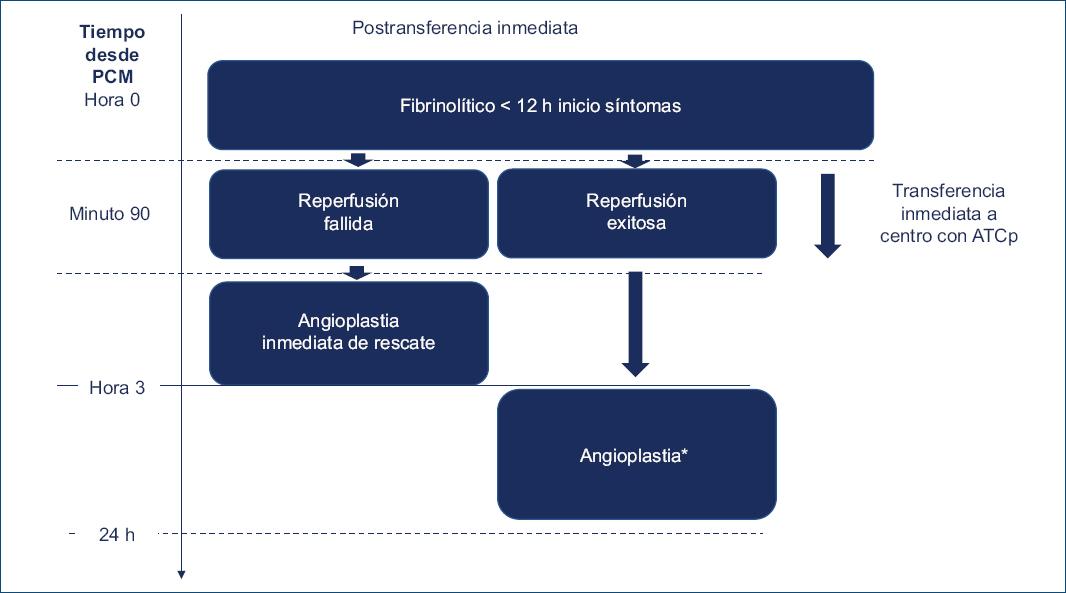
Figura 4 Tratamiento postransferencia inmediata con trombólisis realizada antes de las 12 horas de inicio de los síntomas. *Considerar ATC precoz en pacientes con administración de trombolíticos luego de 6 h de inicio de los síntomas. ATCp: angioplastia coronaria primaria; PCM: primer contacto médico.
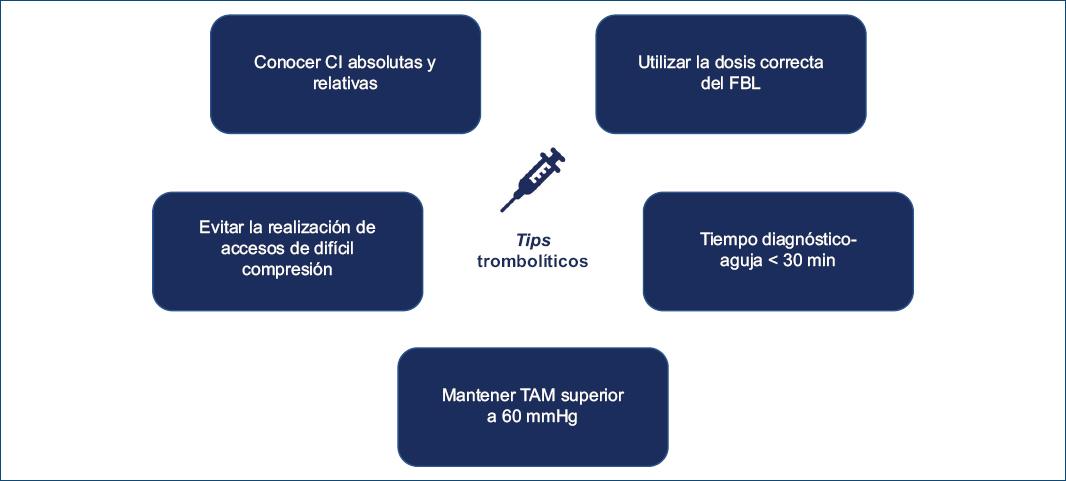
En la tabla 2 se detallan las herramientas para la adecuada administración de FBL (Fig. 5).
Tabla 2 Consideraciones al momento de administrar FBL
| − Antes de iniciar el tratamiento con FBL es importante verificar la presencia de contraindicaciones absolutas y relativas |
| − Evitar cualquier tipo de punción en sitios de difícil compresión |
| − Conocer el protocolo para la administración de FBL, ajustando la dosis en casos en que sea necesario |
| − Perseguir un tiempo puerta-aguja < 30 minutos |
| − Mantener una TAM superior a 60 mmHg |
| − Tener una organización tal que permita la derivación sistemática de todos los pacientes luego del inicio de los FBL |
FBL: fibrinolíticos; TAM: tensión arterial media.
Servicios de emergencias médicas
La mayoría de los países de nuestra región tienen servicios de ambulancias múltiples y fragmentados con un número limitado y a menudo inadecuado para cubrir la población en riesgo. Integrarlos es importante para optimizar los recursos y el acceso17.
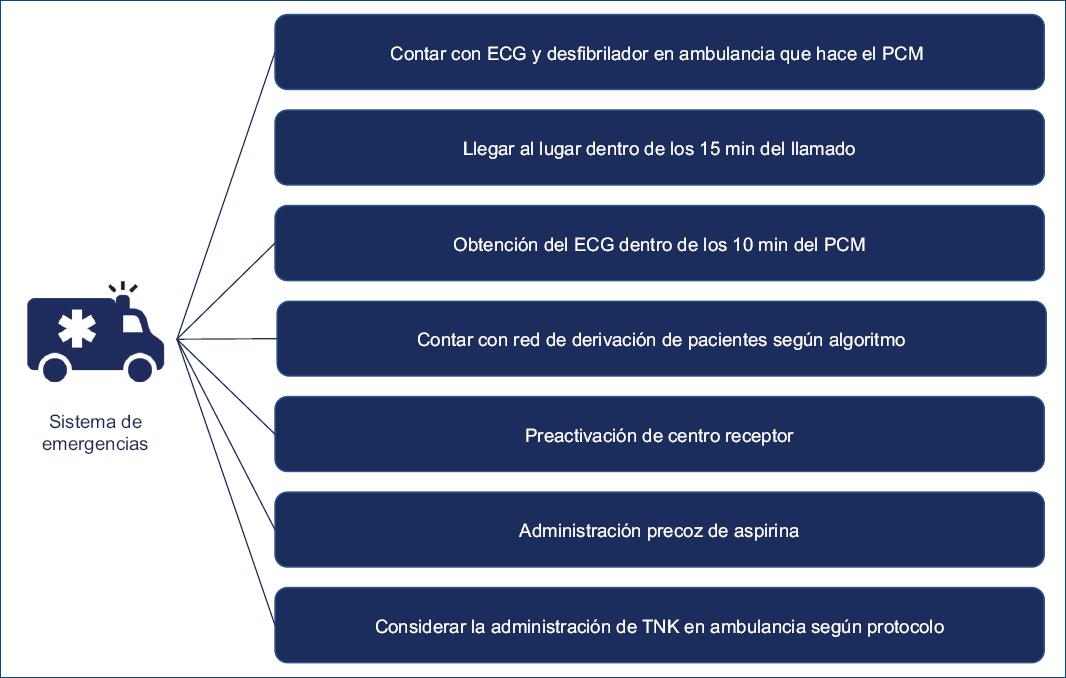
Los requisitos mínimos para el sistema de ambulancia incluirían lo siguiente (Fig. 6):
- Paramédicos capacitados en hacer un ECG y con una capacidad básica para leer el ECG.
- Familiaridad con el protocolo de emergencia para el manejo del IAMCEST.
- Llegar al lugar dentro de los 15 min del llamado.
- Obtención de un ECG dentro de los 10 minutos del primer contacto.
- Medicamentos de emergencia para administración precoz.
- Capacidad de transmisión del ECG al centro receptor según la red con el fin de preactivar al centro receptor.
- Dispositivo de monitorización multifuncional: para monitorizar la saturación de oxígeno, medición ambulatoria de la presión arterial y monitorización del ritmo.
- Equipo de desfibrilador.
- Considerar la administración de terapia FBL en bolo (TNK) cuando sea pertinente según red.
Herramientas para el armado de redes
Al momento de organizar una red para el tratamiento de pacientes con IAMCEST deben considerarse los recursos existentes.
La mejor estrategia será la que puede implementarse en el tiempo más corto posible y para la mayor parte de la población11.
Existen dos modelos básicos de atención que no son excluyentes:
- Modelo preactivación. Son redes que basan la reperfusión en la realización de ATCp. En este modelo se prioriza el PCM en los SEM, quienes trabajan de un modo coordinado con los centros con ATCp. El diagnóstico de IAMCEST se realiza en el momento prehospitalario, luego de lo cual los pacientes son trasladados a los centros con ATPp, evitando a los centros sin capacidad para realizar ATCp.
- Modelo hub and spoke o en rueda de carro. Estos modelos se organizan alrededor de los centros con ATCp (hub), los cuales reciben pacientes desde centros derivadores (spoke) según el tiempo de traslado al centro con ATCp. Si están a menos de 60 minutos de traslado y la ATCp se puede realizar dentro de los 120 min del PCM, se trasladará para una estrategia de ATCp, y si estos tiempos no son posibles, se realizará una estrategia farmacoinvasiva. La extensión de este tipo de red es variable y puede incluir una gran área de cobertura.
Como se ha mencionado previamente, para las áreas remotas se puede utilizar la fibrinólisis prehospitalaria (Fig. 7).
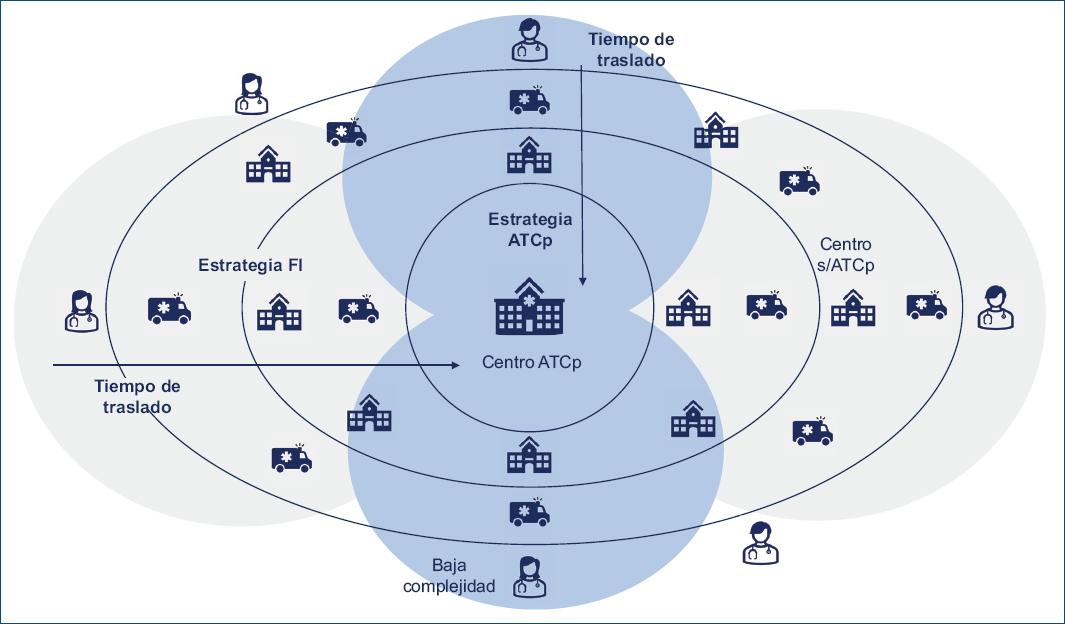
Figura 7 Red integral para la atención del infarto de miocardio. ATCp: angioplastia coronaria primaria; FI: farmacointensiva.
La iniciativa Stent-Save a Life! ha desarrollado una metodología para la creación de redes que sugerimos seguir al momento de organizar una red a nivel regional o nacional. Se basa en cuatro etapas:
- Etapa 1: fase de preparación. El primer paso es establecer un grupo de trabajo local y un plan de acción para desarrollar la red. Este grupo de trabajo también es responsable de asignar roles, desarrollar protocolos estándar para diagnóstico y tratamiento en cooperación con los actores regionales y, posteriormente, coordinar la red.
- Etapa 2: fase de mapeo. En esta fase el grupo de trabajo identifica todos los centros ATCp y no ATCp potenciales, estima las distancias y el tiempo necesario para el transporte, verifica la disponibilidad de SEM y se comunica con los centros y el SEM para confirmar su disposición a participar y su capacidad para hacer frente a la demandas. Todos estos recursos deben mapearse para comprender la situación regional y determinar el mejor diseño posible de la(s) red(es) regional(es).
- Etapa 3: fase de construcción. En el supuesto de que el papel de cada jugador en cualquier red siempre está definido por la presencia o ausencia de otros jugadores. El grupo de trabajo asigna los roles individuales a cada jugador y nombra a los coordinadores de los centros, el SEM y los grupos médicos.
- Etapa 4: evaluación de la calidad y educación. Evaluación de la calidad, con parámetros de rendimiento de todos los componentes de la red que incluye, por ejemplo, el tiempo de presentación, la tasa de pacientes tratados, el éxito del procedimiento y la mortalidad hospitalaria. El grupo de trabajo debe reunirse periódicamente para analizar el desempeño y discutir las adaptaciones necesarias.
No todos los profesionales implicados tienen una formación básica en cardiología. Puede ser importante ofrecer programas educativos y de formación específicos para paramédicos, enfermeras, técnicos y médicos no cardiólogos de forma recurrente debido a la rotación del personal.
La conciencia del paciente sobre los síntomas indicativos y el conocimiento de cómo buscar atención médica de manera efectiva es clave para el éxito de un programa de red IAMCEST, ya que los pacientes suelen causar las demoras más largas. Los programas de concientización que involucran las redes sociales, la industria del entretenimiento, las organizaciones comunitarias y las asociaciones científicas pueden ser útiles; sin embargo sus efectos se desvanecen con rapidez una vez que se suspenden.
Estrategias de mejora continua
Los programas nacionales de control de infarto deben centrarse principalmente en mejorar los resultados de los pacientes. El éxito a largo plazo depende de trabajar hacia un listado definido de objetivos y de la capacidad de obtener métricas de rendimiento; por lo tanto, los programas también deben desarrollar capacidad para medir indicadores de desempeño. Estos deben ser individualizados en el contexto de cada país y jurisdicción9,23.
Este documento enfatiza que la excelencia en la atención del IAMCEST es un proceso continuo en lugar de una inversión única, y el éxito o el fracaso dependen de manera crucial de inversiones adecuadas en pensamiento, ideas, tiempo, esfuerzo y recursos. Esto solo puede lograrse mediante una amplia participación de la maquinaria gubernamental y legislativa, junto con los aportes de los expertos médicos y las organizaciones no gubernamentales en la primera línea de la atención del infarto.
Por lo tanto, es importante la actualización constante de los programas de IAMCEST sobre la base de la evidencia emergente y las lecciones aprendidas de los esfuerzos de implementación actuales.
Resumen de las recomendaciones
- Debemos utilizar todos los medios disponibles para garantizar la reperfusión en tiempos adecuados a la mayor población posible.
- La generación de redes es un proceso clave para sistematizar el traslado de pacientes a centros para reperfusión.
- La angioplastia primaria es la mejor forma de reperfusión cuando es realizada en tiempos adecuados y en centros con experiencia.
- La estrategia farmacoinvasiva es la mejor estrategia cuando la angioplastia primaria en tiempos adecuados y en centros adecuados no está disponible.
- La disponibilidad de trombolíticos fibrinoespecíficos con aplicación única en bolo favorece su administración incluso en el servicio de emergencias médicas.











 nueva página del texto (beta)
nueva página del texto (beta)