Introducción
En general, la fibrilación auricular (FA) complica aproximadamente el 10% de los infartos agudos de miocardio (IAM) y su incidencia es comparable entre la era trombolítica y la era de la intervención coronaria percutánea (ICP)1. Su presencia implica un peor pronóstico hospitalario, a corto y largo plazo. La relevancia de este problema es que pasar su diagnóstico por alto origina alta morbimortalidad en una población vulnerable en donde implementar el tratamiento oportuno será de suma importancia.
Epidemiología
De acuerdo con el documento de consenso en arritmias cardiacas, en contexto de síndrome coronario agudo (SICA) y revascularización coronaria EHRA/EAPCI/ACCA 2019 (European Heart Rhythm Association/European Association of Percutaneous Cardiovascular Interventions/European Acute Cardiovascular Care Association), en pacientes con IAM que presentan elevación del segmento ST (IAMCEST), el 9-10% desarrollan FA durante o inmediatamente después de la ICP2. Otros reportes mostraron la prevalencia en general de FA de primer diagnóstico en el 12.44% de los casos3. Además, durante un evento de SICA aumenta el riesgo de FA en el 77% (hazard ratio [HR]: 1.77; intervalo de confianza del 95% [IC95%]: 1.44-2.19), estimando una incidencia del 21% en el IAMCEST4. La FA complica con mayor frecuencia el IAM en adultos mayores de 70 años de edad, los cuales tienen un riesgo del 16% para desarrollarla en comparación con el 4.2% para aquellos ≤ 59 años de edad5. Un estudio mostró un incremento en la incidencia de FA de novo post-IAM basada en grupos de edad en el área de Worcester (EE.UU.), donde aquellos menores de 65 años tuvieron una incidencia del 7.5%, mientras que en aquellos mayores de 75 años, la incidencia fue del 23.8%6. En otro estudio de comunidad con 3,220 pacientes con IAM incidente, el 7% desarrollaron FA dentro de los primeros dos días del evento y otro 4% dentro de los primeros 30 días7. La FA de nuevo inicio es a menudo una manifestación reversible en estos enfermos críticos, ya que generalmente más del 50% retornaran a ritmo sinusal espontáneamente dentro de las primeras 72 h del inicio del SICA8,9.
Factores de riesgo
Entre las características que han sido más destacadas en aquellos que desarrollaron FA de novo en el evento de SICA se incluyen el sexo femenino, baja fracción de expulsión del ventrículo izquierdo (FEVI)10, diabetes mellitus (DM)11, hipertensión arterial sistémica (HAS)12 y baja función renal13. Esto se explica debido a que el sexo femenino manifiesta con mayor frecuencia SICA a una edad más avanzada en relación con los varones; la FEVI reducida se asocia con mayor frecuencia a enfermedad coronaria de múltiples vasos y a presiones intracavitarias más elevadas que impactan en la mecánica y en el remodelado auricular. Por su parte, la sobrecarga de volumen secundaria a la coexistencia de lesión renal aguda (LRA) o de enfermedad renal crónica (ERC) contribuye a los cambios eléctricos heterogéneos en el tejido atrial. Tanto la DM como la HAS son condiciones inflamatorias crónicas que originan remodelado eléctrico en el tejido auricular, haciéndolo más susceptible a arritmias tanto bajo eventos de estrés agudo como durante el IAM.
La terapia de reemplazo hormonal ha sido estudiada por sus efectos en la FA de novo en contexto de IAM. Un registro retrospectivo de 32,925 mujeres danesas mayores de 40 años de edad mostró una disminución en su frecuencia entre aquellas que tuvieron terapia de reemplazo (HR: 0.63; IC95%: 0.42-0.94)14. Esto se debe al papel que tiene los estrógenos en el sistema cardiovascular por medio de la unión a sus receptores nucleares α y β, activando elementos de respuesta directa dentro de las hebras de ADN o por medio de los factores de transcripción AP1 y Sp115 y coactivadores dependiente de factores de crecimiento16; además, su unión a receptores de membrana plasmática que inician la señalización por la vía fostatidilinositol 3 cinasa disminuyen la lesión por isquemia-reperfusión17. Por otra parte, mejoran la función endotelial por medio de la activación de la enzima óxido nítrico sintasa endotelial18. El Reα, propio del sexo femenino, incrementado en número por la terapia hormonal, regula canales iónicos, ya que los niveles de ARNm de los canales de potasio Kv4.3 y Kv1.5, junto con los canales de Ca tipo L, disminuyen ante su actividad19, junto con incremento en el intercambiador Na/Ca20. También contribuyen a una menor generación de radicales de oxígeno por medio del incremento en la fosforilación del α-cetoglutarato y del dinucleótido de nicotinamida adenina21. Finalmente, el rol del Reβ consiste en disminuir la hipertrofia, promueve la sobrevida de células madre vasculares, incrementa la actividad antiapoptósica vía Akt, disminuye las citocinas inflamatorias y mejora la función contráctil, disminuyendo así el tamaño del IAM22.
En un estudio de cohorte observacional retrospectivo, la FA de nuevo inicio fue más frecuente en aquellos con edad avanzada (p < 0.001), valvulopatía previa (p < 0.001) y cirugía de revascularización miocárdica (CRM) previa (p = 0.049)23. Los resultados coinciden con el conocimiento general de la asociación de la edad avanzada con la senescencia, un estado de paro irreversible de la fase mitótica G1, con una actividad metabólica constante pero inflexible24, precipitado por la acumulación de estrés oxidativo y disfunción mitocondrial, que interviene en el proceso de remodelado cardiaco y aterosclerosis25, siendo su principal generador el acortamiento de los telómeros cromosómicos24,26,27. Así, se ha observado un aumento de cardiomiocitos senescentes en el miocardio posterior a un IAM28.
Por otra parte, referente a las valvulopatías, haciendo énfasis en las del hemicardio izquierdo, estas originan una sobrecarga de presión o volumen desencadenando una respuesta hipertrófica, inicialmente adaptativa29, pero con el tiempo el miocardio afectado supera su propio aporte sanguíneo, lo que conduce a necrosis celular, fibrosis y transición a insuficiencia cardiaca (IC)30. En este contexto, existe proliferación de miofibroblastos31, los cuales regulan al alza una serie de mediadores proinflamatorios y profibróticos32. El depósito de colágeno causa expansión de la matriz extracelular, aumentando la rigidez del tejido y conduce a disfunción global29, junto con el aumento del número de mastocitos, que contribuyen a su degradación y remodelado33. Existen dos categorías de fibrosis: fibrosis intersticial y fibrosis de reemplazo34-36, y ambas manifiestan síntesis de colágeno tipo I y III34. En la fibrosis causada por IAM, la regulación al alza del colágeno tipo I, rígido e inflexible, supera la del tipo III37. No solo hay una superposición de ambos tipos de fibrosis, sino que también suelen coexistir37. La suma de todos estos fenómenos origina un impacto hemodinámico en las aurículas y la creación de un sustrato arrítmico de actividad heterogénea, generando rotores, los cuales tienen un movimiento espiral, formados por un frente de onda y una porción terminal, y entre ambos, cardiomiocitos en periodo refractario absoluto38, los cuales se caracterizan por un acortamiento en el potencial de acción (PA) y una velocidad de conducción lenta, perpetuando los impulsos originados en las mangas de las venas pulmonares, con una susceptibilidad incrementada durante el evento de SICA.
En cuanto a la CRM previa, junto con cualquier otro tipo de cirugía, estas generan sustratos para la FA como los relacionados con las cicatrices debido a la atriotomía, bypass cardiopulmonar o procedimientos de Maze39.
Mientras tanto, otro estudio desarrolló un modelo predictivo de riesgo a cinco años para la aparición de FA con 11 variables, el puntaje CHARGE AF (Cohorts for Heart and Aging Research in Genomic Epidemiology-Atrial Fibrillation), el cual mostró que el IAM incrementó el riesgo de FA cerca del 60% (HR: 1.60; IC 95%: 1.34-1.91)40; basado en varios estudios de cohorte americanos con diversidad racial, su aplicación en la práctica clínica habitual es fácil, permitiendo así un monitoreo más estricto en aquellos de alto riesgo y para seleccionar a individuos para futuros estudios de prevención primaria.
También el hallazgo ecocardiográfico de un patrón de llenado transmitral restrictivo aumenta el riesgo de FA de novo (HR: 2.72; IC95%: 1.83-4.05; p < 0.0001)41. Este hallazgo es el reflejo del incremento de las presiones intracavitarias y su impacto en la distensibilidad atrial.
Características adicionales que incrementan la probabilidad de FA de novo son: IAM previo, taquicardia sinusal al momento de la presentación (aumento del tono simpático y cambios en los periodos refractarios), un alto grado de Killip Kimball (incremento de presión intraauricular izquierda), así como el IAMCEST en la región anatómica inferior (ramas coronarias atriales involucradas)42. Mas aún, es más probable que pacientes con FA de nuevo inicio tengan enfermedad de tronco coronario izquierdo (TCI) que aquellos con historia previa de FA (al involucrar una mayor región miocárdica en riesgo isquémico)43.
Aspectos clínicos
La alta incidencia de FA post-IAM es secundaria a factores neurohormonales que acompañan al evento agudo y a cambios del sustrato atrial secundarios a isquemia44. En un estudio retrospectivo, fue más probable que pacientes con FA preexistente y FA de novo se presentasen con manifestaciones de IC (16 vs. 19 vs. 8%; p = 0.001), FEVI < 40% (22 vs. 28 vs. 13%; p < 0.001) y escala de GRACE (Global Registry of Acute Coronary Events) con riesgo ≥ 3% (secundario a la edad avanzada, al incremento de la frecuencia cardiaca [FC] debido a la arritmia, a la coexistencia de LRA, a la hipoperfusión coronaria asociada y a un mayor grado de congestión sistémica) (54 vs. 64 vs. 31%; p < 0.001) respecto a la población control45. La FA de nuevo inicio se asocia frecuentemente a paro cardiaco extrahospitalario46 debido a la mayor carga de enfermedad coronaria aterosclerosa (incluyendo TCI) junto con una conducción eléctrica heterogénea ventricular en este grupo de pacientes. En el contexto hospitalario, los pacientes con FA de novo exhiben síntomas y signos como palpitaciones, mareos, disnea, debilidad y malestar general. También podrían presentarse con dolor torácico, el cual requeriría diagnóstico diferencial con reinfarto o isquemia en curso. Generalmente la mayoría son episodios transitorios47. Pacientes con FA presentan características de alto riesgo durante la hospitalización como LRA, infecciones respiratorias, bajo nivel de hemoglobina, disfunción biventricular, significativa insuficiencia mitral (IMi) y menor oportunidad de revascularización coronaria48. Para el diagnóstico, hay que documentar el ritmo cardiaco, ya sea con un episodio de duración ≥ 30 segundos en el trazado de una derivación o con un electrocardiograma (ECG) de 12 derivaciones49. En el ECG, la presencia de depresión del segmento ST ocurre a menudo durante frecuencias cardiacas rápidas, enmascarando cambios propios de isquemia, haciendo este valor menos específico ante depresiones < 2 mm50,51. En un estudio de cohorte multicéntrico retrospectivo, pacientes que desarrollaron FA tuvieron más tiempo desde el inicio de síntomas hasta el inicio de la reperfusión (media 243 [166-400] minutos vs. 267 [185-398] minutos; p = 0.033)52, atribuido a los síntomas atípicos asociados a la edad avanzada de los pacientes, que retrasa su atención oportuna en los servicios de urgencias. Además, pacientes con FA tienen mayor probabilidad de tener enfermedad de ramas coronarias atriales53. Por su parte, Luo et al. examinaron el flujo sanguíneo coronario al momento de realizar la ICP en pacientes con FA y en ritmo sinusal. Ellos encontraron que la FA fue independientemente asociada con un alto TFC (TIMI, Thrombolysis in myocardial infarction Frame Count), indicando pobre flujo incluso cuando la FC fue controlada54. Dicho flujo escaso es ocasionado por la disminución de la reserva de flujo coronario y resistencias vasculares coronarias incrementadas preexistentes.
Impacto clínico hospitalario a corto plazo
Durante la hospitalización, aquellos con FA de nuevo inicio durante un SICA a menudo tienen infecciones respiratorias (p = 0.002) (secundario a antecedente de neumopatía crónica asociada a tabaquismo), IC (p < 0.001), altos valores de la porción N-terminal del pro-péptido natriurético tipo B (p = 0.007) y mayores picos de creatinina (p = 0.001). En un estudio de cohorte retrospectivo, los pacientes tuvieron aurícula izquierda (AI) de mayor tamaño (p < 0.001), importante IMi (secundaria a la dilatación del ventrículo izquierdo [VI] y de la AI) (p < 0.001) y FEVI ≤ 40% (p < 0.001), así como menor oportunidad de revascularización (debido a la presentación clínica atípica y comorbilidades) (p < 0.001); dentro de su análisis multivariante, la edad (odds ratio [OR]: 1.06; p = 0.021), FEVI ≤ 40% (OR: 4.91; p = 0.002) y el diámetro de AI (OR: 1.14; p = 0.008) permanecieron como predictores independientes de FA de nuevo inicio de manera significativa23. Otro estudio observacional encontró que la FA es un factor independiente de mortalidad en asociación con DM (mayor frecuencia de enfermedad de múltiples vasos) (p = 0.001), FEVI < 30% (p = 0.000), y clase Killip Kimball III-IV (p = 0.035)44. Cuando se comparó con la FA previa, Almendro-Delia et al. encontraron que la FA de novo casi dobló el riesgo de muerte (HR: 1.70; IC95%: 1.12-3.40)55. Jabre et al. encontraron incrementos significativos en la mortalidad por FA de novo dentro de 30 días posteriores al SICA, y además un riesgo elevado de muerte después de 30 días dentro del análisis de subgrupos7. El más grande estudio en cuanto a FA post-IAM fue hecho por Bang et al., quienes examinaron los registros de 89,793 pacientes daneses, donde la FA de novo se asoció a un incremento de riesgo en todas las causas de mortalidad (HR: 1.89; IC95%: 1.84-1.95) y reinfarto fatal (HR: 1.67; IC95%: 1.55-1.80)56 debido a morbilidad de esta población y a las consecuencias hemodinámicas y trombóticas de esta arritmia. En una revisión del ensayo CARISMA (Cardiac Arrhythmias and Risk Stratification after Acute Myocardial Infarction), una cohorte de pacientes post-IAM con FEVI ≤ 40% que tenían monitores implantables cardiacos, Ruwald et al. encontraron que la FA de novo se asoció a un riesgo incrementado de taquicardia ventricular sostenida (HR: 6.71; IC 95%: 1.83-24.62), implicando que la FA fue un marcador de isquemia más severa y un predictor independiente para fibrilación ventricular hospitalaria debido a una despolarización ventricular errática y a la isquemia de las células de Purkinje57. En un estudio contemporáneo, la mortalidad intrahospitalaria fue más alta en la cohorte de SICA- FA que en aquellos con SICA en ritmo sinusal (7.5 vs. 4.1%; OR: 1.89; IC95%: 1.06-3.38; p = 0.039)58 debido una vez más a las comorbilidades preexistentes. Por su parte, McManus reveló una discrepancia con estudios previos, ya que en su estudio la FA de nuevo inicio fue asociado con incremento del riesgo de muerte hospitalaria (OR: 2.0; IC95%: 1.8-2.3), pero no a 30 días posterior al alta59. Adicionalmente, comorbilidades como la ERC en el contexto de FA después de ICP, tiene un incremento de mortalidad debido principalmente a lesiones ateromatosas coronarias complejas relacionadas10. La FA de nuevo inicio posterior a un IAMCEST se asocia a aumento de la mortalidad y EVC hospitalario, sobre todo en aquellos que ocurrieron en la región miocárdica anterior60.
Impacto pronóstico a largo plazo
En un periodo de 20 años, el riesgo relativo de mortalidad para pacientes con FA post-IAM permanece alrededor de 2.5 veces mayor que en aquellos que no la desarrollaron42. La FA incrementa la probabilidad de IC en un 62-70%, así como la incidencia de taquiarritmias ventriculares postinfarto61, además es un predictor independiente de mortalidad a un año (HR: 1.64; IC 95%: 1.05-2.55)62. A su vez, la presencia de FA se asocia con una mayor tasa de reinfarto y EVC en años posteriores63,64. Reciente evidencia sugiere que pacientes con un primer episodio de FA durante un IAM tienen un riesgo del 13 al 24% de desarrollar FA después de un seguimiento a 1,037 días comparado con un 6% de aquellos que permanecieron en ritmo sinusal65. Pacientes con factores precipitantes de FA tienen aumento del riesgo de recurrencias arrítmicas a largo plazo, incluso si los factores precipitantes transitorios se resolvieron66,67. En caso de que se realizara CRM, en un estudio se mostró un incremento en la mortalidad a seis años cuando la FA de nuevo inicio se desarrolló, debido a los antecedentes de FEVI disminuida y a los factores de riesgo basales del paciente (HR: 1.21; IC 95%: 1.21-1.32; p < 0.0001)68. Otro punto importante en el seguimiento a largo plazo es el posible empleo de forma sistemática de la resonancia magnética cardiaca, la cual es capaz de determinar la gravedad de la fibrosis miocárdica de acuerdo con la clasificación de Utah y predecir el riesgo de recurrencia tras ablación en sus diferentes modalidades69.
Tratamiento
El tratamiento de esta condición es todo un arte, ya que los mecanismos subyacentes a la patología imponen limitaciones al uso de ciertos fármacos. A continuación se muestra el tipo de atención integral al paciente que tener en cuenta con el esquema ABC (Anticoagulation, Better symptom control, Comorbidities/cardiovascular risk factor management), que se asocia a un menor riesgo de mortalidad por cualquier causa, ictus, muerte cardiovascular y primera hospitalización70.
Manejo farmacológico: frecuencia
Para el manejo de la FC contamos con algunas opciones. Está indicada la administración intravenosa (IV) de bloqueadores beta (BB) para el control de la FC si fuera necesario ante la ausencia de signos clínicos de insuficiencia cardiaca aguda (ICA) o hipotensión71,72. La digoxina puede ser agregada para un efecto sinérgico con BB, si se requiere adicional control de la FC, en especial si la FEVI es < 40%73 o ante la presencia de hipotensión74. Sin embargo, la digoxina es ineficaz para convertir la FA de nuevo inicio a ritmo sinusal75. Se puede usar también amiodarona en este contexto, en especial en pacientes con IC, FEVI disminuida y ausencia de hipotensión76. También se podría considerar bloqueador de los canales de calcio si no existe insuficiencia cardiaca o inestabilidad hemodinámica77.
Manejo farmacológico: ritmo
En cuanto al control del ritmo, una vez más mencionamos a la amiodarona, la cual, en contexto de choque cardiogénico, su uso IV podría cardiovertir la FA de forma tardía78. No se usarán antiarrítmicos de clase IC como moricizina, encainidina o flecainidina de forma profiláctica o terapéutica porque ha demostrado incrementar la mortalidad sobre placebo en este escenario79,80, muy probablemente debido a su acción en el canal de potasio IKr en la fase 3 del PA cardiaco, prolongándolo y haciéndolo susceptible a eventos de posdespolarización. En la guía ESC 2020 sobre el diagnóstico y tratamiento de la FA, así como en la actualización AHA/ACC/HFSA 2019 (American College of Cardiology/American Heart Association/Heart Failure Society of America) para el manejo del paciente con FA, indican que la cardioversión eléctrica (CVE) de corriente directa se realizará en caso de inestabilidad hemodinámica, isquemia intratable o cuando un adecuado control de la FC no puede ser obtenido con indicación clase IB y IC, respectivamente. También deberá considerarse el pretratamiento con amiodarona, para facilitar el éxito de la CVE81. El magnesio IV podría incrementar el éxito de la cardioversión en quienes la amiodarona fue ineficaz82. La cardioversión precoz se puede realizar sin ecocardiograma transesofágico en pacientes con una duración de la FA < 48 h83 y se debe iniciar la anticoagulación efectiva tan pronto como sea posible antes de cada cardioversión.
Manejo anticoagulante
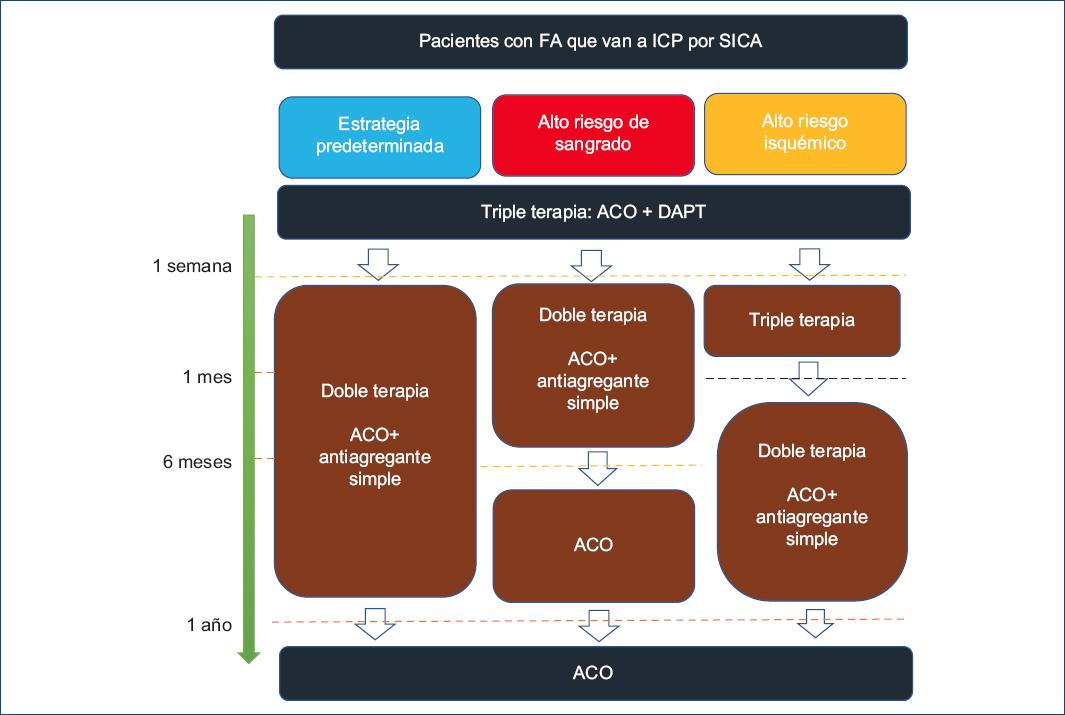
Independiente de la estrategia seleccionada para el tratamiento de la FA (frecuencia o ritmo), cada paciente debe ser evaluado para anticoagulación a largo plazo en aras de prevenir un EVC usando calculadoras de riesgo incluyendo la escala CHA2DS2-VASc con indicación clase IA84,85, además del uso de sistemas para evaluar el riesgo de sangrado como la escala HAS-BLED86,87. Se debe considerar la administración de anticoagulantes orales (ACO) para la prevención del ictus en pacientes con FA y CHA2DS2-VASc de 1 punto para varones o 2 puntos para las mujeres73. El tratamiento debe ser individualizado teniendo en cuenta el beneficio clínico neto y la terapia antitrombótica concomitante88,89. Cuando se realice ICP y se utilice la terapia triple con uso de un antagonista de la vitamina K (AVK) por alguna indicación en particular (válvula mecánica o trombo ventricular izquierdo post-IAM) deberá utilizarse de ser posible una meta de índice internacional normalizado (INR) de 2-2.5 y un tiempo en rango terapéutico > 70%90,91. En una fase posterior al evento índice, doble terapia con un inhibidor P2Y12 (clopidogrel o ticagrelor) y dosis ajustada de AVK es razonable para disminuir el riesgo de sangrado92. Por otra parte, varios metaanálisis han coincidido en demostrar una reducción significativamente mayor de las tasas de hemorragia con el tratamiento doble frente al triple y con nuevos anticoagulantes orales (NACO) frente a AVK93-97(Tabla 1). En el estudio AUGUSTUS, tanto el placebo (frente al AAS) como el apixabán (frente a los AVK) se asociaron con una reducción significativa de las hemorragias y con tasas significativamente más bajas de ictus, muerte u hospitalización98. Los eventos de sangrado han sido más bajos con apixabán que con AVK independientemente del riesgo basal99. Por tanto, los NACO se consideran clase IA en actuales guías si no hay contraindicaciones. Para pacientes con riesgo hemorrágico alto (HAS-BLED ≥ 3) se debe considerar dosis de rivaroxabán de 15 mg/24 h o dabigatrán 110 mg/12 h, mientras dure el tratamiento antiagregante plaquetario100-102. En caso de realización de ICP, se utilizarán abordajes vasculares que minimicen el riesgo de sangrado como el abordaje radial103. En vista de la eficacia de disminuir la frecuencia de reestenosis, se prefiere el uso de stents liberadores de fármaco al uso de stents metálicos (SM)104-106. Para pacientes en alto riesgo de sangrado, se tendrá en cuenta considerar SM, ya que permitirá acortar la duración de los antiagregantes plaquetarios. Aquellos con riesgo hemorrágico alto (HAS-BLED ≥ 3) se realizarán revisiones clínicas y seguimiento más tempranos y frecuentes107. En pacientes con FA y riesgo de ictus inicialmente bajo, la primera reevaluación de dicho riesgo debe realizarse a los 4-6 meses de la evaluación inicial108. Finalmente, se recomienda interrumpir el tratamiento antiagregante plaquetario después de 12 meses en los pacientes tratados con un ACO (IB)109 (Fig. 1). Por otra parte, se ha observado que la utilización de inhibidores de la enzima convertidora de angiotensina y/o carvedilol en el contexto temprano post-IAM ha mostrado reducir la frecuencia de recurrencias de FA110,111. Además, considerando la fisiopatología subyacente para la aparición de FA, los antagonistas del receptor de mineralocorticoides también han demostrado una disminución en su tiempo de aparición112.
Tabla 1 Ensayos clínicos sobre eficacia de NACOs en contexto de fibrilación auricular
| Ensayos | Grupos | Conclusiones finales | Comentarios |
|---|---|---|---|
| WOEST (n = 573) | Clopidogrel 75 mg diario + warfarina vs. ASA 80-100 mg + clopidogrel 75 mg diario + warfarina | Cualquier episodio de sangrado TIMI (mínimo, menor, mayor) a 12 meses Clopidogrel + warfarina: 19.4% ASA + clopidogrel + warfarina: 44.4% (p < 0.0001) | 69% tenían FA/flutter Mucha de la reducción de sangrado fue en mínimo y menor No enfocado en eficacia (eventos trombóticos) |
| ISAR-TRIPLE (n = 614) | ASA 75-200 mg diario + clopidogrel 75 mg diario + warfarina (bajo nivel recomendado INR) por 6 semanas vs. 6 meses | Muerte, IAM, trombosis del stent definitiva, EVC, o sangrado mayor a 9 meses 6 semanas triple terapia: 9.8% (30 eventos) 6 meses triple terapia: 8.8% (27 eventos) (p = 0.63) | El ensayo fue poco ponderado para punto final primario No se encontraron diferencias en eficacia o seguridad Prevalencia de FA: 84% |
| PIONEER-AF (n = 2,124) | Rivaroxabán 15 mg diario + P2Y12 inhibidor (principalmente clopidogrel) Rivaroxabán 2.5 mg dos veces al día + DAPT (ASA + P2Y12 inhibidor, principalmente clopidogrel) desescalando a rivaroxabán 15 mg diario + P2Y12 inhibidor Terapia triple tradicional: ASA + clopidogrel + warfarina | Sangrado significativo clínico (TIMI mayor, menor o que requiere atención médica a 12 meses) – Rivaroxabán 15 mg diario + clopidogrel: 16.8% – Rivaroxabán 2.5 mg dos veces al día + DAPT: 18.0% – Terapia triple tradicional (ASA + clopidogrel + warfarina): 26.7% (p < 0.001 vs. ambos grupos, 1 y 2) | Prevalencia de FA: 100% Clopidogrel usado como el P2Y12 inhibidor en > 93% de pacientes Duración de triple terapia para grupos y 3 fueron no aleatorizados (1, 6 o 12 meses) La mayoría de la reducción del sangrado fue en aquel que requirió atención médica sin diferencias en TIMI mayor o menor No destinado para detectar diferencias en eficacia |
| RE-DUAL PCI (n = 2,725) | Dabigatrán 110 mg dos veces al día + P2Y12 inhibidor (clopidogrel 75 mg diario o ticagrelor 90 mg dos veces al día) Dabigatrán 150 mg dos veces al día + P2Y12 inhibidor (clopidogrel 75 mg diario o ticagrelor 90 mg dos veces al día) Terapia triple tradicional: ASA + clopidogrel + warfarina | Tiempo a evento de sangrado mayor o clínicamente relevante no mayor Terapia dual con dabigatrán 110 mg dos veces al día: 15.4% Grupo triple terapia: 26.9% (p < 0.001) Terapia dual con dabigatrán 150 mg dos veces al día: 20.0% Grupo correspondiente a triple terapia: 25.7% (p = 0.002) | Prevalencia de FA: 100% Clopidogrel usado como P2Y12 inhibidor en 88% de pacientes (ticagrelor en 12% de pacientes) No destinado para detectar diferencias en eficacia |
ASA: ácido acetilsalicílico; DAPT: doble antiagregación plaquetaria; EVC: evento vascular cerebral; FA: fibrilación auricular; IAM: infarto agudo de miocardio; TIMI: trombólisis en infarto del miocardio.
Conclusiones
La FA en el contexto de SICA es una patología que, de no tenerse una pericia en su identificación y seguimiento adecuado, será capaz de llevar a desenlaces desastrosos a corto y largo plazo, por lo que todo el personal que se enfrente a esta situación debe estar atento en las condiciones clínicas generales basales del paciente, en la detección de un cuadro clínico atípico, un diagnóstico temprano y en la implementación de medidas farmacológicas y no farmacológicas para asegurar un pronóstico favorable y una estandarización adecuada en los cuidados sanitarios.











 nueva página del texto (beta)
nueva página del texto (beta)