Introducción
Una especia es definida por la Norma Oficial Mexicana NMX-FF-072-1990 como “cualquiera de los diversos productos vegetales naturales aromáticos, sin materias extrañas, utilizados enteros o en polvo para condimentar, dar sabor, aroma y/o color a los alimentos y bebidas” (NMX-FF-072-1990, 1990; Mercado-Mercado et al., 2013). Otros autores definen a las especias como: “parte de las plantas, como la hoja, raíz, corteza, fruto, flores, etc., utilizadas en pequeñas cantidades para acentuar el sabor de un platillo” (Tapsell et al., 2006). Adicionalmente, las especias pueden tener propiedades protectoras de la salud y ayudar en la conservación de los alimentos, ya que poseen capacidad antioxidante y antimicrobiana, que incluso, superan a los antioxidantes sintéticos (Suhaj, 2006), sin presentar los riesgos a la salud que se les han adjudicado a los antioxidantes sintéticos (Hernández-Valdepeña et al., 2016). Estas propiedades les son conferidas por su contenido y variedad de fitoquímicos, principalmente los compuestos volátiles y los compuestos polifenólicos (Negi, 2012). Debido a esta gran heterogeneidad de los fitoquímicos, es importante desarrollar métodos adecuados para extraer los compuestos de interés. Los compuestos polifenólicos son potentes antioxidantes solubles en soluciones hidroalcohólicas. Existen diversos métodos de extracción de polifenoles; los métodos clásicos se fundamentan en la interacción de un disolvente con la muestra, bajo condiciones de calor u homogeneización, como lo son la destilación, extracción Soxhlet, maceración e hidrodestilación (Azmir et al., 2013; Luthria et al., 2015). Otros métodos, que se denominan no convencionales, como la extracción asistida por ultrasonido, por microondas, fluidos supercríticos y la microextracción en fase sólida (Sousa et al., 2016), poseen ventajas como simplicidad, velocidad, la posibilidad de trabajar con poca cantidad de muestra, la ausencia de disolventes, sensibilidad adecuada y mejores rendimientos (Junior et al., 2011).
El anís, el cilantro y el clavo son especias aromáticas que contienen aceites esenciales, ricos en compuestos volátiles, así como en compuestos polifenólicos solubles en soluciones hidrometanólicas. Estas especias son muy apreciadas por el sabor que le dan a los alimentos, formando parte de diversos platillos de la gastronomía internacional y en especial de la cocina mexicana, la cual, fue declarada patrimonio inmaterial de la humanidad en 2010. La riqueza gastronómica de la cocina mexicana surge de la variedad de ingredientes y las especias utilizadas para su elaboración (UNESCO, 2010).
El anís, es una especia que se obtiene de los frutos de la planta Pimpinella anisum L. pertenece a la familia Apiaceae y ha sido muy utilizada desde la antigüedad, es cultivada en Europa, Asia y países de Latino América (Rodrigues et al., 2003). En la industria alimenticia el anís se adiciona como ingrediente en mariscos, helados, dulces, gomas, bebidas alcohólicas (Salehi, 2010; Yucesoy & Ozen, 2013) y en diversos platillos típicos mexicanos como las tostadas de Aguascalientes, polvorones de anís, mole poblano de sor Andrea, entre otros (González, 1999; De´Angeli & De´ Angeli, 2011). Además de su uso culinario, presenta diversas propiedades medicinales: carminativa, antifúngica, antiviral y antioxidante (Peter, 2001; Fujimatu et al., 2003; Shojaii & Abdollahi Fard, 2012). Se han identificado en el anís compuestos volátiles como anetol, trans-anetol y estragol (Shojaii & Abdollahi Fard, 2012) y compuestos polifenólicos como apigenín-7-glucósido, rutina, isoorientina e isovitexina (Peter, 2001).
El cilantro o Coriandrum sativum L. es una planta perteneciente también a la familia Apiaceae, cultivada en el Mediterráneo, norte de África, Europa central, Asia y América (Seidemann, 2005). El cilantro forma parte de la comida en el medio oriente e India para brindar sabor, y enmascarar olores no deseados en ciertos alimentos (Gil et al., 2002). En México, condimenta una gran variedad de platillos como caldos, mariscos, estofados y salsas, favoreciendo con sus propiedades, a las industrias farmacéutica y cosmética (Wichtl, 1994; Wyk, 2013). A las hojas del cilantro se les atribuyen distintas propiedades biológicas como la antimicrobiana, antioxidante, hipoglucémica, hipolipidémica, ansiolítica, analgésica, antiinflamatoria y anticancerígena, entre otras (Laribi et al., 2015). En el cilantro se han identificado además de los compuestos volátiles como el decanal, trans-decanal, 2-decen-ol, ciclodecano y ácido undecanóico (Bhuiyan et al., 2009), también los compuestos polifenólicos como la apigenina, catequina, luteolina, hiperósido, hesperedina, vicenina, dihidroquercetina, crisoeriol, ácido ferúlico, ácido gálico, ácido vainílico y p-cumárico (Oganesyan et al., 2007; Nambiar et al., 2010).
El clavo, es el botón seco de la flor de Syzygium aromaticum, pertenece a la familia Mirtaceae y es una de las especias más antiguas y cotizadas, procedente de oriente, se le atribuyen propiedades culinarias y medicinales (Alexandru et al., 2013). El clavo es empleado en diversos platillos típicos mexicanos como el tamal totonaco, pollo en mole o la capirotada, etc. (Fernández, 1989; Urandeta & Kanter, 1996). Esta especia, además de su uso culinario, actúa como antiséptico, analgésico, anestésico local y antioxidante (Peter, 2001; Shrivastava, 2006; Sabira et al., 2014). El compuesto más abundante y el responsable del aroma del clavo es el eugenol. El eugenol ha demostrado poseer actividad hepatoprotectora, vasorelajadora y anestésico local en estudios in vivo (Nishijima et al., 1999). Además, el clavo también es rico en compuestos polifenólicos, principalmente, ácidos fenólicos como ácido gálico, cafeico, ferúlico, elágico y en menor concentración, flavonoides como kaempferol, quercetina y sus derivados glucosidados (Cortés-Rojas et al., 2014).
Existen diversos estudios que demuestran que el anís, el clavo y el cilantro poseen propiedades benéficas para la salud, sin embargo, no se ha realizado un perfil completo de los fitoquímicos presentes en estas tres especias. Son especialmente escasos los estudios relativos a los compuestos no volátiles, como los llamados polifenólicos. En este estudio, se evaluarán algunos parámetros, para la optimización de un método de extracción de compuestos polifenólicos en metanol acuoso utilizando el método óptimo para una extracción mayor y con el fin de comparar los perfiles presentes en las tres especias.
Materiales y métodos
Reactivos y muestras
El disolvente para la extracción y la elaboración de curvas de calibración fue el metanol (HYCEL, Zapopan, México). Para cuantificar los compuestos polifenólicos totales, flavonoides solubles totales y capacidad antioxidante se utilizaron: ácido gálico, reactivo Folin-Ciocalteau, carbonato de sodio hidróxido de sodio, nitrito de sodio, catequina, ácido 6-hidroxi-2,5,7,8-tetrametilcroman-2-carboxílico (trolox), fosfato monobásico de potasio, fosfato dibásico de potasio, 2,2´-azinobis (3-etilenbenzotiazolina-6-ácido sulfónico) sal de diamonio (ABTS) y 2,2-difenil-1-picrilhidrazil (DPPH), todos de la marca Sigma-Aldrich (St Louis MO, USA). Para la identificación por HPLC/MS se utilizó como fase móvil un gradiente compuesto por acetonitrilo y ácido fórmico (Tedia, Fairfield OH, USA). Los estándares empleados fueron: ácido shikímico, ácido gálico, pirogalol, ácido protocatecuico, ácido clorogénico, ácido p-hidroxibenzoico, catequina, ácido vanílico, ácido cafeico, ácido siríngico, mangiferina, epicatequina, vainillina, ácido p-cumárico, ácido ferúlico, ácido sinápico, rutina, ácido elágico, ácido 2-hidroxicinámico, miricetina, resveratrol, ácido cinámico, naringenina, luteolina y kaempferol (Sigma-Aldrich, Toluca, México). Todos los reactivos son grado reactivo, excepto las fases móviles que son grado HPLC. Los frutos del anís (Pimpinella anisum L.), botones florales del clavo (Syzygium aromaticum) y hojas del cilantro (Coriandrum sativum L.), fueron adquiridas en mercados locales de Ciudad Juárez, Chihuahua, México.
Optimización del proceso de extracción
Las muestras frescas fueron almacenadas -80 °C en un ultracongelador (Thermo Scientific Revco®, mod.8924, Marietta OH, EUA) y secadas mediante liofilización por 48 h (Labconco®, Freezone 6, Kansas City, MO, USA). Una vez secas, las muestras fueron molidas en un molino comercial (Mr. Coffee®, Cleveland, OH, USA) y tamizadas para obtener un tamaño de partícula homogéneo de 420 µm. Las muestras fueron empacadas al vacío (Food Saver®, mod. V22H) y almacenadas a -80 °C hasta su posterior análisis.
El proceso de extracción se realizó siguiendo el método de extracción asistida por ultrasonicación con algunas modificaciones (De la Rosa et al., 2014). Un gramo de cada muestra fue extraído en un baño con ultrasonido (Branson®, mod. 5800, Danbury, CT, USA), utilizando metanol acuoso al 80%. Para optimizar el proceso de extracción se probaron tres diferentes relaciones muestra:disolvente [1:5, 1:10 y 1:25 (p/v)] y dos tiempos de sonicación (15 y 30 min). Después de la sonicación, las muestras fueron centrifugadas (Eppendorff ®, mod. AG 5810R, Hamburg, Germany) durante 15 min a 3,500 rpm y a 4 °C. El sobrenadante se colectó y se repitió el proceso de extracción sobre el precipitado restante. Los sobrenadantes procedentes de ambas extracciones fueron combinados y evaporados utilizando un rotaevaporador (Buchi Labortechnik®, mod. AG R-3, Flawil, Suiza) a 45 °C. Una vez eliminado el metanol, los extractos fueron congelados a -80 °C, liofilizados durante 48 h, empacados al vacío y almacenados a -80 °C hasta su posterior análisis. El rendimiento de extracción se calculó con la Ecuación 1:
Polifenoles solubles totales en los extractos
El contenido de polifenoles solubles fue determinado empleando el reactivo de Folin Ciocalteu (Muñoz-Bernal et al., 2017). Se elaboró una curva de calibración por dilución seriada con ácido gálico de 0.0125 a 0.2 mg/mL, utilizando metanol acuoso al 80 % como blanco. Los extractos secos fueron disueltos en metanol al 80 % (2 mg/mL); después 250 µL de la curva estándar y las muestras fueron mezcladas con 1,000 µL de carbonato de sodio (7.5%) y 1,250 µL del reactivo de Folin Ciocalteu (10% en agua destilada). La mezcla fue incubada por 15 min a 50°C en ausencia de luz, después de la reacción los tubos fueron enfriados a temperatura ambiente. El producto de la reacción se midió a 760 nm con un lector de microplaca UV-Vis (BioRad Benchmark Plus, BioRad Laboratories, Inc. Hercules CA, USA). El contenido de polifenoles solubles se expresó como miligramos equivalentes de ácido gálico por gramo de peso seco (mg EAG/ g de PS).
Flavonoides solubles totales en los extractos
El contenido de flavonoides totales en las muestras fue determinado usando el método de cloruro de aluminio (De la Rosa et al., 2014). Se elaboró una curva de calibración con catequina de 0.0125 a 0.2 mg/mL por dilución seriada, utilizando metanol al 80 % como blanco. Los extractos secos fueron disueltos en metanol al 80 % (2 mg/mL); después, 31 μL de la muestra o el estándar fueron adicionados a los pozos de la microplaca y mezclados con 9.3 μL de cloruro de aluminio al 5 % (p/v), 125 μL de agua destilada y la mezcla fue incubada por 3 min. Finalmente, se adicionaron 125 μL de hidróxido de sodio 0.5 M y la reacción fue incubada por 30 min a temperatura ambiente y en ausencia de luz. El producto de la reacción fue medido a 510 nm utilizando un lector de microplacas (BioRad Benchmark Plus, Bio Rad Laboratories, Inc. Hercules CA, EUA). Los resultados fueron expresados como miligramos equivalentes de catequina por gramo de peso seco (mg CE/g de PS).
Actividad antioxidante por inhibición del radical ABTS•+
Esta técnica se basa en la capacidad de los extractos de compuestos fenólicos para capturar el radical ABTS•+ (2,2-Azino bis (-3-etil benzotiazolina-6-sulfonato). Se siguió el método desarrollado por Prior et al. (2005), con algunas modificaciones. Se preparó el ABTS•+ por medio de la oxidación del persulfato de potasio. Se diluyó el reactivo ABTS a 7 mM en una solución amortiguadora de fosfatos (50 Mm, pH 7.4), se agregó el persulfato de potasio a 2.5 mM y se dejó incubar por 16 horas en la oscuridad. Una vez transcurrido el tiempo, la solución del radical se ajustó a una absorbancia de 0.7 en un espectrofotómetro (UV-Visible, Agilent®) a 734 nm. Se elaboró una curva de trolox de 25 a 400μM, utilizando metanol al 80% como blanco. A 12 μL de muestra o de la curva estándar de trolox se les adicionaron 285 μL del reactivo de ABTS•+. Se cuantificó la disminución de absorbancia a 734 nm (BioRad Benchmark Plus, Bio Rad Laboratories, Inc. Hercules CA, EUA), cada 30 s por un periodo de 10 min a temperatura ambiente. Se calculó el porcentaje de inhibición del radical con la (Ecuación 2). Los resultados se expresaron como micromoles equivalentes de trolox por gramo de peso seco de muestra (µmol ET/g de PS).
Actividad antioxidante por inhibición del radical DPPH•
La técnica de DPPH se realizó conforme al método descrito por (Prior et al., 2005) con algunas modificaciones. Para esta técnica, se elaboró una curva estándar de trolox de 25 a 400 μM, utilizando como blanco metanol al 80%. A 25 μL de los estándares y las muestras, depositados en la microplaca, se les adicionaron 200 μL del reactivo de DPPH a 190 μM. Posteriormente se midió la absorbancia (Biorad®, mod. xMark) cada 30 s por 15 min a 517 nm a temperatura ambiente. Por último, se calculó el porcentaje de inhibición del radical DPPH• (Ecuación 2). Los resultados se expresaron como micromoles equivalentes de trolox por gramo peso seco de muestra (µmol ET/g de PS).
Identificación de compuestos polifenólicos presentes en los extractos mediante cromatografía de líquidos de alta resolución acoplada a espectrometría de masas (HPLC/MS)
El análisis de los fitoquímicos presentes en el anís, clavo y cilantro se realizó con un HPLC-DAD-ESI-QTOF siguiendo el método de Pellati et al. (2011), con algunas modificaciones. La separación se logró con un HPLC 1,290 Infinity II LC System (Agilent Technologies, Palo Alto, EUA), equipado con un degasificador, automuestreador, una bomba cuaternaria y un detector de arreglo de diodos (DAD). Se utilizó una columna de alta resolución (RRHD) fase reversa C-18 (2.1 x 50 mm; tamaño de partícula 1.8; ZORBAX Eclipse Plus) protegida con un cartucho guarda columna. La columna se mantuvo a una temperatura de 25ºC. Las fases móviles estuvieron compuestas por ácido fórmico (0.1%) en agua desionizada mili-Q (fase A) y acetonitrilo (fase B), ambos, grado HPLC. La separación se realizó con el siguiente gradiente de elución: 0-4 min, 90% A, 4-6 min, 70% A, 6-8 min, 62% A, 8-8.5min, 40% A, 8.5-9.5 min, 90% A; con un flujo de 0.4 mL/min y un volumen de inyección de 2 µL. Los extractos con mejores rendimientos para compuestos fenólicos totales fueron disueltos en metanol al 100% grado HPLC y purificados con filtros de nylon (0.45µm), se inyectaron al equipo a una concentración de 200 µg/mL. Los compuestos fenólicos fueron detectados por su absorción a tres longitudes de onda: 255, 275 y 320 nm.
El sistema de HPLC estaba acoplado a un espectrómetro de masas con fuente de ionización por electro spray (ESI), cuadrupolo y detector de tiempo de vuelo (QTOF) (Agilent technologies 6530 Accurate Mass Q-TOF LC/MS, Palo Alto, CA, EUA). Se operó el equipo con los siguientes parámetros: El voltaje del capilar fue de 4,500 V, la presión del gas nebulizador (N2) fue de 30 psi, la temperatura del gas de secado fue de 340 °C con un flujo de 13 L/min. En cuanto al detector de QTOF: Fragmentador 175V, Skimmer 65V, Octapolo 750 V. Los datos fueron adquiridos en el modo de ionización negativa. El rango de masas comprende de 100 a 1000 m/z. Los compuestos polifenólicos fueron identificados comparando las respuestas obtenidas en el DAD y en el detector de masas (QTOF) con estándares comerciales y librerías presentes en literatura. El tratamiento de los resultados se realizó con el programa MassHunter Workstation, qualitative analysis, versión B.07.00 (Agilent Technologies, Inc. 2014).
Análisis estadístico
Para la optimización del método de extracción se realizó un diseño factorial de dos factores, uno de ellos con tres niveles (relación muestra: disolvente) y otro con dos niveles (tiempo de sonicación). Para cada condición se realizaron tres extractos y cada uno de ellos se analizó por triplicado. Las diferencias en la concentración de compuestos polifenólicos totales, flavonoides totales y las técnicas de capacidad antioxidante en las distintas condiciones de extracción se analizaron por un análisis de varianza (ANOVA) factorial (p<0.05), seguido por una prueba de Tuckey (p<0.05) para la comparación de medias múltiples. Además, se efectuó una correlación de Pearson entre los PST, FST y las técnicas de actividad antioxidante ABTS•+ y DPPH•. El análisis estadístico fue realizado con el programa IBM SPSS Statistics 23.
Resultados y discusión
Optimización de las condiciones de extracción
En las muestras de anís (Figura 1), la mayor concentración de polifenoles solubles totales (PST) se obtuvo con una relación sólido:disolvente (RSD) 1:25 (25 mL de disolvente) y 30 min de sonicación (Figura 1a). Por otro lado, no se observaron diferencias significativas en el contenido de flavonoides solubles totales (FST) (Figura 1b) y la actividad antioxidante por inhibición del radical ABTS•+ (Figura 1c), mientras que la actividad antioxidante por inhibición del radical DPPH• (Figura 1d), fue mayor en el extracto obtenido con la RSD de 1:25 y 30 min de sonicación (el mismo que mostró el mayor contenido de PST).
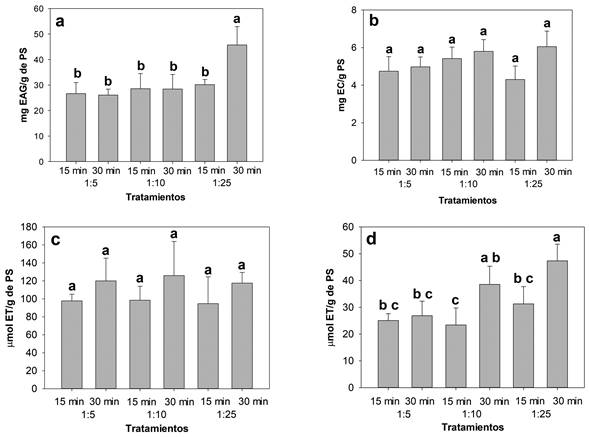
Figura 1 Polifenoles solubles totales (a), flavonoides totales (b), actividad antioxidante por inhibición del radical ABTS•+ (c) y DPPH (d), correspondiente a cada uno de los tratamientos realizados para el anís. EAG Equivalentes de ácido gálico, EC Equivalentes de catequina, ET equivalentes de trolox. Cada dato es el promedio de tres extracciones analizadas por triplicado. Letras diferentes indican diferencia significativa entre tratamientos (Tuckey, p<0.05).
En las muestras de cilantro (Figura 2) se observaron diferencias significativas (p<0.05) en el contenido de PST (Figura 2a), los dos tratamientos con una RSD 1:25 fueron significativamente mayores a los demás. Al evaluar el efecto de las condiciones de extracción sobre el contenido de FST (Figura 2b), se observaron diferencias significativas (p<0.05) con una RSD de 1:25 con 15 min de sonicación. Estas mismas condiciones también fueron las óptimas para la actividad antioxidante medida por inhibición del radical ABTS•+ y DPPH• (Figura 2c y 2d).
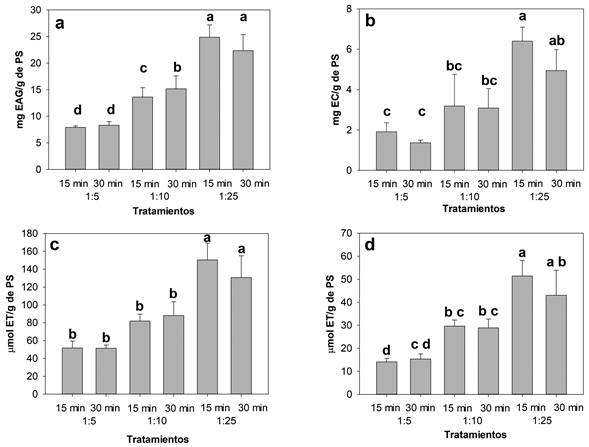
Figura 2 Polifenoles solubles totales (a) y flavonoides totales (b), actividad antioxidante por inhibición del radical ABTS•+ (c) y DPPH (d), correspondiente a cada uno de los tratamientos realizados para el cilantro. EAG Equivalentes de ácido gálico, EC Equivalentes de catequina, ET equivalentes de trolox. Cada dato es el promedio de tres extracciones analizadas por triplicado. Letras diferentes indican diferencia significativa entre tratamientos (Tuckey, p<0.05).
Para el clavo (Figura 3), también se observaron diferencias significativas (p>0.05) en relación a los PST (Figura 3a), el mejor resultado se obtuvo con la RSD 1:25 con 15 min de sonicación. Para FST (Figura 3b) los tratamientos con mejores resultados fueron los de RSD 1:25 tanto a los 15 como 30 min de sonicación y el de RSD 1:10 por 30 min de sonicación. En cuanto a la actividad antioxidante, medida por ambas técnicas, el mejor tratamiento fue el de RSD 1:25 con 30 minutos de sonicación (Figuras 3c y 3d).
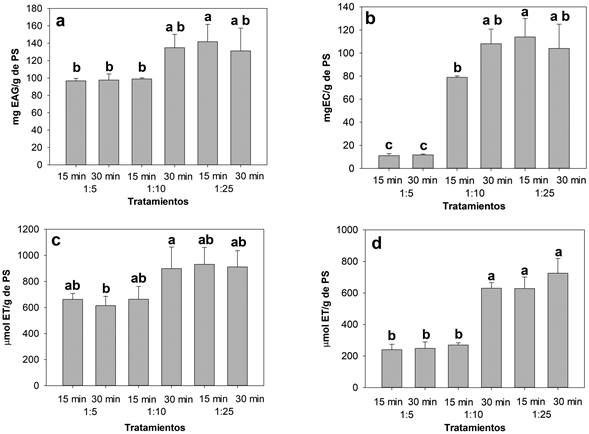
Figura 3 Polifenoles solubles totales (a) y flavonoides totales (b), actividad antioxidante por inhibición del radical ABTS•+ (c) y DPPH (d), correspondiente a cada uno de los tratamientos realizados para el clavo. EAG Equivalentes de ácido gálico, EC Equivalentes de catequina, ET equivalentes de trolox. Cada dato es el promedio de tres extracciones analizadas por triplicado. Letras diferentes indican diferencia significativa entre tratamientos (Tuckey, p<0.05).
Resultados similares a los obtenidos en el presente trabajo, fueron observados durante la optimización del método de extracción de Phyllanthus amarus (Sousa et al., 2016) y mora azul (Vaccinium ashei) donde a medida que aumenta la RSD, aumenta el contenido de polifenoles solubles (He et al., 2016). Esto ocurre debido a que, al existir más disolvente para entrar en contacto con las células, se mejora la permeación de los compuestos fenólicos (Wang et al., 2013), ya que los mecanismos de extracción deben promover la difusión de los compuestos a través de la pared celular o bien provocar la disolución del contenido celular, una vez que las paredes celulares colapsaron (Vintoru, 2001).
Por otro lado, el principal efecto de la sonicación en una extracción con disolvente es ocasionado por la cavitación acústica (Esclapez et al., 2011). Las ondas mecánicas que se difunden en un líquido inducen la compresión y la rarefacción en las moléculas del medio y los cambios de presión producen burbujas, las cuales, al colapsar generan temperaturas y presiones muy altas que rompen los tejidos, lo que permite el ingreso del disolvente a la célula, ocasionando el arrastre de los compuestos de interés (Tiwari, 2015). Además al utilizar una mezcla de dos disolventes se obtienen mejores extracciones, pues existe evidencia de que la combinación de un alcohol y el agua es más efectivo que usar solamente alcohol (Markom et al., 2007).
Si bien es cierto, que la mayor RSD (1:25) mostró en general los mejores resultados, también se puede observar que, en el caso del anís, esta variable tuvo menos efecto que en las otras dos especias. Sólo se observó diferencia significativa en PST y DPPH• con la mayor RSD y el mayor tiempo de sonicación. La distribución y composición de fitoquímicos, así como las características morfológicas y fisiológicas de cada planta, pueden hacer que la extracción de fitoquímicos se facilite en ciertas matrices vegetales (Verma & Shukla, 2015). En el caso del anís, se han descrito unos tejidos llamados ductos secretores, que son cavidades elongadas que crean una red que va desde las raíces hasta los frutos (Svoboda & Svoboda, 2000) y es posible que la presencia de estas estructuras explique el fenómeno de por qué se facilita la extracción a una baja RSD para el fruto de anís. Adicionalmente, se ha reportado que los compuestos polifenólicos en los frutos están menos ligados a macromoléculas de otras partes de la planta, por lo que son más fáciles de solubilizar (Evergetis & Haroutounian, 2014).
En cuanto al tiempo de extracción, existe evidencia en un estudio con extractos de romero (Rosmarinus oficinalis) que sugiere que la mayoría de los compuestos polifenólicos son extraídos en 15 min de sonicación (Albu et al., 2004). Estos resultados concuerdan con los obtenidos en el cilantro del presente estudio, donde se observa que el paso de 15 a 30 minutos de sonicación no tuvo un efecto sobre la abundancia de PST, FST o capacidad antioxidante. Sin embargo, en el caso del anís, el factor tiempo fue más importante, ya que solo la combinación mayor RSD y mayor tiempo tuvo algún efecto; mientras que en clavo el tiempo tuvo un efecto intermedio, ya que, por ejemplo, en una RSD de 1:10 sí se notó la influencia de este parámetro, pero no en las RSD 1:5 y 1:25. Nuevamente, las diferentes características de la matriz vegetal explican las diferencias en la relevancia del factor tiempo. Se ha reportado que en la col silvestre, son necesarios hasta 60 minutos para extraer la totalidad de los ácidos fenólicos de esta especie, sin embargo, los autores sugieren que 40 minutos de sonicación puede ser un tiempo recomendable, para evitar la degradación de algunos compuestos y mejorar las condiciones del proceso, manteniendo una eficiencia de extracción cercana al 90% (Oniszczuk & Olech, 2016). En los resultados del presente estudio, podemos concluir que el tiempo fue un factor significativo solamente en algunos casos (sobre todo anís), mientras que la RSD tuvo una mayor influencia en el cilantro y el clavo, para aumentar el contenido de PST, FST y la actividad antioxidante de los extractos. Por esta razón, se sugiere utilizar extracciones de 15 min en cilantro y clavo, ahorrando, energía y tiempo. Las condiciones óptimas de extracción para el anís fueron RSD 1:25 con 30 min de sonicación. En el cilantro, RSD 1:25 con un tiempo de 15 min. Para el clavo, fueron también una RSD de 1:25 con un tiempo de 15 min (sin diferencia significativa con 30 minutos). Se ha demostrado en el presente estudio que la RSD tiene una influencia en la cantidad de compuestos polifenólicos que son extraídos de una matriz vegetal (Naczk & Shahidi, 2004).
Contenido de PST y FST y correlación con la capacidad antioxidante en las tres especias
Considerando las condiciones óptimas de extracción para cada especia, se compararon sus contenidos de PST, FST y actividades antioxidantes (datos mostrados en las Figuras 1-3). Se observó que en cuanto al contenido de PST en el clavo fue 3 veces mayor al anís y 5 veces mayor al cilantro. En cuanto a FST se observó la misma tendencia presentando el clavo 1.7 veces más que el cilantro y 1.8 veces más que al anís. No se observó una relación directa entre la facilidad de extracción de los compuestos (con respecto a tiempo o RSD) y la abundancia total de éstos en las tres especias estudiadas. Es decir, a pesar de que la extracción del anís fue la más larga, el contenido final de PST y FST fue menor que en el clavo.
Se han reportado para el anís valores de 46.17 mg EAG/100 g de muestra seca, 100 veces menor a lo obtenido en este trabajo, mientras que el contenido de flavonoides reportado en la literatura fue 34 veces menor, con 17.43 mg EC/100 g de muestra seca (Martins et al., 2016). Esto indica que, efectivamente, las condiciones de extracción utilizadas en este trabajo son adecuadas e incluso es posible que sean mejores que otras usadas anteriormente. Para el cilantro, se han reportado en la literatura valores de 17.04 mg EAG/100 g de muestra seca, 146 veces menor a lo obtenido en este trabajo y en cuanto a los flavonoides se menciona la cantidad de 11.10 mg EC/100 g de muestra seca, 57 veces menor (Martins et al., 2016). Al comparar el contenido de PST obtenidos en el clavo se observó que son 15 veces mayores a los de otro estudio (8.96 mg EAG/ g), (Wojdylo et al., 2007). En general, se observa que los valores citados en la literatura son notablemente inferiores a los obtenidos en este trabajo, esto se debe muy posiblemente a la variabilidad entre genotipos, temporada de cosecha, edad, estrés ambiental al que fue expuesta la planta y las características de la tierra donde fueron cultivadas (Salazar et al., 2006). Sin embargo, no se puede dejar de lado que, el método de extracción tiene una importante influencia en el contenido de fitoquímicos obtenidos de la muestra, en el presente estudio se utilizó extracción asistida por ultrasonido, mientras que en el estudio de Martins et al. (2016) en cilantro y anís, solamente se realizó una extracción con agitación orbital. Existe evidencia de que el sistema de extracción asistido por ultrasonido obtiene mejores rendimientos de fitoquímicos comparado con los métodos de extracción con disolventes convencionales (He et al., 2016).
Los valores de la capacidad antioxidante también fueron mayores que los reportados en la literatura, aunque las diferencias no fueron tan evidentes. De acuerdo a la técnica de ABTS•+, para el anís se obtuvieron 125.85 µmoles equivalentes de trolox por gramo de peso seco (µm ET/g de PS), para el cilantro el valor fue de 150.45 µm ET/g de PS y para el clavo se obtuvieron 931.17 µm ET/g de PS (Figuras 1c, 2c y 3c). Los valores de anís son un poco más del doble, mientras que los de clavo son muy similares a lo reportado anteriormente en nuestro mismo grupo de trabajo: 58.25 µm ET/g de PS para anís y 814.95 µm ET/g de PS para clavo (Muñoz-Bernal, 2014). Con respecto al cilantro, no se encontraron otros reportes de actividad antioxidante de esta especia, lo cual pone de manifiesto la falta de una caracterización completa. Sin embargo, sí es posible observar que, según la técnica de ABTS•+, la capacidad antioxidante de las tres especias analizadas en este trabajo, es mucho mayor a la de otras especias como el tomillo y el romero (0.35 y 0.38 µm ET/g de PS, respectivamente, (Wojdylo et al., 2007).
Tendencias similares se observaron utilizando el ensayo del DPPH• (Figuras 1d, 2d y 3d), para el anís se obtuvieron 47.38 µm ET/g de PS, casi el doble de lo que se reporta en la literatura (26.86 µm ET/g de PS, Muñoz-Bernal, 2014). Para el cilantro se obtuvo un valor de 51.43 µm ET/g de PS, ligeramente superior al del anís y muy inferior al del clavo, que tuvo una capacidad antioxidante de 725.33 µm ET/g de PS. Este valor del clavo fue muy superior al encontrado anteriormente por nuestro mismo grupo de trabajo (49.66 µm ET/g de PS, (Muñoz-Bernal, 2014), y tampoco se encontraron reportes de capacidad antioxidante del cilantro utilizando la técnica de DPPH•. Al comparar los valores aquí encontrados con los de especias como tomillo y romero (Wojdylo et al., 2007), se observa que los mencionados en el presente trabajo son mucho mayores. Nuevamente, las diferencias pueden deberse tanto a las características individuales de las muestras como al efecto de unas mejores condiciones de extracción. Asimismo, el clavo fue el primer lugar en actividad antioxidante, aunque en este caso seguido del cilantro y por último el anís.
Se ha comprobado que los compuestos polifenólicos son responsables de la actividad antioxidante de las especias (Shahidi & Ambigaipalan, 2015). Para demostrarlo, se efectuó un análisis de correlación entre los PST y FST y los valores de actividad antioxidante obtenidos, para cada especia con las diferentes condiciones de extracción se observan en la Tabla I. Para el anís, se encontró una correlación baja y no significativa entre estos factores, debida probablemente a la falta de diferencias significativas entre las distintas muestras. Asimismo, esto podría ser porque los compuestos volátiles son los responsables de la actividad antioxidante de este producto y no los polifenoles solubles (Chrysargyris et al., 2017). Por otra parte, el cilantro y el clavo demostraron correlaciones altas y estadísticamente significativas, entre la actividad antioxidante y el contenido de PST en especias, como lo sostienen diversos estudios (Cai et al., 2004; Lu et al., 2011).
Tabla I Coeficientes de correlación (R) entre los PST: polifenoles solubles totales, FT; flavonoides totales y la capacidad antioxidante (ABTS•+ y DPPH) en extractos de anís, clavo y cilantro obtenidos bajo diferentes tiempos y RSD. * Correlación significativa (p<0.05).
| PST vs ABTS | PST vs DPPH | FT vs ABTS | FT vs DPPH | |
| Anís | 0.230 | 0.720 | 0.681 | 0.656 |
| Cilantro | 0.998* | 0.993* | 0.989* | 0.987* |
| Clavo | 0.986* | 0.956* | 0.880* | 0.856* |
Identificación de compuestos por HPLC-DAD-ESI-QTOF
A continuación, se presentan los resultados de los compuestos identificados en las muestras. Estos perfiles se obtuvieron a partir de los extractos que presentaron mayor contenido de FST. Para la identificación de los compuestos individuales del perfil de cada especia, se compararon los tiempos de retención, longitudes de absorción máxima y peso del ion molecular de cada señal detectada en el cromatograma con los de los estándares comerciales y con los de los compuestos reportados en la literatura consultada (Tabla II).
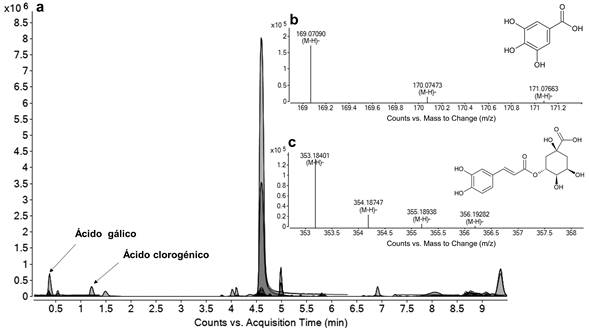
En el extracto de anís se detectaron 92 señales de las que se lograron identificar tres ácidos fenólicos: ácido clorogénico, ácido ferúlico y ácido sinápico, por comparación de su tiempo de retención, espectro de absorción UV-VIS y peso del ion molecular con estándares, así como un isómero del ácido clorogénico con un m/z de 356.16 (Tabla II). Otros autores han identificado en el anís distintos isómeros del ácido clorogénico, como los ácidos 3-O-cafeoilquínico, 4-O-cafeoilquínico y el 5-O-cafeoilquínico (Martins et al., 2016). El ácido sinápico y el ferúlico no han sido reportados en el anís, pero sí en romero, tomillo, orégano, comino, canela y laurel (Vallverdu-Queralt et al., 2014). Los ácidos hidroxicinámicos pueden ser encontrados en casi todas las plantas, son producidos en respuesta al estrés del ambiente, algunos ejemplos son el ácido cafeico, el ferúlico y el p-cumárico. Estos compuestos han demostrado poseer capacidades antioxidantes, hipoglicemiantes, antivirales y hepatoprotectivos, haciendo recomendable el consumo de esta especia (Farah & Donangelo, 2006).
Tabla II Compuestos polifenólicos identificados en los extractos de anís, clavo y cilantro. TR: Tiempo de retención UV-VIS. λ abs máx: longitudes de onda de máxima absorción. m/z(M-H): Ion molecular. *Compuestos identificados por comparación con estándares, #compuestos identificados tentativamente por comparación de sus m/z con los resultados de la literatura consultada.
| Pico | TR | λ abs máx. | m/z[M-H-] | Compuestos identificados | Especia |
|---|---|---|---|---|---|
| 1 | 0.738 | 255,300 | 353.16 | Isómero de ácido clorogénico# | Anís |
| 2 | 1.282 | 215,255,300 | 353.16 | Ácido clorogénico* | Anís |
| 3 | 3.722 | - | 193.1 | Ácido ferúlico* | Anís |
| 4 | 3.795 | 270 | 223.11 | Ácido sinápico* | Anís |
| 1 | 4.507 | 255, 355 | 609.15 | Quercetín-3-rutinósido# | Cilantro |
| 2 | 6.476 | - | 271.0679 | Naringenina# | Cilantro |
| 1 | 0.465 | 215,275 | 169.07 | Ácido gálico* | Clavo |
| 2 | 1.148 | 210,255,295 | 353.18 | Ácido clorogénico* | Clavo |
| 3 | 1.427 | 205,230,255,295 | 353.18 | Isómero de ácido clorogénico# | Clavo |
| 4 | 3.943 | 255,370 | 301.08 | Ácido elágico* | Clavo |
En el cilantro se detectaron 80 señales de las cuales se pudo identificar el quercetín 3-rutinósido (rutina) con una carga masa de 609.14 (m/z) (Abu-Reidah et al., 2013). También se identificó la presencia de un compuesto con un m/z de 271.0611, que fue asignado como naringenina. El quercetín 3-rutinósido es un derivado del flavonoide que ha sido identificado en la sandía (Citrullus lanatus) y las hojas del pepino (Cai, & Wang, 2005; Abu-Reidah et al., 2013). La rutina ha demostrado poseer propiedades bioactivas como antioxidante y antiinflamatorio, además de los efectos protectores al corazón, hígado y riñones en ratas con síndrome metabólico (Panchal et al., 2011; Diwan et al., 2017). Por otra parte, la naringenina es una flavanona, su presencia ha sido reportada en el cilantro (Laribi et al., 2015) y en extractos de pepino (Cucumis sativum L.) en éste último de forma glucosilada (Abu-Reidah et al., 2012). La naringenina presenta efectos similares a la metfomina, para combatir la diabetes, el cáncer y enfermedades cardiovasculares (Nyane et al., 2017).
En el clavo se detectaron 127 señales, tres de ellas (ácido gálico, ácido clorogénico y ácido elágico) coincidieron en sus tiempos de retención, espectros de absorción UV-VIS y tamaños del ion molecular con los estándares correspondientes y se observó un isómero del ácido clorogénico con un m/z de 353.18 (Tabla I). El ácido gálico ya ha sido identificado en el clavo (Cortés-Rojas et al., 2014) pero también en otras especias como romero, tomillo, orégano, comino, canela y hojas de guayaba (Vallverdu-Queralt et al., 2014; Díaz-de-Cerio et al., 2016). El ácido elágico es un polifenol presente en algunos frutos como las bayas y la granada. Estudios recientes demuestran que este compuesto actúa como antioxidante, anticancerígeno y antimutagénico (Hakkinen et al., 2000; Dalvi et al., 2017). En la Figura 4 se observa la información que brinda el HPLC/MS (tiempo de retención, la masa molecular y el patrón de ionización) que permite, comparando con librerías y estándares, la identificación de dos analitos presentes en la muestra.
Conclusiones
Los parámetros óptimos para la extracción de compuestos polifenólicos de anís, cilantro y clavo fueron una RSD 1:25 con 30 min de sonicación para el anís y 15 minutos para el cilantro y el clavo. La RSD tuvo mayor influencia, que el tiempo de sonicación, para mejorar la extracción de compuestos polifenólicos de cilantro y clavo. En el anís se identificaron ácido clorogénico, ferúlico y sinápico. En el cilantro se encontró quercetín-3-rutinósido y naringenina. En el clavo se identificó el ácido gálico, clorogénico y elágico. El clavo fue la especia más rica en compuestos polifenólicos y la que tuvo la mayor capacidad antioxidante. El contenido de polifenoles y flavonoides en los extractos de cilantro y clavo se correlacionó positivamente con su actividad antioxidante. Las especias de la cocina mexicana poseen compuestos que podrían producir efectos benéficos o protectores a la salud debido a su capacidad antioxidante, por lo que se requiere emprender una caracterización exhaustiva.











 nueva página del texto (beta)
nueva página del texto (beta)