Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
TIP. Revista especializada en ciencias químico-biológicas
versión impresa ISSN 1405-888X
TIP vol.13 no.2 Ciudad de México dic. 2010
Artículos originales
Modelo de diferenciación celular en la floración de Arabidopsis thaliana
Inflorescence cell differentiation model of Arabidopsis thaliana
José Roberto Romero-Arias1, Rafael Ángel Barrio1, Elena Álvarez-Buylla Roces2,3, Carmen Varea1 y Aurora Hernández-Machado4
1 Instituto de Física, UNAM., Apdo. Postal 20-360, 01000 México, D.F., México.
2 Instituto de Ecología, UNAM, Apdo. Postal 70-275, México, D.F. 04510 México.
3 Centro de Ciencias de la Complejidad, UNAM, Torre de Ingeniería, Ciudad Universitaria, México, D.F., 04510 México.
4 Facultat de Física, Universitat de Barcelona, Av. Diagonal, 647 E 08028 Barcelona, España.
Artículo recibido el 04 de agosto de 2010.
Aceptado el 10 de noviembre de 2010.
Resumen
Abordamos el problema de diferenciación celular suponiendo que las células reciben del medio en el que se encuentran información espacio-temporal que les permite cambiar la expresión de sus genes a través de la interacción entre campos físicos macroscópicos y sus redes genéticas. La idea fundamental es que la red genética de cada célula responda a la evolución dinámica de los campos macroscópicos, que rompen la simetría del espacio-tiempo, y de esa forma provean información a la red para expresar los genes de forma selectiva. Así, describimos un modelo de coevolución entre dos sistemas físicos que reaccionan químicamente para describir la floración de Arabidopsis thaliana, ya que esta planta ha sido uno de los organismos más estudiados y donde podemos usar una gran cantidad de datos, tanto de la evolución temporal de los órganos como de la actividad de la genética responsable.
Palabras Clave: Modelos de floración, morfogénesis, redes genéticas.
Abstract
We address the cell differentiation problem assuming that cells receive space-time information from the environment that allows them to change their gene expression through the interaction between macroscopic physical fields and their genetic networks. The fundamental idea is that every cell's genetic network responds to the dynamical evolution of the macroscopic fields that break the space-time symmetry and provide information for selective gene expression. Hence, we use a coevolution model between two physical systems reacting chemically in order to describe the inflorescence of Arabidopsis thaliana since this plant has been one of the most studied organisms and there is an enormous quantity of experimental data about the time evolution of its organs and also about the gene activity responsible for those changes.
Key Words: Models of inflorescence, morphogenesis, genetic networks.
Introducción
Las células indiferenciadas de un embrión, o células "madre" comparten no sólo el mismo ADN, sino que también los mismos genes y las mismas redes genéticas. Durante el desarrollo de un ser vivo las células madre adquieren un destino específico indudablemente gobernado por diferencias en la expresión de sus redes genéticas. Hoy en día se acepta que esto ocurre en respuesta a señales que dependen de la posición o del linaje celular[1].
Es indudable que la diferenciación celular ocurre como resultado de una complicada coreografía (sin coreógrafo) entre la química de medio intercelular e intracelular a través del uso de intrincados medios de comunicación entre las células. Entonces es apropiado modelar estos procesos como un sistema coevolutivo, en que la dinámica de las redes genéticas de cada célula responde al estado espacio-temporal de un campo físico macroscópico, el cual a su vez se ve influenciado por la expresión de los genes.
En la literatura se han propuesto varios campos físicos como mecanismos regulatorios de diferenciación, por ejemplo, se ha demostrado que campos de esfuerzos mecánicos dictan la orientación de microtúbulos que determinan la morfogénesis de la flor Arabidopsis thaliana[2]. Dentro de los mecanismos más socorridos para explicar la diferenciación se encuentra la formación de patrones espaciales por difusión de sustancias químicas (patrones de Turing) o comunicación entre las redes genéticas de células contiguas por difusión[3].
En este artículo nos enfocaremos de ahora en adelante al estudio de la floración en la planta Arabidopsis thaliana, aunque el mecanismo general que proponemos puede ser usado en las más diversas situaciones de embriología y biología del desarrollo.
A diferencia de los animales, la morfogénesis en las plantas ocurre durante todo el ciclo de vida en grupos de células indiferenciadas llamados meristemos. Existen dos tipos de meristemos que son activos durante toda la vida de la planta, el de inflorescencia o "shoot apical meristem" (SAM) y el de raíz o "root apical meristem" (RAM). En el primero, durante la formación de la flor, aparecen cuatro regiones concéntricas de células primigenias ("primordios") que eventualmente se convertirán en los cuatro órganos: sépalos, pétalos, estambres y carpelos, dispuestos desde fuera hacia adentro como se muestra en la Figura 1. El patrón espacio-temporal de la morfogénesis de la flor es el mismo en el cuarto de millón de especies de plantas con flores, lo que sugiere que debe existir un mecanismo robusto y general en la formación de este patrón, pero que no se entiende bien hasta la fecha.
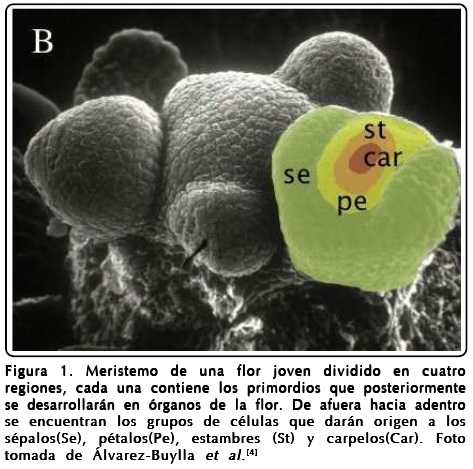
La propuesta más socorrida para explicar la aparición del meristemo es un mecanismo de interacción química que provoca un gradiente de hormonas de crecimiento (en particular auxinas) que promueve la reproducción de células indiferenciadas[5,6].
Existe un modelo de la floración en Arabidopsis thaliana, llamado ABC[7,8] que propone un mecanismo de concentración de agentes químicos, que actúan como activadores selectivos de los diferentes atractores de las redes genéticas que producen los diferentes órganos. Sin embargo, la disposición geométrica de estos activadores en anillos concéntricos no se obtiene con este modelo solamente.
La aparición de cualquier disposición geométrica es interesante de investigar, pues generalmente es el resultado de interacciones que obedecen leyes simples de la Física. Una propiedad de las superficies e interfases geométricas es la curvatura, la cual puede calcularse en cada punto del lugar geométrico localmente sin necesidad de tener información global del sistema. Resulta interesante que estudios recientes in vitro de la floración de Arabidopsis thaliana[9-11] sugieren que la información espacio-temporal necesaria para la construcción de una geometría anillada se obtiene a través de la curvatura local debido a una simetría cilíndrica en el crecimiento de los primordios y a que el cambio de la curvatura media del meristemo sufre cambios notables en la interfase donde conviven dos grupos de células primordiales[9-12].
En este artículo formularemos un modelo coevolutivo espacio-temporal que nos ayude a entender la formación de primordios usando la curvatura media de la interfase donde conviven dos grupos de células primordiales y que los trabajos de Kwiatkowska han revelado como posible secuenciador. Para abordar el problema revisaremos los modelos existentes de floración en A. thaliana, las características de las redes genéticas responsables y sus conformaciones en los atractores que dictan la diferenciación, luego plantearemos una forma coevolutiva puramente espacial que nos sirva de peldaño para después introducir un modelo espacio-temporal que permita obtener los resultados experimentales y predecir, así mismo, los mutantes que se obtendrían cuando algunos de los genes fallen.
El modelo ABC y sus derivados
El modelo más aceptado para entender la floración en A. thaliana es el llamado ABC, el cual supone que existen interacciones entre cinco factores de transcripción que se agrupan en tres clases de genes homeóticos, grupos de genes que se traducen en proteínas y que regulan la expresión del ADN mediante una activación selectiva según su concentración relativa. Un esquema del modelo se muestra en la Figura 2(i). Consecuentemente, el modelo ABC divide a los genes en tres clases y propone la identificación de cada órgano con la interacción de los genes. La forma en que queda determinada la floración de este modelo es la siguiente:
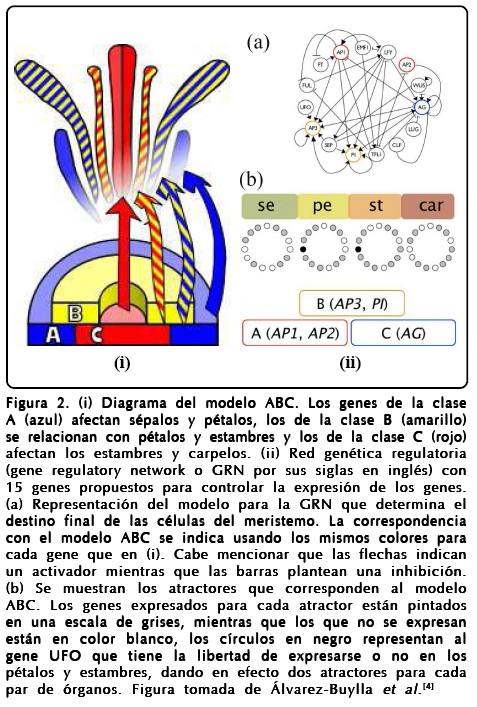
- Los genes de la clase A inducen el desarrollo de los sépalos (Se).
- Los genes de la clase A junto con los de la clase B inducen el desarrollo de los pétalos (Pe).
- Los genes de la clase B junto con los de la clase C inducen el desarrollo de los estambres (St).
- Los genes de la clase C inducen el desarrollo de los carpelos (Car).
Un modelo más elaborado y basado en datos experimentales de la floración de A. thaliana con el espíritu del ABC es el propuesto por Álvarez-Buylla et al.[4], el cual propone una red de 15 genes cuyos atractores pueden reproducir los resultados del modelo ABC. La Figura 2(ii) muestra las relaciones de activación-inhibición de los genes del modelo de Álvarez-Buylla et al. y su relación con el modelo ABC. Es importante mencionar que en el paisaje epigenético, el lugar donde podemos visualizar todas las interacciones entre los 15 genes, Álvarez-Buylla et al. encuentran 10 puntos fijos de los cuales 4 los relacionan con la floración de tal forma que cada punto corresponde a un primordio específico[4,13].
A pesar de que este último modelo abre nuevos canales para la interpretación de mutantes y la floración, la distribución espacio-temporal de los genes no queda clara en la dinámica que tiene la red. Sin embargo, el modelo se presta para plantear un acoplamiento entre la expresión genética y estructura topológica del espacio. Basados en las ideas y resultados previos del crecimiento del meristemo y la aparición de primordios[9,11,12], pensamos que la estructura topológica debe estar relacionada con la curvatura del meristemo, ya que dependiendo de su valor podría imponer la expresión genética selectiva conforme hay crecimiento celular.
Esta idea nos recuerda un proceso genérico de coevolución, en el que los genes responden a la activación e inhibición entre agentes químicos, que dictan la geometría del meristemo (SAM), y a su vez ésta última regula la dinámica entre químicos. Podríamos decir que el problema de diferenciación celular en este caso se reduce a encontrar campos macroscópicos que rompan la simetría espacio-temporal del meristemo para formar diferentes regiones que involucren una situación geométrica determinada, y además asociar factores de transcriptores a estas regiones, que induzcan a las redes de regulación genética (GRN) en cada célula a llegar a alguno de sus diferentes puntos fijos y por consecuencia a formar los órganos de la flor.
Modelo de coevolución espacial
Por el momento olvidemos el crecimiento del meristemo en el tiempo, y consideremos justo el momento en que aparece un primordio. Esto puede interpretarse como que el dominio geométrico del meristemo se ha dividido en dos módulos celulares, que corresponden a la aparición de células primordiales y que están separadas por una interfaz. Estos módulos interactúan entre sí cuando la flor va creciendo, lo que provoca que cada módulo se reajuste en el espacio-tiempo. De esta forma, los procesos más importantes, en cuanto a interacción ocurren justamente en la superficie que separa ambos módulos y en este sentido sólo nos interesaría estudiar lo que ocurre en la frontera siguiendo su dinámica. En Física, este problema se reduce a proponer la interacción de los módulos mediante un intercambio de energía y otras cantidades conservadas que reproduzca la forma de la interfaz y los módulos. Para empezar a formular un modelo que reúna estas características es indispensable que la distribución espacio-tiempo de los primordios cumpla con el crecimiento y distribución espacial de la floración de A. thaliana. En este punto podemos fijar nuestra atención en la distribución espacial de los primordios. Posteriormente podremos usar este modelo estático e incorporarle la parte temporal mediante el crecimiento de los primordios, esta parte del modelo lo realizaremos en la siguiente sección.
El modelo físico que reúne las características espaciales de nuestro problema es el modelo de campo-fase de curvatura espontánea propuesto por Campelo[14]. En este modelo se representaría a los módulos de la floración como fases (en el sentido termodinámico) de un sistema usando un campo mediante un parámetro de orden, digamos ø, que toma la posición espacial y le asocia un valor determinado. De esta forma, diferentes valores del parámetro de orden corresponderían a diferentes fases, separadas abruptamente en los lugares en que el parámetro cambia de valor. Es importante señalar que este modelo se preocupa sólo de la interfase y no de la distribución espacial de cada fase, lo que nos da como resultado inmediato que la dinámica de cada fase (o primordio en el caso de la flor) se describa con ecuaciones diferenciales parciales. Como mencionamos anteriormente, la distribución espacial de cada fase se debe relacionar con la forma en la que los modelos ABC y la red de regulación genética (GRN) distribuyen los primordios. Así que necesitamos otro campo o parámetro, digamos u que represente otra fase distinta y que se acople al campo-fase original en la interfase. De esta forma, formularemos entonces un modelo de campo-fase acoplado con curvatura espontánea[14].
Pensemos en el modelo ABC y consideremos el parámetro ø tal que ø es donde la substancia A domina y ø = -1 en regiones donde la concentración de la substancia C es grande. Ambas regiones están separadas por una delgada interfase, ya que ambas sustancias se excluyen mutuamente. Para tener el acoplamiento del agente B con los otros dos agentes debemos definir otro campo, digamos u, que interactúe con ø a través del término de curvatura espontánea. Siguiendo los resultados de Campelo podemos definir el sistema a través de una densidad de energía, Ω, como sigue[15]:
Ω = μ2 + R (ø2 - 1)2 + D|u|2 + σ | ∇ø |2, (1)
donde R representa la energía potencial del campo u (por simplicidad podemos suponer que u = 1 es un punto de equilibrio dado por un potencial armónico de la forma R = (u - 1)2), D y σ están relacionadas con la energía para cambiar la superficie de los campos u y ø respectivamente, ∇ representa los cambios espaciales de las funciones de los campos y[14]
μ = ø (ø2 - 2) - ∈C (ø2- 1) (1 + ßu) - ∈2∇2ø, (2)
es el potencial "químico" μ2 es la densidad de energía debida al campo-fase) y contiene el término de curvatura espontánea acoplado linealmente al campo u. La C es la curvatura espontánea local, ∈ está relacionado al ancho de la interfase y ß es el parámetro que mide la fuerza de la interacción del campo u con su entorno.
Considerando una cinética conservativa, uno puede obtener la dinámica del sistema calculando la variación de la energía E = ∫vΩdV en función de los campos como:
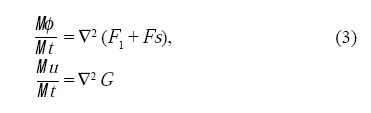
donde
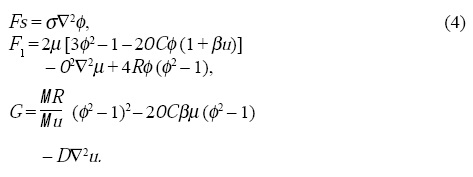
Los Laplacianos en las Ecs. 3 indican la conservación de volumen y el parámetro σ en las Ecs. 4 puede asegurar la conservación del área mediante las integrales de volumen siguientes[15]:
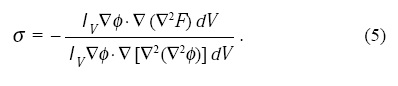
Teniendo en cuenta que el meristemo tiene una simetría cilíndrica y que la fase justo antes de la diferenciación tiene un diámetro de ~ 50 células, integramos numéricamente estas ecuaciones en un plano que contuviera el eje de simetría o, dicho de otra forma, en dominio bidimensional cuadrado de 50 x 50, pensando en que cada píxel del dominio representará el estado de una célula. La forma en que realizamos la simulación numérica fue usando el método de Euler simple con un paso dt = 5 x 10-4, con condiciones a la frontera de cero flujo y con condiciones iniciales que delinean un perfil circular de radio r = 10 (la proyección en el plano que contiene el eje de simetría del perfil de tangente hiperbólica del campo-fase) donde afuera ø = -1 y ø= 1 dentro. Se tomó u=0 como condición inicial sobre todo el espacio. Las Figuras 3(a) y 3(b) muestran la configuración final de los campos ø y u, respectivamente. En las Figuras 3(c) y 3(d) asociamos la aparición de los órganos con el modelo ABC asignando la formación de los carpelos (Car) a ø > 0 y u < 0. La formación de los estambres (St) debida a ø > 0 y u > 0, la de los pétalos (Pe) está dada por ø < 0 y u > 0 y finalmente la formación de los sépalos (Se) debida a ø < 0 y u < 0. Esto fue pensando en que el meristemo siempre está generando células indiferencias y, por tanto, debería tener un valor positivo el parámetro que lo simula en el centro y negativo en la periferia, pues hay menos producción de células indiferenciadas. Por otro lado, los valores del campo u se tomaron según la concentración de la clase B del modelo ABC, es decir, es más fuerte alrededor del centro y casi nulo en la periferia y en el centro.
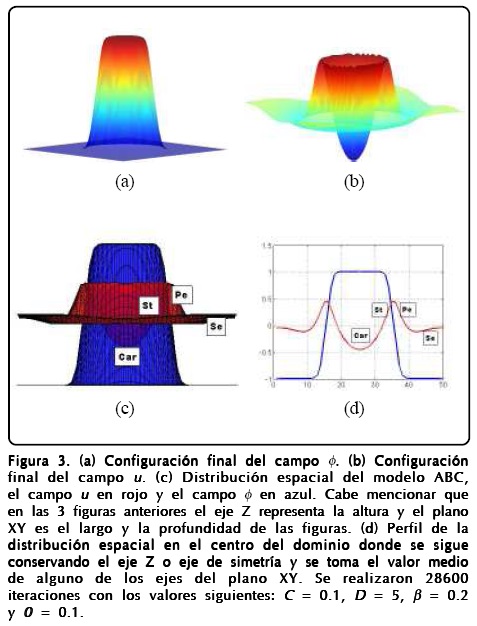
Cabe mencionar que los resultados obtenidos en la Figura 3 se conservan cuando los parámetros cambian dentro de límites razonables, es decir, nuestro modelo tiene un grado de robustez grande que lo hace apropiado para tratar procesos biológicos, pues como sabemos éstos se deben adaptar a la presencia de cambios abruptos del medio sin destruirse.
Hasta ahora nuestro modelo de campo-fase reproduce la geometría postulada por el ABC si asignamos a cada órgano un valor específico de los campos. La labor de asignación de cada órgano debe ser realizada por los genes, de tal forma que tenemos que acoplar la GRN con el campo-fase. Así, necesitamos una red genética que tenga cuatro atractores diferentes, que se correspondan con los valores de los campos en las cuatro regiones. Revisando el modelo propuesto por Álvarez-Buylla et al. [4], los estudios de Szczesny et al. [12], el trabajo de Sablowski[16] y Espinosa-Soto et al.[3], identificamos características importantes de los genes como: que el gene WUS actúa como un regulador y modulador de células indiferenciadas en el núcleo del meristemo (SAM), también encontramos que el gene AP3 está asociado a la formación de estambres y pétalos, que el gene AP1 se relaciona con los sépalos y que el gene AG se relaciona con los carpelos. De esta manera proponemos que la interacción macroscópica con la GRN ocurre principalmente en dos genes, la primera a través del campo ø con el gene WUS para regular el crecimiento del meristemo y la segunda entre el campo u y el gene AP3 para detectar la información de la curvatura en las interfases. Uniendo los resultados conseguimos un modelo simplificado de la GRN que incluye los modelos ABC y los méritos de la GRN para la floración en A. thaliana. La forma esquemática del modelo acoplado aparece en la Figura 4[15].
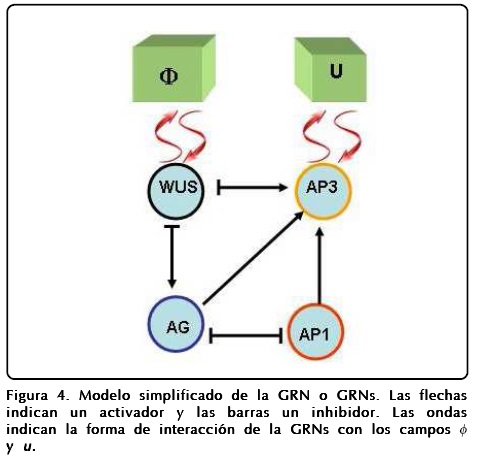
Las operaciones lógicas Fi que están representadas en la Figura 4 son las siguientes:
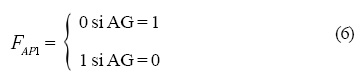
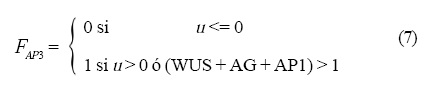
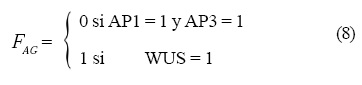
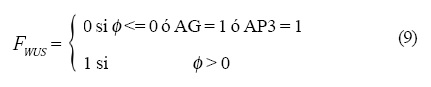
y la dinámica que siguen es:
Xn(t + Τ) = Xn(t) + δ (t + dT)[Fn(t) - Xn(t)], (10)
donde X es la variable dinámica que representa el estado del gene, es decir, prendido o apagado, n representa a los genes WUS, AP1, AP3 y AG y dT es el tiempo que tarda en entrar la GRNs para interactuar con la dinámica de los campos.
Al construir las tablas de verdad encontramos que de las 26 posibles condiciones iniciales de nuestro modelo hay cuatro atractores a los cuales se les puede asignar un órgano en la flor:

donde w representa el estado de WUS y juega el papel de organizador de los primordios, ya que w = 0 se relaciona con los sépalos y pétalos, mientras que w = 1 se relaciona con los estambres y carpelos. Además, esto hace sentido con el modelo ABC si se asocia la activación de AP1 con A, AP3 con B y AG con C. Es de esperarse que la escala de tiempo (dT) en que se acoplan los campos con los genes es más grande que la escala de tiempo característica de la dinámica de los campos (di). Así, en los cálculos numéricos hacemos actuar este acoplamiento después de un número grande de iteraciones.
Estas reglas acoplan los atractores de las redes genéticas a los campos macroscópicos. La influencia de los genes en los campos se logra si uno usa un potencial que dependa de los genes, por ejemplo, los puntos fijos del potencial que necesitamos en este esquema son u = ±1, y escogeremos un nuevo potencial que se adapte a la GRNs. La forma más sencilla es suponer que la curvatura que se rige por la dinámica de u se relacionará con el estado de AP3. De esta forma el potencial que proponemos es:
R = R1 (1 - AP3) + R2 (AP3) (12)
donde R1 = (u + 1)2 y R2=(u -1)2, y será el que usaremos de ahora en adelante. En la Figura 5 mostramos un prototipo de los resultados obtenidos con este modelo usando los parámetros indicados en el pie de la figura.
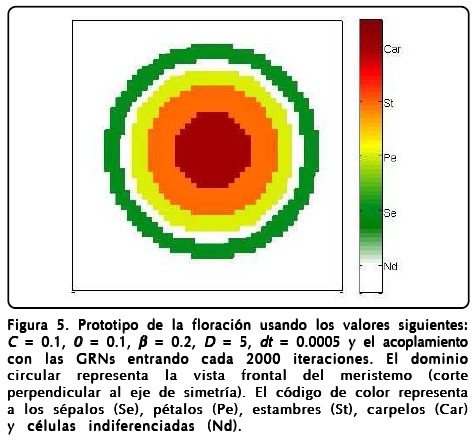
Mencionamos la robustez del modelo argumentando que reproducía patrones muy similares al cambiar los parámetros pero no mencionamos el papel que juegan dichos parámetros. Como es de esperarse el parámetro D hace que el perfil de u se forme más rápidamente o más lentamente. El parámetro ∈ regula la rapidez con que ø llega a encontrar el perfil de tangente hiperbólica, aunque también se relaciona con qué tan grande es la región de sépalos y carpelos, y la formación de estambres y pétalos. Sin embargo, entender qué papel juegan ß y la curvatura espontánea local C no es fácil, para ello hicimos varios cálculos numéricos, como los mostrados en la Figura 6, haciendo que C y ß tomaran valores extremos con las mismas condiciones iniciales y el mismo tiempo de aparición de la GNRs de la Figura 5. Los resultados más notables es que ambos parámetros regulan el ancho de los anillos de los primordios de sépalos (Se), pétalos (Pe), estambres (St), carpelos (Car) y la cantidad de células indiferenciadas (Nd).
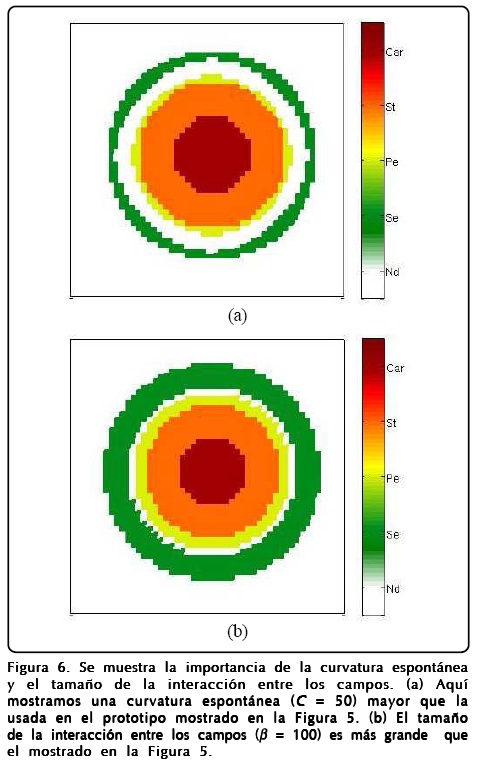
A pesar de la robustez del modelo, la interacción que tiene la GRNs es muy importante, ya que dependiendo de la escala de tiempo dT con la que interactúa con los campos se pueden obtener estructuras diferentes. Esto es debido a que la formación del perfil de ø se ve afectada y no alcanza su estado estacionario. Para mostrar esto hicimos que la GNRs actuara tres veces más rápido y así obtuvimos que los sépalos casi desaparecen y la estructura interna de la flor se modifica. La Figura 7 muestra estos resultados.
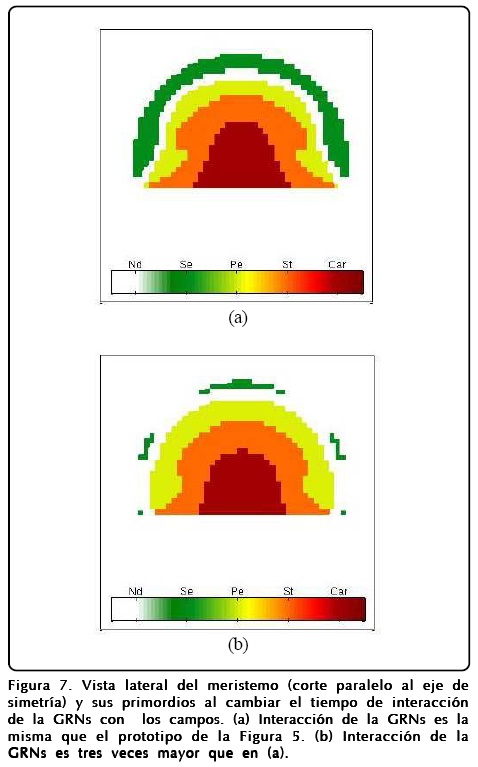
Estos primeros resultados de la coevolución espacial son importantes para construir un modelo que incluya la parte temporal también y que tome en cuenta la reproducción celular, y que es lo que expondremos enseguida.
Modelo de coevolución espacio-temporal (MCET)
Cuando hablamos de un modelo espacio-temporal estamos pensando en la distribución de los agentes biológicos cuando hay reprodución celular. En el caso de A. thaliana se conoce de forma aproximada el crecimiento celular en cada uno de los primordios del meristemo[17] y el cómo van cubriendo el espacio al reproducirse. Modelar la reproducción celular en el espacio de tres dimensiones es laborioso y complicado. Sin embargo, podemos simular el crecimiento del meristemo en un dominio bidimensional aprovechando la geometría cilíndrica del meristemo cambiando la escala en la que lo representamos, es decir, ver ahora a cada pixel como un representante de un grupo de células cada vez mayor.
La justificación de esto es pensando en que, cuando una célula se divide hace que el espacio donde conviven las células aumente en un factor de dos. Ahora bien, si consideramos una nueva "célula" formada por dos células después de la división veremos al mismo sistema inicial de un grupo de células en una escala diferente con las mismas propiedades y así consecutivamente encontramos una nueva "célula" que describe al mismo sistema. Esta nueva forma de ver la reproducción como un cambio de escala nos ayuda a acoplar el modelo de campo-fase con el crecimiento celular, pues para describir los cambios de escala no necesitamos saber la distribución espacial de cada célula, lo que nos deja la libertad de expresar la dinámica del crecimiento de los primordios como la interacción entre sus fronteras. Sabemos que los cambios de escala en ecuaciones conservativas no involucran términos extra en la cinética sino sólo factores de escala en la distribución espacial, que en nuestro caso representan la forma en que crecen los primordios.
Para construir nuestro modelo coevolutivo en el espacio-tiempo es necesario incorporar los cambios de escala en las ecuaciones dinámicas. Los estudios de Plaza et al.[18] en ecuaciones de reacción-difusión se pueden extender a nuestro caso modificando las ecuaciones dinámicas de forma análoga. La forma genérica de estos resultados con la dinámica de los campos acoplados ø y u es la siguiente:
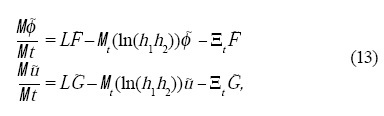
donde la tilde pone de manifiesto que la función depende del tiempo y de la forma del espacio, L es el operador Laplace-Beltrami, que en el caso de curvatura constante y crecimiento isotrópico en un plano se reduce al operador Laplaciano, h1 y h2 representa las direcciones de crecimiento del dominio, Ξt representa los cambios temporales de las h's multiplicados por el gradiente en la superficie y G y F = F1 + Fs son las funciones de las Ecs. 3. La esencia de este modelo genérico es que si conocemos la tasa de crecimiento podemos describir lo que les pasa a los campos en el espacio-tiempo.
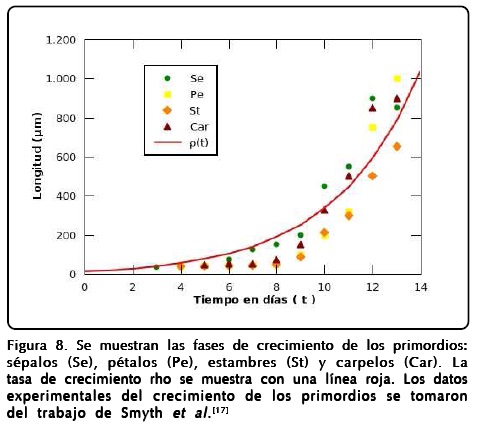
Analizando el trabajo de floración de Smyth et al.[17] notamos que el crecimiento de los primordios es homogéneo e isotrópico en sus primeras etapas y, por tanto, podemos poner las direcciones de crecimiento en función de una tasa de crecimiento exclusiva del tiempo como h1 = h2 = ρ (t), donde la función ρ (t) se puede ajustar a partir de los datos experimentales del crecimiento de los primordios. Cabe mencionar que las etapas descritas por los autores tienen un tiempo promedio de duración y con ello podemos relacionar el tiempo dT en que actúan los genes en cada órgano con la tasa de crecimiento ρ. Mediante un ajuste a todos los datos experimentales por mínimos cuadrados obtuvimos una expresión exponencial del tipo ρ (t) = A + Be(t/m) con A = -10.4, B = 22.5 y m = 3.6. Con estos números, el modelo podrá representar un crecimiento en que el tiempo dt que usaremos para describir la dinámica de los campos está en unidades de horas. El ajuste se muestra en la Figura 8.
Las ecuaciones dinámicas que obtenemos finalmente para nuestro modelo espacio-temporal son:
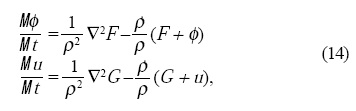
donde F = F1 + Fs y G son las mismas funciones presentadas en las Ecs.4, pero con la diferencia de que σ es constante, ya que el área se modifica en el crecimiento. Cabe mencionar que en el modelo se modificó el tiempo dT para que cada órgano dictado por la GNRs aparezca en el tiempo adecuado de acuerdo a los resultados de Smyth et al.[17]. De esta forma los sépalos entran entre el tercero y cuarto día de crecimiento cuando ρ ≅ 35, los pétalos y los estambres entran después del cuarto día cuando ρ ≅ 45 y los carpelos entran al quinto día cuando ρ ≅ 50.
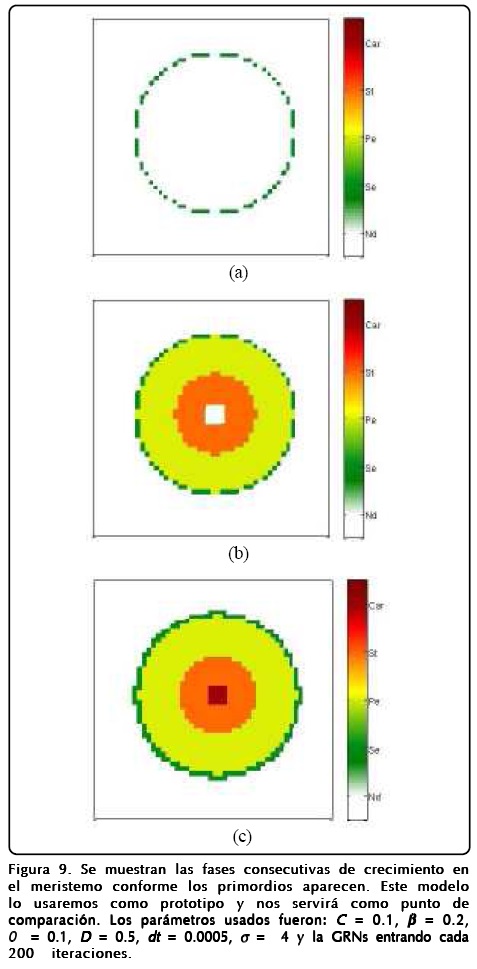
A continuación presentamos los resultados aplicados a la floración en A. thaliana. Las condiciones de frontera que hemos considerado en los cálculos numéricos son de no flujo, iniciando con un perfil de tangente hiperbólica ensanchado para el campo ø y u = 0 en todo el espacio. También cabe mencionar que el punto de referencia para el campo u con respecto a la sensibilidad de los genes lo cambiamos de cero a 0.1, esto fue debido a que el factor ρ/ρ G de las Ecs. 14 hace que el campo u se difunda a valores más positivos. En la Figura 9 mostramos la aparición de los primordios según el tiempo transcurrido. La importancia de esta figura es que los primordios aparecen en la misma distribución espacial y temporal que en los experimentos.
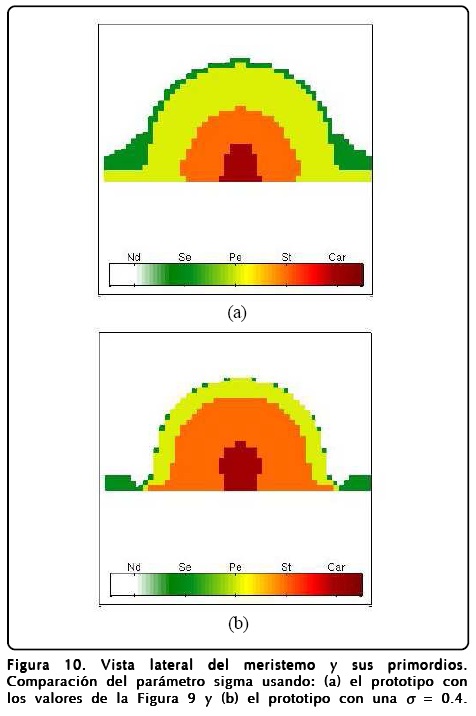
En la Figura 10 mostramos una vista lateral del meristemo y en la Figura 11b mostramos una vista frontal o apical de la simulación. En estas figuras expresamos la importancia de la relación área-volumen a través del parámetro σ haciendo una comparación entre valores chicos y grandes de éste. El resultado más notable es que el crecimiento de σ favorece la existencia de más sépalos. Otro punto a evaluar fue la D del campo u, esta situación la mostramos en la Figura 11c y el resultado más importante es que al aumentar D desaparecen los carpelos y los sépalos. También exploramos los parámetros ∈, C y ß pero éstos no presentaron cambios notables en la estructura de los primordios, lo cual dice que la robustez del modelo espacial mejora ahora que hay crecimiento.
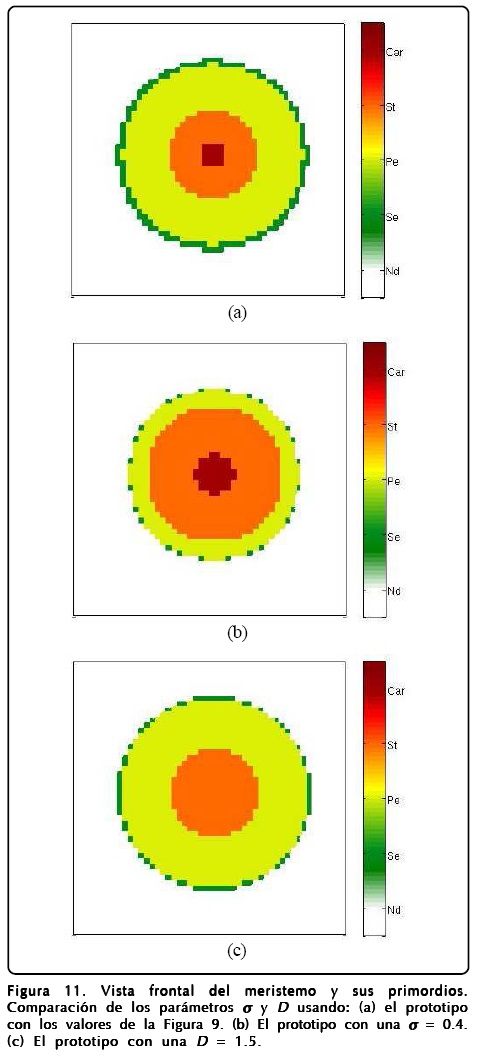
La robustez con la que operan los organismos biológicos es muy importante, pues les permite sobrevivir innumerables generaciones a pesar de los cambios repentinos en su medio ambiente. Esta propiedad fundamental parece estar plasmada en nuestro modelo, lo que lo hace válido para explicar el crecimiento de los primordios en la floración de A. thaliana. Sin embargo, no todos los parámetros del modelo reproducen primordios similares al variarlos, como hemos visto en la Figura 11, lo que nos deja caminos abiertos para tratar de entender las mutaciones que se llevan acabo en dicha planta e inclusive en otras plantas, variando la forma del campo u y su densidad de energía para crearse a partir de D, la relación área-volumen que nos da σ y el tiempo en que la GRNs interactúa con los campos. Para evaluar el poder predictivo de nuestro modelo decidimos investigar los mutantes que produce nuestro MCET cuando alguno de los genes falla. Para esto encontramos que en A. thaliana hay tres tipos de mutantes en estado silvestre: los mutantes de la clase A que se forman con carpelos y estambres y que además se encuentran en la secuencia "Car,St,Car", los mutantes de la clase B que se forma de sépalos y carpelos y que tienen la secuencia "Se,Car" y los de la clase C que se forman por "Se,Pe,Se". Nuestro modelo predice fácilmente los mutantes B y C, ya que sólo hay que inhibir los genes AP3 y AG, respectivamente. Sin embargo, la predicción del mutante A no es tan sencilla, pues la inhibición del gen AP1 muestra los primordios en una secuencia "St,Car" que es diferente a la del mutante tipo A. En este caso, los parámetros del modelo juegan su papel, pues encontramos que el mutante tipo A se puede lograr si se inhibe el gen AP1 y si se hace que el ancho de la interfase (∈) y la interacción (ß) entre los campos sean grandes cuando la GRNs actúa de forma más rápida. En otras palabras, la aparición del mutante tipo A implica un cambio muy grande en los parámetros del modelo, lo que lo hace en un sentido poco probable bajo la condición de apagar el gen AP1 al inicio de la simulación.
Sin embargo, explorando la GRNs encontramos que la activación perenne de ciertos genes también produce mutantes, esta situación nos hace ver que el mutante tipo A se produce con gran facilidad (dejando los parámetros con los que se calculan los mutante B, C y el prototipo de la Figura 9) si se deja prendido siempre el gen AG. En este sentido el MCET nos dice que la aparición del mutante tipo A no se debe a que hay una inhibición de AP1 directa, sino a una inhibición provocada por la activación de AG y que concuerda con el experimento[20]. Dentro de los nuevos mutantes que podemos predecir encontramos que la activación del gen AP1 nos da un mutante C modificado, que llamamos C+, en el cual hay una zona que queda indiferenciada, la que correspondería a los sépalos centrales del mutante tipo C, y que nos da como resultado que la correspondencia entre la activación-inhibición de AP1 y AG no sea biunívoca. La activación de AP3 da como resultado la aparición de pétalos y estambres en la secuencia del mutante tipo B si se intercambian los sépalos por pétalos y carpelos por estambres, a este mutante lo denotamos con el nombre de B+. Los resultados numéricos de los mutantes se encuentran en las Figuras 12 y 13.
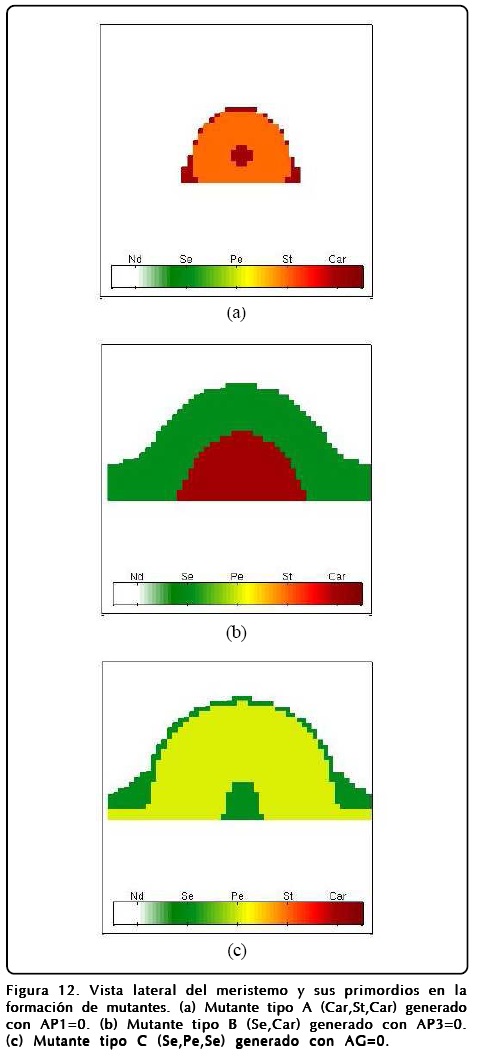
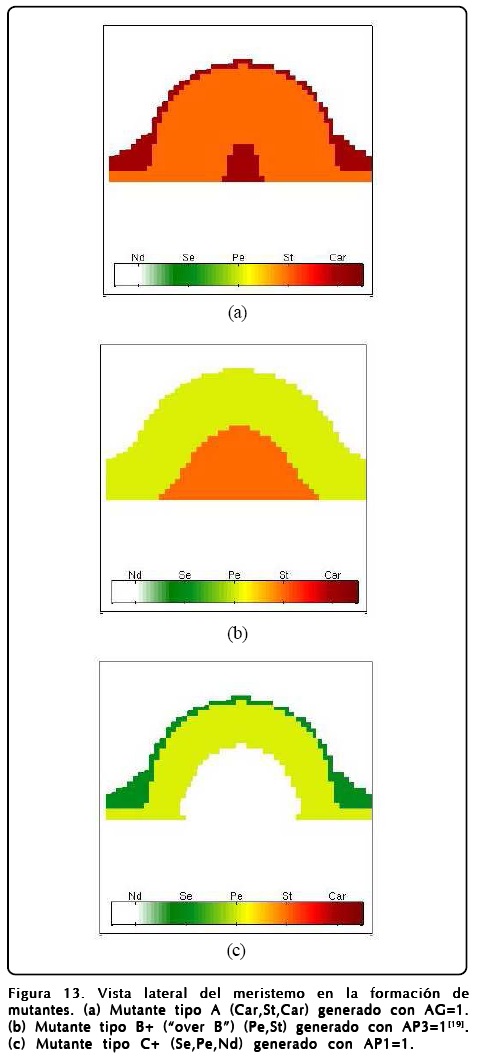
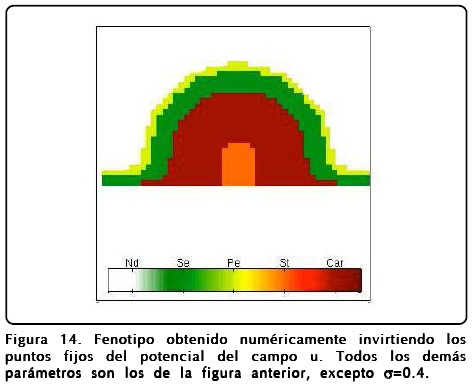
Como mencionamos antes, el papel que juega u es extremadamente importante y puede desviar el desarrollo floral normal. Un fenotipo interesante se puede obtener si se cambia el signo del potencial de u, o de forma equivalente intercambiar los puntos fijos R1 y R2 en la Ec. 12. El resultado que se obtiene es sorprendente y se muestra en la Figura 14, donde se muestra el resultado de un cálculo en donde se ha hecho esta inversión de u. Como puede observarse la disposición de los órganos reproductivos está invertida, así mismo los sépalos ocupan la posición de los pétalos y viceversa.
Conclusiones
Hemos descrito un modelo de coevolución entre dos sistemas dinámicos interactuantes que puede ser utilizado para investigar el problema de diferenciación celular en general. El modelo no propone dinámicas específicas para los sistemas, sino que simplemente se basa en la idea fundamental de que es necesario que las células indiferenciadas del tejido embrionario reciban la información espacio-temporal necesaria para decidir su destino final. El modelo ha sido detalladamente expuesto para tratar el caso de la floración de Arabidopsis thaliana. Hemos aprovechado el amplio conocimiento que se tiene tanto de los mecanismos biomoleculares como del desarrollo del meristemo en este organismo.
El modelo ha sido desarrollado en pasos, proponiendo el modelo espacial que describe la dinámica de los campos macroscópicos que se acoplan a las redes genéticas de cada célula para darles la información espacial que requieren. Esta parte se basó principalmente en las ideas expuestas por el famoso modelo ABC y con la simplificación de la GRN inferidas de los datos experimentales. Este modelo simple por sí solo es capaz de reproducir la conformación de anillos concéntricos de los órganos que se observan experimentalmente.
Finalmente, incorporamos la evolución temporal del proceso suponiendo que la reproducción celular resulta en el crecimiento isotrópico del meristemo. Derivamos las ecuaciones dinámicas del sistema en esta situación y ajustamos los parámetros para reproducir la aparición de los órganos en el lugar y el tiempo adecuados. Provistos de estos resultados examinamos el poder predictivo de nuestro modelo estudiando todas las posibilidades de mutaciones y fuimos capaces de reproducir todas las variedades mutantes en estado silvestre[21] y otras aún no encontradas como la C+ y la inversión de órganos por pares.
El caso del mutante A es interesante, pues nuestro modelo predice que es difícil de obtener y que además puede producirse por causas diferentes. Cabe mencionar que las condiciones que nuestro modelo predice, que son: ya sea AP1 = 0, o AG = 1, son afines a las condiciones que se han investigado experimentalmente para obtener este mutante. En un artículo por Mitzukami y Ma[20] se menciona que el mutante A se logra en el laboratorio, activando anticipadamente AG desde el principio de la floración.
Agradecimientos
Rafael Ángel Barrio y Aurora Hernández-Machado agradecen el financiamiento de Conacyt a través del proyecto No. 79641. Rafael Ángel Barrio agradece la hopitalidad en la Universidad de Barcelona. Elena Álvarez-Buylla agradece el financiamiento a través de los siguientes proyectos: CONACyT No. 81542: "Papel de genes MADS-box en la homeostasis celular. Meristemos de Arabidopsis thaliana como sistema modelo", PAPIIT IN229009-3: "Mecanismos moleculares y consecuencias morfogenéticas del mantenimiento de nichos celulares madres: Arabidopsis thaliana como sistema modelo", CONACyT: Red Temática CONACyT de Investigación: Complejidad, Ciencia y Sociedad. José Roberto Romero-Arias agradece al CONACyT por una beca de posgrado. Aurora Hernández-Machado agradece la hospitalidad en la UNAM y a la Dirección General de Investigación (España) por el proyecto FIS2009-12964-C05-02.
Referencias
1. Scheres, B. Plant Cell Identity. The role of position and lineage. Plant Physiol. 135, 112-114 (2001). [ Links ]
2. Von Dassow, G., Meir, E. & Munro, E.O. The segment polarity network is a robust developmental module. Nature 406, 188-192 (2000). [ Links ]
3. Espinosa-Soto, C., Padilla-Longoria, P. & Álvarez-Buylla, E.R. A gene regulatory network model for cell-fate determination during Arabidopsis thaliana flower development that is robust and recovers experimental gene expression profiles. The Plant Cell 16, 2923-2939 (2004). [ Links ]
4. Álvarez-Buylla, E. et al. Floral morphogenesis: Stochastic explorations of gene network epigenetic landscape. PLoS ONE 3 (2008). [ Links ]
5. Benítez-Alfonso, Y. et al. Control of Arabidopsis meristem development by thioredoxindependent regulation of intercellular transport. Proceedings of the National Academy of Sciences 106, 3615-3620 (2009). [ Links ]
6. Hamant, O. et al. Developmental patterning by mechanical signals in Arabidopsis. Science 132, 1650-1655 (2008). [ Links ]
7. Coen, E. & Meyerowitz, E. The war of the whorls: genetic interactions controlling flower development. Nature 353, 31-37 (1991). [ Links ]
8. Mendoza, L. & Álvarez-Buylla, E.R. Dynamics of the genetic regulatory network for Arabidopsis thaliana flower morphogenesis. J. Theor. Biol. 193, 307-319 (1998). [ Links ]
9. Kwiatkowska, D. Flowering and apical meristem growth dynamics. Journal of Experimental Botany 59, 187-201 (2008). [ Links ]
10. Kwiatkowska, D. Flower primordium formation at the Arabidopsis shoot apex: quantitative analysis of surface geometry and growth. Journal of Experimental Botany 57, 571-580 (2006). [ Links ]
11. Kwiatkowska, D. Surface growth at the reproductive shoot apex of Arabidopsis thaliana pin-formed 1 and wild type. Journal of Experimental Botany 55, 1021-1032 (2004). [ Links ]
12. Szczesny, T., Routier-Kierzkowska, A.-L., & Kwiatkowska, D. Influence of clavata3-2 mutation on early development in Arabidopsis thaliana: quantitative analysis of changing geometry. Journal of Experimental Botany 60, 679-695 (2009). [ Links ]
13. Chaos, A. et al. From genes to flower patterns and evolution: dynamics models of gene regulatory networks. Journal of Plant Growth Regulation 25, 278-289 (2006). [ Links ]
14. Campelo, F. Shapes in Cells. PhD thesis, Universidat de Barcelona (Disponible en la red ) (2008) 236 págs. [ Links ]
15. Barrio, R.A., Hernández-Machado, A., Varea, C., Romero-Arias, J.R. & Álvarez-Buylla, E. Flower development as an interplay between dynamical physical fields and genetic networks. PLoS ONE 5(10) (2010). [ Links ]
16. Sablowski, R. Flowering and determinacy in Arabidopsis. Journal of Experimental Botany 58, 899-907 (2007). [ Links ]
17. Smyth, D.R., Bowman, J.L. & Meyerowitz, E.M. Early flower development in Arabidopsis. The Plant Cell 2, 755-767 (1990). [ Links ]
18. Plaza, R., Sánchez-Garduño, F., Padilla, P., Barrio, R.A. & Maini, P.K. The effect of growth and curvature on pattern formation. Journal of Dynamics and Differential Equations 16, 1093-1121 (2004). [ Links ]
19. Goto, K. Molecular and genetic analyses of flower homeotic genes of Arabidopsis. J. Biosci. 21(3), 369-378 (1996). [ Links ]
20. Mitzukami, Y. & Ma, H. Determination of Arabidopsis floral meristem identity by agamous. The Plant Cell 9, 393-408 (1997). [ Links ]
21. Bowman, J.L., Smyth, D.R. & Meyerowitz, E.M. Genetic interactions among floral homeotic genes of Arabidopsis. Development 112, 1-20 (1991). [ Links ]
Información sobre los autores
José Roberto Romero-Arias
José Roberto Romero-Arias se graduó como Físico en la Facultad de Ciencias. UNAM, actualmente estudia la Maestría en Ciencias Físicas en la UNAM. Los resultados de su tesis de licenciatura fueron publicados en la revista Physical Review. Colaboró en la Dirección General de Divulgación de la Ciencia de la UNAM, en el museo de ciencias Universum, y es miembro activo del grupo de divulgación científica "Nautilus" de la Facultad de Ciencias, UNAM.
Rafael Ángel Barrio
Rafael Ángel Barrio obtuvo su licenciatura y dos maestrías en la UNAM, su doctorado en Física Teórica en la Universidad de Oxford UK y ha trabajado en la UNAM por 36 años, primero en el Instituto de Investigaciones en Materiales y actualmente en el Instituto de Física. Es Profesor Honorario (Adjunt Professor) del Centre of Excellence in Computational Complex Systems Research de la Universidad Aalto, Helsinki, Finlandia. Actualmente coordina el proyecto Patterning, Segregation and Differentiation in Complex Networks, en el que participan la UNAM, la Universidad de Barcelona, la Universidad de Oxford y la Universidad de Helsinki. Es nivel III del SNI.
Elena Álvarez-Buylla Roces
Elena Álvarez-Buylla Roces estudió la carrera de Biología y cursó la Maestría en Ciencias en la Facultad de Ciencias de la UNAM, estudió el Doctorado en Ciencias (Genética y Botánica) en la Universidad de California, Berkeley, USA, y el posdoctorado en la misma universidad en Genética Molecular de Plantas. Actualmente está adscrita al Instituto de Ecología. UNAM, como Jefa del Departamento de Ecología Funcional y dirige el Laboratorio de Genética Molecular, Desarrollo y Evolución de Plantas. Es Académica de Tiempo Completo Titular "C" y nivel III del SNI.
Ha publicado más de 160 artículos en revistas internacionales de alto impacto, con cerca de 3,000 citas.
Sus publicaciones sobre la presencia y dispersión de transgenes, en particular del maíz en México, han sido reseñados por las mejores revistas científicas del mundo, como "Nature". Su área de especialidad comprende desde biología molecular, modelos computacionales, conservación de los recursos biológicos y bioseguridad, así como genética molecular del desarrollo de plantas.
Ha impartido conferencias magistrales, cursos y realizado estancias de investigación en el Santa Fe Institute for Complex Studies, University College de Londres, la Universidad de Barcelona, California Institute of Technology, entre otros.
Ha recibido varias distinciones como son: la Medalla "Gabino Barreda", el Premio "Universidad Nacional-Jóvenes Académicos (UNAM)", el Premio de la Academia Mexicana de Ciencias en Ciencias Biológicas, el Reconocimiento "Sor Juana Inés de la Cruz", el Premio de la Sociedad Americana de Botánica (American Botanical Society), el Premio Ciudad Capital. "Heberto Castillo Martínez", el Premio "Blanca Elena Jiménez Cisneros", el de la "American Naturalist Society" a jóvenes y la "Freund Foundation Visiting Ecologist Program for outstanding scholars".
Fue miembro del Consejo Consultivo de Bioseguridad de México, es miembro del "Faculty of 1000" desde su creación, miembro de la Delegación México de Las Conferencias PUGWASH para evitar el uso bélico de la ciencia y miembro fundador y actual Presidenta de la Unión de Científicos Comprometidos con la Sociedad.
Carmen Varea
Carmen Varea es Doctora en Ciencias por la Universidad de California en Berkeley. Actualmente, trabaja como Investigadora titular "C" en el Instituto de Física de la UNAM. Sus principales líneas de investigación son: la mecánica estadística de sistemas inhomogéneos, la formación de patrones, las cinéticas en sistemas físicos, químicos, biológicos y humanos, y la Física del estado Sólido. Es miembro del SNI nivel III.
Ha colaborado con artículos en diversas publicaciones internacionales y recibió, en 1996, el Premio de investigación de la Sociedad Mexicana de Física.
Aurora Hernández-Machado
Aurora Hernández-Machado es Profesora de la Universidad de Barcelona desde 1987. Su investigación se centra en el estudio biofísico de membranas biológicas, fluidos biológicos en microfluídica y nanoestructuras.














