ANTECEDENTES
La deficiencia de hierro es la principal causa de anemia en el mundo. En 2010 se estimó que, aproximadamente, un tercio de la población (32.9%) la sufría. Los grupos más afectados son los niños menores de cinco años y las mujeres en edad reproductiva. En observaciones posteriores se confirmó que la gestación es la condición de mayor riesgo (46%).1,2 En 2019 se estimaron 1.8 mil millones (IC95%: 1.7-1.8) de personas afectadas. La anemia contribuyó a 50.3 millones de años vividos con discapacidad (IC95%: 33.4 -73.4), lo que refleja la repercusión de la anemia en indicadores de calidad de vida y funcionalidad.3
La prevalencia de esta deficiencia tiene variaciones importantes según la región. Es más pronunciada en países con acceso limitado a la atención médica, carencia de programas de fortificación nutricional o altos índices de pobreza. América Latina, Haití y Panamá exhiben las tasas más elevadas de anemia en mujeres en edad reproductiva (40 y 45.5%, respectivamente), mientras que Chile registra la prevalencia más baja (5.1%). Colombia, El Salvador, Costa Rica, Nicaragua, Ecuador, México, Perú y Argentina se sitúan en un rango de prevalencia moderada, entre 7.6 y 18.7%.4
En México, la prevalencia de anemia en mujeres embarazadas alcanza el 27.8%, ligeramente más alta en áreas rurales en comparación con las urbanas (28 en comparación con 27.7%). Además, se observa una disparidad regional, con tasas más elevadas en el sur del país (23.2%) en contraste con la Ciudad de México (16.4%).5
Casanueva y colaboradores6 hicieron un análisis de diversos estudios observacionales y registros epidemiológicos en México, de 1939 al 2005. A pesar de una disminución en la prevalencia de anemia en mujeres embarazadas (del 35 al 25%), ésta sigue siendo un problema de salud pública. Se estima que se necesitarían 121 años de políticas públicas para su erradicación completa.
Monárrez y colaboradores7 examinaron esta prevalencia en una comunidad rural compuesta, mayormente, por mujeres de la sierra Tarahumara, del Municipio de Guachochi, Chihuahua. Identificaron que las mujeres en el tercer trimestre del embarazo o que amamantaron a sus hijos durante un periodo de seis meses tuvieron una prevalencia más alta de anemia (38.5 y 42.9%, respectivamente).
Esa condición repercute, significativamente, en la salud del recién nacido porque la mayor parte de su reserva de hierro proviene de los depósitos de la madre, al nacer. Si bien parte de esa necesidad se suple durante la lactancia, puede afectarse en madres anémicas o que resultan con anemia en el periodo posparto.8 En el ámbito global se estima que la anemia contribuye con 115,000 muertes maternas y 591,000 muertes perinatales al año, debido principalmente al aumento del riesgo de complicaciones hemorrágicas y de infecciones, derivado del deterioro del sistema inmunitario innato.9
En el organismo, el hierro se encuentra en dos compartimentos distintos: el funcional, que comprende diversos compuestos: hemoglobina, mioglobina, transferrina y las enzimas que requieren hierro como cofactor o grupo prostético, ya sea de forma iónica o como grupo hemo. El segundo compartimento es el de depósito, conformado por la hemosiderina y la ferritina, esta última es la principal reserva corporal de este metal. Su pérdida no solo repercute en la cantidad de hematíes sino también en el correcto funcionamiento del sistema inmunológico, en especial de la inmunidad innata.10
El hierro corporal de un individuo sano de 70 kg es de, aproximadamente, 50 mg/kg, lo que equivale a 3.5 a 4 g en la mujer y de 4 a 5 g en el hombre. Este micronutriente esencial se requiere para una adecuada función eritropoyética, para el metabolismo oxidativo y la respuesta celular.
La mayor parte del hierro se distribuye en la hemoglobina (65% alrededor de 2300 mg). Aproximadamente el 15% está contenido en la mioglobina y enzimas, mientras que el 20% se encuentra como hierro de depósito. Solo del 0.1 al 0.2% se encuentra unido a la transferrina.11
Durante la gestación, la placenta es el principal órgano que regula el metabolismo del hierro hacia el feto. Contiene numerosos receptores de transferrina (TFR1) del lado materno y ferroportina (FPN) del feto. Este delicado equilibrio se modifica en cada etapa del embarazo. Se utilizan cerca de 1200 mg de hierro de la reserva, lo que implica un mayor riesgo de anemia, sobre todo durante el tercer trimestre (30% en el tercer trimestre en comparación con 7% en el primer trimestre).12,13
A diferencia de las mujeres en edad reproductiva, los síntomas durante el embarazo suelen ser inespecíficos: fatiga, pica, edema, disnea y caída del cabello.14 Además, algunos parámetros de laboratorio útiles para el diagnóstico, como la ferritina, requieren una modificación (se considera un valor de ferritina menor a 30 µg/L para el diagnóstico), antes y después del parto.15 Cuadro 1
Cuadro 1 Estudios de laboratorio para evaluar el hierro
| Examen | Valor normal (adultos) | Déficit de hierro | Deficiencia funcional de hierro | Anemia por déficit de hierro | IRIDA | Anemia por enfermedad crónica | Anemia por déficit de hierro y enfermedad crónica |
|---|---|---|---|---|---|---|---|
| Hierro sérico (μmol/L) | 10-30 | ↓ | N/↓ | ↓ | ↓ | ↓ | ↓ |
| Saturación de Transferrina (%) | 16-45 | ≥16 | N/↓ | ˂16 | ˂10 | N/↓ | N/↓ |
| Ferritina (μg/L) | 20-200 (M) 40-300 (H) | ˂30 | N | ˂12 | Variable | ˃100 | ˂100 |
| Hb (g/dL) | ˃12 (M) ˃13 (H) | N | N | ↓ | ↓ | ↓ | ↓ |
| VCM (fl) | 80-95 | N | N | ˂80 | ↓↓ | N/↓ | ↓ |
| HCM (pg.) | 27-34 | N | N | ˂27 | ↓↓ | N/↓ | ↓ |
| Test en investigación | |||||||
| sTFR (ng/mL) | * | ↑ | ↑ | ↑ | ↑ | N/↑ | Variable |
| Indice sTFR/log Ferritina | * | NA | NA | ˃2 | NA | ˂1 | ˃2 |
| Hepcidina | * | ≤10 | ↓ | ↓↓ | N/↑ | ↑ | N/↑ |
| Protoporfirina Zinc (ZPP) | N | ↓ | ↑ | ↑ | ↑ | ↑ | |
| Contenido de Hb reticulocitaria (pg.) | 31.2 ± 1.6 pg | ˂25 | ˂29 | ↓ | ↓ | ↓ | ↓ |
| Tinción de Perls en MO | Negativo | Negativo | Negativo | Negativo | Positiva | Muy positiva | Positiva |
IRIDA = Anemia por déficit de hierro resistente a hierro; sTFR = Receptor soluble de transferrina; MO = médula ósea; M = mujeres; H = hombres; Hb = hemoglobina; VCM = volumen corpuscular media; HCM = hemoglobina; n = normal; * = los valores normales dependen del método utilizado.
Tanto la reserva como la distribución del hierro se ven influidas por el mecanismo de absorción intestinal y el almacenamiento en forma de ferritina. Esto ha llevado al desarrollo de diferentes formulaciones de hierro con un mayor potencial de absorción.
METODOLOGÍA
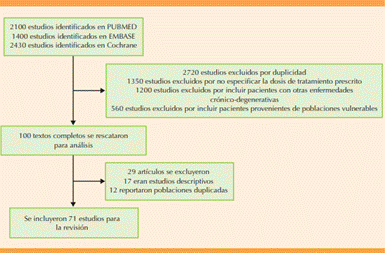
Búsqueda sistemática de bibliografía de estudios retrospectivos y prospectivos en las bases de datos de PubMed, EMBASE y Cochrane de junio 1990 a junio 2024. Se utilizaron los siguientes términos de búsqueda: mechanism AND iron deficiency; anemia AND iron deficiency; oral treatment AND iron deficiency; liposomal iron AND anemia; metabolism AND iron; intolerance AND iron. Se hizo un análisis detallado de ensayos clínicos aleatorizados que incluyeron pacientes con diagnóstico de anemia por deficiencia de hierro. Los estudios seleccionados se evaluaron en relación con los mecanismos de acción de los tratamientos, eficacia, tolerabilidad y perfil de seguridad.
Se revisaron series de casos que describieran la sinergia de nuevas opciones terapéuticas en pacientes con anemia por deficiencia de hierro. La búsqueda bibliográfica se efectuó independientemente por dos autores; las discrepancias entre ambos se resolvieron por consenso.
Criterios de inclusión: 1) Diseño de ensayos clínicos aleatorizados o serie de casos; 2) pacientes con anemia asociada con deficiencia de hierro; 3) utilización de algún tipo de tratamiento (oral, liposomal, etc.; 4) ≥ 18 años.
Criterios de exclusión: 1) Estudios con pacientes con algún otro tipo de enfermedad crónico-degenerativa; 2) pacientes pertenecientes a poblaciones con discapacidad o vulnerables; 3) pacientes con dosis no debidamente indicadas. Todos los resúmenes y textos completos se analizaron para su elegibilidad por dos de los autores de este estudio. Figura 1
Mecanismos de absorción del hierro
La absorción tiene lugar, principalmente, en el duodeno y la primera porción del yeyuno (1 a 2 mg al día). La proporción de hierro elemental que se absorbe es, aproximadamente, del 15 al 20% y se obtiene, principalmente, de dos formas: ligada al grupo hemo y no ligada a éste. El hierro hemo se encuentra en alimentos de origen animal: carnes rojas, pollo y pescado, en forma de hemoglobina o mioglobina, y se absorbe, eficientemente. El hierro no hemo o inorgánico se encuentra en productos de origen vegetal y algunos de origen animal, como leche y huevo; este último se absorbe de una forma menos eficaz (menos del 2%).16
El hierro no hemo o inorgánico de la dieta se encuentra en forma oxidada (Fe3+). En el borde apical del enterocito existe una enzima con actividad ferro reductasa (citocromo b duodenal, Dcytb), que convierte el hierro férrico (Fe3+) en ferroso (Fe2+): la forma química soluble que atraviesa la membrana de la mucosa intestinal. Para su transporte, se requiere una proteína transportadora de metales divalentes 1 (DMT1), que también transporta otros iones metálicos: zinc, cobre y cobalto mediante un mecanismo de protones acoplados. En los túbulos renales también se encuentra la proteína DMT1, lo que sugiere su posible participación en la absorción de hierro en ese órgano.17
El hierro en el enterocito puede seguir dos caminos: una pequeña parte se almacena unida a la ferritina, mientras que el resto atraviesa la membrana basolateral del enterocito para ingresar a la circulación y unirse a la transferrina.
Este proceso requiere una delicada coordinación entre la ferritina, la ferroportina y la transferrina y se regula a través de diferentes proteínas reguladoras del hierro (IRP1 y IRP2) y elementos de respuesta al hierro (IRE). Estas proteínas reguladoras del hierro también son reguladas y estimuladas por la hipoxia, al igual que en el enterocito y macrófago, que lo hace hormonalmente por la hepcidina.18,19
La absorción del hierro no hemínico es sumamente influida por la composición de la dieta, como indica el hecho de que el consumo de carne o ácido ascórbico (vitamina C) mejora la biodisponibilidad del hierro no hemínico. Una dieta que contenga calcio (productos lácteos), taninos (tes) o fitatos (dietas ricas en fibra) y la administración de medicamentos, como: tetraciclinas, inhibidor de la bomba de protones y antiácidos, pueden disminuir la absorción del hierro.20,21
Las proteínas expresadas por el enterocito, DMT1, Dcytb, ferritina y el TfR-1 contienen en su ARNm elementos de respuesta al hierro (IREs) que regulan la cantidad de proteína que se traduce y, por tanto, la cantidad de hierro que debe absorberse en el intestino en respuesta a los cambios en los depósitos corporales de hierro. El enterocito recibe información del estado de esos depósitos a través de la interacción de la Tf-diférrica con el TfR-1 de la membrana basolateral; información que es recibida por las proteínas reguladoras del hierro (IRP-1 e IRP-2).(22
En condiciones de pérdida intracelular de hierro, ambos IRP actúan y se unen a los IREs con alta afinidad. La unión de un IRP al IREs del ARNm de la ferritina impide su traducción, mientras que su unión a los IREs de los ARNm de la transferrina (Tf) y DMT1 (proteína transportadora de metales divalentes-1) los estabiliza, lo que resulta en una traducción más eficiente. Cuando las concentraciones intracelulares de hierro aumentan, los IRPs se disocian de los IREs y, además, el IRP-2 se degrada por el proteosoma. Esto deriva en una disminución en la expresión de TfR-1 (receptor de la transferrina-1) y DMT1, lo que inhibe el transporte apical de Fe2+, mientras que aumenta la expresión de ferritina.23 Varios tipos de proteínas muestran una alta afinidad por el hierro; la hemoglobina y mioglobina son las principales, seguidas de los citocromos, mieloperoxidasa y el óxido nítrico sintetasa.24
En la actualidad, la hepcidina se considera el principal regulador del equilibrio del hierro sistémico, que incluye la absorción de hierro intestinal y el reciclaje del que se encuentra en el sistema reticuloendotelial. La hepcidina (SLC40A1) es una proteína compuesta por 25 aminoácidos que actúa al unirse con la ferroportina, lo que desencadena su internalización y posterior degradación lisosómica.25,26
Puesto que la ferroportina es la proteína conocida por exportar el hierro celular, la hepcidina provoca el atrapamiento del hierro en los enterocitos, así como en los macrófagos y hepatocitos. La producción hepática de hepcidina está regulada por el grado de saturación de la transferrina y las concentraciones de receptores de transferrina (TfR) 1 y 2 en el hígado.27
Cuando la relación entre transferrina diférrica (TF-diférrica) y TfR aumenta, se induce la expresión de hepcidina, lo que inhibe la actividad de la ferroportina-1 y, por lo tanto, el transporte basolateral de hierro. Existen datos que sugieren que la hepcidina puede inhibir el DMT1 en lugar de la ferroportina-1. Por el contrario, cuando la relación TF-diférrica-TfR disminuye, cesa la producción hepática de hepcidina y se restaura la absorción del hierro.28
La transferrina puede unir hasta dos átomos de hierro, por lo que el índice de saturación de transferrina (IST) normalmente se sitúa entre el 30 y 35%. La transferrina transporta el hierro hasta las células, especialmente a los precursores eritropoyéticos de la médula ósea. El IST es un factor que regula la intensidad de la eritropoyesis, disminuye de manera importante cuando el IST es inferior al 16%. Por el contrario, cuando el IST es mayor al 90%, el hierro transportado por la transferrina se desvía hacia el hígado, lo que puede originar hemosiderosis hepática.29 El metabolismo y la distribución del hierro pueden interpretarse a través de los valores de la cinética de hierro y diferentes índices que surgen derivados de su análisis.
Tratamiento nutricional
La calidad de la dieta es un factor determinante del contenido nutrimental. La dieta actual tiene concentraciones bajas no solo de hierro, sino también de zinc, calcio, magnesio, entre otros microelementos, lo que ha impulsado la fortificación de alimentos.30,31 Sin embargo, en México aún se observa deficiencia de hierro en poblaciones en riesgo, como las mujeres embarazadas, niños y adolescentes.32 De forma general, la ingesta diaria recomendada (IDR) de hierro en hombres y en mujeres posmenopáusicas es de 10 a 11 mg al día (para mujeres menstruantes es de 20 mg al día), mientras que para mujeres embarazadas es de 50 mg al día. Gran parte se adquiere de carnes y pescados (hígado de ternera 20 a 100 mg de tejido).33
Skolmowska y colaboradores,34 en una revisión sistemática, evaluaron la eficacia de la dieta como tratamiento de la anemia por deficiencia de hierro. De los 14 estudios analizados, gran parte incluyeron el incremento en el aporte de hierro o la suplementación con vitamina C. Se demostró que esta estrategia es efectiva, lo que sugiere la importancia del aporte nutricional en el tratamiento de la deficiencia de hierro. Las frutas y verduras son ricas en vitamina C (guayaba, fresa, kiwi, mandarina, papaya, toronja, naranja, limón, brócoli, pimiento, jitomate, quelites, huazontles) y pueden incorporarse al tratamiento nutricional de la deficiencia de hierro.
Tratamiento farmacológico de la anemia por deficiencia de hierro
El tratamiento debe iniciarse tan pronto se identifique la deficiencia. Si bien el objetivo es corregir la anemia, lo principal es recuperar la reserva de hierro medida a través de la ferritina (concentración superior a 100 mg/L), evitar las transfusiones y las complicaciones asociadas con la anemia.35 La deficiencia de hierro es la principal causa de anemia en mujeres en edad reproductiva y en el contexto perioperatorio. Su reposición puede ser oral o parenteral.36
Las formulaciones orales son las estrategias más utilizadas a través de diferentes sales ferrosas. Algunos expertos recomiendan que la dosis de hierro elemental debe de ser entre 150 y 200 mg al día. Su disponibilidad está limitada a la capacidad de absorción y a la velocidad de incorporación a los precursores eritroides.37 Las sales utilizadas con más frecuencia son: sulfato ferroso, fumarato ferroso, gluconato ferroso con un perfil de viabilidad similar; se pueden aumentar a través de diferentes facilitadores, como el ácido ascórbico.38
En el Cuadro 2 se mencionan las principales formulaciones de hierro por vía oral disponibles en la actualidad.
Cuadro 2 Formulaciones de hierro por vía oral
| Nombre Genérico | Presentación | Hierro Elemental | Dosis máxima recomendada | Categoría en embarazo | Efectos Adversos (%) | Indicación | Disponibilidad en México |
|---|---|---|---|---|---|---|---|
| Sulfato ferroso | Tableta 200 mg | 65.74 mg | 200 mg/día | A | Dolor abdominal, heces de coloración negra, sabor metálico, estreñimiento | Anemia DH, embarazo | Disponible |
| Fumarato ferroso | Tableta 200 mg | 65.74 mg | 200 mg/día | Sin asignación | Anemia DH, embarazo | Disponible | |
| Hierro carbonilo | Cápsula 18.4 mg | 18 mg | 18.4 mg/día | Sin asignación | Estreñimiento | Anemia DH, embarazo | Disponible |
| Hierro succinilinato | Solución 15 mL | 40 mg | 15-30 mL/día | Sin asignación | Epigastralgia, náusea | Anemia DH | Disponible |
| Combinaciones | |||||||
| Fumarato ferroso, ácido ascórbico, ácido fólico, cianocobalamina | Tableta 350 mg | 115 mg | 350 mg/día | Sin asignación | Náusea, vómito | Anemia DH, embarazo | Disponible |
| Sulfato Ferroso, ácido ascórbico, ácido fólico, ácidos grasos omega 3, vitamina b3, ácido pantoténico, vitamina E | Tabletas 42.5 mg | 14 mg | 42.5 mg/día | Sin asignación | No reportados | Embarazo | Disponible |
| Sulfato ferroso, ácido ascórbico, ácido fólico, cianocobalamina, cobre, sulfato de omega, ácidos grasos, óxido de zinc, piridoxina, riboflavina, selenato de sodio, tiamina, colecalciferol, vitamina E | Tabletas 15.4 mg | 5 mg | 15.4 mg/12horas | Sin asignación | No reportados | Embarazo | Disponible |
| Hierro polimaltosado, ácido fólico | Tableta 100mg/800 mcg | 100 mg | 100 mg/día | Sin asignación | No reportados | Embarazo | Disponible |
| Hierro aminoquelado, ácido fólico | Tableta 30mg/0.500 mg | 30 mg | 30 mg/día | Sin asignación | Epigastralgia | Embarazo | Disponible |
| Hierro liposomado, ácido fólico | Cápsula 179 mg | 15 mg | 179 mg/día | Sin asignación | No reportados | Anemia DH, embarazo | Disponible |
| Hierro liposomado, fibra, ácido ascórbico | Polvo | 19.2 mg | 1 sobre al día | Sin asignación | No reportados | Anemia DH, embarazo | Disponible |
DH=Déficit de hierro.
Posterior a la ingesta de sales ferrosas, el hierro que no se absorbe es el responsable de las principales complicaciones gastrointestinales relacionadas con el tratamiento que, en casos agudos, reducen de forma significativa el apego al tratamiento.39 Las manifestaciones intestinales son variadas (su frecuencia varía hasta en un 75%) e incluyen: estreñimiento, diarrea, sabor metálico, irritación gástrica y cambios en la coloración de las heces. Estas manifestaciones pueden reducirse si se modifican los intervalos de administración del fármaco (por ejemplo cada 48 a 72 horas).40
Si bien la suplementación está indicada en todos los casos de anemia por deficiencia de hierro, también debe iniciarse en personas de riesgo: mujeres embarazadas o con un descenso en el valor de la ferritina.
El objetivo principal del tratamiento es el ascenso progresivo de la hemoglobina, disminuir los síntomas asociados con la anemia y mejorar la capacidad cognitiva. Siempre hay que considerar los eventos adversos gastrointestinales que limitan el apego a su toma.41 A pesar de esto debe considerarse que un tercio de los casos tienen un apego deficiente, en especial las embarazadas y los pacientes pediátricos.42
Posterior al inicio del tratamiento se espera un aumento promedio de 1 g/dL de hemoglobina en las primeras dos semanas. En los casos sin esta respuesta es necesario reconsiderar si la suplementación es insuficiente o si aún no se han controlado las pérdidas: sangrado uterino disfuncional o hemorragia digestiva.43
Debido a los eventos adversos, diversos grupos han modificado los intervalos de administración del hierro. Jongkraijakra y colaboradores44 compararon la administración de 200 mg de fumarato ferroso tres veces a la semana en comparación con tres veces al día, sin encontrar diferencias en la respuesta (72.0%, IC95%: 56.6-88.5 en comparación con 71.9%, IC95%: 53.3-86.3, p = 0.777), pero con una menor proporción de eventos adversos. Estos hallazgos se han reproducido en otras situaciones, como la lactancia, en donde una suplementación de 300 mg de fumarato ferroso (60 mg de hierro elemental) es igual de eficaz una vez a la semana que diariamente pero con disminución de los eventos adversos, en especial los gastrointestinales.45
Fernández-Gaxiola,46 en una revisión Cochrane, analizó los resultados de diferentes ensayos (25 estudios con 10,996 mujeres) que compararon la administración diaria con la intermitente. Identificó que, si bien el ascenso de hemoglobina es semejante, la recuperación de la ferritina parece ser menor con el régimen intermitente (MD -6.07 μg/L, IC95%: -10.66 a -1.48; 4 estudios, 988 participantes, bajo nivel de evidencia). Concluyó que esta estrategia es útil para disminuir los eventos adversos asociados.
Hace poco, Pasupathy y coautores,47 en un estudio aleatorizado, describieron el efecto de una dosis diaria contra una dosis alterna de 100 a 200 mg de hierro, que resultó semejante en cuanto a recuperación de la hemoglobina en ambos grupos. La proporción de eventos adversos, excepto náusea, fue más evidente en el grupo de días alternos posterior a la cuarta semana de tratamiento.
Otras revisiones sugieren que el principal beneficio de las dosis alternas es la reducción significativa de los eventos adversos (náusea, sabor metálico, trastornos intestinales).48
Finalmente, a pesar de que los suplementos con hierro son eficaces, accesibles y económicos, un tercio de los pacientes ameritará una modificación de la administración, principalmente por intolerancia; la formulación endovenosa es la más indicada.
Formulación de hierro por vía endovenosa
El tratamiento por vía intravenosa de hierro se reserva para pacientes con anemia por deficiencia de hierro con intolerancia o falta de respuesta al hierro oral. Según la Agencia Europea de los Medicamentos, también puede preferirse el hierro intravenoso cuando se requiere una corrección rápida de la deficiencia. Las formulaciones de hierro actuales permiten una infusión de dosis única total en tan sólo 60 minutos, con lo que se evitan múltiples dosis fraccionadas para obtener el mismo beneficio clínico, en comparación con formulaciones anteriores que se asociaban con toxicidad inaceptable. La diferencia está en que el hierro elemental se encuentra más estrechamente unido al núcleo del carbohidrato complejo, lo que resulta en menos reacciones de infusión. La anafilaxia es extremadamente rara en menos de 1 por cada 200,000 administraciones.49
Las formulaciones intravenosas disponibles en el mercado para la administración, como infusión única de dosis total, incluyen: hierro dextrán de bajo peso molecular, ferumoxitol, carboximaltosa y desrisomaltosa férrica. Sin embargo, las presentaciones subóptimas para su administración en infusión única son el gluconato y el sacarato férrico. En México solo se comercializan tres formulaciones intravenosas: hierro dextrán de bajo peso molecular, carboximaltosa férrica y sacarato férrico.50 Cuadro 3
Cuadro 3 Formulaciones de hierro por vía endovenosa
| Nombre genérico | Carbohidrato | Presentación | Hierro elemental | Dosis máxima recomendada | Tiempo de infusión | Categoría en embarazo | Efectos adversos (%) | Indicación FDA | Disponibilidad en México |
|---|---|---|---|---|---|---|---|---|---|
| Hierro sacarosa | Sacarosa | 100 mg /5 mL | 100 mg | 200 a 500 mg/día | 15 a 30 minutos | B | Dolor abdominal, vómito | ERC | Disponible |
| Sacarato de óxido férrico | Sacarato | 100 mg/5 mL | 100 mg | 100-200 mg | 30 minutos | B | Dolor en sitio de inyección | Anemia DH, ERC | Disponible |
| Anemia DH, ERC | Disponible | ||||||||
| Carboximaltosa férrica | Carboximaltosa | 500 mg/10 mL | 50 mg/mL | 500-1000 mg/día | 15 minutos | C | Hipofosfatemia (dolor en el sitio de inyección) | Anemia DH, ERC | Disponible |
| Ferumoxytol | Poliglucosa | 510 mg/17 mL | 30 mg/mL | 510-1020 ng/día | 15 minutos | C | Diarrea, cefalea | Anemia DH, ERC | No disponible en México |
DH=Déficit de hierro, ERC= enfermedad renal crónica.
La diferencia entre estas presentaciones radica en que los portadores de carbohidratos, como el gluconato y la sacarosa, se unen al hierro elemental con menos fuerza que otras formulaciones, liberan hierro libre lábil en concentraciones mucho más altas. Esto resulta en reacciones de infusión inaceptables a dosis superiores a 200 a 250 mg. En este contexto se requieren de 4 a 7 administraciones para reponer completamente el hierro.51
El hierro dextrán de bajo peso molecular fue la primera formulación aprobada en Estados Unidos para infusión como dosis total. No debe confundirse con la formulación más antigua de alto peso molecular, que ya no está disponible debido a su alta incidencia de eventos adversos. Múltiples estudios han reportado la seguridad, eficacia y conveniencia de una única infusión de 1000 mg en 250 mL de solución salina normal administrada en 1 hora.52
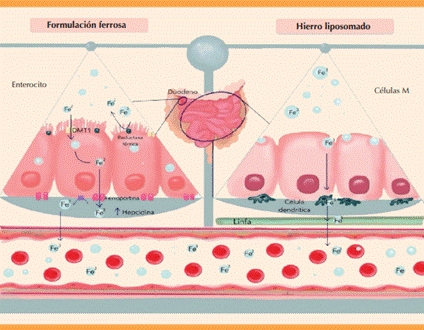
Figura 2 Mecanismo de absorción de hierro según el tipo de suplementación (sales ferrosas comparadas con formulación liposomada).
Para controlar las reacciones a la infusión según la etiqueta de la FDA, existen dos opciones: iniciar la infusión lentamente durante alrededor de 5 minutos o administrar una dosis de prueba de 25 mg con una jeringa llena con la solución diluida e inyectándola lentamente durante el mismo tiempo. Si no se observa reacción, la solución restante deberá infundirse durante el resto de 1 h.53
La inyección de carboximaltosa férrica es un complejo macromolecular de carbohidratos e hidróxido férrico que facilita la liberación lenta de hierro elemental después de su administración. Permite una dosis de hasta 1000 mg diluida en 100 mL de solución salina en 15 a 30 minutos. Ha demostrado seguridad y eficacia, incluso en la enfermedad renal crónica y el embarazo. Sin embargo, se ha asociado con hipofosfatemia emergente, por lo que debe evitarse en pacientes que requieren infusiones repetidas.54
La frecuencia de administración y la duración del beneficio de estas presentaciones intravenosas dependen de la enfermedad subyacente. Si se ha eliminado la causa, una sola infusión debería ser suficiente; sin embargo, si hay pérdidas continuas serán necesarias múltiples administraciones.
La premedicación aún se discute y generalmente se limita a pacientes con factores de riesgo sustanciales para el inicio de una reacción a la infusión: alergias a múltiples medicamentos, reacciones previas a formulaciones de hierro intravenoso y asma, por lo que la principal recomendación se basa en el criterio clínico.55
Arastu y su grupo56 evaluaron 35,737 infusiones de hierro, la proporción más alta de eventos se asoció con hierro sacarosa (4.3%) y la más baja con el sacarato férrico (1.4%). Los eventos graves, extremadamente raros, descartan esta premedicación o dosis de prueba porque los pacientes que la recibieron tuvieron una incidencia mayor de reacciones adversas. Esto sugiere que el hierro endovenoso es generalmente seguro y bien tolerado.
Acorde con la American Society of Hematology57(ASH), la premedicación de una dosis endovenosa de hierro debe limitarse a los pacientes con una reacción aguda previa.
A este propósito, Aung y colaboradores58 evaluaron el efecto de una reexposición de hierro en pacientes con antecedente de reacciones adversas. Identificaron que en más del 80% la reutilización de hierro es tolerable, segura y sin contratiempos.
Las reacciones anafilácticas a la infusión de hierro intravenoso son muy raras con las formulaciones actuales. Gran parte de estas reacciones, etiquetadas como eventos adversos graves, son en realidad pseudoalergias relacionadas con la activación del complemento y no reacciones de hipersensibilidad mediadas por IgE. Estas reacciones suelen desaparecer espontáneamente y se asocian con el hierro libre lábil.59
La activación del complemento sobreviene como una respuesta inflamatoria aguda desencadenada por la administración de ciertos medicamentos y nanopartículas, incluidas las formulaciones de hierro intravenoso. Un estudio reciente demostró que la carboximaltosa férrica y el sacarato férrico tienen una incidencia significativamente menor de reacciones graves en comparación con las formulaciones más antiguas.60 La European Medicines Agency61 (EMA) ha reafirmado la seguridad de las nuevas formulaciones de hierro, subrayando que las reacciones adversas graves son extremadamente raras cuando se administran correctamente.
La activación del complemento se conoce también como reacción de Fishbane, caracterizada por una reacción inmediata mediada por el complemento a nanopartículas de hierro libre que no se unen a la transferrina. Esta reacción, que generalmente no pone en peligro la vida y se resuelve sin tratamiento, suele aparecer al comienzo de la infusión. Los síntomas incluyen: enrojecimiento, mialgias, artralgias, dolor de espalda o presión en el pecho, sin los signos típicos de anafilaxia: hipotensión sistémica, sibilancias, edema periorbitario, estertores o dolor gastrointestinal.62
Esto requiere administraciones en dosis más bajas y contactos con el médico más frecuentes para alcanzar la dosis deseada.
A diferencia de la CARPA, la reacción anafiláctica de hipersensibilidad tipo I es una reacción sistémica potencialmente mortal mediada por IgE. Clínicamente puede caracterizarse por afectación a las vías respiratorias, inflamación de las mucosas, manifestaciones circulatorias y síntomas gastrointestinales. La anafilaxia es una urgencia clínica que puede ocurrir con la administración de cualquier formulación parenteral y debe tratarse correctamente, de la misma manera que la anafilaxia por cualquier otra causa.63
La incidencia de anafilaxia con las formulaciones modernas de hierro intravenoso es extremadamente baja, pero sigue siendo una preocupación importante. A pesar de esto, la incidencia para hierro dextran es de 9.8 casos por cada 10,000 infusiones, a diferencia del hierro sacarosa que es de 1.2 casos por cada 10,000 infusiones.64
Debido a este riesgo, aunque mínimo, las áreas de infusión deben contar con un equipo de respuesta rápida, capacitado para la atención de pacientes con reacciones anafilácticas agudas.65
En caso de reacciones menores siempre se recomienda detener la infusión e iniciar con cristaloides endovenosos. Gran parte de estas reacciones son de alivio espontáneo y deben vigilarse los síntomas hasta su desaparición y evitar, en lo posible, la indicación de antihistamínicos (difenhidramina) debido a que pueden exacerbar la diaforesis, hipotensión y taquicardia e, incluso, inducir un estado de sedación.66
Nuevos mecanismos y formulaciones de hierro
A pesar de que la complementación con hierro es uno de los tratamientos más antiguos y probados, la mayor parte de las formulaciones son para administración oral, en comprimidos o suspensión. Todas las formulaciones comparten los eventos adversos digestivos que merman el apego a la dosis prescrita.
Hace poco se probó una nueva formulación para el tratamiento de la deficiencia de hierro basada en la encapsulación en liposomas. Esta técnica de encapsulación ha sido probada con diversos quimioterápicos (doxorrubicina), antibióticos y diferentes tipos de minerales. Los liposomas que contienen hierro son vesículas esféricas constituidas por una capa de fosfolípidos con un núcleo acuoso en su interior que contiene la molécula de hierro.67,68
A pesar de contar con ventajas, menos eventos adversos y mejor absorción, uno de los desafíos en la fabricación con hierro radica en el control del tamaño y la distribución uniforme de las partículas; esto es decisivo para la estabilidad y eficacia terapéutica del producto. Las técnicas simil-microfluídicas han demostrado ser una mejora significativa respecto de los métodos tradicionales a granel, al permitir un control más preciso de las características de dimensión de los liposomas. Este enfoque innovador se complementa con una etapa adicional de homogenización asistida por ultrasonido que ayuda a reducir aún más el tamaño de las partículas y a obtener una distribución homogénea, evitando la formación de agregados y mejorando la estabilidad física del producto final.69
Los minerales y las vitaminas pueden encapsularse con la finalidad de mejorar su absorción a través de la vía digestiva. Las primeras formulaciones contenían hierro en conjunto con vitamina C (Biofer patentado en 1994) u otras vitaminas (ácido fólico, vitamina B12 o vitamina B6).70 El tamaño de los liposomas es variable, entre 150 y 200 nm con una eficacia de encapsulación del sulfato ferroso variable (58% por microfluidización).71 Otras formulaciones incluyen al pirofosfato férrico.
Además, este sistema permite mejorar la producción de nanoestructuras de sulfato ferroso en condiciones suaves, prescindiendo del uso de solventes agresivos o altas presiones típicamente asociadas con métodos convencionales como la evaporación en fase reversa, la hidratación de una película delgada y la homogeneización por congelación-deshielo.
Ese último método se utiliza, comúnmente, en la producción del suplemento de hierro comercial Biofer® (Lipotech, Barcelona, España). Para evitar la agregación de nanoestructuras, que puede ocasionar precipitación y pérdida de estabilidad del producto, es importante que los liposomas mantengan un potencial zeta (ζ) superior a 30 mV. Esta estabilidad se debe a las cargas negativas proporcionadas por los ácidos grasos poliinsaturados, como el ácido linoleico y oleico, que se encuentran en las vesículas de fosfatidilcolina. Además, los grupos hidroxilo del colesterol tienen una afinidad por la colina en la región polar de la fosfatidilcolina, creando un tropismo dipolar que incrementa las cargas negativas en la superficie de los liposomas. En contraste, la coexistencia de iones de hierro cargados positivamente en los liposomas reduce la negatividad superficial de las vesículas.72
Prichapan y coautores73 evaluaron cómo la formación de cristales de grasa afecta la encapsulación y retención del sulfato ferroso en emulsiones W/O. Se observó que a medida que aumentaba el tiempo de incubación hasta 8 horas en agua destilada, la eficiencia de encapsulación del sulfato ferroso disminuía en emulsiones sin estearina de salvado de arroz. La estearina mejoró la retención del hierro, quizá formando una red de cristales que impide la difusión del hierro. Además, la liberación de hierro está influida por el pH y la fuerza iónica del medio externo, de ahí la menor retención a pH más alto y mayor fuerza iónica, lo que indica una posible expulsión de las gotas de agua que contenían hierro de las emulsiones. Hay otros factores pueden modificar las propiedades fisicoquímicas de las emulsiones W/O, como la temperatura y la luz, y el proceso digestivo después de su consumo. La oxidación de lípidos produce radicales libres, que no solo aceleran su tasa sino que también provocan la pérdida de calidad del liposoma y de sus componentes nutricionales.
A pesar de muchos esfuerzos, las reacciones durante la oxidación de lípidos en emulsiones W/O siguen siendo impredecibles debido a múltiples factores influyentes. Las consecuencias de esta oxidación aún no están suficientemente claras. Los métodos para prevenir la oxidación de lípidos en emulsiones W/O también necesitan mejorarse. Todos estos aspectos del comportamiento químico de los lípidos en las emulsiones pretenden englobarse en un enfoque novedoso denominado oxidómica.74
El beneficio en la biodisponibilidad a través del transporte liposomado ha permitido ampliar su uso, especialmente en población vulnerable. Pisani y su grupo evaluaron, en pacientes con enfermedad renal, la complementación con una formulación liposomada diaria (30 mg de hierro pirofosfato, 70 mg de ácido ascórbico) durante tres meses en comparación con una formulación endovenosa de hierro. El ascenso de la hemoglobina fue semejante con menos eventos adversos asociados.75 Hace poco, Cesarano y colaboradores,76 en un estudio piloto, evaluaron el efecto del hierro liposomal para recuperar la reserva de hierro en pacientes con enfermedad renal crónica, con mejoría en las concentraciones de hemoglobina posterior a los seis meses de tratamiento y con una baja proporción de casos que ameritaron el cambio a hierro endovenoso. Al momento, los estudios que evalúan la eficacia de las formulaciones liposomadas son escasos, pero la evidencia sugiere que el mayor beneficio es su tolerancia y una baja proporción de fallas del tratamiento, que puede beneficiar a poblaciones específicas, como las mujeres embarazadas o los adultos mayores.
CONCLUSIÓN
La anemia por deficiencia de hierro es la forma más común de anemia en todas las poblaciones alrededor del mundo. A pesar de que el tratamiento es sencillo, se han implementado diversas estrategias para fortificar los alimentos, complementar a los individuos de riesgo y mejorar el apego a la toma de comprimidos. Casi todos los tratamientos orales se basan en comprimidos de sales ferrosas, con requerimiento de un aporte diario de al menos 100 a 150 mg de hierro elemental.
En años recientes han surgido nuevas formulaciones basadas en liposomas para mejorar la absorción y reducir los eventos adversos, sobre todo gastrointestinales. Estas nuevas formulaciones representan una opción prometedora para poblaciones vulnerables, como las mujeres embarazadas y los adultos mayores.











 nueva página del texto (beta)
nueva página del texto (beta)