Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.21 no.2 Ciudad de México may./ago. 2011
Biología reproductiva de la raya Rhinoptera bonasus (Elasmobranchii) en el sureste del Golfo de México
Reproductive biology of the cownose ray Rhinoptera bonasus (Elasmobranchii) in the Southeastern Gulf of Mexico
Juan Carlos Pérez–Jiménez
Departamento de Aprovechamiento y Manejo de Recursos Acuáticos, El Colegio de la Frontera Sur (ECOSUR), Calle 10x61 #264, Colonia Centro, Campeche, Campeche, 24000. México. E–mail: jcperez@ecosur.mx
Recibido: 23 de julio de 2010.
Aceptado: 6 de julio de 2011.
RESUMEN
La raya Rhinoptera bonasus es uno de los batoideos más abundantes en el sureste del Golfo de México, en donde es capturada incidentalmente y procesada seca–salada para consumo humano. En esta región, a la fecha no existen estimaciones de los parámetros reproductivos necesarios para conocer su dinámica poblacional y evaluar su vulnerabilidad a la pesca por medio de análisis demográficos o evaluaciones de riesgo ecológico. Del análisis de 136 hembras con un intervalo de longitud de 43–106 cm de ancho de disco (AD) y 56 machos con un intervalo de longitud de 43–93 cm AD, se estimó una longitud de madurez (AD50%) de 89.1 cm y 76.4 cm AD para hembras y machos respectivamente. El ciclo reproductivo de las hembras es aparentemente bienal, con una gestación de 12 meses; la gestación y la vitelogénesis son consecutivas. La ovulación y el alumbramiento ocurren de mediados de marzo a mediados de junio. La fecundidad fue de un embrión y la longitud de nacimiento de 37.5–43 cm AD. La longitud de madurez es diferente entre el sureste y el norte del Golfo de México; en el norte del Golfo es de 65.3 y 64.2 cm AD para hembras y machos, respectivamente. Al parecer también es diferente el ciclo reproductivo entre las poblaciones del sureste del Golfo de México (bienal) y el Atlántico noroeste (anual).
Palabras clave: Longitud de madurez, ciclo reproductivo, Rhinoptera bonasus, raya, Golfo de México.
ABSTRACT
The cownose ray Rhinoptera bonasus is one of the most abundant batoid species in southeastern Gulf of Mexico, where it is occasionally caught and salt–dried for human consumption. To date, there are no estimates of the reproductive parameters which are needed to assess the dynamics of the local population of this species, and its vulnerability to fisheries. The analysis of 136 females with a size range of 43–106 cm disc width (DW) and 56 males with a size range of 43–93 cm DW, allowed to estimate that the lengths at maturity (DW50%) are 89.1 cm DW and 76.4 cm DW for females and for males, respectively. The female reproductive cycle is apparently biennial. The gestation lasts close to 12 months, gestation and vitellogenesis are consecutive, and ovulation and parturition occur from mid–March to mid–June. The results indicate a brood size of one and the lengths at birth ranged between 37.5 and 43 cm DW. Apparently, the sizes at maturity estimated for the southeastern and the northern Gulf of Mexico are different, because the data for the northern Gulf of Mexico indicate DW values of 65.3 and 64.2 cm for females and males, respectively. The biennial reproductive cycle of the southeastern Gulf of Mexico population seems different from that of the northwestern Atlantic, which is apparently annual.
Key words: Length at maturity, reproductive cycle, Rhinoptera bonasus, ray, Gulf of Mexico.
INTRODUCCIÓN
La raya Rhinoptera bonasus (Mitchill, 1815) se distribuye desde el sur de Nueva Inglaterra hasta el norte de Argentina, incluyendo el Golfo de México y Cuba (Bigelow & Schroeder, 1953; McEachran & Carvalho, 2002). Este batoideo es bentónico y epipelágico de las plataformas continentales e insulares (McEachran & Carvalho, 2002), donde se alimenta de bivalvos, gasterópodos y crustáceos (McEachran & Fechhelm, 1998).
El modo reproductivo de R. bonasus es vivíparo aplacentado (Hamlett et al., 1985). Algunos parámetros reproductivos de R. bonasus fueron previamente estimados para la región norte del Golfo de México (Neer & Thompson, 2005), el Atlántico noroeste (Smith & Merriner, 1986) y en todo el rango de su distribución (Bigelow & Schroeder, 1953; McEachran & Carvalho, 2002).
Smith y Merriner (1986) estimaron una longitud de madurez de 85–90 y 80–84 cm de ancho de disco (AD) para hembras y machos, respectivamente, mientras que Neer y Thompson (2005) estimaron un intervalo de 62–71 y 63.5–75 cm AD, respectivamente, observándose aparentes diferencias regionales en esta variable reproductiva. Smith y Merriner (1986) y Neer y Thompson (2005) estimaron una fecundidad de un embrión, a diferencia de lo reportado por Bigelow y Schroeder (1953), quienes estimaron una fecundidad de 2–6 embriones.
Aunque Smith y Merriner (1986) determinaron que el ciclo reproductivo de las hembras es anual, no descartaron que la especie se reproduzca dos veces por año en el Atlántico noroeste. La periodicidad con la que las hembras producen crías es uno de los principales requerimientos para conocer la dinámica poblacional de los elasmobranquios por medio de análisis demográficos (Cortés, 1998) y para evaluaciones de riesgo ecológico (Cortés et al., 2010). Rhinoptera bonasus está catalogada como especie casi amenazada por la Unión Internacional para la Conservación de la Naturaleza (UICN), debido a que su baja productividad biológica la hace susceptible de sobreexplotación (Barker, 2006).
En el litoral mexicano del Golfo de México, el estado de Campeche es el principal productor de rayas, con un 45.7% de la producción total (Poder Ejecutivo Federal, 2010). En Campeche, la producción de rayas (1,186 t, d.s. = 163) fue similar a la producción de tiburón (1,023 t, d.s. = 452) en el periodo de 1997–2008; pero en el periodo 2004–2008 la producción de rayas (1,082 t, d.s. = 182) fue el doble de la producción de tiburones (618 t, d.s. = 188) (SAGAR–PA, Oficina Regional de Campeche). Lo anterior demuestra la relevancia socioeconómica de las rayas en el estado de Campeche y la necesidad de realizar estudios biológicos y pesqueros para generar información que permita el desarrollo de estrategias de manejo. Dasyatis americana (Hildebrand & Schroeder, 1928), Aetobatus narinari (Euphrasen, 1790) y R. bonasus son las principales especies capturadas por flotas artesanales en el estado de Campeche, en donde se consumen frescas o seco–saladas.
El objetivo del presente estudio fue determinar los parámetros reproductivos de R. bonasus en el sureste del Golfo de México. Asimismo, se discuten las diferencias en los parámetros estimados entre el sureste del Golfo de México, la región norte del Golfo de México (Neer & Thompson, 2005) y el Atlántico noroeste (Smith & Merriner, 1986).
MATERIALES Y MÉTODOS
Un total de 192 organismos Rhinoptera bonasus fueron examinados en los meses de abril, mayo, junio, agosto y octubre de 2007, marzo de 2008 y marzo 2009. Los especímenes de R. bonasusfueron capturados incidentalmente por pescadores artesanales de raya pinta A. narinari frente a Seybaplaya, en la costa central del estado de Campeche. Los pescadores utilizaron embarcaciones menores de 10 m de eslora y motor fuera de borda, y redes agalleras de seda de 30 cm de luz de malla.
De cada espécimen se midió el ancho de disco (AD) al centímetro más cercano y se determinó el sexo por la presencia o ausencia de gonopterigios. Todas las rayas fueron medidas y examinadas para cuantificar las variables reproductivas.
En los machos se midió la longitud de los gonopterigios desde el punto de inserción en la cloaca hasta la punta del gonopterigio y se registró su grado de calcificación. Los especímenes fueron considerados inmaduros cuando tenían gonopterigios relativamente cortos y flexibles, y maduros cuando los gonopterigios estaban calcificados y podían ser rotados hacia la parte anterior sin doblarse (Clark & von Schmidt, 1965).
El criterio para determinar la madurez en hembras fue la primera ovulación. De las hembras fueron medidos el diámetro de los ovocitos y el ancho de los úteros. De los ovocitos se registró su coloración y grado de vascularización, que son indicadores de vitelogénesis. El útero izquierdo fue examinado para determinar la longitud y grado de vascularización de la trofonemata (vellocidades de la parte interna del útero que secretan los lípidos y proteínas que nutren a los embriones), y la presencia de huevos uterinos o embriones. Se determinó el sexo de los embriones y se midió su AD. Con estos datos cada hembra fue clasificada como inmadura o madura no grávida o grávida.
La longitud de madurez al 50% fue estimada de acuerdo con Mollet et al. (2000) por medio del ajuste del modelo logístico Y = [1+e–(a+bX)]–1 a los datos binomiales de madurez (inmaduros = 0, maduros = 1) para hembras y machos por separado mediante el cálculo de la mediana de AD (MAD) o AD50% por medio de la fórmula MAD = –a/b. En el modelo logístico a y b son coeficientes estimados en el ajuste, mientras que (Y) es la proporción de especímenes maduros a un ancho de disco (X) determinado. La estimación de los parámetros, incluyendo los intervalos de confianza, se realizó con una regresión binaria en el software Minitab 16.0.
El ciclo ovárico se estimó mediante el análisis del tamaño del ovocito en hembras maduras a través del año, y el período de gestación por medio del análisis de la serie de tiempo de la longitud de los embriones. Se realizó un análisis de correlación entre el AD del embrión y el diámetro del ovocito de cada hembra grávida con el fin de determinar si el ciclo ovárico y el período de gestación eran concurrentes o consecutivos, considerando que una correlación positiva y estadísticamente significativa indica que los ciclos son concurrentes, por lo que las hembras ovularán justo después del alumbramiento. En cambio, una correlación no significativa indicaría que los ciclos son consecutivos, por lo que las hembras tendrían un receso entre el alumbramiento y la siguiente ovulación.
El ciclo reproductivo, la longitud de tiempo entre dos alumbramientos por hembra, se estimó con la información del ciclo ovárico y el período de gestación, y con el resultado sobre sí eran concurrentes o consecutivos estos ciclos. La fecundidad se estimó como el número de huevos uterinos y/o embriones por hembra. El intervalo de la longitud de nacimiento se determinó con el registro de los embriones de mayor tamaño y los juveniles de menor tamaño.
RESULTADOS
Fueron examinadas un total de 136 hembras con un intervalo de longitud de 43–106 cm AD y un promedio de 87.6 cm AD (d.s. = 10.2), y un total de 56 machos con un intervalo de longitud de 43–93 cm AD y un promedio de 79.5 cm AD (d.s. = 10.2) (Fig. 1).
Hembras. Las hembras fueron consideradas inmaduras cuando tenían ovocitos no vitelogénicos, sus úteros estaban delgados y con la trofonemata poco desarrollada, menor de 10 mm de largo y no vascularizada. En hembras inmaduras el ancho de ambos úteros tiene un tamaño similar. Las hembras fueron consideradas maduras cuando estaban grávidas; y maduras no grávidas cuando tenían el útero izquierdo >30 mm y la trofonemata bien desarrollada >10 mm y vascularizada. Se consideran hembras maduras sólo aquellas que tenían desarrollado el útero izquierdo mientras que el derecho midió <31 mm. Para distinguir una hembra madura no grávida de una inmadura fue necesario tomar en cuenta además del ancho del útero izquierdo, el tamaño y grado de desarrollo de su trofonemata y la condición (vitelogénico o no) del ovocito más grande. La longitud de madurez (AD50%) para las hembras resultó de 89.1 cm AD y una pendiente para el modelo logístico de 0.98. El intervalo de confianza de 95% fue de 88.9–89.2 cm AD para AD50% y de 0.93–1.04 para la pendiente (Fig. 2). El ajuste del modelo logístico fue significativo (χ2 = 705, p < 0.0001). Fueron analizadas 60 inmaduras, 42 maduras no grávidas y 34 grávidas. Las dos inmaduras de mayor tamaño midieron 92 cm AD, con ovocitos de 9–22 mm y útero izquierdo de 18–25 mm. La hembra madura de menor tamaño estaba grávida y midió 88 cm AD, con ovocito de 10 mm y útero izquierdo de 67 mm. Fueron examinadas cinco inmaduras con una longitud > 88 cm AD. En esas hembras el ovocito midió entre 9–22 mm y el útero izquierdo entre 13–25 mm.
El crecimiento del ovocito en especímenes menores a 85 cm AD es gradual y no excede los 20 mm, y en especímenes con longitudes mayores a 86 cm se observó un crecimiento abrupto (Fig. 3a). El intervalo de diámetro del ovocito en inmaduras fue de 1–30 (promedio = 10.5 mm, d.s. = 5.7), en maduras no grávidas fue de 9–35 (promedio = 22.3 mm, d.s. = 6.5), y en las grávidas fue de 9–26 (promedio = 15.6 mm, d.s. = 3.7).
El útero derecho creció poco en los diferentes grupos de hembras, su anchura máxima en inmaduras fue de 24 mm, en maduras no grávidas de 28 mm, y en grávidas de 31 mm. El crecimiento del útero izquierdo en hembras con AD < 87 cm es gradual y no excede los 40 mm, y en especímenes con AD > 88 cm se observó un crecimiento abrupto (Fig. 3b). El intervalo de longitud del útero izquierdo en inmaduras fue de 1.5–39 (promedio = 16.0 mm, d.s. = 7.2), en maduras no grávidas fue de 30–58 (promedio = 43.2, d.s. = 7.1), y en grávidas de 38–112 (promedio = 74.7 mm, d.s. = 21.9) (Fig. 3b).
Machos. La longitud de madurez (AD50%) para los machos resultó de 76.4 cm AD y una pendiente para el modelo logístico de 0.34. El intervalo de confianza de 95% fue de 76.05–76.8 cm AD para AD50% y de 0.32–0.37 para la pendiente (Fig. 2). El ajuste del modelo logístico fue significativo (χ2 = 1069, p < 0.0001). Fueron analizados 18 inmaduros y 38 maduros. El inmaduro de mayor longitud midió 83 cm AD y tenía gonopterigios parcialmente calcificados de 130 mm. El maduro de menor longitud midió 72 cm AD y tenía gonopterigios calcificados de 130 mm. Fueron examinados seis inmaduros con AD > 72 cm AD, con gonopterigios parcialmente calcificados de 110–135 mm.
El intervalo de longitud de los gonopterigios en inmaduros fue de 40–135 (promedio = 98.8 mm, d.s. = 25.8), y estaban de flácidos a parcialmente calcificados en algunos especímenes con longitudes mayores a 70 cm AD. Los maduros tenían gonopterigios calcificados con un intervalo de longitud de 130–165 (promedio = 151.6 mm, d.s. = 9.1) (Fig. 4).
Ciclo reproductivo. Los datos disponibles sugieren que el periodo de gestación dura alrededor de 12 meses (Fig. 5). La longitud de los embriones se incrementó gradualmente hasta que algunos alcanzaron longitudes mayores a 30 cm AD entre mediados y finales de marzo. La variabilidad de la longitud de los embriones analizados a mediados de abril, con un intervalo de 0–17.5 cm AD (promedio = 10.5, d.s. = 7.5), y en marzo con un intervalo de 21.037.5 cm AD (promedio de 29.9, d.s. = 5.2) indican que la ovulación ocurre en un periodo de al menos tres meses, y que el alumbramiento por lo tanto ocurrirá en un periodo de tiempo similar. El alumbramiento sería, por lo tanto, de mediados de marzo a mediados de junio (Fig. 5).
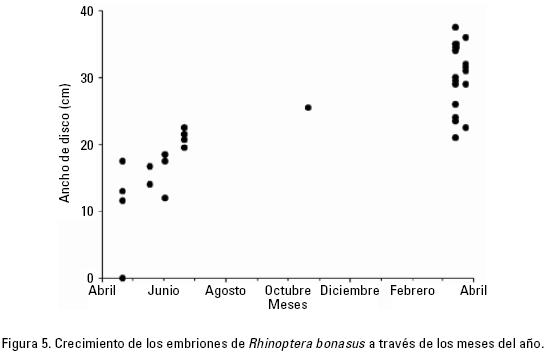
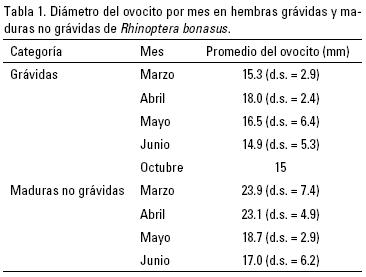
El análisis del diámetro de ovocito de las hembras maduras a través del año (Tabla 1) no permitió estimar el ciclo ovárico. No existieron diferencias significativas en el diámetro del ovocito de hembras grávidas entre meses (F4,29= 0.52, p = 0.72). Las hembras grávidas tenían ovocitos no vitelogénicos menores a 26 mm (promedio = 15.6 mm, d.s. = 3.7). Las hembras maduras no grávidas tuvieron el ovocito de 9–35 mm, (promedio = 22.3 mm, d.s. = 6.5), y fueron registradas entre mediados de marzo y principios de junio (Tabla 1). No existieron diferencias significativas en el diámetro del ovocito de hembras maduras no grávidas entre meses (F3,38 = 2.12, p = 0.11). El intervalo amplio de diámetro del ovocito registrado en hembras maduras no grávidas indica que algunas estaban próximas a ovular porque tenían un ovocito grande y vitelogénico, y otras habían alumbrado recientemente porque tenían ovocitos pequeños y no vitelogénicos.
La información disponible sugiere que las hembras de R. bonasus se reproducen bienalmente. Se determinó que no existe una correlación significativa entre el ancho de disco de los embriones y el diámetro del ovocito (r = –0.17, p = 0.38), con lo que se concluye que el ciclo ovárico y la gestación no son concurrentes. Por ejemplo, las hembras que contenían embriones con longitud cercana al nacimiento (>340 mm) tenían ovocitos no vitelogénicos menores de 18 mm.
Esta información indica que una vez que las hembras alcanzan la madurez, ovulan entre mediados de marzo y mediados de junio del año 1, y alumbran entre mediados de marzo y mediados de junio del año 2. Entre el alumbramiento y la siguiente ovulación transcurre un año, en el que se lleva a cabo la vitelogénesis, por lo que estas hembras ovularán nuevamente entre mediados de marzo y mediados de junio del año 3. De esta manera, cada hembra de R. bonasus produce una cría cada dos años. Esto implica que cada año la mitad de las hembras maduras estará gestando y la otra mitad estará en el proceso de la vitelogénesis.
Se determinó que la fecundidad de R. bonasus es de un embrión por hembra. Excepto por una hembra que contenía un huevo uterino, el resto contenían un embrión. De los 33 embriones analizados, 16 fueron hembras y 17 machos. El intervalo de longitud de nacimiento resultó de 37.5–43.0 cm AD. El embrión de mayor tamaño tenía una longitud de 37.5 cm AD y los juveniles de menor tamaño fueron dos de 43 cm AD registrados a mediados de agosto.
DISCUSIÓN
A pesar de la frecuencia alta de R. bonasus en las capturas de la región, este es el primer estudio que realiza estimaciones del ciclo reproductivo de las hembras, longitud de madurez de ambos sexos, fecundidad y longitud de nacimiento para esta especie en aguas mexicanas del Golfo de México.
Mediante una comparación cualitativa, se aprecia que las longitudes de madurez estimadas para hembras y machos en el presente estudio son similares a las reportadas por Smith y Merriner (1986) en el Atlántico noroeste, pero difieren de las estimadas por Neer y Thompson (2005) en el norte del Golfo de México (Tabla 2). Las diferencias podrían deberse a las condiciones ambientales o al uso de diferentes criterios para determinar la madurez en los estudios.
Neer y Thompson (2005) clasificaron como maduras a las hembras con el ovocito y útero >10 mm. Smith y Merriner (1986) clasificaron como maduras a las hembras con el ovocito >10 mm, el útero bien desarrollado y la longitud de su trofonemata >10 mm de largo. En el presente estudio se consideró el desarrollo de la trofonemata y la condición del ovocito, ya que no es apropiado usar como criterio una longitud mínima de ovocito o de útero para determinar la madurez.
Al considerar la primera ovulación como criterio para determinar la madurez, por lo general la hembra grávida más pequeña de la muestra será también la madura más pequeña, y en el mejor de los casos contendrá huevos uterinos, indicando una ovulación reciente. Smith y Merriner (1986) registraron la hembra grávida más pequeña de 87 cm AD, mientras que la hembra madura más pequeña midió 85 cm AD, que seguramente era una hembra madura no grávida que ya había alumbrado al menos una vez, lo que indica que su longitud al momento de la primera ovulación (e incluso al inicio de la vitelogénesis) era aún menor. Neer y Thompson (2005) registraron que la hembra grávida de menor longitud en su muestra fue de 76 cm AD y que la hembra madura de menor longitud tenía 62.3 cm AD, que seguramente era una hembra madura no grávida con al menos una gestación, por lo que su longitud al momento de su primera ovulación era aún menor. En el presente estudio la hembra grávida más pequeña fue también considerada la hembra madura de menor longitud. Esa hembra midió 88 cm AD y contenía un embrión de 17.5 cm AD.
Si en el presente estudio se hubiera adoptado la metodología utilizada por Neer y Thompson (2005), la hembra madura más pequeña habría resultado de 76 cm AD en lugar de 88 cm AD, con un ovocito de 10 mm, el útero derecho de 11 mm y el izquierdo de 12 mm. Esta longitud coincide con la longitud de la hembra grávida más pequeña reportada por Neer y Thompson (2005). En el presente estudio, esa hembra de 76 cm AD fue clasificada como inmadura debido a que su útero izquierdo estaba poco desarrollado, con la trofonemata muy pequeña y no vascularizada, y tres ovocitos no vitelogénicos de 10 mm. Esto indica que el criterio utilizado por Neer y Thompson (2005) no era apropiado aplicarlo en el presente estudio.
Esto también sugiere que a pesar de las diferentes metodologías utilizadas aparentemente sí existe diferencia en la longitud de madurez de las hembras entre el sureste y el norte del Golfo de México, más no entre el sureste del Golfo de México y el Atlántico noroeste (Tabla 2).
En este estudio se determinó que aparentemente las hembras de R. bonasus se reproducen bienalmente, por lo que alrededor del 50% de las hembras maduras estarán gestando cada año, y cada hembra madura de la población aportará una cría cada dos años. Smith y Merriner (1986) sugieren que el ciclo reproductivo de esta especie es anual, ya que estimaron una gestación de 11–12 meses y que las rayas ovulan justo después del alumbramiento. Esto indica que todas las hembras maduras estarán gestando cada año y aportarán una cría a la población. Sin embargo, Smith y Merriner (1986) no reportaron cual fue la condición del ovario en las hembras grávidas, para determinar por ejemplo, que aquellas que contenían embriones próximos a nacer contenían también un ovocito vitelogénico próximo a ser ovulado. En el presente estudio no se encontró una correlación entre el diámetro del embrión y el ovocito, indicando que las hembras no ovulan poco tiempo después del alumbramiento porque la vitelogénesis y la gestación no ocurren al mismo tiempo. Neer y Thompson (2005) suponen que el ciclo reproductivo es anual, pero no presentaron información para sustentarlo.
Smith y Merriner (1986) también discuten la posibilidad de que la gestación sea de seis en lugar de 11–12 meses. La estimación de una gestación de 11–12 meses fue realizada con base en un supuesto de cese del crecimiento embrionario por seis meses. Sin el supuesto anterior, la gestación resulta de 5–6 meses, con dos alumbramientos al año. En este escenario y considerando que Smith y Merriner (1986) indicaron que las hembras ovulan justo después del alumbramiento, resultaría en un ciclo bianual, en el que cada hembra de la población producirá dos crías por año. Sin embargo, Neer y Thompson (2005) indicaron que la información sobre el ciclo hormonal reproductivo de R. bonasus mantenidas en cautiverio no sustenta la posibilidad de que existan dos gestaciones por hembra por año en esta especie.
Considerando lo anterior, se deduce que de haber dos gestaciones por año, como lo sugieren Smith y Merriner (1986), estas no son realizadas por las mismas hembras. Si la gestación y la vitelogénesis no ocurren al mismo tiempo, alrededor del 50% de las hembras estarían alumbrando en verano y el otro 50% en invierno. El ciclo reproductivo sería anual con una gestación de 5–6 meses, y cada hembra aportaría una cría cada año a la población.
Aunque los datos del presente estudio sugieren una gestación de alrededor de 12 meses, en un estudio futuro es importante generar registros de hembras grávidas entre finales de julio y principios de marzo para evaluar la posibilidad de que ocurran dos gestaciones por año en el sureste del Golfo de México. Lo anterior llevaría a replantear la estimación del ciclo reproductivo, de ser bienal a anual, en el que cada hembra produciría una cría cada año y no cada dos años como lo sugieren los datos disponibles hasta ahora. En el presente estudio, al igual que en Smith y Merriner (1986), los movimientos estacionales de la especie impidieron registrar información durante todo el año.
En una especie del mismo género, Rhinoptera steindachneri (Everman & Jenkins, 1891), Bizzarro et al. (2007) estimaron un periodo de gestación de 11–12 meses y un ciclo reproductivo anual. Sin embargo, los autores no hicieron referencia sobre la condición del ovario en hembras grávidas para determinar si la vitelogénesis y la gestación ocurren o no al mismo tiempo.
Bigelow y Schroeder (1953) documentaron una fecundidad de 2 a 6 crías por hembra para R. bonasus. Los datos que proporcionaron Bigelow y Schroeder (1953) son anecdóticos y no basados en estudios específicos sobre la especie. En el presente estudio y en los realizados por Smith y Merriner (1986) y Neer y Thompson (2005) se estimó una fecundidad de un embrión por hembra. En otras especies del género Rhinoptera, R. steindachneri (Bizzarro, et al. 2007) y Rhinoptera javanica (Müller & Henle, 1841) (James, 1970), se ha documentado también un embrión por hembra.
La longitud de nacimiento estimada en el presente estudio (37.5–43 cm AD) es similar a las reportadas por Smith & Merriner (1986) y Neer y Thompson (2005) (Tabla 2). Baldassin et al. (2008) estimaron que especímenes nacidos en cautiverio de 38 cm AD, crecieron hasta 46.5 cm AD en 23 días. De esta forma, a pesar de que en este estudio no se contó con especímenes de vida libre menores a 43 cm AD, se puede establecer que el intervalo de longitud de nacimiento es apropiado (37.5–43 cm AD) debido al crecimiento tan rápido que experimentan los individuos de esta especie durante los primeros días de desarrollo.
La raya R. bonasus es muy vulnerable a la presión de pesca debido a sus características de historia de vida, con una madurez relativamente tardía de 4–5 años (Neer & Thompson, 2005), y fecundidad de un embrión por año o cada dos años. En la costa de Campeche ocurre en grandes agregaciones y aunque es poco utilizada para consumo humano, llega a ser capturada en grandes cantidades de manera incidental por pescadores que dirigen su esfuerzo sobre la raya pinta A. narinari. Las concentraciones altas de ácidos grasos y lípidos en los hígados de esta especie representan una alternativa de uso dada la demanda creciente de aceite de pescado tanto para consumo humano como para acuacultura (Navarro–García, et al. 2009).
AGRADECIMIENTOS
Especial agradecimiento para los pescadores de Seybaplaya por permitirme analizar sus capturas, y al Sr. Salomón Ortega, permisionario de pesca, quien nos permitió analizar las rayas y colectar material biológico en su bodega de acopio. I. Méndez–Loeza, E. Cuevas–Zimbrón, N. H. Cu–Salazar, J. Ortega–Puch, Y. Mo, M. J. Cuevas–Sulú participaron en el registro de datos y colecta de material en campo.
REFERENCIAS
Baldassin, P., H. Gallo & V. G. Azevedo. 2008. Reproduction of the cownose ray, Rhinoptera bonasus Mitchill, 1815 (Elasmobranchii, Rhinopteridae), in captivity and newborn care. Brazilian Journal of Biology 68 (4): 905–906. [ Links ]
Barker, A. S. 2006. Rhinoptera bonasus. In: IUCN 2008. 2008 IUCN Red List of Threatened Species. <www.iucnredlist.org>. Fecha de consulta: 4 de mayo de 2009. [ Links ]
Bigelow, H. B. B. & W. C. Schroeder. 1953. Fishes of the Western North Atlantic. Memoir Sears Foundation for Marine Research Number I. Part 2. Sawfishes, Guitarfishes, Skates and Rays. 588 p. [ Links ]
Bizzarro, J. J., W. D. Smith, J. F. Márquez–Farias & R. Hueter. 2007. Artisanal fisheries and reproductive biology of the golden cownose ray, Rhinoptera steindachneri Everman & Jenkins, 1891, in the northern Mexican Pacific. Fisheries Research 84: 137–146. [ Links ]
Clark, E. & K. von Schmidt. 1965. Sharks of the central gulf coast of Florida. Bulletin of Marine Science 15: 13–83. [ Links ]
Cortés, E. 1998. Demographic analysis as an aid in shark stock assessment and management. Fisheries Research 39: 199–208. [ Links ]
Cortés, E., F. Arocha, L. Beerkircher, F. Carvalho, A. Domingo, M. Heupel, H. Holtzhausen, M. N. Santos, M. Ribera & C. Simpfendorfer. 2010. Ecological risk assessment of pelagic sharks caught in Atlantic pelagic longline fisheries. Aquatic Living Resources 23: 25–34. [ Links ]
Hamlett, W. C., J. P. Wourms & J. W. Smith. 1985. Stingray placental analogues: structure of trophonemata in Rhinoptera bonasus. Journal of Submicroscopic Cytology 17 (4): 541–550. [ Links ]
James, P. S. B. R. 1970. Further observations on shoals of the Javanese cownose ray Rhinoptera javanica Müller and Henle from the Gulf of Mannar with additional notes on the species. Journal of the Marine Biological Association of India 12: 151–157. [ Links ]
McEachran, J. D. & J. D. Fechhelm. 1998. Fishes of the Gulf of Mexico. Vol. 1: Myxiniformes to Gasterosteiformes. University of Texas Press, Austin. 1112 p. [ Links ]
McEachran, J. D. & M. R. Carvalho. 2002. Batoid Fishes. In: Carpenter, K. E. (Ed.) The living marine resources of the Western Central Atlantic. Vol. 1. Introduction, molluscs, crustaceans, hagfishes, sharks, batoid fishes and chimaeras. FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. Roma, pp. 507–589. [ Links ]
Mollet, H. F., G. Cliff, H. L. Pratt Jr. & J. D. Stevens. 2000. Reproductive biology of the female shortfin mako, Isurus oxyrinchus Rafinesque, 1810, with comments on the embryonic development of lamnoids. Fishery Bulletin 98: 299–318. [ Links ]
Navarro–García, G., J. C. Ramírez–Suárez, J. Ortega–García, R. García–Camarena, J. F. Márquez–Farías, J. Santos–Valencia & L. Bringas–Alvarado. 2009. Lipid composition, natural antioxidants and physicochemi–cal characteristics in liver oil from rajiforms from the Gulf of Mexico. Journal of the American Oil Chemists' Society 86 (4): 323–328. [ Links ]
Neer, J. A. & B. A. Thompson. 2005. Life history of the cownose ray, Rhinoptera bonasus, in the northern Gulf of Mexico, with comments on geographic variability in life history traits. Environmental Biology of Fishes 73: 321–331. [ Links ]
Poder Ejecutivo Federal. 2010. Carta Nacional Pesquera. Publicada en el Diario Oficial de la Federación el 2 de diciembre de 2010, Tercera Sección. Ciudad de México, pp. 7–9. [ Links ]
Smith, J. W. & J. V. Merriner. 1986. Observations on the reproductive biology of the cownose ray, Rhinoptera bonasus, in Chesapeake Bay. Fishery Bulletin 84 (4): 871–877. [ Links ]














