INTRODUCCIÓN
El cromo presenta cinco estados de valencia, de los cuales los más importantes y estables en medios naturales son el cromo (III) y (VI), que se encuentran presentes en acuíferos naturales y aguas residuales (Cheung y Ji 2007, Dhal et al. 2013, Evelyne y Ravisanka 2014, Tommasi y Lombardelli 2017). El Cr(VI) es considerado un agente mutagénico, carcinogénico y teratogénico, el cual se presenta como cromato o dicromato, dependiendo del pH en donde se encuentre (Dhal et al. 2013, Suh et al. 2019). Debido a su naturaleza química, no puede degradarse, sólo transformarse a una forma menos tóxica como es el Cr(III), el cual es esencial para el metabolismo humano en bajas concentraciones, ya que participa en el metabolismo de la glucosa, el colesterol y los ácidos grasos, donde desempeña un papel importante en diferentes reacciones enzimáticas (Arderiu 1998, Watson y Logan 2011, Dhal et al. 2013, Suh et al. 2019). El Cr(III) considerado 100 veces menos tóxico y 1000 veces menos mutagénico que el Cr(VI) (Dhal et al. 2013, Kanmani et al. 2012, Guan et al. 2019, Suh et al. 2019) se encuentra en la naturaleza formando hidróxidos, óxidos o sulfatos, los cuales son solubles en agua.
Para el tratamiento de la contaminación por Cr(VI) existen diferentes estrategias como el uso resinas de intercambio iónico, los procesos de filtración y los métodos de reducción química. Sin embargo, estas estrategias no son limpias, usualmente tienen altos costos y generan productos secundarios, que a su vez originan otros problemas de contaminación. Por lo tanto, se plantea el uso de alternativas que sean amigables con el ambiente, como es el caso de la biorremediación (Rehman et al. 2008, Cárdenas et al. 2011). Método que se basa en el aprovechamiento de las características de diferentes organismos como plantas, levaduras, hongos y bacterias, entre otros (Alcalá 2007, Gaun et al. 2019), los cuales poseen diferentes mecanismos para retener, degradar o transformar sustancias tóxicas, siendo una de ellas el Cr(VI) (Rehman et al. 2008, Benítez-Campo 2011, Thatoi et al. 2014).
Adicionalmente, la biorremediación puede combinarse con la tecnología de las celdas de combustible microbianas (CCM) en la cual se emplean aguas residuales domésticas o industriales como sustrato directo para producir espontáneamente energía, a la vez que se disminuye la concentración de diferentes contaminantes (Min y Logan 2004, Thygesen et al. 2011, Wang et al. 2008, Zhang et al. 2016, Liu et al. 2019).
En las CCM la energía química contenida en la materia orgánica se transforma por los microorganismos en energía eléctrica en el ánodo. El circuito se cierra con un medio electrolítico, un circuito externo (Bond et al. 2002) y un cátodo recubierto generalmente con platino (Li et al. 2009, Revelo et al. 2018). Un aspecto importante de las CCM es el tipo de sustrato que se emplea, ya que a partir de este se produce la energía. En la literatura se reportan desde compuestos puros hasta mezclas complejas, como es el caso de sedimentos de aguas marinas (Reimers 2001, Logan et al. 2006), agua contaminada con Cr(VI), aguas residuales domésticas (Sophia y Sai 2016a, 2016b), celulosa, acetato, glucosa y lactosa entre otras sustancias (Pant et al. 2010, Zhang et al. 2016, Kim et al. 2017, Loloei et al. 2017, Tommasi y Lombardelli 2017).
Además, los microorganismos que se emplean se caracterizan por ser anaerobios facultativos o anaerobios estrictos, no fermentativos y electroquímicamente activos (exoelectrogénicos), entre los cuales se han reportado bacterias como Shewanella oneidensis, Geobacter sulforreducens, Geobacter metallireducens, Rhodoferax ferrireducens, Klebsiella pneumoniae, Clostridium butyricum, y Exiguobacterim acetylicum (Debabov 2008, Wang et al. 2008, Xing et al. 2008, Vejarano et al. 2018).
En estudios previos realizados por Mora y Bravo (2017), se aisló la cepa CrLIM26 del electrodo de una CCM ubicada en el lago de la estación experimental del Departamento de Biología de la Universidad del Valle. Esta cepa presentó actividad electroquímica y, considerando dicho antecedente, el objetivo de este trabajo fue determinar la actividad electrogénica acoplada a la biorremediación de cromo hexavalente con la cepa bacteriana CrLIM26. Para esto se realizaron ensayos de tolerancia al Cr(VI) por concentración mínima inhibitoria (CMI) y ensayos de reducción del Cr(VI). Asimismo, se hizo la identificación filogenética de la cepa bacteriana y se evaluó su capacidad para producir energía durante la remoción del Cr(VI) en CCM.
MATERIALES Y MÉTODOS
Este trabajo fue realizado en el Laboratorio de Investigaciones Microbiológicas (LIM) del Departamento de Biología de la Universidad del Valle, Santiago de Cali, Colombia, 3º22´30´´N 76º32´04´´O.
Ensayo de tolerancia al Cr(VI)
Para determinar la tolerancia de la cepa CrLIM26 al Cr(VI), se utilizó el método de concentración mínima inhibitoria (CMI) en el medio de cultivo LB, inoculado con 10 % V/V de un cultivo fresco de la cepa CrLIM26 y suplementado con Cr(VI) a concentraciones de 5, 10, 20, 40, 80, 160, 320, 640, 1280 y 2560 mg/L, ajustado a un volumen final de 2 mL. Se usó un testigo positivo sin Cr(VI) y un testigo negativo sin inóculo, con el fin de garantizar la inocuidad de los tratamientos y verificar si existía reducción química espontánea. Todas las pruebas se realizaron por triplicado. La CMI fue interpretada como la concentración de Cr(VI) a la cual se inhibió el crecimiento visible de la cepa después de 24 h de incubación por comparación con el crecimiento del testigo positivo y las diferentes soluciones evaluadas (Rangdale et al. 1997, Andrews 2001). El crecimiento se midió por espectrofotometría a una longitud de onda de 550 nm.
Estimación del potencial de reducción del Cr(VI)
En pruebas preliminares se determinó que la cepa CrLIM26 presentó condiciones óptimas de crecimiento a 35 ºC y pH 7.0 (p = 0.00321 ensayos no mostrados en el presente trabajo), motivo por el cual los bioensayos de reducción de cromo se realizaron a esas condiciones de incubación. Todos los bioensayos de remoción de Cr(VI) se realizaron por triplicado, en matraces Erlenmeyer a los cuales se les agregaron 45 mL de caldo LB, 100 µL de una solución patrón de Cr(VI), para garantizar una concentración final de 10 mg/L de Cr(VI) y 5 mL del inoculo bacteriano de 14-16 h de incubación. Se dispuso un testigo positivo de crecimiento sin cromo y un testigo negativo con cromo, pero sin inoculo bacteriano. Las variables de respuesta fueron la concentración de Cr(VI) y el crecimiento bacteriano; la concentración de cromo se estimó por el método de la 1.5 difenilcarbazida usando un espectrofotómetro Hach DR/890 (Ramírez y Benítez 2013) y el crecimiento bacteriano se midió por densidad óptica a 550 nm. Dichas mediciones se realizaron cada 2 h, hasta que la concentración de cromo fue imperceptible.
Efecto del Cr(VI) en la morfología de la cepa CrLIM26
El efecto del Cr(VI) sobre la morfología bacteriana se observó por microscopía electrónica de barrido. Para esto se realizaron dos cultivos de la cepa CrLIM26 en caldo LB con y sin Cr(VI), a los cuales se les agregó una barra de grafito como soporte de fijación para las bacterias, dejándose en incubación a temperatura ambiente durante 15 días. Para el proceso de fijación se tomaron las barras de grafito y se sumergieron en solución de glutaraldehído a 2.5 % en amortiguador de fosfato de sodio 0.1 M a pH 7.2 por 42 h a 4 ºC. Después de retirar el glutaraldehído se les agregó solución fría de etanol a 10 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % y 100 %, cada solución se incubó a 4 ºC durante 10 min. Las muestras se retiraron del etanol e inmediatamente fueron secadas agregando gotas de hexametildisiloxano (HMDS). Las muestras se adhirieron a un soporte metálico y se mantuvieron en desecador con sílica gel hasta su recubrimiento con oro en el equipo Sputter Coater - Denton Vacuum Desk IV para la observación en microscopio electrónico de barrido (Joel JSM 6490LV).
Identificación de la cepa CrLIM26
Para la identificación de la cepa CrLIM26, se realizó la extracción del ADN genómico utilizando el paquete de extracción Ultraclean Microbial DNA isolation de Mobio, siguiendo las indicaciones del fabricante. A partir del ADN obtenido se amplificó por PCR el gen 16S rRNA utilizando los cebadores universales 27F (5’-AGAGTTTGATCMTGGCTCAG3’) y 1492R (5’TACGGYTACCTTGTTACGACTTT’3). La mezcla de la PCR se preparó con base en las siguientes concentraciones finales: solución amortiguadora (1X) MgCl2 (1.75 µM) DNTPs (20 µM cada uno) cebadores (4 µM cada uno) polimerasa Taq (1 unidad). El programa utilizado para la amplificación consistió en un ciclo de desnaturalización a 94 ºC durante 5 min, una fase de amplificación de 35 ciclos con una desnaturalización a 94 ºC durante 1 min, hibridación a 54 ºC durante 45 s y extensión a 72 ºC durante 40 s; seguido de una extensión final a 72 ºC durante 10 min. Se determinaron las secuencias mediante procedimientos estándares del servicio suministrado por la compañía Macrogen (EUA), amparados por la Resolución 1070 (MADS, ANLA 2015).
Las secuencias obtenidas fueron comparadas directamente con la base de datos del Genbank y del Ribosomal Database Project, para clasificar y asignar los taxones jerárquicos. Se colectaron secuencias de las especies registradas para el género Exiguobacterium y fueron alineadas con el programa Bioedit Sequence Alignment para la construcción de los árboles filogenéticos mediante el método de máxima verosimilitud utilizando el programa PAUP versión 4.0b10 con el algoritmo de TBR (Tree-Bisection-Reconnection). El modelo de sustitución nucleotídica fue seleccionado por el criterio de Akaike en Modeltest versión 2.1; el soporte estadístico fue evaluado con el método “bootstrap” de máxima parsimonia con 10 000 repeticiones (MP), máxima verosimilitud 1000 repeticiones (ML) y análisis de inferencia bayesiana con 1 000 000 de remuestreos, tomando muestras cada 100 generaciones. Se generó un árbol consenso con el 50 % de los árboles más representativos. Esta identificación se complementó con la realización de pruebas bioquímicas, resultados no mostrados en este trabajo.
Monitoreo de actividad electroquímica en presencia y ausencia de Cr(VI)
Se construyeron cuatro celdas de combustible microbianas (CCM) de una sola cámara (simples), fabricadas en vidrio con un volumen de 100 mL. En cada una de ellas se colocaron dos colectores de corriente anódica y catódica, compuestos por grafito con dimensiones de 8 mm de diámetro y 5 cm de longitud, con área superficial de 13.57 cm2. Con la ayuda de un taladro se realizaron orificios para introducir un alambre de cobre, que se conectó al circuito. El colector catódico fue recubierto con Pt/C hasta depositar 0.416 mg/cm2 de platino a partir de una mezcla de Pt/C 20 % de peso de Pt / (peso de Pt + peso del soporte de carbono), 50 μL de Nafion en solución al 5 % en alcoholes de bajo peso molecular y 50 μL de isopropanol. La mezcla fue homogeneizada en un ultrasonido por 1 h, y luego se aplicaron tres capas de la solución a la barra de grafito, dejando secar cada capa a temperatura ambiente, con el fin de obtener una capa homogénea.
Se usaron tres celdas iguales, con un volumen de 67.5 mL de medio LB, más 7.5 mL de inóculo de la cepa CrLIM26; el ánodo se ubicó en la parte inferior para mantenerlo en condiciones anaerobias y el cátodo en la parte superior en contacto con el aire, la separación entre los electrodos fue de 2 cm. La cuarta celda con un volumen de trabajo de 75 mL de caldo LB, se empleó como testigo.
Se obtuvo una curva de polarización de acuerdo con Xing et al. (2008), al medir el voltaje (V) y la corriente (I) usando resistencias externas (Rex = 1Ω a 3900kΩ), conectadas a un circuito eléctrico con dos multímetros. Para la toma de datos se usó una fase de estabilización de 15 min, después con cada resistencia se realizaron tres ciclos de 5 min y se tomaron los datos de voltaje (V) y la corriente (I) generados en el último ciclo. La potencia (P) se calculó a partir de P = IV, la densidad de potencia (DP) fue igual a P/Acat, donde Acat es el área del cátodo usado, y la densidad de corriente (DI) fue igual a I/ Acat, los datos fueron normalizados tomando como referencia el área del cátodo (Martinez-Santacruz et al. 2016). La curva de densidad de corriente se construyó usando los valores de DI máxima generada diariamente. Adicionalmente, para evaluar la cantidad de energía que se produce al reducir Cr(VI), se agregaron 150 µL de la solución patrón de Cr(VI), para obtener una concentración final de 10 mg/L de Cr(VI), a cada celda. Inmediatamente se inició el monitoreo de la concentración de Cr(VI) con mediciones cada hora hasta su agotamiento. La adición del metal se hizo los días 14 y 28 después de iniciado el experimento, el voltaje se midió usando una resistencia de 1 kΩ.
RESULTADOS
Estimación del potencial de reducción de Cr(VI)
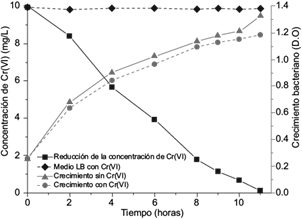
Los resultados de los bioensayos mostraron que el crecimiento de la cepa siguió una cinética de orden 1, con una disminución leve cuando se comparó con el testigo positivo (ausencia de Cr(VI)). El microorganismo redujo durante las primeras 6 h de crecimiento el 60 % de la concentración del cromo, alcanzando la remoción del 100 % de la concentración del metal en 11 h (Fig. 1), mientras que el testigo negativo reveló que no hubo reducción abiótica en el medio LB.
Efecto del Cr(VI) en la morfología de la cepa CrLIM26 y concentración mínima inhibitoria (CMI)
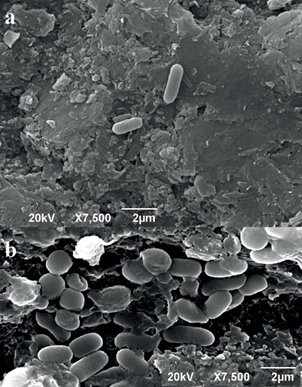
La cepa CrLIM26 en ausencia de Cr(VI) presenta forma de bacilos cortos de 1 a 2 µm de longitud, móviles, Gram positivos, sin endosporas, agrupados en pares o en forma individual (Fig. 2a). Las colonias en agar LB, prestaron forma redondeada, de color crema, con borde entero y elevadas, se tornaron de color naranja después de 24 h. Esta coloración no se presentó cuando el microorganismo fue cultivado en anaerobiosis. Mientras que en presencia de Cr(VI) las células de CrLIM26 se tornaron más largas y anchas, formando agregados (Fig. 2b). Además de los cambios morfológicos se evidenció la reducción del crecimiento bacteriano de la cepa en estudio, ocasionada por la toxicidad del cromo, pues el crecimiento se afectó a concentraciones superiores a 160 mg/L de Cr(VI).
Identificación de la cepa CrLIM26
La cepa CrLIM26 se identificó como Exiguobacterium acetylicum, según se indica en el árbol filogenético obtenido por el método de máxima verosimilitud (Fig. 3) con el modelo de sustitución GRT+I+G, donde la cepa se agrupó en el clado conformado por Exiguobacterium indicum y Exiguobacterium acetylicum.
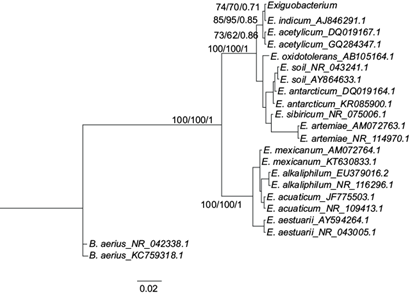
Fig. 3 Árbol filogenético de la cepa CrLIM26 entre organismos del género Exiguobacterium, basados en las secuencias del gen ARNr 16S, con el grupo externo de Bacillus aerius, los valores en las ramas indican máxima parsimonia, máxima verosimilitud y valor de inferencia bayesiana (izquierda a derecha)
Monitoreo de actividad electroquímica en presencia y ausencia de Cr(VI)
En las CCM operando con medio LB se tomaron los valores de voltaje y corriente durante 30 días, observándose diariamente valores para estos parámetros similares en las tres réplicas. En la figura 4a se observa la curva de polarización para el día de mayor densidad de potencia (día 25), con una resistencia externa de 3 kΩ alcanzando un máximo de 89.74 µW/m2 (DI = 4.75 mA/m2 y V = 18.88 mV).
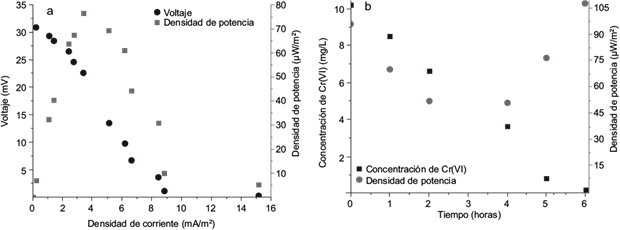
Fig. 4 Curva de polarización y de densidad de corriente máxima obtenida para la cepa CrLIM26 en las celdas de combustible microbianas (CCM) en ausencia de Cr(VI) (a), reducción de la concentración de Cr(VI) y densidad de corriente generadas en las CCM en presencia de cromo (b) medido a través del tiempo en horas (h)
En las CCM, al adicionar el Cr(VI) durante las primeras dos horas, se observó la disminución de la densidad de potencia (Fig. 4b), pero una vez la concentración del cromo (VI) alcanzó 50 % de la adicionada, los valores de la densidad de potencia comenzaron a incrementarse. Nótese que la reducción de 100 % de la concentración de Cr(VI) en la CCM, ocurrió después de 6 h, siendo mucho más rápido que en los bioensayos de reducción de cromo iniciales. Igualmente se alcanzó una DP final de 107.34 µW/m2, mayor a la inicial que fue de 96.1 µW/m2; esta tendencia se observó en los dos días evaluados, el día 14 y el día 28.
DISCUSIÓN
La reducción del 60 % del Cr(VI) por el aislado bacteriano CrLIM26 se produjo durante las primeras 6 horas de crecimiento, coincidiendo con la fase exponencial, mientras que el 40 % restante se removió más lentamente durante la fase estacionaria. Este fenómeno está asociado al crecimiento bacteriano, lo cual se evidencia en estudios similares, en los que se demostró que durante la fase exponencial también existe un aumento en la velocidad de reducción del Cr(VI) ligada a los procesos metabólicos que generan un crecimiento en la población bacteriana (Ramírez y Benítez 2013, Guerrero et al. 2017). Es importante señalar que el testigo negativo no presentó reducción de Cr(VI), evidenciando que ningún componente del medio utilizado fue un agente reductor de Cr(VI).
El crecimiento celular de la cepa CrLIM26 disminuyó levemente en comparación con el testigo positivo que no contenía Cr(VI), este resultado puede deberse a que, bajo condiciones de estrés inducido por el Cr(VI), las bacterias activan mecanismos de absorción o expulsión de iones o cascadas redox asociadas a rutas metabólicas. Esto genera una inversión energética en procesos de transporte activo para controlar la entrada de este metal altamente toxico, generando una disminución en el proceso de división celular y provocando que sea más lento el crecimiento celular (Morais et al. 2011, Thatoi et al. 2014, Viti et al. 2014, Guerrero et al. 2017).
La cepa CrLIM26 sufrió cambios morfológicos en presencia de Cr(VI) formando agregados y su morfología celular se tornó más larga y ancha, en comparación con la morfología en ausencia de Cr(VI), (Fig. 2). Los cambios morfológicos en presencia de Cr(VI) como son la deformación y el aumento de tamaño celular en bacterias se atribuye a la acumulación de este metal en el interior celular, según Sarangi y Krishnan (2008), Recillas et al. (2010), Morais et al. (2011), Singh et al. (2015) y Echeverry (2016).
La acumulación del Cr(VI) en el interior celular ha sido asociada a la presencia de grupos funcionales amino, carboxilos, carbonilo e hidroxilos en la superficie de la membrana celular, que facilita el ingreso de este metal al interior celular (Oves et al. 2013, Guerrero et al. 2017). Adicionalmente, la formación de agregados o biopelículas, proporciona una cooperación fisiológica en la células y protección contra diferentes condiciones ambientales hostiles o de estrés ambiental, brindando mayor resistencia y tolerancia a agentes peligrosos como el Cr(VI) (Loera et al. 2012, Olarte y Cristiano 2012, Mendoza et al. 2015).
La cepa CrLIM26 presentó una CMI de 160 mg Cr(VI)/L, resultado asociado a la acumulación en el interior celular y a los diferentes mecanismos de resistencia que se han reportado para microorganismos similares, los cuales son variados y pueden ser conferidos por genes localizados en los cromosomas o en plásmidos (Morais et al. 2011). Por lo general, estos mecanismos son codificados por genes que permiten la expulsión del cromato a través de la membrana. Otros sistemas de resistencia están relacionados con estrategias como la reducción del Cr(VI) de forma enzimática específica o no específica, o por actividad de enzimas de destoxificación de especies reactivas de oxígeno (ROS). Finalmente, estos procesos pueden estar asociados con la homeostasis de azufre, hierro, sulfatos y/o por reparación de daños del ADN (Morais et al. 2011, Thatoi et al. 2014, Viti et al. 2014).
La cepa CrLIM26 se identificó como Exiguobacterium acetylicum, resultado que se confirmó con las pruebas bioquímicas realizadas. Otros autores como Okeke (2008), Sarangi y Krishnan (2008) y Zumbair y Malik (2008), han reportado la capacidad de esta especie para reducir Cr(VI) a concentraciones mayores o menores a la presentada en este estudio. Sin embargo, no se ha informado el modo de reducción del Cr(VI) en este género.
En cuanto a la evaluación electroquímica de la cepa E. acetylicum CrLIM26, esta generó una densidad de potencia máxima de 89.74 µW/m2 a una densidad de corriente de 4.75 mA/m2. Esta especie, en estudios preliminares mostró una densidad de potencia de 6.9 mW/m2 (Mora y Bravo 2017). Estos resultados contrastan con la potencia generada al usar distintos microorganismos como Desulfovibrio desulfuricans (Pant et al. 2010), Geobacter sulfurreducens (Nevin et al. 200), Rhodopseudomonas palustris (Xing et al, 2008) y Geobacter sulfurreducens (Bond y Lovley 2003), los cuales generaron potencias máximas de 1150 mA/m2, 2.15 kW/m3, 1170 mW/m2 y 1150 mA/m2, respectivamente. Esto demuestra la relación entre la bacteria usada, la corriente y el voltaje generado, causado por la diferencia en la actividad metabólica, el mecanismo de transferencia de electrones al colector de corriente por parte de cada bacteria y los factores asociados al sistema como el diseño, la resistencia usada en el circuito, el suministro de oxígeno y el tiempo de funcionamiento de las celdas (Min y Logan 2004, He et al. 2005, Debabov 2008, Watson y Logan 2011, Chen et al. 2014, Parkash 2016, Penteado et al. 2016)
La curva de polarización (Fig. 4a) mostró un aumento paulatino del desempeño electroquímico, lo que indica un crecimiento en la colonización de la superficie del ánodo (Mendoza et al. 2015, Revelo et al. 2018), incrementando el número de bacterias por área y generando un mayor flujo de electrones que entran al circuito externo de las celdas (Vejarano et al. 2018, Revelo y Hurtado 2013). Adicionalmente, en las curvas de voltaje vs DI se observó que la pendiente fue poco pronunciada, lo que indica una mejora en la capacidad del sistema al dejar pasar mayor cantidad de corriente (Vejarano et al. 2018). En otros trabajos se argumenta que esto se relaciona con la maduración de la biopelícula donde la población bacteriana logra establecerse, multiplicarse y adaptarse al medio (Bond y Derek 2003, Watson y Logan 2011).
La DI alcanzó su valor máximo en los primeros 15 días, tiempo en el cual se presume el establecimiento de una biopelícula bacteriana sobre los ánodos de la CCM. Posterior al establecimiento de la biopelícula, los microorganismos trasmiten electrones de forma óptima desde la matriz celular hasta los electrodos del dispositivo; proceso mediado por contacto directo o mediante nanocables y nanohilos conductivos, que facilitan la transferencia de electrones (Min y Logan 2004, Debabov 2008, Fernández-Marchate et al. 2016, Parkash 2016, Bose et al. 2018, Li et al 2018).
Un factor que influyó durante todo el proceso fue la cantidad de nutrientes disponibles en el medio durante el experimento. Se ha demostrado que a mayor cantidad de materia orgánica, mayor es la cantidad de corriente generada, ya que a partir del sustrato se produce la energía (Min y Logan 2004, Cheng y Logan 2011, Sophia y Sai 2016a, Bose et al. 2018, Vejarano et al. 2018). Otro factor influyente es la actividad microbiana debida a la naturaleza misma de las bacterias, que emplean mecanismos específicos de transferencia de carga al colector anódico y tipo de sustrato (Bond et al. 2002, Li et al. 2009, Sophia y Sai 2016b). Adicionalmente, Martínez-Santacruz et al. (2016) consideran que las resistencias bajas favorecen el desarrollo de biopelículas de microorganismos exoelectrogénicos.
Wartson y Logan (2011), encontraron que las biopelículas necesitan un tiempo más largo de adaptación a las resistencias aplicadas, recomendando el uso de resistencias fijas. Ellos reconocen que dichas características pueden producir un incremento de la corriente y la potencia, al igual que el suministro de oxígeno (He et al. 2005, Watson y Logan 2011, Martínez-Santacruz et al. 2016, Parkash 2016). Asimismo, se ha demostrado que el uso de electrodos de grafito, empleados por su relación costo beneficio en lugar de colectores metálicos, puede proporcionar una superficie de adherencia para las bacterias (Logan et al. 2007, Loloei et al. 2017, Li et al 2018).
En cuanto a la producción de energía de la CCM en presencia de Cr(VI), se encontró un efecto negativo al inicio del experimento en términos de la producción de potencia, asociada al uso del Cr(VI) como aceptor de electrones en el cátodo. Otros reportes hechos por Wang et al. (2008), Li et al. (2009), Huang et al. (2011), Wu et al. (2015), Carmalin y Saikant (2016) y Kim et al. (2017), sugieren que la disminución en la producción de energía está asociada al poder electronegativo del Cr(VI) que al agotarse deja de funcionar como un sumidero de electrones y el voltaje vuelve a restablecerse, situación coherente con la evidencia experimental de la presente investigación.
También, se plantea que el Cr(VI) no sólo está siendo reducido por la actividad bacteriana, sino por actividad electroquímica, lo que genera una disminución en la producción de potencia de la CCM y una aceleración del proceso de reducción de Cr(VI) en el medio (Huang et al. 2011, Wei et al. 2011, Wu et al. 2015, Carmalin y Saikant 2016, Loloei et al. 2017). Considerando que el Cr(VI) es un agente oxidante, podría ser que la actividad electroquímica encontrada y su efecto en la reducción del Cr(VI) resultara de una combinación de factores, tales como: cantidad de biomasa, crecimiento celular en su fase exponencial y mecanismos de adsorción y reducción del cromo, pues a mayor cantidad de inóculo, hay más sitios de unión al metal (Cárdenas et al. 2011, Wu et al. 2015, Carmalin y Saikant 2016, Loloei et al. 2017, Revelo et al. 2018), además de un aumento en la actividad electroquímica por parte del microorganismo.
CONCLUSIONES
En este trabajo la cepa nativa E. acetylicum CrLIM26 mostró, a pesar del efecto tóxico del metal, la capacidad de tolerar y disminuir la concentración de Cr(VI) en caldo LB, evidenciado por un mayor volumen y longitud celular. Se demostró la transferencia de electrones en presencia y ausencia de Cr(VI) en celdas de combustible microbianas, mostrando su potencial para la biorremediación de ambientes contaminados con este ión en futuros estudios con sistemas acoplados a la generación de energías alternativas en CCM.
En futuros estudios podría evaluarse la eficiencia y factibilidad de la aplicación del sistema de CCM empleando E. acetylicum cepa CrLIM26 como inóculo masivo, para la remoción de Cr(VI) en residuos industriales o en ambientes contaminados con este metal.











 nueva página del texto (beta)
nueva página del texto (beta)