Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista fitotecnia mexicana
versión impresa ISSN 0187-7380
Rev. fitotec. mex vol.32 no.4 Chapingo oct./dic. 2009
Artículo científico
Acción de oligosacáridos en el rendimiento y calidad de tomate
Action of ogligosaccharides on the yield and quality of tomato
Ma. Luisa García Sahagún1*, Víctor Martínez Juárez1, Adriana N. Avendaño López1, Ma. del Carmen Padilla Sahagún2 y Humberto Izquierdo Oviedo3
1 Departamento de Producción Agrícola, División de Ciencias Agronómicas, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara. Km 15.5 Carretera a Nogales. 45510, Las Agujas, Zapopan, Jalisco, México, Tel. 0133-3777-1169. *Autor para correspondencia (mgarcia@cucba.udg.mx)
2 Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco, A. C. Av. Normalistas 800, Colinas de la Normal. 44270, Guadalajara, Jal.
3 Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas. Km. 3 1/2 Carretera a Tapaste. 32700, San José de las Lajas, La Habana, Cuba.
Recibido: 25 de Febrero del 2008.
Aceptado: 12 de Octubre del 2009.
Resumen
En esta investigación se evaluó la acción de oligosacáridos extraídos de pared celular de plantas en el rendimiento y la calidad de frutos de tomate (Lycopersicon esculentum Mill.) tipo bola var. 'EF 163'; para ello se compararon los productos comerciales Enerplant®, Pectimorf® vs. un testigo. Las variables de calidad medidas en los frutos rojos, de los cuatro primeros racimos fueron: pH, acidez titulable (AT), sólidos solubles totales (SST), relación SST/AT, peso de fruto, firmeza y color (valor "L", ángulo Hue° y croma). Entre racimos hubo diferencias (P ≤ 0.05) en calidad. Los mejores racimos en acidez titulable (AT) fueron el primero y el cuarto; en la relación SST/AT fue el segundo; en el peso del fruto fue el primero; y en rendimiento fue el tercero. Con respecto al testigo, la aplicación de oligosacáridos incrementó el rendimiento de fruto por planta en 22 % con el producto comercial Enerplant® y en 40 % con Pectimorf®. Tales aplicaciones también mejoraron la calidad de los frutos al aumentar en 0.06 y 0.04 % la acidez titulable, los sólidos solubles totales en 13 % con Pectimorf® y en 9 % con Enerplant®, así como la firmeza del fruto en 47 % con Enerplant® y en 27 % con Pectimorf®. En cuanto al color, el Enerplant® produjo frutos con mayor brillo y rojo menos intenso, que con Pectimorf® y que el testigo. En el pH los oligosacáridos no produjeron efecto. Se concluye que la aplicación de oligosacáridos incrementó el rendimiento de fruto por planta y mejoró la calidad de los frutos de tomate.
Palabras claves: Lycopersicon esculentum, oligosacáridos, rendimiento, calidad, firmeza.
Abstract
In this research oligosaccharides extracted from plant cell walls were evaluated regarding yield and quality of tomato fruits (Lycopersicon esculentum Mill.) "bola" type of cv. 'EF 163'. The commercial products Enerplant® and Pectimorf® were compared against a control without oligosaccharidies. The quality variables evaluated in four bunches of red tomatoes were: pH, titratable acidity (TA), total soluble solids (TSS), TSS/TA ratio, fruit weight, firmness and color ("L" value, Hue angle and chrome). Differences (P ≤ 0.05) between bunches were found regarding their quality traits. The best by titratable acidity (TA) were the first and fourth bunches; the second bunch was best in the TSS/TA ratio; the first bunch was best in fruit weight; and the third bunch outstanded in yield. The applied oligosaccharides increased plant yield in 22 % by Enerplant® and in 40 % by Pectimorf®. Those products also improved fruit quality by increasing in 0.06 and 0.04 % the titratable acidity, total soluble solids in 13 % with Pectimorf® and in 9 % with Enerplant®, fruit firmness in 47 % with Enerplant® and in 27 % with Pectimorf®. Enerplant® produced shiny and less red fruits, compared to Pectimorf® and the control. The applied oligosaccharides had not effect on the pH. In conclusion, the of applications oligosaccharides increased yield and quality of tomato fruits.
Key words: Lycopersicon esculentum, oligosaccharides, yield, quality firmness.
INTRODUCCIÓN
El tomate o jitomate (Lycopersicon esculentum Mill.) es uno de los cultivos hortícolas más importantes en México. Los principales estados productores de tomate durante el 2006 fueron Sinaloa (783 314 t), Baja California Norte (216 000 t) y Michoacán (134 177 t) (SIAP, 2006). Para aumentar la calidad del tomate, en los últimos años se han implementado sistemas especiales de producción que incluyen: invernadero, hidroponía (Ucan et al., 2005) fertirrigación y uso de productos químicos, como los ácidos húmico y cítrico y otras sustancias que estimulan el desarrollo vegetal. Otro factor que influye en la calidad es la función del racimo en la planta, pues según León (2001) los tres primeros racimos contribuyen con 50 % de la cosecha obtenida, y además establece que hay una diferencia de producción y tamaño de frutos en los primeros cuatro racimos respecto al resto de racimos.
Según Albersheim y Darvill (1985), ciertos oligosacáridos procedentes de las paredes celulares, denominados oligosacarinas, poseen actividad biológica y podrían controlar varios procesos fisiológicos. Estos oligosacáridos pueden producirse por degradación enzimática de polisacáridos de la pared celular o por síntesis directa (Fry, 2000). Algunos oligosacáridos a bajas concentraciones ejercen efectos de señalización en células y tejidos de los vegetales. Las oligosacarinas son solubles, activas biológicamente en la interacción de las plantas con el ambiente, y se les considera un nuevo grupo de biomoléculas (Aldington et al., 1991), que una vez liberadas son capaces de controlar funciones relacionadas con el crecimiento, desarrollo y organogénesis (Albersheim y Darvill, 1985; Ryan y Farmer, 1991).
Investigaciones recientes han permitdo verificar el efecto que tiene la aplicación de oligosacáridos derivados de pectina extraída de cítricos y contenidos en el producto comercial llamado Pectimorf® producido por investigadores de Instituto Nacional de Ciencias Agrícolas (INCA) en Cuba. Este producto, compuesto de oligosacáridos de pectina con un grado de polimerización entre 9 y 16 con una fracción molar de 10.4 y 7.2 % respectivamente, favoreció la regeneración de plantas de tomate in vitro a partir de hipocotilos (Plana et al., 2003). También se han reportado efectos de oligosacáridos pécticos en varios procesos: inducción de etileno (Simpson et al., 1998; Campbell y Labavitch, 1991), inhibición de la acción de auxinas (LoSchiavo et al., 1991), crecimiento y desarrollo de anturio (Anthurium andreanum, L.) con 10 mg L-1 aplicados por aspersión foliar (Hernández et al., 2007), y crecimiento de plántulas de tomate con aplicaciones de 1 y 10 mg L-1 (Costales et al., 2007).
Sin embargo, poco se sabe del efecto que tienen los oligosacáridos extraídos de vegetales en la calidad postcosecha de frutos. Mariña et al. (2005) reportaron que los oligosacáridos contenidos en otro producto comercial llamado Enerplant® producido por la empresa mexicana Biotec aceleró el crecimiento, aumentó el rendimiento y mejoró la calidad del jugo de caña de azúcar (Saccharum officinarum L.). Este producto comercial contiene 0.01 % de oligosacáridos equivalente a 0.58 g L-1 de ingrediente activo, alcohol etílico 49.99 % como conservador, agua 49.99 %, y colorante vegetal 0.01 %.
Por la importante acción que producen estos compuestos en las plantas, en este estudio se plantearon los siguientes dos objetivos: 1) Evaluar la acción de Enerplant® y Pectimorf® sobre el rendimiento por racimo de tomate, y 2) Evaluar su efecto sobre las variables de calidad del fruto: tamaño, contenido de sólidos solubles totales (SST), pH, acidez titulable (AT), relación SST/AT, firmeza y color.
MATERIALES Y MÉTODOS
Manejo agronómico y diseño experimental
El estudio se hizo en un invernadero tipo túnel durante el ciclo Primavera-Verano del 2006 (marzo - agosto), en la población de Zapopan, Jalisco, México. Se utilizaron semillas de tomate tipo "bola" de la variedad 'EF163' de la compañía Asgrow. Las semillas se germinaron en charolas de germinación, con el sustrato comercial Sunshine®. Las plántulas se trasplantaron a los 28 d de edad a macetas de 12 L de capacidad, que contenían como sustrato una mezcla de tezontle (1 a 4 mm de diámetro) y polvo de coco, en proporción 7:3; el polvo de coco se lavó previamente para eliminar las sales. A partir del trasplante se aplicó una solución nutritiva en sistema de riego, con base en un análisis de agua y los requerimientos de la planta. Se irrigó diariamente con la solución nutritiva a una dosis de 1 a 4 L d-1, variación que dependió de las condiciones climáticas y del desarrollo de las plantas. Las concentraciones de nutrientes (en mg L-1) fueron: nitrógeno 300, fósforo 60, potasio 300, calcio 300, magnesio 75, azufre 250, hierro 3, boro 0.5, manganeso 0.5, cobre 0.1 y zinc 0.1. La conductividad eléctrica varió de 1 a 2.5 dS m-1.
Los tres tratamientos aplicados a las plantas fueron: Tratamiento 1. Enerplant® aplicado por aspersión foliar a una dosis de 1.3 mL ha-1; Tratamiento 2. Pectimorf® también aplicado vía foliar a una dosis de 10 mg L-1; Tratamiento 3. Testigo, sin aplicación de oligosacáridos.
Los tratamientos se distribuyeron en un diseño en bloques al azar con cuatro repeticiones, éstas colocadas transversalmente al aparente gradiente de temperatura y de intensidad luminosa en el interior del invernadero, gradiente que fue provocado por la falta de aduana en la puerta de ingreso y por la sombra de invernaderos aledaños.
Al terminar el trasplante se hizo la primera aplicación foliar de Pectimorf® y Enerplant®. A los 15 d del trasplante se hizo la segunda aplicación, y así sucesivamente cada 15 d hasta completar ocho aplicaciones. Las cantidades de producto utilizadas por tratamiento fueron las recomendadas por las compañías comerciales.
Las plantas de tomate se podaron a los 45 d de trasplante para dejar solamente un tallo de producción mediante eliminación de los brotes laterales; también se eliminaron las hojas senescentes una vez que inició la cosecha. Las evaluaciones de rendimiento y calidad se hicieron en frutos rojos (maduros) de los primeros cuatro racimos.
Variables evaluadas
Estas variables evaluadas se midieron en los frutos de cuatro plantas por tratamiento y por bloque y la unidad experimental fue una planta o un grupo de 20 frutos, según la variable. Los frutos de cada racimo se cosecharon en madurez comercial (más de 90 % de color rojo), y se efectuaron cuatro cortes.
Rendimiento. Se determinó al momento de cosecha, mediante el pesaje de todos los frutos producidos por cada racimo por planta, con una balanza Adventurer Ohaus®. Con la suma de los cuatro racimos se obtuvo rendimiento en kg/planta.
Calidad de frutos. Se midió en el primero, segundo, tercero y cuarto racimos, en 20 frutos por tratamiento y por corte. Las variables de calidad fueron:
Contenido de sólidos solubles totales. Se midió en °Brix con un refractómetro Atago N-1E® (Japón) conforme al Método 970.59, en 20 frutos por tratamiento (AOAC, 1998).
pH. Se midió con el método 981.12 (AOAC, 1990), mediante un potenciómetro Hanna pH 213® en una muestra de 20 frutos por tratamiento.
Acidez titulable (AT). Se midió en 20 frutos que se dividieron en cuatro grupos de cinco frutos cada uno. Los frutos de cada grupo se partieron en trozos y se mezclaron, y luego se tomaron tres muestras. Se midió con el método potenciométrico 942.15 de la AOAC (1990), que se basa en titular la muestra con una solución de hidróxido de sodio 0.1 N hasta alcanzar un pH de 7.2. Se utilizó un potenciómetro Hanna pH 213®, y el resultado se expresó como porcentaje de ácido cítrico.
Firmeza. Se determinó con el analizador de textura TA-XT2® de Stable Micro Systems (EE. UU.) por medio de una prueba de penetración de una punta cónica TA-15, a una velocidad de 2 mm s-1, hasta una profundidad de 10 mm. Antes de proceder a la penetración se retiró la cutícula de la región ecuatorial del fruto en una franja de 1.4 a 1.5 cm de ancho. También se midió en 20 frutos, y los resultados se expresaron en gramos fuerza (gf).
Color. Se midió con un colorímetro Ultra Scan (HunterLab) CR-200b® (EE. UU.) (Iluminante C y observador 10 °) en dos posiciones opuestas del fruto en la región ecuatorial. Se obtuvieron así los valores L*, a* y b* de la Comisión Internacional en Iluminación (CIELab), donde L* representa el brillo o luminosidad de la superficie del fruto, cuya escala va de cero a cien, en la que el representa cero al color negro y el 100 al color blanco; se desplaza en dirección perpendicular a los ejes a* y b*; a* representa el cambio de color verde a rojo, y b* el cambio del color azul al amarillo. Los valores de a* y b* se utilizaron para calcular el tono o cromaticidad (Cr) con la fórmula Cr= (a*2+b*2)1/2, y el ángulo Hue o ángulo de matiz con la fórmula Hue= Tg-1 (arco tangente) (b*/a*) (McLaren, 1976).
Relación de sólidos solubles/ acidez titulable. Esta relación es una medida del sabor de los frutos y se calculó al dividir de SST entre el porcentaje de acidez titulable.
Análisis estadístico
En el análisis de varianza se consideraron como fuentes de variación el efecto de bloques, de tratamientos y de racimos. Dicho análisis se hizo con el modelo general lineal, y como prueba de comparación de medias se aplicó Tukey (P ≤ 0.01). Además se hicieron análisis de correlación (Pearson) entre variables. En todos los casos se utilizó el paquete estadístico Number Cruncher Statistical System (NCSS, UTA, EE. UU.) versión 2007.
RESULTADOS Y DISCUSIÓN
Análisis de varianza
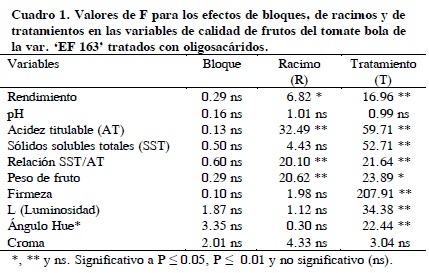
No hubo diferencias significativas por el efecto de bloques en el rendimiento ni en las variables de calidad evaluadas (Cuadro 1). Entre racimos hubo diferencias (P ≤ 0.01) en las variables: acidez titulable (AT), relación SST/AT, y peso del fruto, y así como diferencias (P ≤ 0.05) en el rendimiento. Entre tratamientos también se observaron diferencias (P ≤ 0.01) en rendimiento, acidez titulable (AT), sólidos solubles totales (SST), relación SST/AT, firmeza, color (luminosidad y ángulo Hue), así como diferencias (P ≤ 0.05) en el peso del fruto.
Entre los tratamientos aplicados se encontró que tanto Pectimorf® como Enerplant® superaron (P ≤ 0.01) al testigo (1.50 kg/planta) en 22 y 40 % en rendimiento de fruto (Cuadro 3). Ello se debió al efecto de tales oligosacáridos en el tamaño del fruto, pues los de mayor peso se obtuvieron con la aplicación de Enerplant® (177 g) seguidos de los tratados con Pectimorf® (130.8 g), que también superaron (P ≤ 0.01) al testigo (78.5 g).
Según McDougall et al. (1992), los oligosacáridos aplicados en plantas de tomate se mueven a través del xilema y del apoplasto hasta las hojas donde producen efectos de fosforilación en proteínas membranales al unirse a ellas (Jacinto et al., 1993), e inducen así la floración y los consecuentes incrementos en el rendimiento (Marfa et al., 1991).
Los incrementos aquí obtenidos en el rendimiento de tomate por la aplicación de Enerplant® con respecto al testigo, concuerdan, con los aumentos reportados por Mariña et al. (2005) de 13 % en caña de azúcar al aplicar Enerplant® (38.30 t ha-1), en comparación con el testigo (32.30 t ha-1).
Acidez titulable
La acidez titulable fue estadísticamente igual entre los racimos segundo y tercero (0.46 %), y ambos fueron superados por el primero (0.51 %) y el cuarto (0.50 %) racimos (Cuadro 2). El ácido cítrico expresado como acidez titulable, se produce a partir de la oxidación de azúcares durante la respiración y por ello depende de la ubicación de los frutos, ya que existe una jerarquía de éstos (Wardlaw, 1990) en la demanda de azúcares por su tamaño y por su actividad metabólica (Ho, 1996).
Entre tratamientos se encontró que tanto Enerplant® como Pectimorf® superaron (P ≤ 0.01) al testigo en 0.06 y 0.04 % en el contenido de ácido cítrico (Cuadro 3). Se infiere así que los oligosacáridos aplicados activaron la respiración y la producción de etileno (Leliévre et al., 1997; Simpson et al., 1998; Cutillas-Iturralde et al., 1998), ya que éste controla la síntesis de ácido cítrico (Andrews, 1995; Bartz y Brecht, 2003). De la activación de la fosforilación como parte de la respiración y de la síntesis de etileno depende la energía disponible para generar los ácidos orgánicos (Salisbury y Ross, 1992).
Sólidos solubles totales y relación SST/AT
No hubo diferencias significativas (P ≤ 0.01) entre los racimos en cuanto a la cantidad de sólidos solubles totales cuyo valor promedio fue de 5.52 °Brix (Cuadro 2). En cambio, los tratamientos de Enerplant® y de Pectimorf® superaron (P ≤ 0.05) al testigo (5.14 °Brix) en la concentración de SST, en 9 y 13 % respectivamente (Cuadro 3). Estas diferencias en sólidos solubles por efecto de los oligosacáridos podrían atribuirse al efecto producido sobre el influjo de potasio y el eflujo de calcio que permiten la apertura de estomas y en consecuencia hay mayor captación de CO2, mayor eficiencia fotosintética y más azúcares (Mathieu et al., 1991).
Los oligosacáridos también inducen producción de etileno (Campbell y Lavabitch, 1991; Priem y Gross, 1992) que a su vez induce la síntesis de enzimas que degradan azúcares de almacenamiento, de modo que se pueden generar azúcares simples que incrementan la concentración de sólidos solubles en los frutos durante la maduración (Farmer et al., 1991).
Los valores de la relación SST/AT fueron menores (P ≤ 0.01) en el primer racimo (10.88) que en el cuarto, tercero y segundo racimos, en 2.8, 9.4 y 17 % respectivamente (Cuadro 2). Según Kader et al. (1978), los frutos de tomate de alta calidad obtienen una relación mayor a 10, por lo que todos los frutos producidos en este experimento tuvieron calidad. La relación SST/AT fue igual (P ≤ 0.01) entre Pectimorf® y el testigo (11.96), mientras que hubo una reducción de 7.8 % por efecto de Enerplant®; este último tratamiento produjo mayor concentración de ácido cítrico en los frutos (Cuadro 3).
Firmeza
La firmeza fue igual en los racimos segundo, tercero y cuarto y estos tres superaron (P ≤ 0.01) en 3.42, 2.79 y 0.36 % al primero, que tuvo una firmeza de 817 gf (Cuadro 2).
La firmeza de los frutos está determinada por varios compuestos que integran la pared celular, entre los que destacan los pectatos de calcio y magnesio. Como el calcio no puede ser transportado por las células traslocadoras del floema, los síntomas de deficiencias de calcio son más agresivos en tejidos jóvenes. Ello podría producir variación en la distribución del calcio entre racimos, en cuanto a valores de firmeza del fruto (Fry et al., 1992; Salisbury y Ross, 1994).
Entre tratamientos se encontró que tanto Pectimorf® como Enerplant® superaron en 27 y 47 % respectivamente al testigo que produjo frutos con firmeza de 666 gf (Cuadro 3). Ello se debió a que los oligosacáridos de pectina pueden formar el complejo denominado "caja de huevo" al unirse al calcio y así estabilizar la estructura de la pared celular, como proponen Darvill et al. (1992). El calcio es un elemento que se encuentra unido a polisacáridos llamados pectatos en las paredes celulares, los cuales proporcionan mayor firmeza a los tejidos vegetales (Salisbury y Ross, 1998).
Color
Los valores de luminosidad y de ángulo Hue como parámetros del color del fruto, fueron iguales en los cuatro racimos, con promedios de 48.33 para L (luminosidad o brillo) y de 50.99 para el ángulo Hue (Cuadro 2).
Entre tratamientos se encontró que tanto el testigo como Pectimorf® fueron iguales entre sí, con un promedio de 46.97, y que Enerplant® los superó (P ≤ 0.01) a ambos en luminosidad con 10 % (Cuadro 3). Es decir Enerplant® indujo la formación de frutos más "blancos o brillantes". En el ángulo Hue también el testigo y Pectimorf® fueron iguales con un promedio de 47.74, y Enerplant® los superó (P ≤ 0.01) en 21 % a ambos, porque los frutos tuvieron una coloración roja con tendencias al amarillo. En el caso del tomate cuyo color se encuentra en el cuadrante rojo/amarillo de Hue°, implica que a menor ángulo Hue° el color se acercaría más al rojo intenso, y que conforme aumente dicho ángulo el color tendería más a los tonos amarillentos. Es decir, los tratamientos del testigo y Pectimorf® produjeron frutos con color rojo más intenso que los producidos con Enerplant® que tendieron al color amarillo.
Correlaciones entre variables
Las correlaciones de los valores del color (L, croma y ángulo Hue) no fueron significativas con las variables sólidos solubles totales, acidez titulable, pH y firmeza, pero tuvo una correlación significativa (P ≤ 0.01) y positiva con sólidos solubles totales, y una negativa (P ≤ 0.05) con el pH (Cuadro 4) debido a que estas características se relacionan de forma inversa, y todas estas variables son responsables del sabor en frutos de tomate (Anastasio y Abad, 1997). En el sabor es importante la relación entre los azúcares y los ácidos orgánicos contenidos en los frutos (Peiris et al. , 1998), generalmente, un incremento en estos compuestos resulta en un correspondiente aumento en la intensidad del sabor (Malundo et al., 1995).
La firmeza presentó una correlación positiva (P ≤ 0.01) con el peso del fruto y también (P ≤ 0.05) con la acidez titulable, mientras que con el pH fue negativa (P ≤ 0.01) (Cuadro 4). La firmeza de un fruto depende de los polisacáridos que integran la pared celular. La pared celular primaria contiene 10 % de pectina dispersa que forma una matriz de gel entre la red de celulosa-hemicelulosa. La pectina es una mezcla de ramas heterogéneas de polisacáridos hidratados ricos en ácido D-galacturónico, polisacáridos que se clasifican como homogalacturonano, rhamnogalacturonano I , rhamnogalacturonano II y azúcares neutros (arabinanos y galactanos).
Las pectinas determinan la porosidad de la pared que a su vez influye en el peso del fruto, además de que proveen superficie de carga que modula el pH en la pared celular y el balance de iones, y regulan la adhesión entre células en la lámina media (Buchanan et al., 2000).
CONCLUSIONES
La aplicación de oligosacáridos incrementó el rendimiento de fruto por planta en 22 % con el producto comercial Enerplant® y en 40 % con Pectimorf®. Tales aplicaciones también mejoraron la calidad de los frutos al aumentar en 13 % y 8 % la acidez titulable, a los sólidos solubles totales en 13 % con Pectimorf® y 9 % con Enerplant®, así como a la firmeza del fruto en 47 % con Enerplant® y en 27 % con Pectimorf®. Enerplant® produjo frutos con mayor brillo pero de rojo menos intenso que el testigo. En el pH los oligosacáridos no produjeron efecto.
AGRADECIMIENTOS
Al Dr. Juan Carlos Cabrera y a los investigadores del Departamento de Fisiología y Bioquímica Vegetal del Instituto Nacional de Ciencias Agrícolas de San José de las Lajas, en La Habana, Cuba, por haber donado el producto Pectimorf® para realizar esta investigación.
BIBLIOGRAFÍA
Albersheim P , A G Darvill (1985) Oligosaccharins. Sci. Amer. 253:5864.
Aldington S, G J McDougall, S C Fry (1991) Structure-activity relationships of biologically active oligosaccharids. Plant Cell Environ. 14:625-636. [ Links ]
Anastasio G, J Abad (1997) Recuperación del sabor en tomate. Horticultura 5:70-77. [ Links ]
Andrews J (1995) The climateric respiration rise in attaches and detached tomato fruit Postharv. Biol. Technol. 6:287-289. [ Links ]
AOAC, Association of Analytical Communities (1990) Official Methods of Analysis 16th ed. S. William (ed). Published by Association of Official Analytical Chemists. Washington, D.C. USA pp:918-919. [ Links ]
AOAC, Association of Analytical Communities (1998) Official Methods of Analysis. 16th. ed. S. William (ed). Published by Association of Official Analytical Chemists. Washington, D.C. USA. 1055 p. [ Links ]
Bartz JA , J K Brecht (2003) Postharvest Physiology and Pathology of Vegetables. Marcel Dekker, Inc. U.S.A. pp:299-324. [ Links ]
Buchanan G, W Gruissen, R Jones (2000) Biochemistry and Molecular Biology of Plants. Chapter 2. Cell Wall. Am. Soc. Plant Physiol. pp:52-108.
Campbell A , J Labavitch (1991) Induction and regulation of ethylene biosynthesis and ripening by pectic oligomers in tomato pericarp discs. Plant Physiol. 97:706-713. [ Links ]
Costales D, L Martínez, M Núñez (2007) Efecto del tratamiento de semillas con una mezcla de oligogalacturónidos sobre el crecimiento de plántulas de tomate (Lycopersicon esculentum Mill.). Cult. Trop. 28:85-91. [ Links ]
Cutillas-Iturralde A, J Peña, I Zarra, E P Lorences (1998) A xyloglucan from persimmon fruit cell wall. Phytochemistry 48:607610. [ Links ]
Darvill A, C Augur, C Bergmann, R W Carlson, J J Cheong, S Eberhard, M G Haahn, M V Lo, V Marfa, B Meyer, D Mohnen, MA O'Neil, M D Spiro, H V Halbeck, W S Cork, P Albersheim (1992) Oligosaccharins-oligosaccharides that regulate growth, development and defense responses in plants. Glycobiology 2:181198. [ Links ]
Farmer E E, T D Moloshok , M J Saxton, C A Ryan (1991) Oligosaccharide signaling in plants Specificity of oligouronide enhanced plasma membrane protein phosphorylation. J. Biol. Chem. 266:3140-3145. [ Links ]
Fry S C (2000) The Growing Plan Cell: Chemical and Metabolic Analysis. The Blackburn Press. Caldwell, New Yersey, USA. pp:219-221. [ Links ]
Fry S C, R Smith, K F Renwick, D J Martin, S K Hoolge, K J Matthews (1992) Xyloglucan endotransglycosidase, a new wall-loosening enzyme activity from plants. Biochem. J. 282:821-828. [ Links ]
Hernández L, B Benítez, F Soto, M E Domini (2007) Efecto de una mezcla de oligogalacturónidos en el crecimiento y desarrollo de Anthurium andreanum. Cult. Trop. 28:83-86. [ Links ]
Heuvelink E (1995) Dry matter partitioning in a tomato plant: one common assimilate pool. J. Exp. Bot. 46:102-1033. [ Links ]
Ho L C (1996) The mechanism of assimilate partitioning and carbohydrate compartmentation in fruit in relation to the quality and yield of tomato. J. Exp. Bot. 47:1239-1243. [ Links ]
Jacinto T, E E Farmer, C A Ryan (1993) Purification of potato leaf plasmamembrane protein pp34, a protein phosphorylated in response to oligogalacturonide signals for defense and development. Plant Physiol. 103:1393-1397. [ Links ]
Kader A A, L L Morris, M A Stevens y Albright-Holton (1978) Composition and flavor quality of fresh market tomatoes as influenced by some postharvest handling procedures. J. Amer. Soc. Hort. Sci. 103:6-11. [ Links ]
Leliévre J-M, Latché A, Jones B, Bouzayen M, J C Pech (1997) Ethylene and fruit ripening. Physiol. Plant. 101:727-739. [ Links ]
León G H M (2001) Manual para el Cultivo de Tomate en Invernadero. 1a. ed. Talleres Gráficos del Gobierno de Chihuahua. México. 239 p. [ Links ]
López D U M (1992) Factores precosecha que afectan la fisiología y manejo postcosecha de frutas y hortalizas. In: Fisiología y Tecnología Postcosecha de Productos Hortícolas. E M Yahia, C I Higuera (eds). Grupo Noriega Editorial. México. pp:37-48. [ Links ]
LoSchiavo F, F Filippini, F Cozziani, D Vallone, M Terzi (1991) Modulation of auxin-binding protein in cell suspensions. I. Differential response in carrot embryo culture. Plant Physiol. 97:6064. [ Links ]
Malundo T M, R L Shewfelt, J W Scott (1995) Flavor quality of fresh tomato (Lycopersicum esculentum Mill.) as affected by sugar and acid levels. Postharv. Biol. Technol. 6:103-110. [ Links ]
Marcelis L F M (1996) Sink stregth as a determinant of dry matter partitioning in the whole plant. J. Exp. Bot. 47:1281-1291. [ Links ]
Marfa V, D J Gollin, S Eberhard, D Mohnen, A Darvill, P Albersheim (1991) Oligogalacturonides are able to induce flowers to form on tobacco explants. Plant J. 1:217-225. [ Links ]
Mariña de la H C, L G Fernández, M S Saborit, P F Castillo, M M Nieto (2005) Comportamiento de la planta de caña de azúcar tratada con Enerplant cultivada en suelos vertisoles. Rev. Electr. Granma Cien. 9:1-6. [ Links ]
Mathieu Y, A Kurkdjian, H Xia, J Guern, A Koller, Spito A, M D O'Neil, P Albersheim, A Darvill (1991) Membrane responses induced by oligogalacturonides in suspension cultured tobacco cells. Plant J. 1:333-343. [ Links ]
McDougall A J, N M Rigby, P W Needs, E E Salvedran (1992) Movement and metabolism of oligogalacturonide elicitors in tomato shoots. Planta 188:566-574. [ Links ]
McLaren K (1976) The development of the CIE 1976 (L* a* b*) uniform color-space and color-difference formula. J. Soc. Dyers Color 92:338-341. [ Links ]
Peiris K, G Dull, R Leffler, S Kays (1998) Near infrared spectrometric technique for Nondestructive determination of soluble solids content in processing tomatoes. Amer. Soc. Hort. Sci. 123:1089-1093. [ Links ]
Plana D, M Alvarez, Florido M, R M Lara, J J Cabrera (2003) Actividad biológica del Pectimorf en la morfogénesis in vitro del tomate (Lycopersicum esculentum Mill.) var. Amalia. Cult. Trop. 24:29-33. [ Links ]
Priem B , K Gross (1992) Mannosyl- and xylosyl containing glycans promote tomato (Lycopersicum esculentum Mill.) fruit ripening. Plant Physiol. 98:399-401. [ Links ]
Ryan C A, E E Farmer (1991) Oligosaccharide signaling in plant: A current assessment. Annu. Rev. Plant Physiol. Mol. Biol. 42:651674. [ Links ]
Salisbury B F, W C Ross (1994) Fisiología Vegetal. Grupo Editorial Iberoamericana, S. A. de C. V. México. pp:127-202. [ Links ]
SIAP, Servicio de Información Agroalimentaria y Pesquera (2006) Análisis respecto al comportamiento de la producción y consumo del jitomate mexicano así como de su participación en el comercio internacional. Disponible en: http://www.siea.sagarpa.gob.mx/InfOMer/analisis/antomate.html. (Junio 2006). [ Links ]
Simpson S D, D A Ashford, D J Harvey, D J Bowles (1998) Short chain oligogalacturonides induce ethylene production and expression of the gene encoding aminocyclopropane 1-carboxylic acid oxidase in tomato plants. Glycobiology 6:8:579-583. [ Links ]
Ucan I Ch, F Sánchez del C, E Contreras, M T Corona T (2005) Efecto de la densidad de población y raleo de frutos sobre el rendimiento y tamaño del fruto en tomate. Rev. Fitotec. Mex. 28:3338. [ Links ]
Wardlaw I F (1990) The control of carbon partitioning in plants. New Phytol. 116:341-381. [ Links ]














