Introducción
La familia Cactaceae es un grupo de plantas suculentas originarias de América, con un elevado índice de endemismo en México (Hernández y Godínez Á., 1994). Se estima que, a nivel nacional, la familia ocupa el séptimo lugar en diversidad florística, con alrededor de 62 géneros y 677 especies (Villaseñor, 2016). Las cactáceas se distribuyen principalmente en zonas áridas o semiáridas de México, y son una fuente importante de alimento para humanos y animales (Godínez-Álvarez et al., 2003). Asimismo, muchas especies de esta familia son explotadas y representan un recurso de importancia económica y cultural (Alanís-Flores y Velasco-Macías, 2008).
Cabe resaltar que varias especies de la familia se encuentran bajo amenaza de extinción debido a actividades antropogénicas, tales como el cambio de uso de suelo, la extracción ilegal y la venta de ejemplares en el mercado negro (Hernández y Godínez Á., 1994; Godínez-Álvarez et al., 2003). Según la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (SEMARNAT, 2019), en México están registradas 983 plantas vasculares en alguna de las cuatro categorías establecidas (extintas, en peligro de extinción, amenazada y sujeta a protección especial), siendo la familia Cactaceae la que presenta mayor número, con 244 especies.
El género Stenocereus (A. Berger) Riccob. incluye 23 especies que se distribuyen desde el sur de los Estados Unidos de América hasta Sudamérica (Alvarado-Sizzo et al., 2018; POWO, 2024); habitan principalmente en el bosque tropical caducifolio y el matorral xerófilo (Arreola-Nava y Terrazas, 2003). Es uno de los géneros de mayor importancia económica y es considerado parte de la identidad cultural de México (Quiroz-González et al., 2018; Rzedowski, 2019).
En el estado de Sinaloa, México, Stenocereus está bien representado al contar con la presencia de siete especies: S. alamosensis (J.M. Coult.) A.C. Gibson & K.E. Horak, S. kerberi (K. Schum.) A.C. Gibson & K.E. Horak, S. martinezii (J.G. Ortega) Buxb., S. montanus (Britton & Rose) Buxb., S. standleyi (J.G. Ortega) Buxb., S. thurberi (Engelm.) Buxb. y S. quevedonis (J.G. Ortega) Buxb. (Vega-Aviña et al., 2021). Tres de estas se aprovechan de manera comercial: S. martinezii (centro y sur), S. montanus (zona serrana) y S. thurberi (norte) (Márquez-Salazar, 1997; Salomón-Montijo et al., 2022; Pío-Léon et al., 2023).
Stenocereus martinezii, llamada comúnmente pitayo de Martínez o pitaya roja (Salomón-Montijo et al., 2024), es una cactácea columnar arbórea de crecimiento diseminado-irregular con troncos bien definidos (Arreola-Nava y Terrazas, 2003). Esta especie es endémica de Sinaloa y se encuentra sujeta a protección especial (SEMARNAT, 2019; Pío-León et al., 2023). Se estima que tiene un área de distribución restringida (menor a 5000 km²) y su hábitat está experimentando una reducción causada por actividades agrícolas y ganaderas (Terrazas et al., 2013). Se ha registrado en seis municipios de Sinaloa, incluyendo Mocorito, Culiacán, Cosalá, Elota, San Ignacio y Mazatlán (Bravo-Hollis, 1978; Vega-Aviña et al., 2000; Arreola-Nava y Terrazas, 2003; GBIF, 2024). Sin embargo, existe un vacío de conocimiento en los detalles de su limitación geográfica, los cuales son importantes para su conservación.
Sinaloa sobresale como uno de los estados líderes en valor de producción agrícola a nivel nacional, con un estimado de mercado de aproximadamente 80,187 millones de pesos. Se cultivan cerca de un millón de hectáreas que, en 2023, produjeron 12,388,925 toneladas de alimentos (CODESIN, 2024). Sin embargo, esta actividad ha sido identificada como la principal causa de deforestación en el estado (Monjardín-Armenta et al., 2017), y probablemente esté propiciando aún más la fragmentación y pérdida de hábitat de especies de cactáceas, incluyendo S. martinezii.
La modelación de nicho ecológico (MNE) es una herramienta que permite caracterizar y predecir áreas potenciales de distribución de especies, utilizando la relación entre condiciones ambientales y registros geográficos (Anderson et al., 2011). Esta técnica ha sido aplicada en diversos campos científicos, como la biogeografía, la identificación de zonas para conservación y reforestación, la descripción de distribuciones geográficas y la proyección de posibles cambios en la distribución de especies ante escenarios climáticos futuros (Anderson et al., 2011). En particular, los estudios que analizan la distribución de cactáceas mediante MNE han focalizado sus esfuerzos en delimitar áreas favorables para la introducción de estas especies (Meza-Rangel et al., 2014). Además, estas técnicas han demostrado su utilidad en la expansión de áreas protegidas, conservación de cactáceas, identificación de zonas con potencial invasivo, control de poblaciones, y en la evaluación de los efectos del cambio climático (Mosco, 2019; Cavalcante et al., 2023; Mokotjomela et al., 2024).
La implementación de análisis predictivos que restrinjan áreas geográficas podría fortalecer las estrategias de manejo y conservación de S. martinezii, al tiempo que identificarían actividades humanas, como el cambio en el uso de suelo, que aceleran la pérdida de hábitat. Los objetivos de este estudio son definir la distribución potencial y área geográfica de S. martinezii, determinar las actividades antrópicas de mayor impacto en la vulnerabilidad del hábitat, así como ubicar las poblaciones con mayor riesgo de desaparecer y cuáles están actualmente en proceso de recuperación.
Materiales y Métodos
Área de estudio
Sinaloa está ubicado en el noroeste de México y colinda al norte con Sonora y Chihuahua, al este con Durango y Nayarit, al sur con Nayarit y el Océano Pacífico, y al oeste con el Golfo de California y Sonora. Cuenta con una superficie de 57,377 km², lo que equivale a 2.9% del territorio nacional, con una población aproximada de 3,026,943 habitantes (INEGI, 2021).
La superficie estatal cubre parte de tres provincias fisiográficas: la Sierra Madre Occidental, Sonorense y la Llanura Costera del Pacífico (CONABIO, 1997), donde se encuentran diversos tipos de clima. Estos incluyen: clima cálido subhúmedo A(w), que cubre 37% del territorio estatal; clima cálido BS1(h') con 21%; clima seco muy cálido y cálido BS0(h') con 18.5%; clima semicálido subhúmedo ACw, que abarca 11%; clima semiseco muy cálido y muy seco BW(h'), que representa 10%; y clima templado subhúmedo Cw, que ocupa 2.3% (INEGI, 2020). La temperatura media anual en el estado se ha establecido en alrededor de 25 °C, con temperaturas mínimas y máximas promedio de alrededor de 10.5 y 36 °C, mientras que la temporada de lluvias se presenta durante el verano en los meses de julio a septiembre, con una precipitación media anual de 790 mm (INEGI, 2020).
Datos de presencia
Entre los años 2015 y 2024, se registró la presencia de S. martinezii en 25 sitios diferentes en el estado de Sinaloa, de acuerdo con datos recopilados por investigadores de la Facultad de Biología de la Universidad Autónoma de Sinaloa (UAS) durante diversas exploraciones. A esto se sumaron 158 registros adicionales obtenidos del Global Biodiversity Information Facility (GBIF, 2024), los cuales fueron sometidos a un análisis exhaustivo para detectar posibles errores de identificación y localización geográfica. Este proceso incluyó la verificación de las fotografías y coordenadas proporcionadas por los autores al momento de su inclusión en GBIF. La identificación de S. martinezii en todos los casos fue realizada utilizando las claves dicotómicas de Arreola-Nava y Terrazas (2003). Con el fin de reducir la autocorrelación espacial, se descartaron los puntos de ocurrencia repetidos dentro de un radio de 10 km (Radosalvljevic y Anderson, 2014), seleccionando finalmente 53 puntos de ocurrencia para el análisis (Fig. 1A).
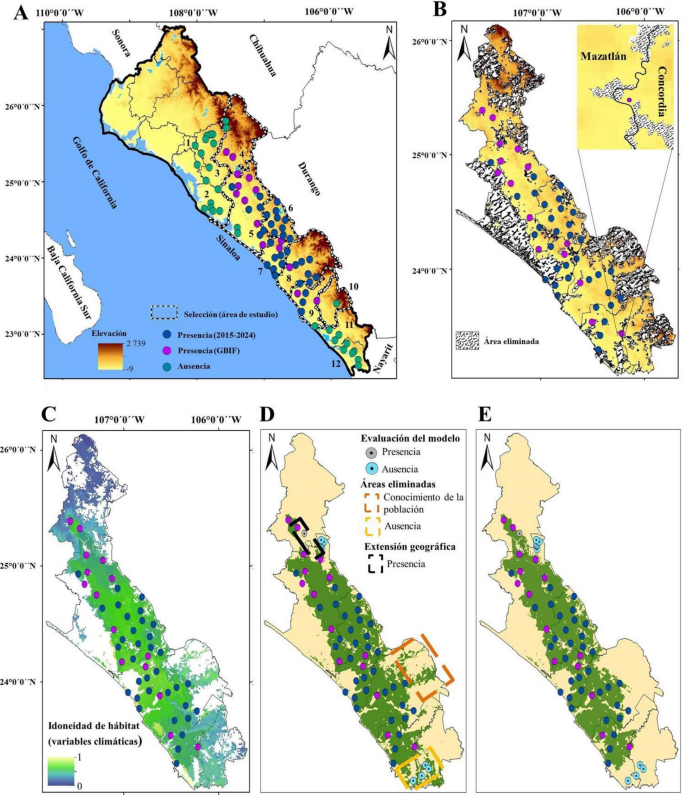
Figura 1: Distribución geográfica y modelado de nicho ecológico de Stenocereus martinezii (J.G. Ortega) Buxb., con base en los datos climáticos en Sinaloa, México. A. registros geográficos históricos obtenidos del GBIF y determinados por salida a campo en este estudio; B. área accesible (M) para Stenocereus martinezii. Raster y salida binomial del MNE (C y D). E. edición final del mapa binario del MNE. Municipios de Sinaloa: Salvador Alvarado (1); Navolato (2); Mocorito (3); Badiraguato (4); Culiacán (5); Cosalá (6); Elota (7); San Ignacio (8); Mazatlán (9); Concordia (10); El Rosario (11); Escuinapa (12).
Variables ambientales
Para la caracterización ambiental del área de estudio, se utilizaron datos climáticos y de teledetección de características de la vegetación. Se obtuvieron 19 variables climáticas de la base de datos WorldClim v. 2.1 (Fick y Hijmans, 2017) con una resolución espacial de 30 arcosegundos. Estas variables climáticas se generaron a partir de la interpolación de datos históricos de estaciones climáticas correspondientes al período de 1970 a 2000.
En cuanto a los datos de vegetación, nueve imágenes del índice de diferencia normalizada (NDVI) con una resolución espacial y temporal de 250 m y 16 días fueron obtenidas de información registrada por el sensor MODIS (Espectrorradiómetro de Imágenes de Resolución Moderada) del satélite Terra correspondiente a la estación de ausencia de precipitaciones (enero a junio) de 2023 (MODIS, 2024). El NDVI determina la biomasa relativa (el verdor de la vegetación) con base en bandas espectrales calculadas a partir de la reflejancia florística. Los valores oscilan entre -1 y +1 que varían dependiendo, por ejemplo, de la composición florística de un área determinada (Quipildor et al., 2017). Además, se ha comprobado que el NDVI es una variable clave en el modelado de MNEs de diversas especies vegetales y ha sido ampliamente utilizado en investigaciones recientes (Khan et al., 2022; Zhang et al., 2022).
Datos de entrada
Establecer el área hipotética de accesibilidad para la especie (M), la cual determina el área dentro del cual se calibran los modelos, es un paso importante para el desarrollo de modelos predictivos, como el MNE (Barve et al., 2011). La base biológica de una especie, fundamentada en un conocimiento preciso de su distribución y puntos de presencia, como ocurre con S. martinezii, es esencial para delimitar el área accesible. Este proceso puede apoyarse en la creación de un buffer alrededor de los puntos geográficos previamente identificados (Warren y Seifert, 2011).
En el análisis, la máscara se diseñó utilizando la relación entre puntos de presencia y ausencia de la especie en el estado. Se excluyeron de este análisis los municipios de Sinaloa que no cuentan con registros históricos ni evidencia de la presencia de la especie. Además, dentro de los municipios seleccionados, se excluyeron las áreas correspondientes a 14 categorías de capas de uso de suelo, ya que no se cuenta con evidencia alguna de la distribución de la especie en esas zonas. Las capas fueron descargadas como mapas vectoriales de la plataforma del Instituto Nacional de Estadística y Geografía (Uso de Suelo y Vegetación, serie VII, INEGI, 2021). Incluyeron categorías como manglares, cuerpos de agua, asentamientos humanos, acuicultura, bosques de encino o pino (bosques de pino, encino, encino-pino y pino-encino), y áreas de agricultura de riego (anual, anual permanente y semipermanente, permanente, semipermanente y semipermanente-permanente) (Fig. 1 A, B).
Dentro del área que resultó adecuada en el primer modelado con las variables ambientales, se sumaron los datos de NDVI, lo cual permitió obtener un panorama más amplio para la calibración de los MNEs de S. martinezii. A partir de excursiones de campo llevadas a cabo en áreas específicas donde existían dudas sobre la presencia o ausencia de esta cactácea, se ajustó previamente el mapa generado con los datos climáticos para reducir errores de omisión y comisión. Además, se recolectaron datos, mediante preguntas directas a los habitantes cercanos a las localidades registradas.
Se redujo la intercorrelación entre las capas de datos climáticos y NDVI. Para este propósito, por medio de ArcGIS v. 10.4.1 (ESRI, 2016), se realizó un análisis de componentes principales (PCA) para cada grupo de variables ambientales (climáticas y NDVI) y se seleccionaron los primeros componentes que en conjunto tuvieron un poder explicativo de varianza >90%, respectivamente.
Modelo de nicho ecológico
El MNE para S. martinezii se desarrolló en Maxent v. 3.4.1 (Phillips et al., 2017). Este software reconstruye el nicho ecológico de una especie solo con los datos de presencia y variables ambientales (Elith et al., 2006). Así mismo, se ha demostrado que es robusto aún en casos de ocurrencias geográficas escasas (Pearson et al., 2006) y se ha demostrado que ha tenido un buen desempeño en estudios comparativos (Warren y Seifert, 2011).
Se implementó Maxent con 10 repeticiones bootstrap en donde 70 y 30% de los registros geográficos se seleccionaron aleatoriamente para el entrenamiento y prueba de los modelos, respectivamente. El resto de los parámetros se dejaron como predeterminado en Maxent. Los MNEs se probaron con diferentes clases de respuestas (LQHTP, LQHP, LQHT y LQH) y β (0.8, y 1), resultando en ocho combinaciones paramétricas distintas para cada modelo. Se utilizó la mediana como medida de estimación y el rendimiento de cada combinación paramétrica fue evaluado por la característica operativa parcial del receptor (pROC) (Lobo et al., 2008).
El pROC permite evaluar la robustez de los modelos predictivos, tomando en cuenta solo el error de omisión como medida de análisis de los datos de entrada (Peterson et al., 2008). En cambio, el ROC tradicional pondera errores de omisión y comisión polarizando información espacial de los errores del modelo (Barve et al., 2011). ROC parcial se determinó por medio de plataforma bioinformática en línea NicheToolbox (Osorio-Olvera et al., 2018). Se consideró el umbral de error de omisión admitido de 5% (Peterson et al., 2008) y se realizaron 500 repeticiones bootstrap basado en submuestras aleatorias de 50% de los puntos de prueba. Así mismo, las relaciones de AUC se compararon con el rendimiento de un clasificador aleatorio (Lobo et al., 2008), respectivamente.
Las combinaciones de los valores de parámetros que tuvieron un rendimiento significativo (P<0.05) se analizaron mediante ENMtools v. 1.4.4 (Warren et al., 2010). Se seleccionó el mejor modelo de acuerdo con el valor más bajo del criterio de información de Akaike para tamaño de muestra reducido (AICc) (Warren y Seifert, 2011). Las salidas logísticas en Maxent se convirtieron en mapas binarios de presencia/ausencia con base en una tasa de error de omisión de 5% (E=5%) de los datos del umbral mínimo logístico de presencia (Peterson et al., 2008).
Cálculos del área geográfica
El área geográfica ocupada por S. martinezii se determinó sumando los polígonos de presencia generados a partir del mapa binario, utilizando la función 'calcular geometría' en km² con la proyección Cónica Equiárea de Albers en ArcGIS v. 10.2.2 (Saupe et al., 2015). Así mismo, se eliminaron de esta área las capas de pastizal cultivado e inducido, así como la agricultura de temporal (anual, anual y permanente, y permanente), ya que se identificaron como factores de riesgo para la reducción de las poblaciones, debido a la susceptibilidad de estos ambientes a los incendios forestales. Por otro lado, la capa de vegetación secundaria se consideró como zonas geográficas en proceso de recuperación de la especie, ya que así está reportado para otras especies del mismo género en el norte del estado (Salomón-Montijo et al., 2016).
Resultados
Caracterización del área M
De acuerdo con los puntos de ocurrencias geográficas, el área M de S. martinezii abarcó siete municipios en el estado de Sinaloa, siendo Badiraguato su límite septentrional de distribución y Concordia el meridional (Fig. 1 A, B). Además, los datos indicaron que esta especie se encuentra a altitudes que varían entre 2 y 700 metros, siendo Culiacán y Cosalá los municipios con el mayor número de puntos de ocurrencia para esta especie (Fig. 1 A, B).
MNE con variables ambientales (área de calibración)
Del total de los componentes principales (PC) resultantes del PCA derivados para los datos climáticos en el área M, se seleccionaron cinco, que en conjunto explicaron >99% de la variación total. Los primeros dos PCs se relacionaron principalmente con la precipitación anual (BIO12) y la temperatura media del trimestre más cálido (BIO18) y la precipitación del trimestre más húmedo (BIO16), mientras que para los PC restantes (3, 4 y 5), variables relacionadas con la temperatura fueron las que tuvieron mayor poder explicativo (Cuadro 1).
Cuadro 1: Matriz de puntuación de autovectores para el análisis de componentes principales (PCA). UM=unidad de medida.
| Variables | UM | PC-1 | PC-2 | PC-3 | PC-4 | PC-5 |
| Temperatura media anual (BIO1) | °C | -0.01 | 0.00 | -0.02 | 0.02 | 0.04 |
| Intervalo medio diurno (media por mes (temperatura máxima - temperatura mínima)) (BIO2) | °C | 0.00 | 0.01 | 0.01 | 0.01 | 0.03 |
| Isotermalidad (BIO2/BIO7) (× 100) (BIO3) | °C | 0.00 | -0.02 | -0.02 | -0.03 | -0.04 |
| Estacionalidad de la temperatura (SD × 100) (BIO4) | °C | -0.16 | 0.44 | 0.54 | 0.68 | 0.03 |
| Temperatura máxima del mes más cálido (BIO5) | °C | 0.00 | 0.01 | 0.01 | 0.03 | 0.08 |
| Temperatura mínima del mes más frío (BIO6) | °C | 0.00 | -0.01 | -0.03 | 0.00 | 0.02 |
| Intervalo de temperatura anual (BIO5-BIO6) (BIO7) | °C | 0.00 | 0.02 | 0.03 | 0.03 | 0.06 |
| Temperatura media del trimestre más húmedo (BIO8) | °C | -0.01 | 0.01 | -0.01 | 0.03 | 0.03 |
| Temperatura media del trimestre más seco (BIO9) | °C | 0.00 | 0.00 | -0.01 | 0.02 | 0.06 |
| Temperatura media del trimestre más cálido (BIO10) | °C | -0.01 | 0.01 | -0.01 | 0.03 | 0.04 |
| Temperatura media del trimestre más frío (BIO11) | °C | 0.00 | 0.00 | -0.02 | 0.01 | 0.03 |
| Precipitación anual (BIO12) | mm | 0.78 | -0.18 | 0.40 | -0.10 | 0.23 |
| Precipitación del mes más húmedo (BIO13) | mm | 0.18 | -0.04 | 0.07 | 0.15 | 0.50 |
| Precipitación del mes más seco (BIO14) | mm | 0.01 | 0.00 | 0.03 | -0.01 | 0.03 |
| Temporalidad de la precipitación (Coeficiente de variación) (BIO15) | mm | -0.02 | -0.01 | -0.15 | 0.14 | -0.06 |
| Precipitación del trimestre más húmedo (BIO16) | mm | 0.45 | -0.17 | -0.45 | 0.60 | -0.38 |
| Precipitación del trimestre más seco (BIO17) | mm | 0.04 | 0.01 | 0.16 | -0.12 | 0.02 |
| Precipitación del trimestre más cálido (BIO18) | mm | 0.33 | 0.86 | -0.31 | -0.23 | 0.01 |
| Precipitación del trimestre más frío BIO19) | mm | 0.13 | 0.05 | 0.44 | -0.22 | -0.73 |
Las salidas de los PCs analizados en Maxent con las diferentes combinaciones paramétricas (LQHTP, LQHP, LQHT y LQH; β=0.8 y 1) tuvieron un poder explicativo significativo mejor que la aleatoriedad (pROC, P<0.05). Sin embargo, la combinación LQHPT/β=1 arrojó el valor más bajo de AICc y por lo tanto se seleccionó como la mejor parametrización (Cuadro 2). La extensión geográfica de distribución estimada con los datos climáticos abarcó amplias áreas en la mayor parte del área M (Fig. 1 C, D).
Cuadro 2: Resultados del criterio de información de Akaike (AICc) para las diferentes combinaciones de parámetros de los modelos de nicho ecológico. L=clases de entidad linear, Q=cuadrática, H=bisagra, T=umbral y P=producto; coeficiente de regularización (β); error estándar de la media (ES); índice de diferencia normalizada (NDVI). Los datos en letras en negritas indican los parámetros seleccionados para el MNE (Modelación de Nicho Ecológico).
| Variables | Combinaciones paramétricas | AICc | ES |
| LQHTP/β = 0.8 | 2226.62 | 2021.90 | |
| LQHTP/β = 1 | 1111.65 | 41.55 | |
| LQHP/β = 0.8 | 1337.41 | 403.50 | |
| Climáticas | LQHP/β = 1 | 1281.88 | 273.27 |
| LQHT/β = 0.8 | 1675.63 | 627.24 | |
| LQHT/β = 1 | 1405.32 | 514.24 | |
| LQH/β = 0.8 | 1760.34 | 1080.61 | |
| LQH/β = 1 | 1365.67 | 368.19 | |
| LQHTP/β = 0.8 | 1348.65 | 402.97 | |
| LQHTP/β = 1 | 969.13 | 22.73 | |
| LQHP/β = 0.8 | 1134.21 | 222.53 | |
| NDVI | LQHP/β = 1 | 1052.06 | 155.21 |
| LQHT/β = 0.8 | 2536.02 | 2092.14 | |
| LQHT/β = 1 | 1117.09 | 197.71 | |
| LQH/β = 0.8 | 1473.40 | 142.11 | |
| LQH/β = 1 | 1013.43 | 80.91 |
Evaluación del área de calibración
En relación con la validez del mapa climático, se redujeron las áreas de presencia hacia el noreste de San Ignacio y el sur de los municipios Mazatlán y Concordia, al no poderse confirmar por exploración e información proporcionada por pobladores la presencia de la especie en esas regiones (Fig. 1 D, E). En cuanto a Badiraguato y Culiacán, se incorporó una franja que conecta las poblaciones de ambos municipios, debido a que se registró la presencia de la especie en esa zona posteriormente al primer MNE (Fig. 1 D, E).
MNE final (área de calibración y NDVI)
Para los datos de NDVI, las evaluaciones de pROC indicaron que todos estos modelos fueron significativamente mejores que al azar (P<0.05). Los primeros cinco PCs en conjunto explicaron >99% de la varianza total de NDVI. En cuanto a la selección de los modelos predictivos, la combinación paramétrica LQHPT/β=1 fue la más robusta debido a que presentó el valor más bajo de AICc (Cuadro 2). Geográficamente, los resultados del modelo sugirieron un patrón similar al observado con los datos climáticos. Sin embargo, en este mapa se evidenciaron restricciones importantes, mediadas por pequeños parches de ausencia de la especie, ubicados principalmente en Culiacán y Cosalá, lo que corresponde a una mayor precisión del mapeo según el conocimiento derivado de registros históricos, actuales y la experiencia de expertos (Fig. 2A, B).
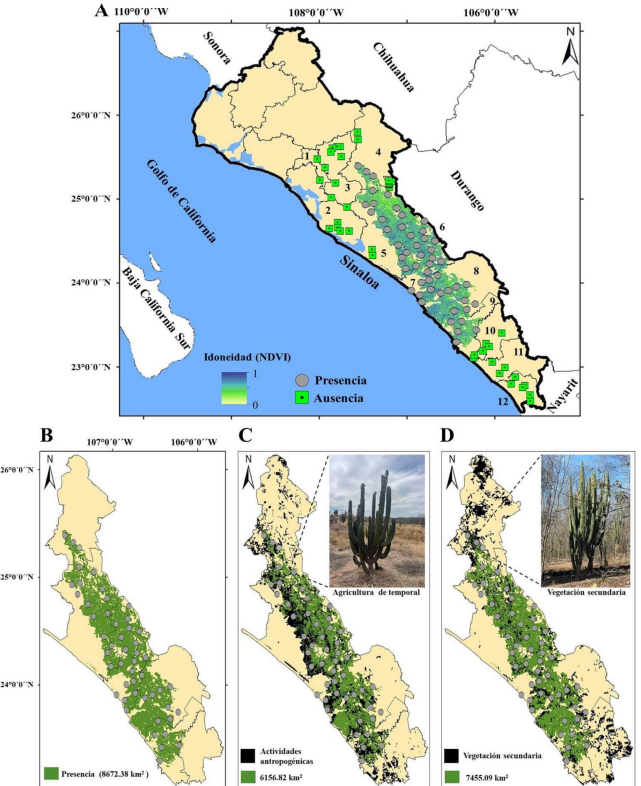
Figura 2: Distribución potencial de Stenocereus martinezii (J.G. Ortega) Buxb. basado en los datos multitemporales del NDVI y detección de áreas vulnerables de hábitat en Sinaloa, México. Mapas ráster y binomial (A y B) que muestran la vulnerabilidad del hábitat en relación con actividades antropogénicas, incluyendo áreas de pastizal y agricultura de temporal, así como vegetación secundaria (C y D). Municipios de Sinaloa: Salvador Alvarado (1); Navolato (2); Mocorito (3); Badiraguato (4); Culiacán (5); Cosalá (6); Elota (7); San Ignacio (8); Mazatlán (9); Concordia (10); El Rosario (11); Escuinapa (12).
Tomando como base la parametrización geográfica de este último mapa, se pudo evidenciar que la distribución potencial de S. martinezii abarca aproximadamente 8672.38 km² que representa 15.12% de la cobertura estatal de Sinaloa. Esta especie se encuentra con una mayor extensión en los municipios Culiacán, San Ignacio y Cosalá, y en menor medida en Badiraguato y Concordia (Cuadro 3; Fig. 2B).
Cuadro 3: Análisis de área ocupada, área en riesgo y en recuperación de Stenocereus martinezii (J.G. Ortega) Buxb. en diferentes municipios de Sinaloa, México. El valor numérico entre paréntesis indica el porcentaje del área de hábitat por municipio.
| Municipios | Área ocupada | Área en riesgo | Área en recuperación | |
| Mapa binomial en km2 | Pastizal en km2 | Agricultura de temporal en km2 | Vegetación secundaria en km2 | |
| Badiraguato | 317.80 (3.67%) | 1.19 (0.37%) | 116.86 (36.76%) | 91.71 (28.85%) |
| Culiacán | 2634.90 (30.39%) | 19.63 (0.74%) | 1000.08 (37.95%) | 393.41 (14.93%) |
| Cosalá | 1682.85 (19.39%) | 8.12 (0.482%) | 319.93 (19.00%) | 159.66 (9.47%) |
| Elota | 970.52 (11.19%) | 18.64 (1.92%) | 341.96 (35.24%) | 193.54 (19.93%) |
| San Ignacio | 1973.80 (22.75%) | 20.67 (1.05%) | 283.47 (14.36%) | 252.19 (12.75%) |
| Mazatlán | 1052.80 (12.13%) | 74.08 (7.03%) | 307.82 (29.19%) | 119.94 (11.37%) |
| Concordia | 39.71 (0.46%) | 0 (0%) | 3.11 (7.83%) | 6.84 (17.24%) |
| Total | 8672.38 (100%) | 142.33 (1.64%) | 2373.23 (27.36%) | 1217.29 (14.03%) |
Impacto del cambio de uso de suelo
Dentro de esta zona potencial del hábitat de S. martinezii, alrededor de 43% (3732.85 km²) se clasificó como áreas vulnerables para la especie, ya que han sido o están siendo constantemente modificadas en relación con el cambio en el uso del suelo (Fig. 2C, D).
Se estima que las áreas con mayor riesgo de desaparecer representan aproximadamente 29% (2515.56 km²) del total del hábitat ocupado por S. martinezii, siendo la agricultura de temporal la actividad que genera un impacto más significativo en esta categoría (Fig. 2C). Culiacán, Elota y Cosalá son los municipios con la mayor extensión geográfica en riesgo, y también cuentan con la mayor superficie en términos de recuperación de hábitat (Cuadro 3). En contraste, Badiraguato y Concordia son los municipios que tienen la menor extensión geográfica en ambas clasificaciones (área en riesgo de desaparecer y en recuperación) (Cuadro 3).
Discusión
Área M
El análisis de los puntos de ocurrencia geográfica de S. martinezii, basado en registros históricos y en salidas de campo realizadas durante el estudio, indicó que la especie está presente en siete municipios de Sinaloa: Badiraguato, Culiacán, Cosalá, Elota, San Ignacio, Mazatlán y Concordia. La presencia de S. martinezii en Badiraguato y Concordia constituye nuevos registros estatales. Estas observaciones, en relación con los límites municipales, son congruentes con lo reportado por diversos autores (Bravo-Hollis, 1978; Vega-Aviña et al., 2000; Arreola-Nava y Terrazas, 2003). Sin embargo, Bravo-Hollis (1978) menciona un punto específico de presencia de la especie en la frontera entre Mocorito y Culiacán (en la comunidad de Pericos, Mocorito). No obstante, los datos recopilados en este estudio indican que actualmente S. martinezii no se encuentra en este municipio. En este sentido, cabe la posibilidad de que la especie se haya restringido a una región muy limitada de Mocorito, como se observó en Badiraguato y Concordia, y debido al crecimiento de tierras agrícolas o urbanas, se haya deforestado y extirpado esas poblaciones de los registros históricos para el estado. Además, es importante destacar que los registros de S. martinezii se encontraron en elevaciones entre 2 y 700 metros sobre el nivel de mar, representando un nuevo límite superior de altitud comparado a los 100 que reporta la literatura (Terrazas et al., 2013).
Área de calibración (variables climáticas)
La distribución mapeada basada en los datos climáticos y su posterior edición por su validación en campo fueron importantes para la calibración del modelo final con los datos multitemporales del NDVI. Las variables ambientales con mayor capacidad explicativa en el modelo climático estuvieron principalmente determinadas por la combinación de tres factores: la precipitación anual (BIO12), la temperatura media del trimestre más cálido (BIO18), así como la precipitación del trimestre más húmedo (BIO16). Esto sugiere que el hábitat óptimo para la especie se encuentra en climas con altas precipitaciones y temperaturas elevadas.
Estos resultados coinciden con investigaciones previas, como las de Mosco (2019) y Rosas-Reinhold et al. (2022), quienes subrayan que, aunque la temperatura es crucial para la distribución de algunas cactáceas, la precipitación desempeña un papel significativo en la limitación de su distribución geográfica. Además, se ha observado que la aridez es un factor determinante de la riqueza y el endemismo en cactáceas. Sin embargo, también se ha señalado que otros factores climáticos desempeñan un papel esencial en la formación de los nichos ecológicos, lo que explica las diferencias en los nichos ocupados por distintas especies de cactáceas (Mosco et al., 2019).
En cuanto a la temperatura, no se han realizado estudios específicos que analicen esta relación en S. martinezii. Sin embargo, es posible que esta variable juegue un papel importante en la regulación de su ciclo reproductivo, dado que se ha demostrado que Stenocereus queretaroensis (F.A.C. Weber) Buxb. requiere de ciertos cambios de temperatura para un desarrollo reproductivo adecuado (Gudiño y De la Barrera, 2014). Asimismo, se ha informado que las temperaturas bajas, como las de ambientes templados, limitan la distribución de las cactáceas columnares, ya que no pueden tolerar heladas sin sufrir daños en sus tejidos (Gibson y Nobel, 1986). A diferencia del género Stenocereus, otras cactáceas como Echinocereus Engelm. desarrollaron adaptaciones morfológicas para proteger la areola de las bajas temperaturas, lo que les permitió promover la diversificación de este linaje a estos ambientes (Sánchez et al., 2015). Esto podría explicar la ausencia de S. martinezii en el norte del estado y zonas altas de la Sierra Madre Occidental, donde las temperaturas descienden por debajo del punto de congelación. Sin embargo, S. thurberi y S. montanus han logrado adaptarse a sitios donde es recurrente bajen las temperaturas, como el Desierto Sonorense y lomeríos de la Sierra Madre Occidental (Parker, 1988; Turner et al., 1995; Salomón-Montijo et al., 2022).
MNE final
El modelo sugiere que S. martinezii se distribuye desde Badiraguato, en el norte de su distribución, hasta Mazatlán y Concordia, en el sur, cubriendo aproximadamente 15% (8672.38 km²) del área estatal de Sinaloa. Estos valores son superiores a los reportados por Terrazas et al. (2013), quienes estimaron una extensión menor a 5000 km². Sin embargo, al ajustar el área ocupada por S. martinezii utilizando las capas de cambio en el uso del suelo, se determinó una extensión geográfica de alrededor de 4900 km², lo cual coincide con lo reportado por dichos autores. Se observó que la distribución de S. martinezii se concentra principalmente en los municipios del centro de Sinaloa, los cuales también presentan la mayor extensión en términos de vulnerabilidad de hábitat.
Efecto del cambio de uso de suelo
La agricultura de temporal se identificó como la variable con mayor riesgo para la reducción de las poblaciones de S. martinezii, lo que podría explicarse por el hecho de que gran parte del producto interno bruto del estado está vinculado a estas actividades, fomentando su implementación (CODESIN, 2024). Este tipo de agricultura ha sido señalado como uno de los principales factores de deforestación en Sinaloa (Monjardín-Armenta et al., 2017). En contraste, dentro de las áreas vulnerables, se determinó que aproximadamente 1227.29 km² se encuentra en proceso de recuperación debido a que estas poblaciones colonizaron áreas que anteriormente fueron impactadas y en la actualidad están en proceso de sucesión vegetativa (vegetación secundaria). Esto coincide con Entrocassi et al. (2020), al mencionar que estos tipos de vegetación llegan a presentar especies de valor forestal, que son una evidencia del estado actual de recuperación de los bosques que anteriormente habían sido sobreexplotados. Esto los hace importantes para implementar vigilancia sobre ellos y evitar de nuevo ser desmontados.
Se debe prestar especial atención a las poblaciones de S. martinezii en los municipios Badiraguato y Concordia, ya que su distribución es más limitada en comparación con las poblaciones de otros municipios. Esta situación se ve agravada por la alta representación de áreas vulnerables que, en algunos casos, abarca más de 50% de la cobertura total ocupada por esta especie. A pesar de que S. martinezii no se restringe a divisiones geográficas limitadas por decisiones políticas, muchas de las decisiones y acciones para la conservación se promulgan por gobiernos locales o regionales (Pío-León et al., 2023). Por tal motivo es pertinente aplicar las acciones competentes para evitar la desaparición de esta especie dentro de los límites municipales antes mencionados.
Entre las plantas vasculares endémicas de Sinaloa, S. martinezii se sitúa como una de las especies prioritarias para la conservación (Pio-León et al., 2023), y está clasificada en riesgo según las normas mexicanas (SEMARNAT, 2019). Esta situación podría deteriorarse si no se implementan medidas preventivas para evitar la pérdida y fragmentación de hábitat, las cuales han sido identificadas como las principales causas de la pérdida de biodiversidad y la degradación de ecosistemas a nivel global (Wu, 2013). Además, se ha informado que la fragmentación puede tener repercusiones en la reducción del núcleo de hábitat y un incremento en el efecto borde (Fahrig, 2003; Ewers et al., 2007), lo que compromete de manera significativa la supervivencia de las especies.
El mapeo de S. martinezii y la identificación de las áreas vulnerables son esenciales para determinar las zonas prioritarias para la conservación y reforestación de esta especie. En este sentido, Pío-León et al. (2024) proponen la creación de áreas prioritarias para la conservación considerando la presencia de especies endémicas, con importancia biocultural y valor económico, encontrando que S. martinezii y otras especies con distribución focalizada del centro del estado de Sinaloa definen áreas prioritarias para la conservación que podrían ser decretadas como reservas.
Lo anterior tendría como consecuencia la protección y conservación de otras especies con distribución restringida que cohabitan en esos sitios. Esto implica que las autoridades locales y regionales deben crear políticas integradas que enfoquen sus esfuerzos en la preservación de los hábitats, la promoción de prácticas agrícolas sostenibles y el apoyo a iniciativas de reforestación con especies nativas. Además, es vital llevar a cabo campañas de educación y concienciación para involucrar a las comunidades, fomentando así un compromiso compartido con la protección del patrimonio natural del estado. Los datos recopilados servirán como un punto de partida para el monitoreo de las poblaciones de S. martinezii y la evaluación de la ganancia o pérdida de hábitat a corto plazo, utilizando técnicas de monitoreo geoespacial.
Contribución de autores
JITA, BSM y MGMO concibieron la idea. JITA, BSM, MGMO, JSD y GMS realizaron el trabajo de campo. JITA se encargó del manejo de software. JITA y BSM analizaron los datos y prepararon el manuscrito. Todos los autores contribuyeron con mejoras y aprobaron la versión final del manuscrito.











 nueva página del texto (beta)
nueva página del texto (beta)



