Introducción
Los hongos patógenos de artrópodos evolucionaron para explotar a la gran mayoría de especies de insectos y algunas de arácnidos, y comprenden una amplia gama de especies morfológica, filogenética y ecológicamente diversa (Araújo y Hughes, 2016). Varias especies de hongos patógenos de artrópodos de importancia ecológica, agrícola y medicinal se incluyen en el phylum Ascomycota y son utilizadas como agentes de control biológico para regular poblaciones de insectos que afectan la agricultura; algunas son cultivadas en sustratos orgánicos para la producción de metabolitos como la Beauvericina y Cordicepina (Maina et al., 2018). La mayoría de las especies de hongos patógenos de artrópodos se clasifican en el orden Hypocreales en el complejo de especies de Cordyceps s.l., que constituía un género de la familia Clavicipitaceae donde se agrupaban hongos parásitos de varios órdenes de insectos y arácnidos, de semillas y de otras especies fúngicas de hábitos hipogeos como las del género Elaphomyces T. Nees (Sung et al., 2007a). Las especies de este complejo, mediante un análisis filogenético combinado con datos morfológicos y ecológicos, se reclasificaron reconociendo las familias Clavicipitaceae, Cordycipitaceae y Ophiocordycipitaceae. Actualmente este grupo de hongos está constituido por más de 1000 especies con distribución a nivel mundial, excepto en las regiones polares (Sung et al., 2007b).
En México se han registrado 48 especies de hongos del complejo Cordyceps s.l., que son patógenos de artrópodos, la mayoría de zonas del occidente, sur y centro del país (Mains, 1958; Pérez-Silva, 1977, 1978; Blackwell y Gilbertson, 1981; Sánchez-Peña, 1990; Ulloa y Benavides, 1991; Rodríguez et al., 1993; Carrión et al., 1996; Rubio-Bustos et al., 1999; Guzmán et al., 2001; Lara-Reyna, 2010; Hernández-Velázquez et al., 2011; Casique-Valdés et al., 2011; Castro-Bustos et al., 2012, 2020; García et al., 2013; Carrillo-Benítez et al., 2013; Castro-Bustos, 2015; Berlanga-Padilla et al., 2016b, 2018; Pérez-Villamares et al., 2017; Luz et al., 2019; Pérez-Silva et al., 2020; Tello-Salgado et al., 2021; López-Rodríguez et al., 2022).
En el centro de México, particularmente en el estado de Morelos, se han registrado 13 especies de este grupo de hongos. La primera contribución fue la de Pérez-Silva (1977), quien registró Cordyceps militaris Fr. en el municipio Tepoztlán, en el Cerro del Tepozteco y a C. farinosa (= Paecilomyces farinosus (Holmsk.) Kepler, B. Shrestha & Spatafora), para los municipios Huitzilac y Tepoztlán. Más tarde, Carrión et al. (1996) registraron a Beauveria bassiana (Bals.-Criv.) Vuill. y Metarhizium anisopliae (Metschn.) Sorokin en hormigas cortadoras de hojas (Atta mexicana F. Smith, 1858) en el municipio de Cuernavaca. Hernández-Velázquez et al. (2011) registraron tres especies de hongos entomopatógenos (Beauveria bassiana, Metarhizium anisopliae y Paecilomyces sp.) al ser aislados de insectos en suelos cultivados con maíz. Posteriormente, Castro-Bustos et al. (2012) determinaron a Cordyceps militaris sobre pupas de lepidópteros; Ophiocordyceps sphecocephala (Klotzsch ex Berk.) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora, parásito de himenópteros; O. melolonthae (Tul. & C. Tul.) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora, sobre larvas de coleópteros y Paraisaria gracilioides (Kobayasi) C.R. Li, M.Z. Fan & Z.Z. Li (= Ophiocordyceps gracilioides), como parásito de larvas de coleópteros. Brunner-Mendoza et al. (2017) determinaron a Metarhizium robertsii J.F. Bisch., S.A. Rehner & Humber y a M. pinghaense Q.T. Chen & H.L. Guo, mencionando que fueron aislados del suelo y de coleópteros. Castro-Bustos et al. (2020) estudiaron a Paraisaria gracilis (Grev.) Luangsa-ard, Mongkols. & Samson (= Ophiocordyceps gracilis), sobre larvas de lepidópteros, y a Beauveria scarabaeidicola (Kobayasi) S.A. Rehner & Kepler (= Cordyceps scarabaeicola), como parásito de coleópteros adultos de Phyllophaga Harris 1827; ambas especies del municipio Cuernavaca; y a Purpureocillium atypicola (Yasuda) Spatafora, Hywel-Jones & Luangsa-ard, del municipio Tlaquiltenango, sobre arácnidos. Por último, Tello-Salgado et al. (2021) aislaron cepas de Beauveria bassiana y Lecanicillium aphanocladii Zare & W. Gams del escarabajo Pseudips mexicanus Hopkins 1905 en Montecasino, municipio de Huitzilac.
Morelos, al ser el segundo estado más pequeño de la República Mexicana y contar con una gran diversidad biológica y de ecosistemas, derivado de sus tres zonas climáticas (templada, semicálida y cálida) y albergar ocho tipos de vegetación (Magaña y Galicia, 2020), ha sido el objeto de estudio por varios autores, y es una oportunidad para estudiar a los hongos patógenos de insectos y arácnidos. Es probable que el número de especies registradas sea mayor hasta lo hoy conocido (Valenzuela et al., 2020), por lo que el presente estudio tiene como objetivo actualizar el conocimiento sobre las especies de Cordyceps s.l patógenos de artrópodos del estado de Morelos, describir nuevos registros para la micobiota mexicana, proporcionar comentarios taxonómicos y discutir acerca de las especies y su distribución.
Materiales y Métodos
Área de estudio
Morelos tiene una extensión de 4878.9 km2, representa 0.2% del territorio nacional; la superficie estatal comprende las provincias fisiográficas Sierra Madre del Sur y el Eje Neovolcánico (Guerrero et al., 2020)(Fig. 1). Las zonas centro, centro-norte y centro-sur están conformadas por sierras. En la parte norte se encuentra altitudes superiores a 3000 m, en la parte central las sierras están separadas por valles, llanuras y algunos lomeríos, mientras que, en la parte occidental, en su mayoría, son sierras en forma de meseta, separadas por lomeríos y valles. En el extremo nororiental del estado se encuentra la mayor elevación, el volcán Popocatépetl con 5380 m s.n.m., y el punto más bajo se localiza en el cauce del Río Amacuzac a 800 metros de altitud (Contreras-McBeath et al., 2006; INEGI, 2023).
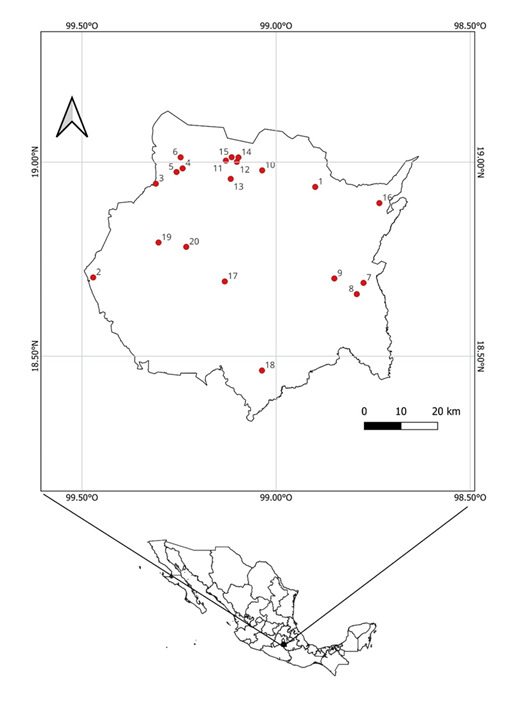
Figura 1: Ubicación geográfica de las localidades donde se recolectaron y hay registros de Cordyceps s.l. en el Estado de Morelos, México. (Municipio: localidad); 1. Atlatlahucan: Atlatlahucan; 2. Coatlán del Río: Michapa; 3. Cuernavaca: Buena Vista del Monte; 4. Cuernavaca: Jardín Botánico (Universidad Autónoma de Estado de Morelos); 5. Cuernavaca: Santa María Ahuacatitlán; 6. Huitzilac: Montecasino; 7. Jantetelco: Chalcatzingo; 8. Jonacatepec: Tetelilla; 9. Jonacatepec:Tlayca; 10. Tepoztlán: Amatlán de Quetzalcoátl; 11. Tepoztlán: Autopista a Cuautla, 5 km al oeste de Tepoztlán; 12. Tepoztlán: Cerro del Tepozteco; 13. Tepoztlán: San Andrés de la Cal; 14. Tepoztlán: San Juan Tlacotenco; 15. Tepoztlán: Santo Domingo Ocotitlán; 16. Tetela del Volcán: Tetela del Volcán; 17. Tlaltizapán: Cerro de Santa María; 18. Tlalquiltenango: Cruz Pintada, Sierra de Huautla; 19. Xochicalco: 1 km al sur de las pirámides; 20. Xochitepec: Xochitepec.
En la zona norte del estado se presentan siete tipos de vegetación: bosque de coníferas, bosque de encino, bosque mesófilo de montaña, bosque tropical caducifolio, matorral xerófilo, pastizal, vegetación acuática y subacuática en un intervalo altitudinal de 1200 a 3400 m (Rzedowski, 1978; Contreras-McBeath et al., 2006). En esta zona se ubica el Corredor Biológico Chichinautzin (CBC), Área Natural Protegida (ANP) que cuenta con una extensión de 65,901 ha. Al sur del estado el principal tipo de vegetación es la selva baja caducifolia, aunque también se presentan en menor superficie el bosque de encino, de pino y selva mediana subcaducifolia (Valle-Marquina et al., 2021). Aquí se localiza la Reserva de la Biosfera Sierra de Huautla (REBIOSH) ANP, con una extensión de 59,030 ha.
El clima que predomina es cálido subhúmedo en 87% de la superficie del estado, mientras que 11% de la superficie está representada por clima templado húmedo, en la parte norte, y 2% por clima templado subhúmedo, en el noreste y también presenta una pequeña zona con clima frío. La temperatura media anual es de 21.5 °C, la mínima promedio, de 10 °C en el mes de enero y la máxima promedio es de alrededor de 32 °C entre los meses de abril y mayo. Las lluvias se presentan durante el verano, de junio a septiembre, y la precipitación media es de alrededor de 900 mm anuales (Sorani, 2020; INEGI, 2023).
Revisión de herbario y esfuerzo de recolecta
Se examinaron dos especímenes del Herbario Micológico de la Universidad Autónoma del Estado de Morelos (HEMIM) y dos de la colección de Hongos Entomopatógenos depositados en el Laboratorio de Entomología y Fitopatología del Centro de Investigaciones Biológicas de dicha universidad (LEyF-CIB).
Para la recolecta de especímenes frescos, se efectuaron 27 exploraciones en la temporada de lluvias (mayo a octubre) de 2019 a 2022 en 14 localidades del estado de Morelos. Se realizó la búsqueda de insectos con micosis (Berlanga-Padilla et al., 2016a) ubicados en áreas sombreadas y húmedas, en la corteza de árboles, la hojarasca, el suelo, el haz y el envés de hojas (Evans et al., 2011). Se realizó un registro fotográfico de los especímenes recolectados usando una cámara digital Canon 70D (Tokio, Japón), Lente Canon EF 100 mm F/2.8 Macro USM (Tokio, Japón), flash Godox TT600 (Shenzhen, China). Al material recolectado se le registraron los caracteres morfológicos en fresco, el hábitat, el tipo de vegetación y el hospedero. Las muestras recolectadas se transportaron al laboratorio en contenedores de plástico a temperatura ambiente para su posterior determinación taxonómica y el aislamiento de cepas.
Identificación de especímenes
La caracterización morfológica macro- y microscópica consideró la forma, tamaño (largo por ancho), color, y disposición de los peritecios en el estroma (Raymundo et al., 2017). Para determinar el tamaño, con un vernier Spurtar EPC MEA 10M (Londres, Reino Unido) se midió la longitud total del estroma y el largo y ancho de la parte fértil o ascógena (Raymundo et al., 2017). El color se registró en fresco y se utilizó el manual de colores de Kornerup y Wanscher (1978). Los estromas y ostiolos se fotografiaron con un microscopio estereoscópico Leica EZ4 HD (Wetzlar, Alemania). De cada ejemplar recolectado se realizaron cortes transversales muy delgados de la parte fértil del estroma o sinemas, y los cortes obtenidos se montaron en portaobjetos con azul de algodón en lactofenol y/o hidróxido de potasio (KOH) al 5%. Las preparaciones se examinaron en un microscopio óptico Nikon eclipse N1 (Tokio, Japón), se fotografiaron con la cámara Infinity 1 (Pennsylvania, EUA), y con el software NIS-Elements D v. 3.2 se midieron peritecios, hifas de la capa cortical, ascas, ápices y ascosporas de cada espécimen, de acuerdo con el formato elaborado por Castro-Bustos (2015) para la descripción de Cordyceps s.l.
Los hospederos se determinaron hasta el nivel taxonómico de orden, de acuerdo con Gibb y Oseto (2019). De la mayoría de los especímenes recolectados se obtuvieron cepas en medio de cultivo Papa Dextrosa Agar (PDA) y Sabouraud Dextrosa Agar con Extracto de Levadura (SDAY). Se incubaron durante siete días a 25 °C en ausencia de luz, de acuerdo con lo propuesto por Shrestha et al. (2006). Los cultivos se fotografiaron con una cámara digital Canon 70D (Tokio, Japón), Lente Canon ZOOM LENS EF 16-35 mm USM (Tokio, Japón), flash Godox TT600 (Shenzhen, China) y se realizaron preparaciones para la determinación de los caracteres morfológicos microscópicos. Los especímenes y las cepas se depositaron en el herbario HEMIM y en el LEyF-CIB. La determinación taxonómica de los especímenes se realizó con base en monografías, descripciones taxonómicas y claves de identificación, consultando los trabajos de Kobayasi (1941, 1981); Hywel-Jones (1995); Hywel-Jones y Sivichai (1995); Sung y Spatafora (2004); Sung et al. (2007b); Luangsa-ard et al. (2008); Shrestha et al. (2014); Kepler et al. (2017); Catania et al. (2018); Mongkolsamrit et al. (2018); Wang et al. (2020, 2022a).
Resultados
Se recolectaron 176 especímenes y se determinaron ocho especies de Cordyceps s.l. de las cuales cinco son nuevos registros para Morelos (Beauveria pseudobassiana S.A. Rehner & Humber, Blackwellomyces cardinalis (G.H. Sung & Spatofora) Spatafora & Luangsa-ard, Cordyceps mexicana L. López-Rodríguez, C. Burrola-Aguilar & R. Garibay-Orijel, Samsoniella haniana Hong Yu bis, Yao Wang & Z.Q. Wang, Ophiocordyceps humbertii (C.P. Robin) Petch), mientras que el género Samsoniella Mongkols., Noisrip., Thanakitp., Spatafora & Luangsa-ard se registra por primera vez para México, con la especie S. haniana.
En los sitios muestreados, los especimenes de herbario revisados y lo registrado en la literatura para el estado de Morelos (Fig. 1) se encontraron como hospederos a adultos y larvas de coleópteros, larvas y pupas de lepidópteros, himenópteros adultos y una especie de arácnido. La mayoría de las especies se distribuyen en el Corredor Biológico Chichinautzin (CBC) y la Reserva de la Biosfera Sierra de Huautla (REBIOSH), Área Natural Protegida que se localiza al sur del estado.
A continuación, se describen las ocho especies que se determinaron, se incluyen fotografias in situ y de las estructuras de reproducción, como los estromas, peritecios, ascas, ascosporas, sinemas y conidios. Una clave de identificación taxonómica de estas y otras especies encontradas en el país se encuentra en Sung et al. (2007b); Luangsa-ard et al. (2008); Shrestha et al. (2014); Kepler et al. (2017); Catania et al. (2018); Mongkolsamrit et al. (2018); Wang et al. (2020, 2022a).
Taxonomía
Cordycipitaceae
Beauveria scarabaeidicola (Kobayasi) S.A. Rehner & Kepler, IMA Fungus 8(2): 345. 2017. Fig. 2.

Figura 2: Beauveria scarabaeidicola (Kobayasi) S.A. Rehner & Kepler. A. estroma emerge del tórax del hospedero; B. peritecios inmersos en el estroma, sobresalen los ostiolos de color anaranjado rojizo; C. hospedero coleóptero de la familia Scarabaeidae; D. peritecios dispersos hacia la base de la parte fértil; E. peritecios; F. ascas y ápices, al interior de las ascas se observan las ascosporas filiformes (flecha); G. anverso de la cepa en medio de cultivo SDAY, de textura algodonosa; H. reverso de la cepa en medio de cultivo SDAY, se observan pliegues al centro de la cepa.
TIPO: PAPUA NUEVA GUINEA. Sin localidad, en coleóptero adulto de la familia Scarabaeidae, sin fecha, sin colector s.n. (holotipo: no localizado).
= Cordyceps scarabaeidicolaKobayasi (as ‘scarabaeicola’), in Bull. Nat. Sci. Mus., Tokyo B 2(4): 137. 1976.
Estromas 25-40 × 1.3 mm, cilíndricos, solitarios o gregarios, 1-4 por hospedero, emergen de la parte abdominal del hospedero; estípite del estroma 5-35 × 1.3 mm, color anaranjado claro en fresco (5A4); parte fértil 10-15 × 1.6-2.0 mm, cilíndrica ligeramente más ancha que el estípite, color anaranjado pálido (5A3), textura rugosa por la presencia de ostiolos que sobresalen del estroma, hacia la base de la parte fértil los peritecios son dispersos; peritecios 280-350 × 150-200 µm, pseudoinmersos en el estroma en ángulo recto, ovoides con una punta obtusa, ostiolos 20-25 × 8 µm, prominentes, sobresalen hasta 40 µm del estroma, color anaranjado brillante (5B8); ascas 160-180 × 5-6 µm, cilíndricas, hialinas, inamiloides; ápice del asca 1.5 × 3 µm de largo por ancho, poro apical 0.9 µm de largo; ascosporas se desarticulan en esporas secundarias 8-10 × 1-1.2 µm, cilíndricas, filiformes con extremos truncados, hialinas en KOH al 5%, inamiloides.
Hábitat y hospedero: suelo de bosque de pino-encino, en coleópteros de Phyllophaga sp. (Scarabaeidae) en estado adulto.
Distribución: China (Liang et al., 1993), Corea (Sung, 1996), Japón (Kobayasi y Shimizu, 1978), Nueva Guinea (Kobayasi y Shimizu, 1976) y Taiwan (Kobayasi, 1981). En la República Mexicana se ha registrado en el Estado de México (Pérez-Villamares et al., 2017), municipio Malinalco, carretera Malinalco - Tenancingo; municipio Ocuilan, La Haciendita; municipio Tenancingo, Santo Desierto El Carmen y en el estado de Morelos (Jardín Botánico de la Universidad Autónoma del Estado de Morelos (UAEM), municipio Cuernavaca, en bosque de pino y encino (Castro-Bustos et al., 2020).
Material examinado: MÉXICO. Morelos, municipio Cuernavaca, Jardín Botánico de la UAEM, 1750 m, 18°59'2.37''N, 99°14'26.73''O, bosque de pino-encino, 9.X.2022, D. Castro-Bustos 607 (LEyF-CIB), 608 (HEMIM). Municipio Tepoztlán, Amatlán de Quetzalcóatl, 1150 m, 18°58'44''N, 99°02'09''O, 13.VI.2021, D. Castro-Bustos 441 (LEyF-CIB).
Notas taxonómicas: esta especie fue descrita por Kobayasi y Shimizu (1976) de Nueva Guinea como Cordyceps scarabaeicola, parásito de coleópteros de la familia Scarabaeidae. Shrestha et al. (2014) encuentran una relación entre el anamorfo Beauveria sungii S.A. Rehner & Humber y el teleomorfo Cordyceps scarabaeicola con evidencia morfológica, ecológica y molecular, razón por la cual B. sungii se trató como sinónimo de C. scarabaeicola. Sin embargo, Kepler et al. (2017) proponen una nueva combinación Beauveria scarabaeidicola con el basónimo Cordyceps scarabaeidicola y como sinónimo B. sungii. Beauveria subscarabaeidicola Hong Yu bis, Yao Wang & Qi Fan es muy similar y prácticamente indistinguible en la variación morfológica con B. scarabaeidicola. Wang et al. (2022b) describieron la especie y mediante la observación de los caracteres morfológicos no encontraron diferencias significativas del teleomorfo y anamorfo entre las dos especies por lo que las delimitaron utilizando metodologías basadas en el ADN para distinguir entre B. subscarabaeidicola y B. scarabaeidicola.
Beauveria pseudobassiana S.A. Rehner & Humber, Mycologia 103: 1068. 2011. Fig. 3.
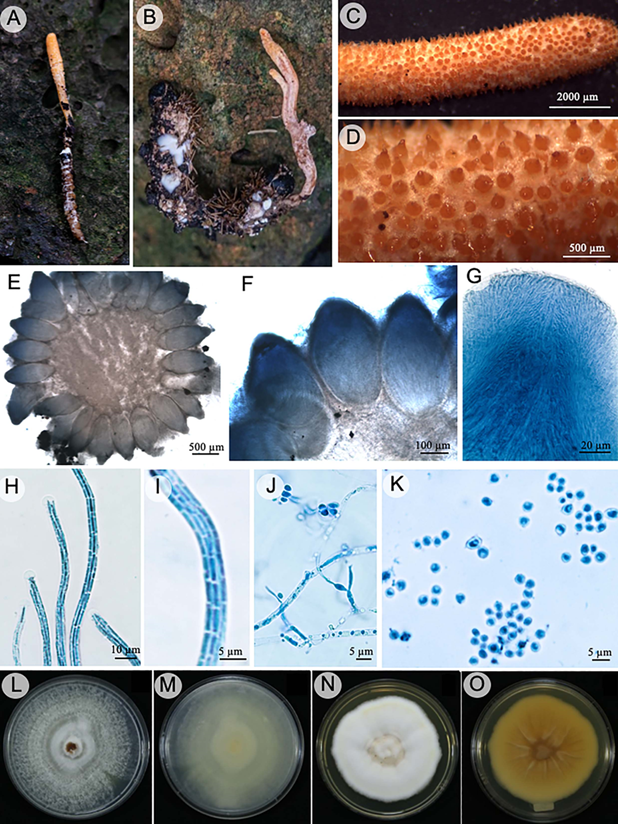
Figura 3: Beauveria pseudobassiana S.A. Rehner & Humber. A-B. hospedero: larvas de lepidópteros; C. estroma; D. peritecios semi-inmersos en el estroma, ostiolos sobresalen de color anaranjado rojizo; E, F. disposición de los peritecios en el estroma; G. canal ostiolar; H. ascas; I. ascosporas filiformes; J. células conidiógenas; K. conidios; L-M. cepa en medio de cultivo PDA, anverso y reverso; N, O. cepa en medio de cultivo SDAY, anverso y reverso.
TIPO: ESTADOS UNIDOS DE AMÉRICA. Virginia, Page County, Koontz Lokey, aislado de larva de Lymantria dispar (Lepidoptera: Lymantriidae), 10.VI.1991, A. E. Hajek s.n. (holotipo: BPI 881002).
Estromas 15-40 × 0.5-1.5 mm, cilíndricos, solitarios o gregarios, simples o raramente ramificados, 1-5 por hospedero, emergen del torax, abdomen o cabeza del hospedero, color anaranjado claro (5A4); estípite del estroma 10-30 × 0.5-1.5 mm, cilíndrico, claviforme, color anaranjado claro (5A4); parte fértil 4-7 × 1.5-3 mm, cilíndrica, color anaranjado (5A6), textura rugosa por los ostiolos que sobresalen del estroma; peritecios 550-680 × 300-450 µm, semi-inmersos en el estroma en ángulo recto, los peritecios son dispersos en la base de la parte fértil, ovoides a elipsoides; ostiolos sobresalen del estroma, color anaranjado rojizo (7A6); ascas 215-310 × 5-7 µm, cilíndricas, hialinas, inamiloides, con ápices prominentes; ápice del asca 3.9 × 2 µm de largo por ancho, poro apical 1.2 µm de largo; ascosporas se desarticulan en esporas secundarias, 4-6 × 1-1.3 µm, filiformes, septadas, hialinas en KOH al 5%; crecimiento de la colonia en SDAY, aéreo, abundante, textura algodonosa, color blanco cuando crece en oscuridad y amarillo blanquecino (4A2) cuando crece en condiciones de luz; en PDA el crecimiento de la colonia es poco abundante, color anaranjado blanquecino (5A2) en condiciones de oscuridad y amarillo blanquecino (4A2) amarillo pálido (2A3), en condiciones de luz; el diámetro de la colonia en incubación a 25 °C, en el día 10 de crecimiento en SDAY es 20-33 mm, en PDA es 20-30 mm; en cultivos viejos se forma una capa farinosa de conidios sobre la superficie de la colonia, color amarillo blanquecino (4A2) a amarillo marrón (5C8); conidios 2.1-3.3 × 1.5-2.8 µm, subglobosos, algunos presentan hilum en la base, hialinos, aseptados.
Hábitat y hospedero: Beauveria pseudobassiana es un hongo patógeno de artrópodos con un amplio rango de hospederos, parasita a miembros de seis órdenes de artrópodos: Araneae, Coleoptera, Hemiptera, Hymenoptera, Lepidoptera y Thysanoptera en distintos estadios, desde larvas hasta adultos (Wang et al., 2020). Los principales órdenes de hospederos son Coleoptera y Lepidoptera (Rehner et al., 2011; Wang et al., 2020). En este estudio, se registra como parásito de larvas y pupas de lepidópteros.
Distribución: Canadá, China, Corea, Estados Unidos de América, Francia, Portugal, Tailandia y Vietnam (Rehner et al., 2011; Wang et al., 2020). Las especies del complejo Beauveria rara vez se encuentran en estado sexual. En este trabajo se presenta el primer registro del teleomorfo de Beauveria pseudobassiana en México; anteriormente se conocía el estado asexual aislado de Phyllophaga sp. en Guanajuato (Carrillo-Benítez et al., 2013).
Material examinado: MÉXICO. Morelos, municipio Tepoztlán, San Juan Tlacotenco, km 5 antigua vía del ferrocarril, 2280 m, 19°0'44.17''N, 99°05'49.03''O, 17.VII.2021, D. Castro-Bustos 443 (LEyF-CIB), 449 (LEyF-CIB), 450 (LEyF-CIB), 451 (LEyF-CIB), 452 (LEyF-CIB), 453 (LEyF-CIB), 454 (LEyF-CIB), 455 (LEyF-CIB), 456 (LEyF-CIB), 457 (LEyF-CIB), 458 (LEyF-CIB), 459 (LEyF-CIB), 460 (LEyF-CIB), 466 (LEyF-CIB), 483 (LEyF-CIB), 488 (LEyF-CIB), 489 (LEyF-CIB), 490 (LEyF-CIB), 491 (LEyF-CIB), 492 (LEyF-CIB), 493 (LEyF-CIB), 494 (LEyF-CIB), 495 (HEMIM), 496 (HEMIM), 497 (HEMIM), 498 (HEMIM), 499 (HEMIM), 500 (HEMIM), 501 (HEMIM), 502 (HEMIM), 503 (HEMIM), 504 (HEMIM), 505 (LEyF-CIB), 506 (HEMIM), 507 (HEMIM), 508 (HEMIM), 509 (HEMIM), 510 (HEMIM), 511 (LEyF-CIB), 512 (HEMIM), 513 (HEMIM).
Notas taxonómicas: Fenotípicamente Beauveria pseudobassiana y B. bassiana son muy similares, presentan estromas cilíndricos, clavados, ascosporas que se desarticulan y difieren en la fase asexual por el tamaño de los conidios. Los de B. pseudobassiana son generalmente más pequeños, 1.7-3.3 × 1.5-2.8 µm, subglobosos, algunos presentan hilum, mientras que B. bassiana presenta conidios de 2-3 × 2-3 µm. Otra característica que las diferencia es que B. pseudobassiana es más abundante en suelo forestal, a diferencia de B. bassiana que predomina en suelo cultivable (Wang et al., 2020). Las especies B. varroae S.A. Rehner & Humber, B. kipukae S.A. Rehner & Humber y B. australis S.A. Rehner & Humber presentan conidios globosos a subglobosos similares a B. pseudobassiana y son muy cercanas filogenéticamente; entre las especies, las medidas del tamaño y forma se sobrelapan, pero se distinguen de B. pseudobassiana porque no presentan hilum (Rehner et al., 2011). Beauveria kipukae se diferencia por ser una especie endémica de Hawaii, parasita homopteros, presentan conidios de 2-3.5 × 1.5-3 µm y no se conoce la fase sexual (Rehner et al., 2011). Beauveria australis solo se conoce de Australia y parasita Ortópteros de la familia Acrididae mientras que B. varroae parasita al ácaro Varroa destructor Anderson & Trueman 2000 y únicamente se ha registrado en Francia y Suiza (Rehner et al., 2011).
Blackwellomyces cardinalis (G.H. Sung & Spatafora) Spatafora & Luangsa-ard, IMA Fungus 8(2): 345. 2017. Fig. 4.
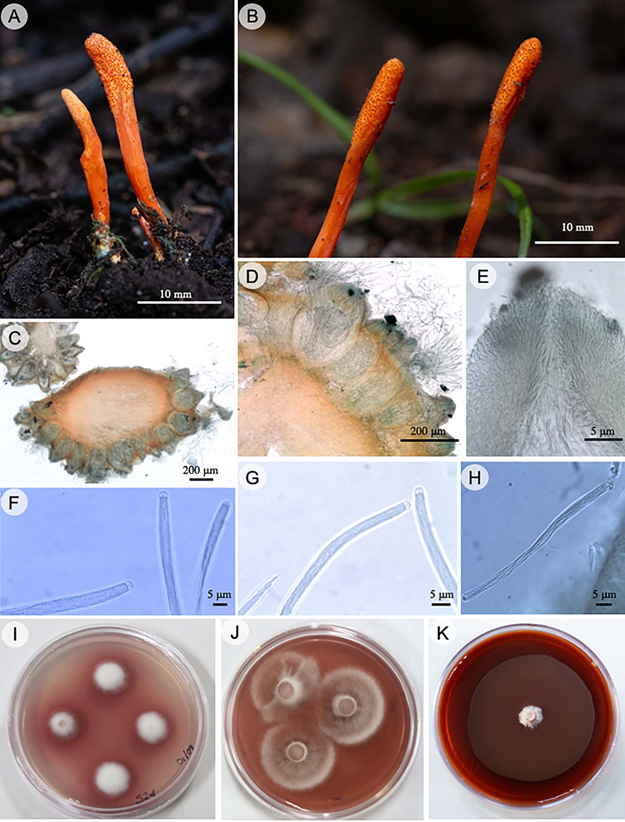
Figura 4: Blackwellomyces cardinalis (G.H. Sung & Spatafora) Spatafora & Luangsa-ard. A-B. estromas; C. disposición de los peritecios en el estroma; D. peritecios; E. ostiolo y canal ostiolar; F, G. ascas y ápices; H. ascosporas entrelazadas que no se desarticulan; I. cepa en medio de cultivo PDA; J. cepa en medio de cultivo en SDAY; K. cepa avejentada, se observa cambio en la textura del micelio.
TIPO: ESTADOS UNIDOS DE AMÉRICA. Tennessee, Parque Nacional de las Grandes Montañas Humeantes, Sendero Hen Wallow, sobre larva de Archolophinae, 19.VII.2000, sin colector s.n. (holotipo: OSC 93609 ).
= Cordyceps cardinalis G.H. Sung & Spatafora, Mycologia 96(3): 660. 2004.
Estromas 10-45 × 0.5-1.5 mm, cilíndricos, simples o raramente ramificados 2-6 por hospedero, emergen de la cabeza o abdomen del hospedero, estípite del estroma 10-30 × 0.5-1.5 mm carnoso, color anaranjado rojizo (7A8); parte fértil, 5-10 × 2-4 mm, cilíndrica, elipsoide o fusiforme, color anaranjado rojizo a rojizo (8A8); peritecios 250-500 × 110-200 μm, compactos, semi-inmersos en el estroma en ángulo recto, ovoides a elipsoides, ostiolos prominentes 5-10 μm de ancho, sobresalen del estroma hasta 15 μm, color anaranjado rojizo (7A8); ascas 220-300 × 3-5 μm, octosporicas, cilíndricas, hialinas, inamiloides; apice del asca prominente 3 × 2.5 μm largo por ancho, poro apical 1.6 μm de largo; ascosporas 170-300 × 1-1.5 μm, filiformes, con septos irregulares, no se desarticulan en esporas secundarias, hialinas en KOH al 5%, con disposición entrelazada; en medio de cultivo PDA y SDAY, el micelio es aéreo de textura algodonosa, color amarillo blanquecino (4A2) a amarillo pálido (2A3), el reverso de los cultivos es anaranjado rojizo a rojizo (8A8); fiálides anchas en la base y estrechas en el ápice, en forma de matraz, 10-15 × 1.5-2 μm en la base; conidios elipsoidales 4-5 × 1.5-2.2 μm, se producen en largas cadenas.
Hábitat y hospedero: solitario o gregario, parasita larvas de lepidópteros envueltas en seda generalmente.
Distribución: NE de Estados Unidos de América, sureste de Japón, este de China, Corea y Tailandia (Sung y Spatafora, 2004; Kepler et al., 2017). En México se citó al anamorfo por primera vez del estado de Campeche mediante aislados de suelo de hongos entomopatógenos (Lara-Reyna, 2010); sin embargo, no se mencionaron las características morfológicas de la especie. En este trabajo se registra por primera vez en el país al teleomorfo de Blackwellomyces cardinalis.
Material examinado: MÉXICO. Morelos, municipio Tepoztlán, Santo Domingo Ocotitlán, 2060 m, 19°00'46''N, 99°06'52''O, 18.VIII.2019, D. Castro-Bustos 402 (LEyF-CIB), 403 (LEyF-CIB), 404 (LEyF-CIB), 406 (LEyF-CIB), 406(LEyF-CIB); loc. cit., 28.VIII.2021, Castro-Bustos D. 520 (HEMIM), 521 (HEMIM), 522 (HEMIM), 523 (HEMIM), 524 (HEMIM), 525 (HEMIM), 526 (HEMIM), 527 (HEMIM), 528 (HEMIM), 529 (HEMIM), 530 (HEMIM), 531 (HEMIM), 532 (HEMIM), 533 (HEMIM), 534 (HEMIM), 536 (HEMIM), 537 (HEMIM), 538 (HEMIM), 539 (HEMIM), 540 (HEMIM).
Notas taxonómicas: los estromas son rojizos, emergen de larvas de lepidópteros enterrados 2-3 cm bajo el suelo, el hospedero generalmente está envuelto en seda. La disposición de las ascosporas dentro de las ascas es entrelazada, las ascosporas no se desarticulan en esporas secundarias, a diferencia de otras especies similares, las cuales no presentan cambio de coloración del medio de cultivo. Blackwellomyces cardinalis muestra una coloración rojo cardenal en los medios de cultivo PDA y SDAY; el epiteto cardinalis se refiere al color rojo cardenal. Blackwellomyces pseudomilitaris (Hywel-Jones & Sivichai) Spatafora & Luangsa-ard es una especie similar en morfología y ecología, forma estromas de colores rojizos, ascosporas que no se desarticulan y parasita larvas de lepidópteros. Difieren en tamaño de los peritecios semi inmersos, elongados, elipsoides, a elongado obovoides, ascas 290-410 × 5-6 μm, ascosporas multiseptadas, de mayor longitud 280-390 × 1 μm; el anamorfo es de tipo Simplicillium W. Gams & Zare y de color blanquecino en el cultivo (Mongkolsamrit et al., 2020).
Cordyceps mexicana L. López-Rodríguez, C. Burrola-Aguilar & R. Garibay-Orijel, Mycologia 114(4): 738. 2022. Fig. 5.
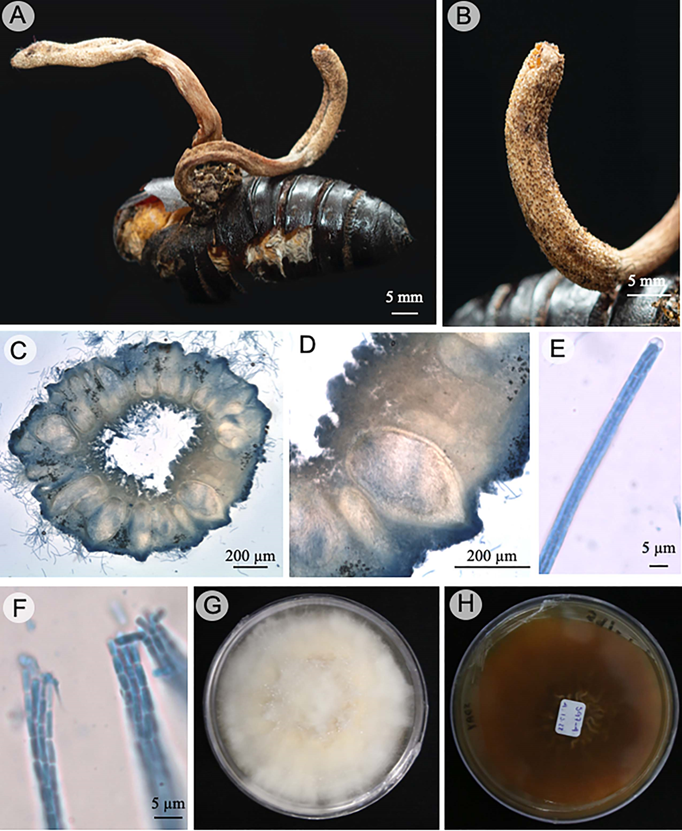
Figura 5: Cordyceps mexicana L. López-Rodríguez, C. Burrola-Aguilar & R. Garibay-Orijel. A. estromas emergen del hospedero; B. disposición de los peritecios en el estroma; C, D. peritecios y canal ostiolar; E. asca y ápice; F. ascosporas filiformes que se desarticulan en esporas secundarias; G, H. cepa en medio de cultivo SDAY, anverso y reverso.
TIPO: MÉXICO. Estado de México, Tenancingo, sobre pupa de Paradirphia sp. (Lepidoptera), VIII.2015, L. López-Rodríguez s.n. (holotipo: MEXU 29955).
Estroma 450-500 mm de longitud, claviforme, gregarios, 2-4 por hospedero, emergen de la parte anterior del hospedero; estípite del estroma 250-300 × 3-4 mm, color amarillo intenso (4A8) a amarillo claro (2A5), presenta rizoides; parte fértil de consistencia carnosa con hendidura en la parte basal, 8-12 × 3 mm, de color amarillo intenso (4A8); peritecios 562-582 × 270-330 µm, inmersos en el estroma, ovoides; pared del peritecio 17-18 µm de ancho; ascas cilíndricas 600-650 × 4-6 µm, ápice del asca 2.3-2.7 × 4 µm; ascosporas 2.8-4.6 × 0.8-1.2 µm, cilíndricas, filiformes con extremos truncados, se desarticulan en esporas secundarias hialinas en KOH al 5%, inamiloides.
Hábitat y hospedero: parásito de pupas de Paradirphia sp.
Distribución: Estado de México, México. En bosque de pino y bosque de pino encino (López-Rodríguez et al., 2022). En el presente trabajo se registra por primera vez en el estado de Morelos.
Material examinado: MÉXICO. Morelos, municipio Cuernavaca, Jardín Botánico de la UAEM, 1750 m, 18°59'2.37''N, 99°14'26.73''O, bosque de pino-encino, 6.IX.2022, D. Castro-Bustos 597 (LEyF-CIB). Municipio Tepoztlán, San Juan Tlacotenco, km 5 antigua vía del ferrocarril, 2280 m, 19°0'44.17''N, 99°5'49.03''O, 17.VII.2021, R. Kelly 10 (LEyF-CIB).
Notas taxonómicas: se caracteriza por los estromas cilíndricos, claviformes de color amarillo intenso que emergen del hospedero. Cordyceps mexicana morfológicamente es similar a C. militaris por las características compartidas que incluyen estromas cilíndricos, clavados, ascas cilíndricas y ascosporas filiformes que se desarticulan en esporas secundarias y parasitan pupas de lepidópteros, pero se diferencian porque C. miltaris es de color anaranjado brillante y no presenta hendidura en la parte basal del estroma, las ascosporas son de menor tamaño de 2-4.5 × 1-1.5 µm (Sung y Spatafora, 2004).
Samsoniella haniana Hong Yu bis, Yao Wang & Z.Q. Wang, J. of Fungi 8: 747. 2022. Fig. 6.
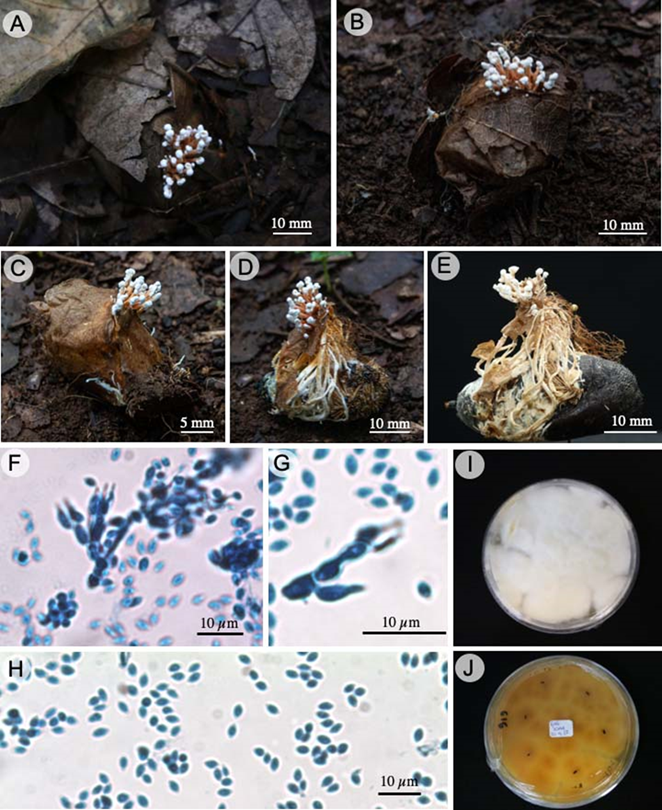
Figura 6: Samsoniella haniana Hong Yu bis, Yao Wang & Z.Q. Wang. A. sinemas que emergen del sustrato; B. hospedero envuelto en hojarasca; C. sinemas que emergen del capullo del hospedero; D. pupa de lepidóptero y formación de sinemas; E. sinemas de tipo Isaria; F, G. células conidiógenas; H. conidios; I. anverso de la cepa en medio de cultivo SDAY; J. reverso de la cepa en medio de cultivo SDAY.
TIPO: CHINA. Provincia de Yunnan, Yuanyang, Xinjie, Duoyishuxia, 15.XII.2021, Y. Wang s.n. (holotipo: YHH 20175).
Sinemas 35-40 × 1-1.7 mm, ramificados irregularmente en el ápice, color anaranjado (6A7), emergen de todo el cuerpo del insecto hospedero, erectos, de forma tipo Isaria, produce masas de conidios en el ápice de las ramificaciones, pulverulentas, flocosos; fiálides 4.5-7 × 1.5-2.5 µm, verticiladas o solitarias, porción basal cilíndrica, estrechamente lageniforme, estrechándose abruptamente hacia el ápice; conidios 2.7-4.7 × 1.8-2.1 µm, lisos, hialinos, ovalados, unicelulares; crecimiento de la colonia en SDAY es abundante, algodonosas o flocosa, el reverso de color anaranjado claro (5A4).
Hábitat y hospedero: pupas de lepidópteros en capullos enterrados en el suelo.
Distribución: especie descrita de la provincia de Yunnan, China (Wang et al., 2022a). Tanto el género Samsoniella como la especie representan el primer registro en México.
Material examinado: MÉXICO. Morelos, municipio Cuernavaca, Jardín Botánico de la UAEM, 1750 m, 18°59'2.37''N, 99°14'26.73''O, bosque de pino-encino, 24.X.2022, D. Castro-Bustos 616 (LEyF-CIB).
Notas taxonómicas: las especies de Samsoniella presentan fiálides tipo Isaria, con las bases ensanchadas abruptamente formando un cuello distinto (Mongkolsamrit et al., 2018) y se diferencian del género Akanthomyces Lebert por que produce estromas de color rojo a anaranjado brillante, cilíndricos a claviformes con peritecios superficiales y sinemas anaranjados, con fiálides y conidios ovalados a fusiformes de color blanco a crema. Una especie similar es S. aurantia Mongkols., Noisrip., Tahnakitp., Spatafora & Luangsa-ard por presentar sinemas de color anaranjado brillante en fresco, flocosos y se diferencia por presentar fialides de mayor tamaño 5-13 × 2-3 μm, conidios fusiformes a ovalados 2-4 × 1-2 μm y parasita larvas de lepidópteros enterrados en el suelo (Mongkolsamrit et al., 2018).
Ophiocordycipitaceae
Ophiocordyceps humbertii (C.P. Robin) Petch (as ‘humberti’), Trans. Br. Mycol. Soc. 19(3): 172. (1935). Fig. 7.

Figura 7: Ophiocordyceps humbertii (C.P. Robin) Petch. A. hospedero avispa del género Agelaia sp. B, C. sinemas que emergen de las antenas, tórax y patas del hospedero (flechas); D. hospedero se sujeta al borde de la hoja por las mandíbulas; E, F. sinemas subulados; G, I. células conidiógenas y conidios citriformes.
TIPO: SENEGAL. Sin localidad, sin fecha, sin colector s.n. (holotipo: no localizado).
= Cordyceps humbertii C.P. Robin (as ‘humberti’), in de Saussure, Monogr. Guepes Social. trib. Vesp., Etud. Fam. Vespid. 2: clxiv. 1858.
= Torrubia humbertii (C.P. Robin) Tul. & C. Tul. (as ‘humberti’), Select. fung. carpol. (Paris) 3: 18. 1865.
= Isaria saussureiCooke, Vegetable wasps and plant worms (London): 53. 1892.
= Isaria saussurei Cooke ex Sacc., in Saccardo & Traverso, Syll. fung. (Abellini) 19: 984. 1910.
= Hirsutella saussurei (Cooke ex Sacc.) Speare, Mycologia 12(2): 69. 1920.
Sinemas, 100-500 × 50-60 μm, numerosos, emergen del tórax, segmentos abdominales, patas y antenas del hospedero, color naranja grisáceo (5B2), erectos, subulados; células conidiógenas 11.9-13.5 × 3.8-5.0 μm, monofiálides, septadas, dispersas, surgen lateralmente de las hifas de los sinemas, 18-35 × 1.5-2.5 μm, cilíndricas a elipsoides, formando un cuello largo y delgado, ápice atenuado, delgado; conidios 5.1-9.6 × 3.1-6.11 μm, hialinos, lisos, unicelulares, citriformes, producidos individualmente, rara vez en grupos en el ápice del cuello.
Hábitat y hospedero: la infección por Ophiocordyceps humbertii ocurre en la etapa adulta de himenópteros de la familia Vespidae y se ha registrado como parásito de especies de los géneros Agelaia Lepeletier 1836, Apoica Lepeletier 1836, Mischocyttarus Saussure 1853, Polistes Latreille 1802, Polybia Lepeletier 1836, Pseudopolybia Saussure 1863 y Vespa Linnaeus 1758 (Petch, 1924; Kobayasi, 1941; Ulloa y Benavides, 1991; Sobczak et al., 2019; Somavilla et al., 2019). En este estudio se encontró como parásito de una avispa del género Agelaia.
Distribución: Jamaica (Saussure, 1858), Antillas y Guyana (Cooke, 1892), Isla Mauricio (Lloyd, 1918), Estados Unidos de América (Speare, 1920), Sri Lanka (Kobayasi, 1981), Papúa Nueva Guinea e Indonesia (Seifert, 1990), Tailandia (Luangsa-ard et al., 2008), Chile (Montalva et al., 2017), Brasil, Colombia (Somavilla et al., 2019; Sobczak et al., 2019), Ecuador (Mollá et al., 2020). En México se registró por primera vez en el municipio Candelaria Loxicha, Oaxaca, el anamorfo Hirsutella saussurei (Cooke ex Sacc.) Speare = Ophiocordyceps humbertii (Ulloa y Benavides, 1991). En el presente estudio se registra por primera vez para el estado de Morelos en la localidad de Santa María Ahuacatitlán, municipio Cuernavaca, y es el segundo registro para el país.
Material examinado: MÉXICO. Morelos, municipio Cuernavaca, Santa María Ahuacatitlán, 1820 m, 18°58'29''N, 99°15'23''O, bosque de pino-encino, 20.IX.2019, E. Martínez-Fernández 154 (LEyF-CIB).
Notas taxonómicas: especie registrada por Robin en 1853 de Senegal y descrita por Petch en 1935 (Somavilla et al., 2019). Ophiocordyceps humbertii se encuentra comúnmente en las regiones tropicales y con menor frecuencia en las zonas templadas (Somavilla et al., 2019). La especie presenta dos estromas claviformes que emergen de ambos lados del tórax, presentan varios sinemas que surgen de los segmentos abdominales, patas y antenas. Actualmente el nombre válido para la fase sexual y asexual es O. humbertii.Somavilla et al. (2019) introdujeron el término “avispa zombie cuando registraron esta estrategia del hongo O. humbertii en un huésped diferente a las hormigas, entonces estudiadas ampliamente con el llamado hongo “hormiga zombie” Ophiocordyceps unilateralis (Tul. & C. Tul.) Petch. observaron que las avispas infectadas por O. humbertii se adhieren al sustrato por sus mandíbulas y estructuras fúngicas asegurando una unión a largo plazo y promoviendo condiciones óptimas para el desarrollo del hongo. En este estudio se observó que la avispa infectada exhibe el mismo comportamiento de “avispa zombie”, que consiste en morder y sujetarse con sus mandíbulas para adherirse al envés de las hojas de los árboles.
Ophiocordyceps sphecocephala (Klotzsch ex Berk.) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora, Studies Mycology 57: 47. 2007. Fig. 8.

Figura 8: Ophiocordyceps sphecocephala (Klotzsch ex Berk.) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora. A. hospedero, avispa del género Polistes sp.; B. estroma claviforme a capitado; C. estroma que emerge del tórax del hospedero; D. asca filiforme; E. ápice del asca; F, G. ascosporas; H. formación de sinemas en medio de cultivo PDA; I. formación de sinemas en SDAY.
TIPO: JAMAICA. St. Vincent, sin fecha, Bancroft s.n. (holotipo: K 116579).
= Isaria sphecophila Ditmar (as ‘sphaecophila’), in Sturm, Deutschl. Fl., 3 Abt. (Pilze Deutschl.) 1(4): 115. 1817.
= Ceratonema crabronis Pers., Mycol. eur. (Erlanga) 1: 48. 1822.
= Sphaeria sphecocephala Klotzsch ex Berk., London J. Bot. 2: 206. 1843.
= Torrubia sphecocephala (Klotzsch ex Berk.) Tul. & C. Tul., Select. fung. carpol. (Paris) 3: 16. 1865.
= Cordyceps sphecocephala (Klotzsch ex Berk.) Berk. & M.A. Curtis, J. Linn. Soc., Bot. 10(no. 46): 376. 1869.
= Hymenostilbe sphecophila (Ditmar) Petch, Trans. Br. Mycol. Soc. 21(1-2): 55. 1937.
= Hirsutella sphecophila (Ditmar) Van Vooren, Bull. Soc. Linn. Lyon 74(7-8): 225. 2005.
Estromas 25-40 mm de longitud claviformes a capitados, 1-3 por hospedero, emergen entre el tórax y la cabeza del hospedero; estípite del estroma 20-23 × 0.5 mm, superficie lisa, color amarillo pálido (2A3), formado por hifas septadas, compactas, dispuestas de forma paralela; parte fértil del estroma 5-7 × 1.5-2 mm apical, obovoide o piriforme, color anaranjado blanquecino (5A2) de superficie irregular papilada por la presencia de ostiolos; peritecios 850-1100 × 200-250 µm, inmersos en el estroma en forma oblicua, con cuello curveado en ángulo recto hacia la capa externa de la parte fértil; ostiolos 16 µm de diámetro, prominentes; ascas 700-820 × 6.5-7.5 µm, hialinas, cilíndricas, filiformes, inamiloides con ápices prominentes 6.5 × 7 µm; poro apical 4.5-5.0 µm largo; ascosporas 10-15 × 1.5-2.2 µm, se desarticulan en esporas secundarias, fusiformes, lisas, hialinas en KOH 5% inamiloides; caracteristicas de la colonia en medio de cultivo PDA y SDAY forma sinemas 30-40 × 0.5 mm, color amarillo pálido (2A3).
Hábitat y hospedero: estroma emerge entre el tórax o entre la cabeza de avispas del género Polistes sp.
Distribución: Jamaica (Berkeley, 1843; Lloyd, 1916), Cuba (Berkeley, 1843; Van Vooren y Audibert, 2005), Brasil (Kobayasi, 1941), Japón (Kobayasi, 1941), Puerto Rico (Kobayasi, 1941), China (Kobayasi, 1941; Zang y Kinjo, 1998), India (Sen, 1949), República Democrática del Congo (Moureau, 1949), Estados Unidos de América (Mains, 1958), Tailandia (Hywel-Jones, 1995), Corea del Sur (Van Vooren y Audibert, 2005), Ecuador (Van Vooren y Audibert, 2005). En México se conoce de Jalisco (Pérez-Silva, 1977; Chacón y Guzmán, 1983; Rubio-Bustos et al., 1999), Morelos en donde se registró en la Sierra de Huautla, municipio Tlaquiltenango y municipio Tlaltizapan, Cerro de Santa María; Jardín Botánico de la UAEM en Cuernavaca (Castro-Bustos et al., 2012), y en Tabasco en el Parque Estatal Agua Blanca (García et al., 2013).
Material examinado: MÉXICO. Morelos, municipio Cuernavaca, Jardín Botánico de la UAEM, 1750 m, 18°59'2.37''N, 99°14'26.73''O, bosque de pino-encino, 2.IX.2022, D. Castro-Bustos 591 (LEyF-CIB), 594 (LEyF-CIB). 24.X.2022, D. Castro-Bustos 617 (LEyF-CIB). Municipio Tepoztlán, Amatlán de Quetzalcóatl, 1150 m, 18°58'44''N, 99°02'09''O, 13.VI.2021, D. Castro-Bustos 615 (LEyF-CIB). Municipio Tlaquiltenango, Cruz Pintada, 955 m, 18°27'64''N, 99°02'8.3''O, bosque tropical caducifolio, 12.VII.2018, D. Castro-Bustos 398 (LEyF-CIB), 399 (LEyF-CIB), 400 (LEyF-CIB).
Notas taxonómicas: la especie se caracteriza por sus estromas claviformes de color amarillo pálido, peritecios inmersos en forma oblicua con cuello curveado en ángulo recto y ascas con ápices prominentes. Ophiocordyceps myrmecophila es similar por sus estromas claviformes color amarillo crema, de 30-80 mm de largo, con peritecios inmersos de manera oblicua y cuello curveado. Se diferencia por presentar ascas 500 × 5-6 µm y ascosporas secundarias 6-7.5 × 1.5-2 µm. Además, O. sphecocephala crece sobre avispas a diferencia de O. myrmecophila que parasita hormigas. Kendrick y DiCosmo (1979) y Van Vooren y Audibert (2005) mencionaron a Hymenostilbe sphecophila (Ditmar) Petch = Hirsutella sphecophila como el anamorfo de Ophiocordyceps sphecocephala.
Purpureocillium atypicola (Yasuda) Spatafora, Hywel-Jones & Luangsa-ard, IMA Fungus 6(2): 361. 2015. Fig. 9.

Figura 9: Purpureocillium atypicola (Yasuda) Spatafora, Hywel-Jones & Luangsa-ard. A. sinema que emerge del sustrato, color lila grisáceo; B. capullo del hospedero enterrado en el sustrato; C, D. hospedero arácnido; E. fálides; F. conidios; G. crecimiento de la cepa en medio de cultivo PDA; H. crecimiento de la cepa en medio de cultivo SDAY.
TIPO: JAPÓN. Hakusan, Bunkyo City, Tokyo, Jardín Botánico de Koishikawa, sin fecha, sin colector s.n. (holotipo: no localizado).
= Isaria atypicola Yasuda, in Lloyd, Bot. Mag., Tokyo 29: 117. 1915.
= Spicaria atypicola (Yasuda) Petch, Trans. Br. Mycol. Soc. 23(2): 140. 1939.
= Nomuraea atypicola (Yasuda) Samson, Stud. Mycol. 6: 84. 1974.
Sinema 55 × 10 mm, emerge de la cabeza del hospedero enterrado en su madriguera bajo el sustrato, cubierto por una capa superficial de apariencia afelpada, velutinosa, flocosa, color grisáceo a lila grisáceo (16B2) hacia la parte apical; conidios 4.5-5.5 × 1.5-2.3 µm, elipsoidales a cilíndricos, hialinos, lisos; hifas 2.5-5.5 µm de ancho, septadas de paredes lisas, hialinas; conidióforos 3.4-4.7 µm de ancho, densamente agrupados, forman racimos de 2-6 métulas cilíndricas que se ensanchan hacia la base, paredes lisas; fiálides 7.1 × 2.4-4.4 µm, 2-6 compactas, cilíndricas, hialinas; conidios en cadena 4.8-5.6 × 1.6-2.4 μm, elipsoidales a cilíndricos, lisos, hialinos; en medio de cultivo PDA forma micelio aéreo, color blanquecino (3A1) y se torna a color violeta pálido (18A3) y se observan conidios en los cultivos, las cepas envejecidas se tornan de color violeta grisaceo (18C4).
Hábitat y hospedero: se ha citado como parásito de arañas trampilla Atypus karschi Dönitz 1887 y Latouchia typica Kishida 1913 (Araneae).
Distribución: Argentina, Brazil, China, Ecuador, Estados Unidos de América, Ghana, Islas Salomón, Japón, Panamá, Sudafrica, Tailandia, Taiwan (Evans, 1982; Evans y Samson, 1987; Hywel-Jones y Sivichai, 1995; Shrestha et al., 2019). En México se conoce de los estados de Nuevo León, municipio Monterrey, en bosque de pino y encino, parasitando arañas (Sánchez-Peña, 1990) y Morelos, municipio Tlaquiltenango, Cruz Pintada, Sierra de Huautla (Castro-Bustos et al., 2020); en ambos casos no se mencionaron las características morfológicas de la especie.
Material estudiado: MÉXICO. Morelos, municipio Tepoztlán, San Juan Tlacotenco, km 5 antigua vía del ferrocarril, 2280 m, 19°0'44.17''N, 99°5'49.03''O, 17.VII.2021, D. Castro-Bustos 482 (LEyF-CIB).
Notas taxonómicas: la especie se caracteriza por presentar un sinema de color lila grisáceo de 45 mm y tiene como hospederos a especies de arácnidos (Hywel-Jones y Sivichai, 1995). Purpureocillium lilacinum (Thom) Luangsa-ard, Houbraken, Hywel-Jones & Samson es una especie similar por presentar sinemas color lila grisáceo; sin embargo, presenta conidios elipsoides a fusiformes de 2-3 × 2-4 μm.
Esta especie se ha aislado del suelo, además de ser patógena de insectos y ocasionar micosis oculares en el humano (Luangsa-ard et al., 2011).
Discusión
El análisis morfológico de las especies recolectadas y de los especímenes de herbario estudiados, coinciden con lo descrito para el grupo de hongos considerado como complejo Cordyceps s.l. Varios autores mencionan que este grupo es morfológica y ecológicamente diverso y su distribución está condicionada a la presencia de sus hospederos (Kobayasi, 1941, 1981; Sung y Spatafora, 2004; Sung et al., 2007b; Luangsa-ard et al., 2008; Shrestha et al., 2014; Kepler et al., 2017; Catania et al., 2018; Mongkolsamrit et al., 2018; Wang et al., 2020, 2022a).
Con los resultados de este trabajo se incrementa a 49 el número de especies de Cordyceps s.l. patógenas de artrópodos distribuidas en la República Mexicana, con 18 presentes en Morelos, mientras que el número de géneros para México se eleva a 17 y a nueve para Morelos, lo que equivale a 52.94% y 36.73% respectivamente (Cuadro 1). La ubicación geográfica de dicho estado, las dos provincias fisiográficas que en él convergen y la variedad de tipos de vegetación con los que cuenta, le confieren una gran diversidad de especies tanto de insectos como de este grupo de hongos.
Cuadro 1: Especies de Cordyceps s.l. patógenos de artrópodos citadas en México distribuidas en tres familias. Se menciona el nombre actualizado de acuerdo con Index Fungorum (2024). Las especies entre paréntesis corresponden al nombre reportado en la publicación original. * especies reportadas en el estado de Morelos, ** nuevo registro para México.
| Familia | Especie | Referencia |
|---|---|---|
| Clavicipitaceae | Aschersonia aleyrodis Webber | Sánchez-Peña, 1990 |
| Aschersonia turbinata Berk. | Sánchez-Peña, 1990 | |
| Metarhizium acridum (Driver & Milner) J.F. Bisch., S.A. Rehner & Humber | Hernández-Velázquez et al., 2003 | |
| *Metarhizium anisopliae (Metschn.) Sorokīn | Carrión et al., 1996 | |
| Metarhizium brunneum Petch | Serna-Domínguez et al., 2019 | |
| Metarhizium guizhouense Q.T. Chen & H.L. Guo | Bustillos-Rodríguez et al., 2016 | |
| Metarhizium humberi C. Luz, L. Rocha & I. Delalibera | Luz et al., 2019 | |
| Metarhizium rileyi (Nomuraea rileyi) (Farl.) Kepler, S.A. Rehner & Humber | Sánchez-Peña, 1990 | |
| *Metarhizium robertsii J.F. Bisch., S.A. Rehner & Humber | Carrillo-Benítez et al., 2013 | |
| *Metarhizium pinghaense Q.T. Chen & H.L. Guo | Carrillo-Benítez et al., 2013 | |
| Metarhizium pemphigi Driver & Milner) Kepler, Humber & S.A. Rehner | Serna-Domínguez et al., 2019 | |
| Cordycipitaceae | Akanthomyces pistillariiformis (Insecticola pistillariaeformis) (Pat.) Samson & H.C. Evans | Pérez-Silva et al., 2020 |
| Akanthomyces tuberculatus (Cordyceps tuberculata) (Lebert) Spatafora, Kepler & B. Shrestha | Sánchez-Peña, 1990 | |
| Akanthomyces fragilis (Hymenostilbe fragilis) (Petch) K.T. Hodge | Pérez-Silva et al., 2020 | |
| *Beauveria bassiana (Bals. -Criv.) Vuill. | Sánchez-Peña, 1990 | |
| *Beauveria scarabaeidicola (Cordyceps scarabaeicola) (Kobayasi) S.A. Rehner & Kepler | Pérez-Villamares et al., 2017 | |
| *Beauveria pseudobassiana S.A. Rehner & Humber | Carrillo-Benítez et al., 2013 | |
| *Blackewellomyces cardinalis (Cordyceps cardinalis) (G.H. Sung & Spatafora) Spatafora & Luangsa-ard | Lara-Reyna, 2010 | |
| *Cordyceps farinosa (Paecilomyces farinosus) (Holmsk.) Kepler, B. Shrestha & Spatafora | Pérez Silva, 1977 | |
| Cordyceps fumosorosea (Paecilomyces fumosoroseus) (Wize) Kepler, B. Shrestha & Spatafora | Pérez Silva, 1978 | |
| Cordyceps javanica (Isaria javanica) (Bally) Kepler, B. Shrestha & Spatafora | Berlanga-Padilla et al., 2018 | |
| *Cordyceps mexicana L. López-Rodríguez, C. Burrola-Aguilar & R. Garibay- Orijel | López-Rodríguez et al., 2022 | |
| *Cordyceps militaris (L.) Fr. | Pérez Silva, 1977 | |
| Cordyceps polyarthra Möller | Sánchez-Peña, 1990 | |
| Cordyceps pruinosa Petch | Guzmán et al., 2001 | |
| Cordyceps takaomontana Yakush. & Kumaz. | Pérez-Villamares et al., 2017 | |
| Cordyceps tenuipes (Paecilomyces tenuipes (Peck) Kepler, B. Shrestha & Spatafora | Sánchez-Peña, 1990 | |
| Gibellula arachnophila (Gibellula leiopus) (Ditmar) Vuill. | Sánchez-Peña, 1990 | |
| Gibellula pulchra (Sacc.) Cavara | Sánchez-Peña, 1990 | |
| Isaria cicadae Miq. | Petch, 1935 | |
| *Lecanicillium aphanocladii Zare & W. Gams | Tello-Salgado et al., 2021 | |
| Lecanicillium longisporum (Petch) Zare & W. Gams | Berlanga-Padilla et al., 2016b | |
| Pseudogibellula formicarum (Mains) Samson & H.C. Evans | Pérez-Silva et al., 2020 | |
| **Samsoniella haniana Hong Yu bis, Yao Wang & Z.Q. Wang | Presente estudio | |
| Simplicillium lanosoniveum (J.F.H. Beyma) Zare & W. Gams | Berlanga-Padilla et al., 2018 | |
| Ophiocordycipitaceae | Hirsutella citriformis Speare | Casique-Valdés et al., 2011 |
| Hirsutella thompsonii F.E. Fisher | Sampedro y Rosas, 1989 | |
| Ophiocordyceps dipterigena (Cordyceps dipterigena) (Berk. & Broome) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora | Guzmán et al., 2001 | |
| Ophiocordyceps entomorrhiza (Cordyceps entomorrhiza) (Dicks.) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora | Pérez-Silva, 1978 | |
| *Ophiocordyceps humbertii (Hirsutella saussurei) (C.P. Robin) Petch | Ulloa y Benavides, 1991 | |
| *Ophiocordyceps melolonthae (Tul. & C. Tul.) G.H. Sung, J.M. Sung, Hywel- Jones & Spatafora | Pérez-Silva, 1977 | |
| Ophiocordyceps octospora (Cordycepioideus octosporus) (M. Blackw. & Gilb.) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora | Blackwell y Gilbertson, 1981 | |
| Ophiocordyceps sobolifera (Cordyceps sobolifera) (Hill ex Watson) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora | Mains, 1958 | |
| *Ophiocordyceps sphecocephala (Cordyceps sphecocephala) (Klotzsch ex Berk.) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora | Pérez-Silva, 1977 | |
| Ophiocordyceps stylophora (Cordyceps stylophora) (Berk. & Broome) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora | Pérez-Silva, 1978 | |
| *Paraisaria gracilis (Cordyceps gracilis) (Grev.) Luangsa-ard, Mongkols. & Samson | Rodríguez et al., 1993 | |
| *Paraisaria gracilioides (Cordyceps gracilioides) (Kobayasi) Luangsa-ard, Mongkols. & Samson | Castro-Bustos et al., 2012 | |
| *Purpureocillium atypicola (Nomuraea atypicola) (Yasuda) Spatafora, Hywel- Jones & Luangsa-ard | Sánchez-Peña, 1990 | |
| Purpureocillium lilacinum (Thom) Luangsa-ard, Houbraken, Hywel-Jones & Samson | Núñez-Camargo et al., 2012 |
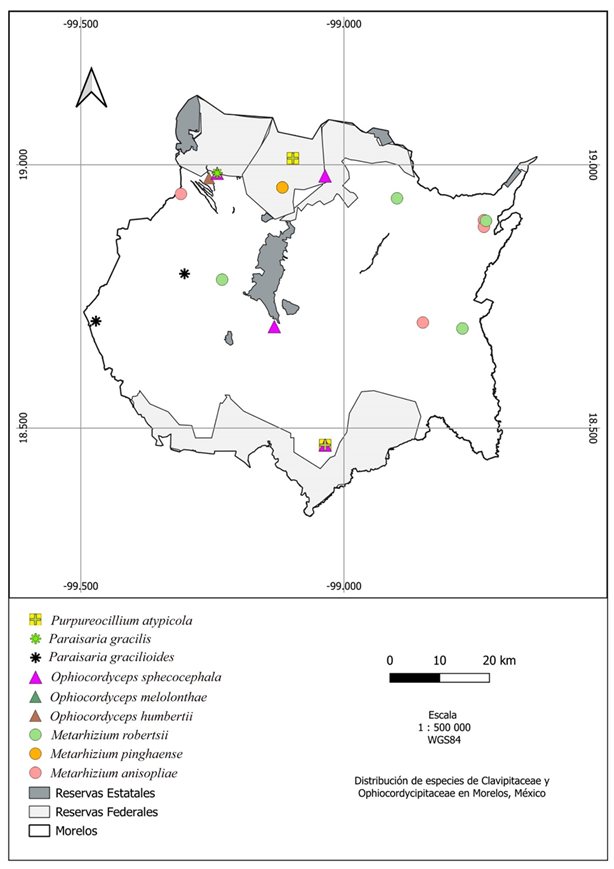
La especie con mayor distribución en el estado de Morelos es Metarhizium anisopliae registrada en cinco localidades en la que destaca el Corredor Biológico Chicinautzin en el municipio de Tepoztlán y en localidades de asentamientos humanos (Fig. 10). Le sigue Ophiocordyceps sphecocephala y M. robertsii registradas en cuatro municipios, mientras que Beauveria bassiana y Cordyceps militaris están presentes en tres municipios.
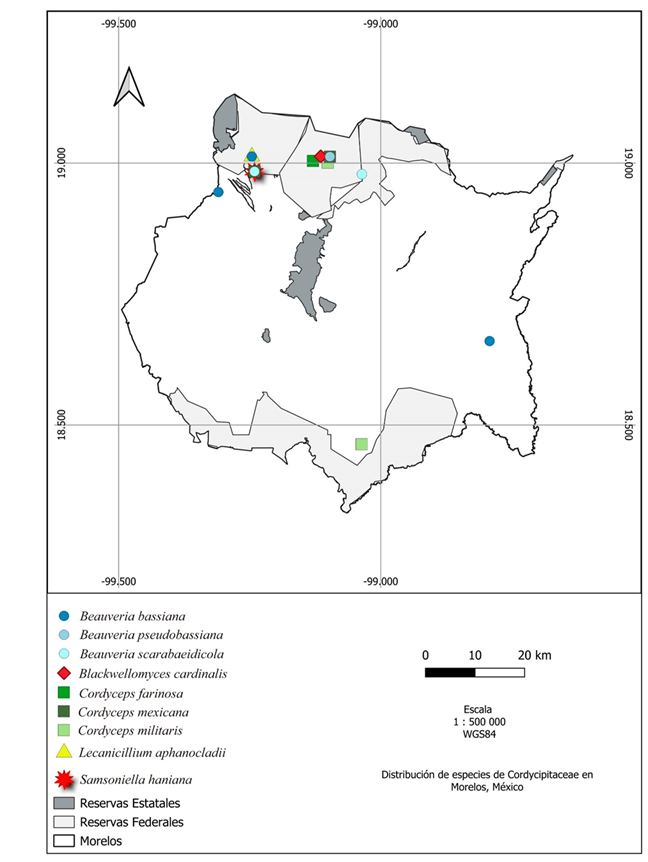
Figura 10: Mapa de distribución de especies de las familias Clavicipitaceae y Ophiocordycipitaceae en Morelos, México.
La familia Cordycipitaceae presenta la mayor diversidad y distribución en el estado de Morelos con cinco géneros y nueve especies (Beauveria bassiana, B. scarabaeidicola, B. pseudobassiana, Blackwellomyces cardinalis, Cordyceps farinosa, C. mexicana, C. militaris, Lecanicillium aphanocladii, Samsoniella haniana) (Fig. 11), seguido de la familia Ophiocordycipitaceae con tres géneros y seis especies (Ophiocordyceps humbertii, O. melolonthae, O. sphecocephala, Paraisaria gracilioides, P. gracilis, Purpureocillium atypicola) (Fig. 10) y por último la familia Clavicipitaceae con un género y tres especies (Metarhizium anisopliae, M. pinghaense, M. robertsii) (Fig. 10). Con la información presentada en este trabajo, los registros previos de otros autores y la revisión de herbarios, los géneros presentes en el estado de Morelos son: Beauveria Vuill., Blackwellomyces Spatafora & Luangsa-ard, Cordyceps Fr., Lecanicillium W. Gams & Zare, Metarhizium Sorokīn, Ophiocordyceps Petch, Paraisaria Samson & B.L. Brady, Purpureocillium Luangsa-ard, Hywel-Jones, Houbraken & Samson y Samsoniella Mongkols., Noisrip., Thanakitp., Spatafora & Luangsa-ard.
El presente estudio contribuye a la taxonomía de Cordyceps s.l., su distribución en Morelos y brinda elementos para tomar en cuenta el valor de las Áreas Naturales Protegidas, el estado de conservación de las localidades y la distribución de sus hospederos. En este sentido, surge la necesidad de continuar realizando muestreos en áreas donde no existan reportes de las especies de Cordyceps s.l. patógenas de artrópodos o en sitios que estén poco explorados, así como en regiones con alta diversidad de insectos y arácnidos.
Conclusiones
Se registra al género Samsoniella por primera vez para México y se adicionan cinco nuevos registros de hongos patógenos de artrópodos para el estado de Morelos, así incrementándose a un total de 18 especies en el estado lo cual lo ubica con el mayor número de registros de Cordyceps s.l. en la República Mexicana, seguido del estado de Colima con 16 especies y el Estado de México con 11. El número de especies de Cordyceps s.l. patógenas de artrópodos presentes en México se incrementa a 49. La revisión de herbario permitió determinar a nivel de especie a Ophiocordyceps humbertii anteriormente determinado como Cordyceps sp. La familia Cordicipitaceae destaca como la de mayor riqueza y abundancia de especies en el estado y a nivel nacional con el mayor número de hospederos dentro de los órdenes Lepidoptera y Coleoptera. El Corredor Biológico Chichinautzin ubicado al norte del estado presenta una gran diversidad de especies de hongos patógenos de artrópodos por la notable diversidad de hábitats, las condiciones geográficas climáticas y la distribución de sus hospederos.











 nueva página del texto (beta)
nueva página del texto (beta)