Introducción
Los primeros registros de algas marinas para el litoral de Veracruz fueron hechos por Liebmann en 1846; 114 años después, Huerta-Múzquiz (1960) enriqueció esta información y registró 48 especies en cinco localidades de la costa de Veracruz (Tuxpan, Playa Hotel Pensiones, Veracruz-Boca del Río, Coatzacoalcos y Montepío), de las cuales 10 corresponden a Phaeophyceae, 24 a Rhodophyta y 14 a Chlorophyta. Posteriormente, Humm y Hildebrand (1962) realizaron un estudio en el litoral del Golfo de México, que incluyó Texas (EUA) y Veracruz, y citaron 32 taxones: 10 de Phaeophyceae, 12 de Rhodophyta y 10 para Chlorophyta, provenientes de siete localidades entre Boca Andrea y Veracruz. Dos años después, Huerta-Múzquiz y Garza-Barrientos (1964) registraron 19 especies de algas para Tuxpan. Más tarde, en un reconocimiento preliminar de las algas marinas del estado de Veracruz, De la Campa-De Guzmán (1965) obtuvo muestras de 16 localidades del estado, siete en arrecifes coralinos, cuatro de lagunas costeras y cinco en playas rocosas y arenosas, y registró 59 especies en la zona litoral, de las cuales hubo 12 en Phaeophyceae, 34 para Rhodophyta y 13 de Chlorophyta. Luego, Sánchez-Rodríguez (1967) hizo un listado ficológico de Montepío que incluyó diez taxones.
Durante 13 años, las investigaciones estuvieron pausadas y fue hasta 1980 cuando se reanudaron y hubo publicaciones referentes a las algas marinas para el litoral de Veracruz, reiniciando con un estudio ficológico de las áreas rocosas de cinco localidades de las estribaciones de la Cordillera Neovolcánica y tres de las estribaciones de la Sierra de los Tuxtlas. Se registraron 116 especies, de las cuales 32 pertenecen a Phaeophyceae, 58 a Rhodophyta y 26 a Chlorophyta (Sánchez-Rodríguez, 1980). En un trabajo del género Dictyopteris J.V. Lamouroux, en México, Mendoza-González y Mateo-Cid (2005) citaron únicamente a D. delicatula J.V. Lamouroux (Dictyotaceae) en Veracruz. De la Cruz-Francisco et al. (2017) registraron 51 especies de macroalgas marinas, 10 para Heterokontophyta, 29 en Rhodophyta y 12 de Chlorophyta. Posteriormente, Landa-Cansigno et al. (2019) documentaron 45 especies de algas en ambientes rocosos de Playa Paraíso, Playa Villa Rica y Playa Muñecos (los cuales están influenciados por las estribaciones del Eje Neovolcánico), 18 taxones corresponden a Chlorophyta, 16 Rhodophyta y 11 Heterokontophyta. Existen dos trabajos enfocados exclusivamente a las algas verdes (Chlorophyta) del litoral de Veracruz, el de Garduño-Solórzano et al. (2005) quienes reportaron 72 especies, y el de García-López et al. (2017) quienes citaron 82 Chlorophyta. Recientemente, García-García et al. (2020), en una actualización taxonómica de las algas rojas bentónicas del Atlántico de México, incluyeron 153 taxones para el litoral veracruzano.
En las investigaciones anteriormente citadas se encuentran registradas 312 especies de algas marinas para el litoral de Veracruz, lo que resalta la riqueza de este grupo de organismos en la región, por lo que el objetivo del presente trabajo es dar a conocer una lista florística de 11 sitios de muestreo, en donde siete localidades han sido poco estudiadas: Barra de Cazones, Lechuguillas, Punta-Delgada-Boca Andrea-Los Muñecos, Villa Rica, El Canal-Escolleras de Alvarado, Punta Puntilla y Playa Hermosa. También se incluyen las escolleras de Tuxpan y El Canal-Escolleras de Coatzacoalcos, Veracruz-Boca del Río y Montepío, aportando nuevos registros de Phaeophyceae, Chlorophyta y Rhodophyta, además de una actualización taxonómica de las algas marinas para la costa de Veracruz.
Materiales y Métodos
Área de estudio
El litoral de Veracruz se encuentra en la llanura costera del Golfo de México, una extensa planicie que abarca desde el sureste de Estados Unidos de América hasta la Península de Yucatán, México (Álvarez-Arellano y Gaitán-Morán, 1994). De norte a sur incluye las subprovincias fisiográficas Cuenca del Bravo, Cuenca del Río Purificación, Cuenca Pánuco-Tuxpan (Tampico-Nautla) y la porción NO de Veracruz; además de la Barra de Tuxpan, que es una isla de barrera localizada entre Tampico y Tuxpan probablemente controlada por la topografía submarina y procesos marinos construccionales (Álvarez-Arellano y Gaitán-Morán, 1994). Otra subprovincia, la Llanura costera veracruzana, se extiende desde Punta Delgada hasta las inmediaciones de Coatzacoalcos, Veracruz. Esta subprovincia al norte incluye parte del extremo oriental de la Cordillera Neovolcánica, mientras que en sus porciones central y sur, a la Planicie Costera de Sotavento (Carranza-Edwards et al., 1975).
La oceanografía física del Golfo de México está relacionada con la circulación de gran escala (Corriente de Lazo), fenómenos de mesoescala (giros anticiclónicos y ciclónicos) que interactúan con el talud y la plataforma continental, así como el clima, influenciado por eventos meteorológicos como ciclones tropicales y nortes (Pereyra et al., 1992). Además de lo anterior, se relaciona con el aporte de numerosos ríos que modifican las características hidrográficas por dilución, procesos de mezcla y transporte de agua con características oceánicas desde el talud hasta la plataforma continental (Monreal- Gómez et al., 2004).
El clima de la región costera de Veracruz de norte a sur incluye desde semiseco muy cálido y cálido (BS1(h’)w(i’) y BS0(h’)w”(x’), respectivamente hasta cálido subhúmedo Aw0(i’)(gw”) y cálido húmedo (Am) (García, 1983). En el Golfo de México la temperatura está determinada por el influjo de la Corriente del Lazo, que transporta aguas superficiales, tiene forma de herradura y fluye en el sentido de las manecillas del reloj transfiriendo aguas cálidas subtropicales del Mar Caribe a través del Estrecho de Yucatán hacia el Golfo de México. La capa superficial del agua de mar (hasta los 200 m de profundidad) presenta temperaturas fluctuantes (de la Lanza Espino y Gómez-Rojas, 2004).
La presencia de frentes polares y nortes en los meses de invierno (diciembre-marzo) propicia que los valores de temperatura oscilen de 15-25 °C y que en el verano (de finales junio a fines de septiembre) alcancen 28 °C; dichas variaciones se deben a la influencia de las corrientes del Lazo y la del Caribe, ambas cálidas. En la costa de Veracruz las mareas son diurnas (de la Lanza Espino y Gómez-Rojas, 2004). Las aguas del Golfo de México tienen una salinidad de 36.5 ups, producto de la mezcla de los giros anticiclónicos con la masa de agua subtropical subsuperficial cuya salinidad es de 36.7 ups a una profundidad de 70 m (de la Lanza Espino y Gómez-Rojas, 2004).
Localidades de muestreo
La ubicación de las 11 localidades se presenta en la Figura 1. En estas localidades se recolectó material ficológico exclusivamente en la zona litoral marina. En el Cuadro 1 se indican las coordenadas de cada localidad, fechas de muestreo, así como datos de fisiografía y geomorfología.
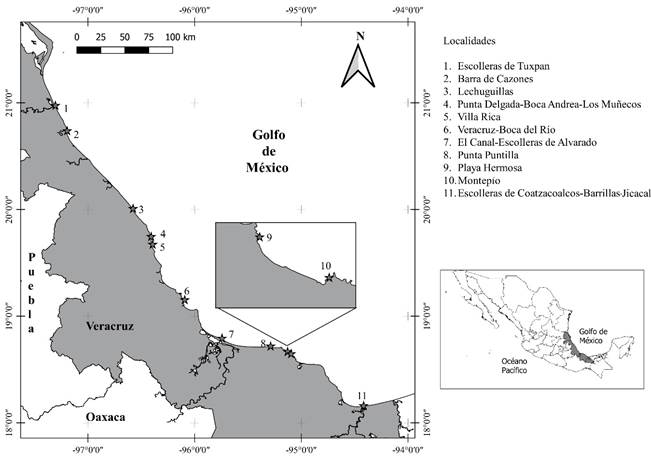
Figura 1: Ubicación del área de estudio y las localidades de muestreo en el estado de Veracruz, México. En el cuadro inferior derecho está la ubicación de Veracruz en México y en el izquierdo, las localidades de muestro ubicadas en la región costera de Veracruz.
Cuadro 1 Ubicación y características fisiográficas y geomorfológicas de las localidades de muestreo de la zona litoral de Veracruz, México.
| Localidades | Coordenadas | Fisiografía | Exposición al oleaje | Sustrato | Profundidad | Fecha de recolecta mes/año |
|---|---|---|---|---|---|---|
| 1. Escolleras de Tuxpan | 20°58'22''N 97°18'17''O | Escolleras con grandes agregados de rocas | Expuesto | Rocoso | 0-1 m | 03, 07, 08, 10/2013; 09/2015; 03, 04, 08, 12/2016; 03, 04, 07/2017 |
| 2. Barra de Cazones | 20°44'08''N 97°11'41''O | Playa arenosa con promontorios rocosos y praderas de pastos marinos | Expuesto y protegido | Rocoso, con pozas, arenoso y praderas de Thalassia testudinum K.D. Koenig | 0-2 m | 03, 07, 09, 11/2014; 02, 03, 05, 07, 09, 11/2015; 03, 04/2016; 01, 03, 04, 06, 10/2017; 04, 07, 10, 12/2018; 03, 07, 09, 12/2019; 03/2020 |
| 3. Lechuguillas | 20°0'22''N 96°34'36''O | Playa arenosa con numerosos cantos rodados | Expuesto | Rocoso y arenoso | 0-0.5 m | 07, 09/2009; 08, 11/2013; 07, 08/2014; 03, 07/2017 |
| 4. Punta Delgada- Boca Andrea-Los Muñecos | 19°44'38''N 96°24'27''O | Playas arenosas con acantilados, plataformas con pozas intermareales | Expuesto | Rocoso y arenoso | 0-0.5 m | 09/2002, 09/2003; 05, 07, 09, 10, 11, 12/2004; 05, 06, 07, 09, 11/2005; 06, 09/2006; 09, 10/2007; 03, 05, 09, 11/2008; 06, 07, 09/2009; 03, 07,10/2012; 03, 04, 05, 08, 09, 10, 11/2013; 07/2014; 09/2015; 04, 09/2016; 05/2017 |
| 5. Villa Rica | 19°40'14''N 96°23'37''O | Playa arenosa con fuerte oleaje, con un macizo rocoso expuesto | Expuesto | Rocoso con pozas intermareales | 0-0.5 m | 05, 07, 08, 09, 12/2004; 07/2007; 09/2008; 07/2009; 03/2012; 08/2013; 11/2013; 03/2014; 01, 07, 09, 10/2016; 05, 06, 07, 09/2017; 03, 04, 08, 09, 12/2018; 03, 04, 09/2019; 03/2020 |
| 6. Veracruz-Boca del Río | 19°09'04''N 96°05'34''O | Playas arenosas, pequeños agregados de rocas y praderas de pastos marinos | Expuesto y protegido | Rocoso, arenoso y praderas de Thalassia testudinum | 0-1 m | 04/2002;09/2003; 02, 07, 09, 12/2004; 04/2005; 04, 09/2006; 05, 09/2007; 05, 07/2008; 10/2013; 03, 04, 06, 07, 08/2014; 02, 04/2015; 01, 04, 07/2016; 01, 07, 09/2017 |
| 7. El Canal- Escolleras de Alvarado | 18°47'27''N 95°44'34''O | Escolleras con grandes agregados de rocas | Expuesto | Rocoso | 0-0.5 m | 06, 07/2014; 04, 06/2015; 04/2016; 07/2017, 05/2018, 2019 |
| 8. Punta Puntilla | 18°43'00''N 95°17'16''O | Playa arenosa, con agregados rocosos dispersos que en ocasiones forman pozas intermareales | Expuesto y protegido | Rocoso y arenoso | 0-1.5 m | 07/2004; 07/2009; 04, 08/2014; 04, 06, 07/2015; 05, 08/2016; 04, 05, 06, 07, 11/2017; 05, 09/2018; 05/2019 |
| 9. Playa Hermosa | 18°39'54''N 95°07'43''O | Playa arenosa con una plataforma rocosa en donde se forman pozas intermareales | Expuesto y protegido | Rocoso y arenoso | 0-0.5 m | 03, 07/2009; 09, 10/2013; 02, 08/2014; 06, 07/2017; 07/2018 |
| 10. Montepio | 18°38'44''N 95°05'43''O | Playa arenosa con agregados rocosos dispersos y restos de formaciones coralinas | Expuesto y protegido | Rocoso y arenoso | 0-1 m | 07/2009; 12/2011; 10/2013; 02, 03, 07/2014; 05/2016; 04, 06, 07/2017 |
| 11. Escolleras de Coatzacoalcos- Barrillas-Jicacal | 18°09'30''N 94°24'57''O | Escolleras formadas por grandes rocas, además de zonas arenosas protegidas y con agregados de rocas | Expuesto y protegido | Rocoso y arenoso | 0-1 m | 05, 06/2014; 07, 09/2015; 08/2018 |
Trabajo de campo y de gabinete
La recolección de material ficológico se realizó en las escolleras de Tuxpan, escolleras de Coatzacoalcos, Veracruz-Boca del Río, Montepío, Barra de Cazones, Lechuguillas, Punta Delgada-Boca Andrea-Los Muñecos, Villa Rica, El Canal-Escolleras de Alvarado, Punta Puntilla y Playa Hermosa (Fig. 1). Se recolectó material desde abril de 2002 hasta marzo de 2020 mediante 92 muestreos: 42 en lluvias, 18 en nortes o lluvias de invierno y 32 en temporada de sequía (Cuadro 1, Apéndice). Los ejemplares se obtuvieron en diferentes sustratos donde las algas marinas pueden establecerse, como son rocas, arena, invertebrados bentónicos (epizoicas), esqueletos de coral y Thalassia testudinum (epífitas).
Los especímenes fueron recolectados a mano con ayuda de espátulas flexibles de acero y alcolanas-picoletas, ambas de marca Truper® (Querétaro, México), en el nivel intermareal. Solo en Barra de Cazones y Villa Rica se recolectó en el submareal por medio de buceo libre hasta una profundidad de 3 m. Las recolectas se hicieron en segmentos de las playas de aproximadamente 500 m lineales de extensión.
Los ejemplares se fijaron en una solución de formaldehido al 5% en agua de mar y se etiquetaron con datos referentes a la localidad de colecta, fecha, sustrato, profundidad y recolectores. El material fue incorporado a la sección ficológica del herbario de la Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional (ENCB) (acrónimo según Thiers, 2023). Para el análisis de las algas se usó un microscopio binocular Olympus CX31RBSF (Guangdong, China). Para distinguir estructuras reproductivas y vegetativas se hicieron cortes longitudinales y transversales de los talos con navajas de doble filo DORCO (Dongyang Razor Company, Seúl, Corea). La descalcificación de los representantes de las familias Liagoraceae, Galaxauraceae, Corallinaceae, Udoteaceae y Polyphysaceae se realizó con ácido nítrico (HNO3) 0.6 M.
Para la identificación de las especies se utilizaron las claves y descripciones referidas en los trabajos de Taylor (1960), Schneider y Searles (1991), Littler y Littler (2000), De Clerck et al. (2006), Dawes y Mathieson (2008), Cho et al. (2008), Won et al. (2009) y Díaz-Tapia et al. (2017). Además, se obtuvo información relativa a los especímenes del herbario ENCB recolectados previamente por otros investigadores y se corrigió la identificación taxonómica de algunos ejemplares. Se realizó una revisión bibliográfica de los estudios llevados a cabo en la región litoral de Veracruz desde 1960 hasta 2020, para obtener los registros de las algas marinas previamente citados para el litoral del estado y con ello cotejarlos con los datos obtenidos en el presente estudio.
Con la información obtenida se elaboró una lista de especies de las algas marinas de la costa de Veracruz que se agrupó por categorías taxonómicas; las familias, géneros y especies se ordenaron filogenética y alfabéticamente. Para cada una de las 316 especies recopiladas en este estudio se incluyeron datos referentes a su distribución, estado reproductivo, hábitat, observaciones de nuevos registros, referencias y número de catálogo del herbario ENCB. El esquema taxonómico de las algas de Veracruz sigue la propuesta de Wynne (2022), y la actualización nomenclatural de todos los taxones se hizo de acuerdo con la base global AlgaeBase (Guiry y Guiry, 2024).
La diversidad α para cada localidad fue calculada mediante índice de Shannon-Wiener, el cual considera que los individuos se muestrean al azar a partir de una población infinita y se asume que todas las especies están representadas en la muestra (Magurran, 1988).
Donde H´=diversidad de Shannon Wiener, pi es la proporción de individuos de la misma especie=ni/N, ni=número de individuos de cada especie, N=número total de especies.
Además, se realizó un análisis de agrupamiento (Clúster) mediante UPGMA (ligamiento promedio no ponderado) con el fin de observar qué tan similares son las localidades en términos de presencia/ausencia de especies. Estos análisis fueron realizados en el programa estadístico PAST v. 3 (Hammer et al., 2001).
Feldmann (1937) propuso el índice R/P (número de especies de Rhodophyta entre número de especies de Phaeophyceae) para el estudio de la ficogeografía descriptiva, la cual es una herramienta útil para clasificar la flora algal de una región determinada en función del gradiente latitudinal. Así, un valor de la correlación R/P≥4 se encuentra en regiones tropicales, mientras que si R/P≤2 corresponde con una ficoflora de regiones templado-frías. Posteriormente, Cheney (1977) integró a las Chlorophyta (C) en un índice análogo al de Feldmann (1937), siendo este (R+C)/P y demostró que valores de la relación (R+C)/P≥6 se obtienen en floras tropicales, en tanto que las de mares templados-fríos tienen índices ≤3.
Resultados
Composición florística y factores de la diversidad
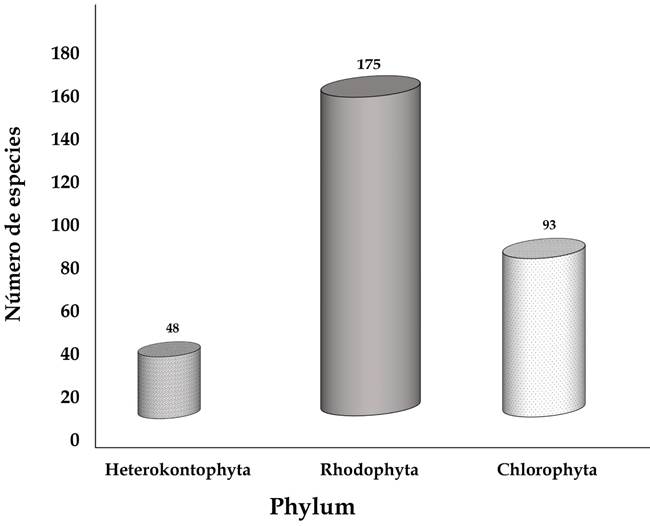
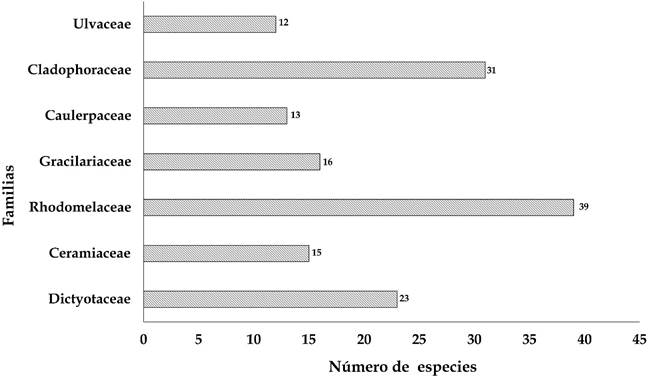
Durante el período de estudio (abril de 2002 a marzo de 2020) se identificaron 316 taxones infragenéricos de algas marinas: 48 Heterokontophyta, 175 Rhodophyta y 93 Chlorophyta (Fig. 2) en 11 localidades del litoral de Veracruz (Fig. 1). En Heterokontophyta se ubicó una 1 (Phaeophyceae), con 7 órdenes, 11 familias, 25 géneros y 48 especies; el orden Dictyotales y la familia Dictyotaceae fueron los mejor representados con 23 especies (47.9%) (Fig. 3), 12 de ellas pertenecen al género Dictyota J.V. Lamoroux. Para Rhodophyta se encontraron cuatro clases (Bangiophyceae, Florideophyceae, Compsopogonophyceae y Stylonematophyceae), 18 órdenes, 33 familias, 80 géneros y 175 especies (Apéndice). Los órdenes Ceramiales con 70 taxones (40%) y Corallinales con 20 (11.42%) son los que cuentan con la mayor riqueza específica.
Las familias con más taxones fueron Rhodomelaceae con 39 (21.71%), seguida de Gracilariaceae con 16 (7.14%) (Fig. 3). Los géneros más diversos fueron Gracilaria Greville (12), Chondria C. Agardh (7), Jania J.V. Lamouroux, Ceramium Roth y Laurencia J.V. Lamouroux, con seis especies cada uno. Bangia Lyngbye, Asparagopsis Montagne, Titanoderma Nägeli, Lithothamnion Heydrich, Melobesia J.V. Lamouroux, Vertebrata S.F. Gray, Gelidiella Feldmann & G. Hamel, entre otros, solo están representados por una especie. Finalmente, Chlorophyta tiene 93 taxones, distribuidos únicamente en la clase Ulvophyceae, con 6 órdenes, 16 familias, 25 géneros y 93 especies. En el orden Cladophorales, hubo 38 taxones, siendo la familia Cladophoraceae (31 spp.), la más diversa. Caulerpaceae (13 spp.) y Ulvaceae (12 spp.), ocupan el segundo y tercer lugar, respectivamente. Caulerpa J.V. Lamouroux es el género con mayor riqueza (13 spp.), seguido de Ulva L. con 11 especies (Apéndice).
La integración del listado florístico permitió reconocer 70 nuevos registros de algas marinas para el litoral de Veracruz; siendo los géneros Dictyota (6), Acrochaetium Nägeli (4), Centroceras Kützing (2), Ceramium (2) y Cladophora Kützing (2), entre otros, los que concentran el mayor número de especies (Apéndice), mientras que Lithophyllum pseudoplatyphyllum J.J. Hernández-Kantun, W.H. Adey & P.W. Gabrielson es nuevo reporte para la porción mexicana del Golfo de México. De los 316 taxones registrados reportados en este trabajo, 246 ya tenían registros previos y 75 no pudieron ser ubicados en el material recolectado ni depositado en el herbario ENCB. Cabe aclarar que algunas de las especies previamente registradas en la zona se consideran dudosas y están señaladas en el Cuadro 2. En virtud de lo anterior, el número de algas marinas bentónicas para la costa del estado de Veracruz aumentó a 391 especies, que representan un incremento de 19.4% del total de macroalgas conocidas previamente en el área de estudio.
Cuadro 2: Especies de algas marinas bentónicas del litoral de Veracruz no ubicadas en este estudio. Referencias: 1=Huerta-Múzquiz, 1960; 2=Humm y Hildebrand, 1962; 3=De La Campa-De Guzmán, 1965; 4=Sánchez-Rodríguez, 1980; 5=Flores-Davis, 1993; 6=Garduño-Solórzano et al., 2005; 7= Ramírez-Rodríguez y Blanco-Pérez, 2011; 8= Lozano-Orozco et al., 2015; 9=García-López et al., 2017; 10=De La Cruz-Francisco et al., 2017; 11=Landa-Cansigno et al., 2019; 12=García-García et al., 2020; 13=García-García et al., 2021. Observaciones: RD-Registro incierto.
| Especies | Referencias | Observaciones |
|---|---|---|
| HETEROKONTOPHYTA | ||
| Phaeophyceae | ||
| Dictyotales | ||
| Dictyotaceae | ||
| 1. Dictyota canariensis (Grunow) Tronholm | 8, 13 | |
| 2. D. guineënsis (Kützing) P. Crouan & H. Crouan in Mazé & Schramm. | 1, 3 | |
| 3. D. humifusa Hörnig, Schnetter & Coppejans | 13 | |
| 4. Lobophora variegata (J.V. Lamouroux) Womersley ex E.C. Oliveira | 1, 13 | RD |
| Ectocarpales | ||
| Acinetosporaceae | ||
| 5. Acinetospora crinita (Carmichael) Sauvageau | 5, 13 | |
| 6. Feldmannia padinae (Buffham) Hamel | 5, 13 | |
| 7. Hummia onusta (Kützing) J. Fiore | 13 | |
| Scytosiphonaceae | ||
| 8. Hydroclathrus clathratus (C. Agardh) M. Howe | 4, 13 | |
| 9. Rosenvingea endiviifolia (Martius) M.J. Wynne | 5, 13 | |
| 10. R. floridana (W.R. Taylor) W.R. Taylor | 5, 13 | |
| Fucales | ||
| Sargassaceae | ||
| 11. Sargassum buxifolium (Chauvin) M.J. Wynne | 2, 4 | |
| 12. S. fluitans (Børgesen) Børgesen | 2, 4, 8 | |
| 13. S. natans (Linnaeus) Gaillon | 2, 4, 8 | |
| 14. S. polyceratium Montagne | 8 | |
| 15. S. vulgare C. Agardh | 3, 4, 7, 10, 11 | RD |
| RHODOPHYTA | ||
| Florideophyceae | ||
| Corallinaceae | ||
| 16. Corallina officinalis L. | 10, 12 | RD |
| Hydrolithaceae | ||
| 17. Hydrolithon boergesenii (Foslie) Foslie | 12 | |
| Acrochaetiales | ||
| Acrochaetiaceae | ||
| 18. Acrochaetium pulchellum Børgesen | 4, 7, 12 | |
| 19. A. sagraeanum (Montagne) Bornet | 12 | |
| Nemaliales | ||
| Galaxauraceae | ||
| 20. Dichotomaria obtusata (J. Ellis & Solander) Lamarck | 10, 12 | |
| 21. Tricleocarpa fragilis (L.) Huisman & R.A. Townsend | 4, 7, 12 | |
| Liagoraceae | ||
| 22. Ganonema farinosum (J.V. Lamouroux) K.C. Fan & Yung C. Wang | 1, 12 | |
| 23. G. megagynum (Børgesen) Huisman | 1, 12 | |
| 24. Liagora viscida (Forsskål) C. Agardh | 4, 7, 12 | |
| 25. Trichogloea requienii (Montagne) Kützing | 12 | |
| Nemaliaceae | ||
| 26. Nemalion longicolle Børgesen | 1, 3 | |
| Ceramiales | ||
| Callithamniaceae | ||
| 27. Aglaothamnion halliae (Collins) Aponte, D.L. Ballantine & J.N. Norris | 12 | |
| Ceramiaceae | ||
| 28. Acrothamnion butlerae (Collins) Kylin | 12 | |
| 29. Centroceras clavulatum (C. Agardh) Montagne | 3, 4, 7, 10, 12 | RD |
| 30. Ceramium brevizonatum H.E. Petersen | 12 | |
| 31. C. diaphanum (Lightfoot) Roth | 4, 12 | |
| 32. C. leutzelburgii O.C. Schmidth | 4, 12 | |
| 33. C. nitens (C. Agardh) J. Agardh | 13 | |
| 34. C. subtile J. Agardh | 12 | |
| 35. C. virgatum Roth | 10, 12 | |
| Delesseriaceae | ||
| 36. Dasya ocellata (Grateloup) Harvey | 12 | |
| 37. Dictyurus occidentalis J. Agardh | 2, 12 | RD |
| 38. Heterosiphonia gibbesii (Harvey) Falkenberg | 4, 7, 12 | |
| 39. Taenioma nanum (Kützing) Papenfuss | 2, 12 | |
| Rhodomelaceae | ||
| 40. Acanthosiphonia echinata (Harvey) A.M. Savoie & G.W. Saunders | 12 | |
| 41. Digenea simplex (Wulfen) C. Agardh | 10 | RD |
| 42. Chondria sedifolia Harvey | 3, 12 | |
| 43. Herposiphonia pecten-veneris (Harvey) Falkenberg | 12 | |
| 44. Polysiphonia ramentacea Harvey | 3, 12 | |
| 45. Xiphosiphonia pennata (C. Agardh) Savoie & G.W. Saunders | 12 | |
| Wrangeliaceae | ||
| 46. Griffithsia globulifera Harvey ex Kützing | 4, 7, 12 | |
| Gelidiellaceae | ||
| 47. Millerella pannosa (Feldmann) G.H. Boo & L. Le Gall | 4, 7, 12 | |
| 48. Parviphycus trinitatensis (W.R. Taylor) M.J. Wynne | 4, 7, 12 | |
| Solieriaceae | ||
| 49. Wurdemannia miniata (Sprengel) Feldmann & Hamel | 4, 7, 12 | |
| Gracilariales | ||
| Gracilariaceae | ||
| 50. Gracilaria caudata J. Agardh | 10, 12 | |
| 51. G. cornea J. Agardh | 1, 12 | |
| 52. G. curtissiae J. Agardh | 12 | |
| 53. G. gracilis (Stackhouse) Steentoft, L.M. Irvine & Farnham | 12 | |
| 54. G. mammillaris (Montagne) M.A. Howe | 10, 12 | RD |
| 55. G. usneoides C. Agardh | 12 | |
| 56. Gracilariopsis sjoestedtii (Kylin) E.Y. Dawson | 4, 12 | |
Temporalidad
El número de taxones encontrados en cada temporada climática está representado en la Figura 4. En general hay alta diversidad en las tres épocas, siendo en las lluvias de verano cuando se ubicó la mayor riqueza con 269 especies, seguida por la temporada seca con 189 y, finalmente, las lluvias de invierno (nortes) con 121 taxones. Con respecto al número de especies por localidad, Barra de Cazones presentó la mayor cantidad (181), seguida de Punta Puntilla (130) y Punta Delgada-Boca Andrea-Los Muñecos (108) y Villa Rica (108) (Fig. 5). Las localidades con la menor riqueza son Coatzacoalcos-Barrillas-Jicacal (47), escolleras de Tuxpan (51) y Lechuguillas (61). Tanto Coatzacoalcos-Barrillas-Jicacal como Tuxpan son escolleras; es decir, un sustrato artificial con grandes bloques de cemento, que sirven para proteger la zona del oleaje y, por lo tanto, no son adecuados para el establecimiento de las algas. Por el contrario, Lechuguillas es una playa mayormente arenosa con cantos rodados, sustratos que en conjunto no favorecen el establecimiento de las algas (Fig. 6).
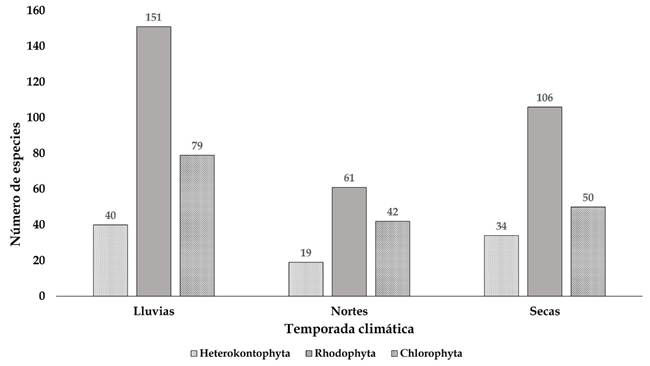
Figura 4: Número de especies por Phylum documentadas en cada temporada climática (lluvias, nortes y secas).
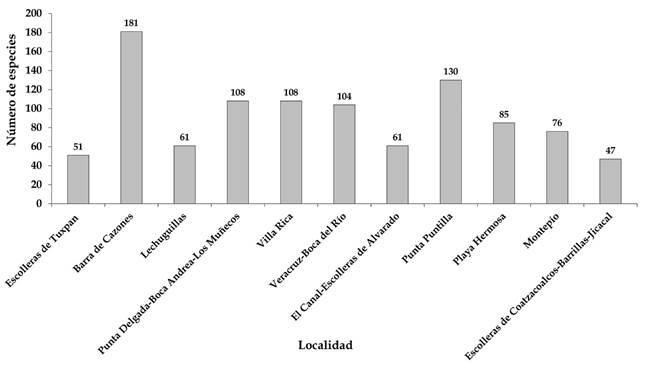
Figura 5: Número de especies por localidad de muestreo resaltando la diferencia de la riqueza especifica entre localidades.
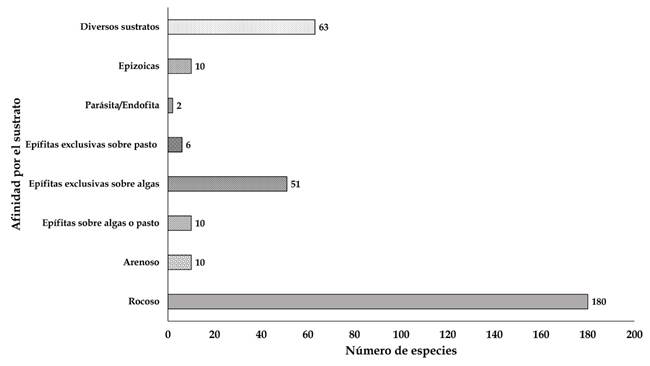
Figura 6: Afinidad de las algas presentes en el litoral de Veracruz, México, por diferentes sustratos indicando el número de especies en cada uno.
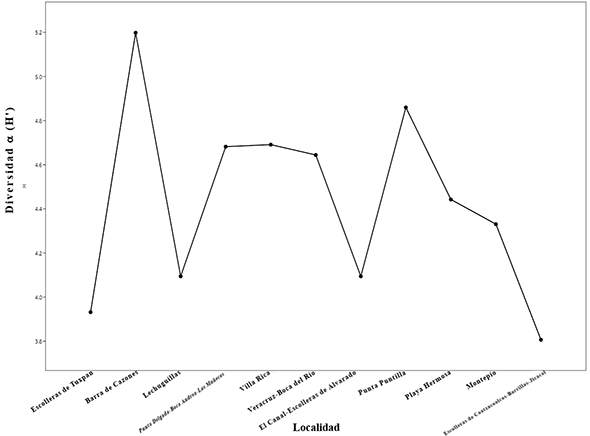
De acuerdo con el análisis de diversidad α, las localidades más diversas son Barra de Cazones (H´=5.198) y Punta Puntillas (H´=4.86), seguidas de Punta Delgada-Boca Andrea-Los Muñecos (H´=4.682), Villa Rica (H´=4.691) y Veracruz-Boca del Río (H´=4.644). Los sitios menos diversos fueron Escolleras de Tuxpan (H´=3.932), Lechuguillas (H´=4.094), El Canal-Alvarado (H´=4.094) y Coatzacoalcos-Barrillas-Jicacal (H´= 3.807) (Fig. 7).
En el análisis de agrupamiento (Clúster) se observan cinco grupos (Fig. 8). En el primero, se encuentran las localidades Barra de Cazones, Villa Rica, Punta Delgada-Boca Andrea-Los Muñecos y Punta Puntillas con un porcentaje de similitud de 58%. En el Grupo II se agrupan Veracruz-Boca del Río, Playa Hermosa y Montepío con 59% de similitud entre ellas. En el grupo III están Lechuguillas y Coatzacoalcos-Barrillas-Jicacal con 80%; finalmente, los grupos IV y V están conformados únicamente por El Canal-Alvarado y Escolleras de Tuxpan, respectivamente, localidades con 8% de similitud, siendo esta la más baja (Fig. 8).
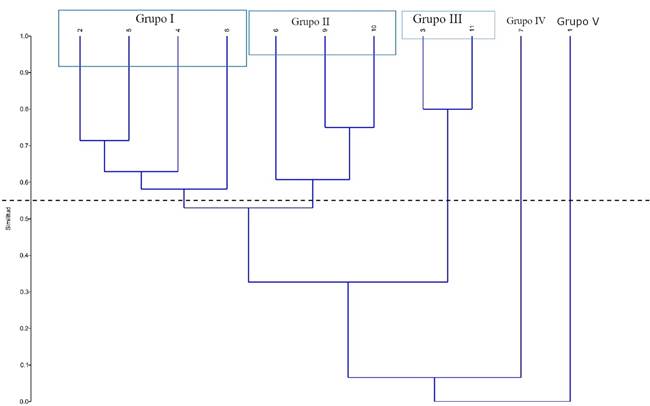
Figura 8: Análisis de agrupamiento UPGMA mediante similitud de Bray Curtis. 1. Escolleras de Tuxpan, 2. Barra de Cazones, 3. Lechuguillas, 4. Punta Delgada-Boca Andrea-Los Muñecos, 5. Villa Rica, 6. Veracruz-Boca del Río, 7. El Canal-Escolleras Alvarado, 8. Punta Puntilla, 9. Playa Hermosa, 10. Montepío, 11. Escolleras de Coatzacoalcos-Barrillas-Jicacal.
Sustrato
La preferencia que tienen las especies de algas documentadas en este estudio por un determinado sustrato está representada en la Figura 6. El mayor número de taxones se encontró en rocas (180), seguido de aquellos con hábito epífito sobre diversas macroalgas (51), exclusivas del pasto marino Thalassia testudinum (6), epífitas de otras algas o pastos marinos (10), epizoicas (10), en arena (10). Por último, las parásitas y endófitas están representadas con una especie cada una. Además, se ubicaron 63 especies que habitan en todo tipo de sustrato (orgánico e inorgánico). De ellas, 30 habitan en rocas y son epífitas de otras algas, ocho crecen sobre invertebrados y rocas; seis en rocas y arena; seis sobre rocas, arena e invertebrados; cinco en rocas, pastos y otras macroalgas; tres en rocas, invertebrados y T. testudinum; dos en sustrato rocoso y T. testudinum; una en rocas, arena y epizoica; una epizoica y epífita de algas y rocas; y una epizoica y epífita de T. testudinum y otras algas. El análisis de diversidad α sustenta estos resultados, ya que en uno de los grupos obtenidos en el diagrama de agrupamiento (grupo I), están las cuatro localidades que registraron la mayor diversidad (Fig. 8.) y tienen en común el sustrato predominantemente rocoso.
Biogeografía
Los resultados del presente estudio fueron analizados con los índices de Feldmann (1937) y Cheney (1977); luego se compararon con lo registrado por otros autores para Isla Cozumel (Mateo-Cid y Mendoza-González, 2008); Isla Mujeres (Mendoza-González et al., 2007), Caribe mexicano (Cetz-Navarro et al., 2008), litoral de Campeche (Mateo-Cid et al., 2013), litoral de Tabasco (Mendoza-González et al., 2017) y costa de Yucatán (Ortegón-Aznar y Tejera, 2022). El Cuadro 3 contiene los resultados obtenidos de los índices de Feldmann y Cheney aplicados a las seis regiones antes mencionadas, las cuales muestran que tienen una semejanza fitogeográfica tropical para ambos índices. Por otro lado, los índices calculados en este estudio muestran que las algas marinas del litoral de Veracruz presentan afinidad mixta. Con base en lo anterior, hubo especies con distribución netamente tropical y/o caribeña como Porolithon antillarum (Foslie & Howe) Foslie & Howe, Neogoniolithon propinquum (Foslie) Me. Lemoine, Avrainvillea mazei G. Murray & Boodle, Penicillus capitatus Lam., Hypnea musciformis (Wulfen in Jacq) J.V. Lamouroux, Gracilaria blodgettii Harvey, Dictyota pulchella Hörnig & Schnetter, Padina gymnospora (Kützing) Sonder, Chaetomorpha antennina (Bory) Kützing, Codium isthmocladum Vickers y Ulva lactuca L., entre otros, así como especies con distribución en la costa del Atlántico de Estados Unidos de América, entre ellas, Halymenia floridana J. Agardh, Streblonema invisibile Hoyt y Hecatonema floridanum (W.R. Taylor) W.R. Taylor y finalmente, taxones con distribución en aguas templadas como son Myrionema strangulans Greville y Phyllodictyon anastomosans (Harvey) Kraft y M.J. Wynne. Los géneros Dictyota J.V. Lamouroux, Padina Adanson, Chnoospora J. Agardh, Sargassum C. Agardh, Acanthophora J.V. Lamouroux, Alsidium C. Agardh, Palisada K. W. Nam, Gracilaria, Caulerpa J.V. Lamouroux y Ulva L. son comunes en el litoral veracruzano, algunas especies representativas de estos se ilustran en las Figuras 9 y 10.
Cuadro 3: Índices de Feldmann y Cheney para algunos ambientes marinos del litoral del Golfo de México y Caribe mexicano. Referencias: 1=Mendoza-González et al. (2007); 2=Mateo-Cid y Mendoza-González (2008); 3=Cetz-Navarro et al. (2008); 4=Ortegón-Aznar y Tejera (2022); 5=Mateo-Cid et al. (2013); 6=Mendoza-González et al. (2017).
| Localidad/estado | Índice de Feldmann (R/P) | Afinidad fitogeográfica | Índice de Cheney (R+C)/P | Afinidad fitogeográfica |
|---|---|---|---|---|
| Isla Mujeres, Quintana Roo1 | 4.50 | Tropical | 7.15 | Tropical |
| Isla Cozumel, Quintana Roo2 | 4.40 | Tropical | 7.04 | Tropical |
| Caribe mexicano (Quintana Roo)3 | 4.51 | Tropical | 7.08 | Tropical |
| Litoral del estado de Yucatán4 | 6.00 | Tropical | 9.00 | Tropical |
| Litoral de Campeche5 | 5.37 | Tropical | 9.30 | Tropical |
| Litoral de Tabasco6 | 4.42 | Tropical | 6.73 | Tropical |
| Litoral de Veracruz (este estudio) | 3.64 | Mixta | 5.58 | Mixta |

Figura 9: Especies comunes de algas pardas y rojas en el área de estudio. A. Dictyota ciliolata Sonder ex Kützing, B. Padina boergesenii Allender & Kraft, C. Chnoospora minima (Hering) Papenfuss, D. Sargassum cymosum, E. Jania subulata (Ellis & Solander) Sonder, F. Acanthophora spicifera (Vahl) Børgesen, G. Alsidium triquetrum (S.G. Gmelin) Trevisan, H. Palisada perforata (Bory de Saint-Vincent) K.W. Nam. Fotografías: Luz Elena Mateo Cid y A. Catalina Mendoza-González.

Figura 10: Especies comunes de algas rojas y verdes en el área de estudio. A. Gracilaria flabelliformis (P. Crouan & H. Crouan) Fredericq & Gurgel, B. G. blodgettii Harvey, C. Caulerpa mexicana Sonder ex Kützing, D. C. racemosa var. macrophysa (Sonder ex Kützing) W.R. Taylor, E. C. sertularioides (S. Gmelin) M. Howe, F. Ulva lactuca L. Fotografías: Luz Elena Mateo Cid y A. Catalina Mendoza-González.
Reproducción
La etapa reproductiva de las algas estudiadas se presenta en el apéndice. Con mayor frecuencia se registró la fase tetraspórica, superando a la fase gamética masculina o femenina. De las 316 especies documentadas en este estudio, 73.89% (235) estaban en etapa fértil y 26.1% (82) en estado vegetativo, como es el caso de los representantes de los géneros Ulva, Caulerpa y Bryopsis J.V. Lamouroux, entre otros. En 170 taxones se encontró la fase esporofítica, mientras que la gametofítica estuvo presente únicamente en 15, como fue el caso de los géneros Dictyota, Padina, Sargassum y Gracilaria. Finalmente, 22 taxones se hallaron tanto en fase esporofítica (esporofito y carpoesporofito) como gametofítica; esto ocurrió en especies de los géneros Chondria, Palisada y Polysiphonia (Apéndice).
Epifitismo
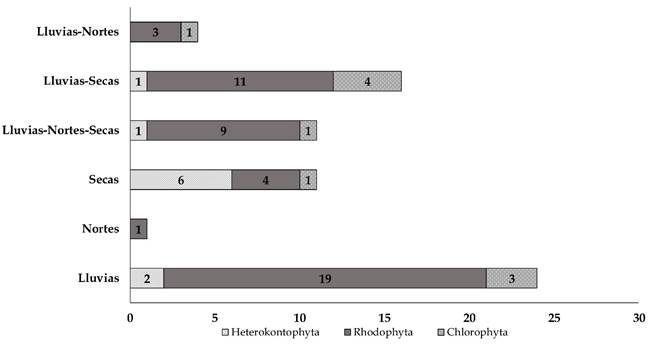
Se registraron 67 especies epífitas, 10 de ellas corresponden a Heterokontophyta, 47 a Rhodophyta y 10 a Chlorophyta (Fig. 11); en la temporada de lluvias únicamente hubo dos especies de Heterokontophyta, 19 de Rhodophyta y tres de Chlorophyta. En la época de secas se encontraron seis especies de Heterokontophyta, cuatro en Rhodophyta y una de Chlorophyta. Finalmente, durante los nortes hubo una especie de Rhodophyta que es exclusiva de esta temporada; sin embargo, hay especies que se encontraron en más de una temporada climática (Fig. 12). Once especies fueron registradas en las tres (una Heterokontophyta, nueve Rhodophyta y una Chlorophyta), 16 se encontraron tanto en lluvias como en secas (una de Heterokontophyta, 11 Rhodophyta y cuatro de Chlorophyta) y cuatro durante las lluvias y nortes (tres Rhodophyta y una Chlorophyta).
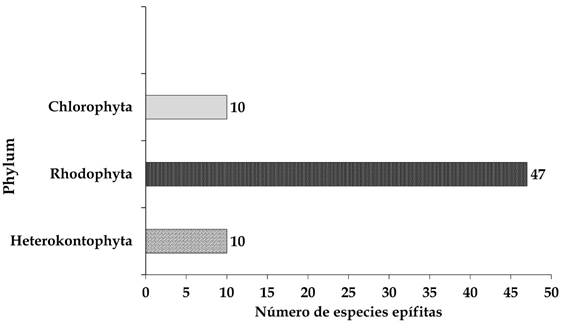
Figura 11: Número de especies de algas epífitas de otras algas o pastos marinos agrupadas por Phylum.
Discusión
Composición florística y factores de la diversidad
De los 312 taxones infragenéricos de algas marinas bentónicas citados previamente para el litoral de Veracruz, 246 fueron ubicados en la zona de estudio y, además, otros 70 corresponden a nuevos registros. De estos últimos, uno es nuevo para el litoral del Golfo de México, 12 para el litoral (previamente citados para la región insular) y 57 lo son para Veracruz (incluye tanto el litoral como la región insular). Se registran taxones citados previamente por Huerta-Múzquiz (1960), Humm y Hildebrand (1962), De La Campa-De Guzmán (1965), Sánchez-Rodríguez (1980), Garduño-Solórzano et al. (2005), Ramírez-Rodríguez y Blanco-Pérez (2011), García-López et al. (2017), De La Cruz-Francisco et al. (2017), Landa-Cansigno et al. (2019)) y García-García et al. (2020, 2021), que no fueron ubicados en el presente estudio (Cuadro 2). Su ausencia obedece a varias razones, pero destacan tanto el hecho de que algunas especies han sido excluidas por el tipo y número de muestreos realizados previamente por otros investigadores, como por el uso de nombres erróneamente aplicados. Esto último debido a que varios géneros como Cladophora, Ulva, Caulerpa, Bryopsis, Dictyota, Padina, Jania, Lithophyllum Philippi, Gracilaria y Laurencia J.V. Lamouroux se encuentran en una situación taxonómica compleja, pues para identificarlos se utilizan características vegetativas y reproductivas que se sobreponen entre ellas o incluso las claves taxonómicas no son lo suficientemente claras. Además, la incidencia de eventos climáticos (como huracanes), el incremento en la densidad poblacional y las construcciones urbanas pueden modificar la fisiografía de las playas y con ello, la riqueza y composición de comunidades algales, como ocurrió en el caso particular del litoral de Campeche (Mateo-Cid et al., 2013).
Otro ejemplo es el señalado por Martínez-Rivera et al. (2020), quienes mencionaron que el litoral constituye uno de los ambientes más frágiles de la tierra. Por lo tanto, es muy vulnerable a experimentar desequilibrios en su balance sedimentario, especialmente cuando la dinámica de los sedimentos o su medio de transporte son alterados considerablemente por la actividad humana. Estos mismos autores indicaron que, por ejemplo, en el caso de la península de Yucatán, por su posición geográfica y el relieve relativamente llano, la península está expuesta a fenómenos meteorológicos que históricamente han afectado su litoral. A su vez, los procesos de planeación urbana e infraestructura no han sido bien diseñados, por lo que la combinación de factores naturales y antrópicos están causando un paulatino retroceso de la línea de costa. Dentro de las causas naturales, se demostró que la temporalidad de los eventos (como el huracán Gilberto de categoría cinco) tienen incidencia directa sobre las modificaciones experimentadas por Punta Cancún en 1988. Mientras que en los factores antrópicos se detectó la ubicación de infraestructura urbana u hotelera a escasos metros de la línea de costa (Martínez-Rivera et al., 2020). Este último elemento de mala planeación urbana impide la disipación de la energía del oleaje o de las penetraciones del mar acelerando los procesos erosivos. Otra causa antrópica referida en los casos de estudios analizados está relacionada con la infraestructura portuaria de Chelem-Progreso (Martínez-Rivera et al., 2020). Ambos ejemplos pueden ser utilizados para explicar las afectaciones naturales o antrópicas que ocurren a lo largo del litoral del Golfo de México, incluyendo Veracruz.
Por otro lado, la gran cantidad de nuevos registros reportados en el presente estudio (Apéndice) puede atribuirse a varios factores, entre ellos a la realización de 92 muestreos en 11 localidades durante un periodo de 18 años, tres de ellas con pocos registros o sin ellos (Lechuguillas, El Canal-Escolleras de Alvarado, Playa Hermosa). Además, el trabajo se realizó durante las tres temporadas climáticas (lluvias de verano, lluvias de invierno (nortes) y secas) y se tomaron en consideración las epífitas, lo que permitió recolectar y enlistar un mayor número de especies. Por lo tanto, es posible que el incremento en el esfuerzo de muestreo reditúe en la recolecta y hallazgo de nuevos registros.
El número de algas marinas bentónicas conocidas para el litoral de Veracruz se incrementó de 312 a 391 especies. Esto indica que se trata de un área con alta riqueza específica, comparada con la zona costera de otros estados ubicados en el Golfo de México como son Campeche (211 especies; Mateo-Cid et al., 2013), Tabasco (172 taxones; Mendoza-González et al., 2017; Quiroz-González et al., 2017, 2018) y Yucatán (254 spp.; Ortegón-Aznar y Tejera, 2022). La alta diversidad de especies encontrada en el litoral veracruzano puede deberse al tipo de sustrato presente en las localidades de muestreo, el número de colectas realizadas, así como la minuciosa revisión de especímenes que permitió identificar un elevado número de epifitas (67), que en conjunto representan 21.6% del total de especies registradas.
En las familias mejor representadas resaltan Cladophoraceae, Caulerpaceae y Ulvaceae en Chlorophyta. Cladophora fue el género con el mayor número de especies (17), seguido de Caulerpa (13) y Ulva (11). Cladophora y Caulerpa coinciden con lo reportado por Garduño-Solórzano et al. (2005)), así como Ortegón-Aznar y Aguilar-Perera (2014) para el Golfo de México y litoral de Yucatán, respectivamente. Cladophora es un género de ambientes dulceacuícolas y marinos, con amplia distribución en todo el mundo (Lee, 2008); al igual que Caulerpa, solo que este género predomina en mares tropicales y subtropicales (Carruthers et al., 1993); siendo la península de Yucatán uno de sus tres centros de diversidad a nivel mundial (Espinoza-Ávalos et al., 2015). Sin embargo, en el litoral del Golfo de México aún no se han realizado estudios monográficos de Caulerpa. Ulva también es un género muy diverso, común en las costas de mares tropicales y lagunas costeras de México (Garduño-Solórzano et al., 2005; García-López et al., 2017), lo que explicaría su notable presencia en el área de estudio.
Por el contrario, algunos de los géneros registrados en el presente estudio, como Derbesia Solier, Phaeophila Hauck, Ulvella P. Crouan & H. Crouan, Boodlea G. Murray & De Toni y Parvocaulis S. Berger, U. Fettweiss, S. Gleissberg, L.B. Liddle, U. Richter, H. Sawitzky & G.C. Zuccarello, son poco diversos (Guiry y Guiry, 2024); la mayoría de ellos tienen ciclos de vida cortos, generalmente de algunas semanas a tres o cuatro meses. Por ejemplo, las especies del género Derbesia tienen ciclos digenéticos en donde la fase gametofítica es un talo vesicular inconspicuo que prevalece la mayor parte del tiempo, siendo la fase esporofítica macroscópica y de corta duración (Mateo-Cid y Mendoza-González, 1993). En el caso del género Phaeophila, los talos son pequeños y epífitos por lo que pasan desapercibidos y los registros de especies resultan escasos (Mateo-Cid et al., 2013). También se encontraron especies como Caulerpa prolifera (Forsskål) J.V. Lamouroux, Chaetomorpha linum (O.F. Müller) Kützing, Cladophora vagabunda (L.) C. Hoek, Ulva flexuosa Wulfen y Rhizoclonium riparium (Roth) Harvey, que Garduño-Solórzano et al. (2005) y Espinoza-Ávalos et al. (2015) han identificado en el Golfo de México como eurihalinas, las cuales tienen la capacidad de tolerar condiciones extremas de salinidad y con ello, sobrevivir en hábitats cambiantes.
De los registros previos para el litoral de Veracruz (Huerta-Múzquiz, 1960; Humm y Hildebrand, 1962; De La Campa-De Guzmán, 1965; Sánchez-Rodríguez, 1980; Garduño-Solórzano et al., 2005; Ramírez-Rodríguez y Blanco-Pérez, 2011; García-López et al., 2017; De La Cruz-Francisco et al., 2017; Godínez-Ortega et al., 2009, 2019; Landa-Cansigno et al., 2019; García-García et al., 2020, 2021), 75 especies previamente registradas en la zona, no se ubicaron en las muestras recolectadas (Cuadro 2). Lo anterior puede obedecer a diferentes razones; entre ellas, el cambio en los hábitats donde actualmente existe mayor influencia humana que ha transformado la arquitectura del paisaje, tal como lo mencionó Chong-Garduño (2015). Este autor indicó que la expansión de la ciudad y zona conurbada de Veracruz ha derivado en un área fragmentada debido a la urbanización, lo que ha impactado al medio natural particularmente a los servicios ecosistémicos que ofrecen manglares, lagunas costeras y litorales.
Algunos de los registros previos no encontrados en el presente estudio se consideran dudosos (Cuadro 2). Por citar algunos ejemplos, un trabajo del género Sargassum enfocado en su caracterización morfológica y molecular reveló que de las 16 especies previamente registradas en el Golfo de México y el Caribe mexicano, 10 formaron una politomía única con baja divergencia genética al emplear tres marcadores (mitocondrial, de cloroplasto y núcleo), lo cual indicaría que pertenecen a la misma especie (González-Nieto et al., 2020). Además, en varios estudios realizados a nivel mundial se ha demostrado que Sargassum es un género con alta plasticidad fenotípica, ya que la identificación de especies se basa únicamente en morfología, derivando en una sobreestimación de su diversidad en todo el mundo (González-Nieto et al., 2020).
Otro ejemplo es Dictyota, género que incluye 12 taxones, la delimitación de cada una de sus especies se basó en características morfológicas y reproductivas, dando como resultado que la identificación de los individuos fuera complicada. Aunado a eso, los tipos de ramificación del talo y de los ápices en algunos géneros de la familia Dictyotaceae, como Dictyota y Canistrocarpus De Paula & De Clerck, están influenciados por la luz, los nutrientes y la temperatura, entre otros factores (Bogaert et al., 2020). Lo anterior sugiere que la identificación de especies usando caracteres morfológicos puede no ser adecuada debido a la alta plasticidad fenotípica presente en Dictyota (Lozano-Orozco et al., 2015; 2016).
Estudios anteriores que intentaron esclarecer la naturaleza polifilética del orden Cladophorales, se centraron en las relaciones intragenéricas y no entre especies (Leliaert et al., 2007, Boedeker et al., 2012). Sin embargo, Taylor et al. (2017) sí analizaron las relaciones interespecíficas y sus resultados respaldaron aún más la necesidad de hacer revisiones taxonómicas de Cladophora y “Siphonocladus”, que además involucren a Chaetomorpha y Rhizoclonium, pues concluyen que la morfología de los géneros del orden Cladophorales no es filogenéticamente informativa ya que no refleja la evolución de este linaje.
Temporalidad
Las diferencias en la riqueza específica entre las localidades de muestreo pueden ser explicadas por el tipo de ciclo de vida de las especies identificadas, los cambios de los factores ambientales y el sustrato disponible para su establecimiento y desarrollo. Por ejemplo, Barra de Cazones, localidad donde se realizaron 34 muestreos, presentó el número más alto de especies (181) debido a que cuenta con una extensa proporción de sustrato rocoso (plataformas con pozas intermareales), arenoso y praderas del pasto marino Thalassia testudinum, que en conjunto favorecen el establecimiento de algas marinas (Ortegón-Aznar et al., 2001; Mateo-Cid et al., 2013). Barra de Cazones, que se encuentra influenciada por el Río Cazones, es una comunidad con importante actividad pesquera, presencia de basura tanto en el mar como en la playa y mal olor en el agua, pero dichos factores parecen no limitar el establecimiento y desarrollo de un gran número de especies.
Punta Puntilla, donde se hicieron 18 muestreos, tiene el segundo lugar en número de taxones (130), esto por la presencia de sustrato rocoso y arenoso. En Punta Delgada-Boca Andrea-Muñecos, Villa Rica, Veracruz-Boca del Río, Playa Hermosa y Montepío, se hicieron 39 muestreos y también se encontró un elevado número de especies, lo cual está relacionado con el tipo de sustrato de cada localidad, que es rocoso con extensas playas arenosas. Lechuguillas presenta una zona de cantos rodados y sustrato areno-limoso que causa movilidad, lo que implica que sea poco estable para muchas algas.
Las escolleras de Tuxpan, El Canal-Escolleras de Alvarado y Coatzacoalcos-Barrillas-Jicacal mostraron la menor riqueza específica comparada con el resto de las localidades. Lo anterior debido a tres factores: menor número de muestreos realizados (Tuxpan con 12, ocho en El Canal-Alvarado y cinco en Coatzacoalcos), aunado a que son zonas con escolleras y una proporción importante de sustrato arenoso. Las tres localidades comparten una problemática común de descargas residuales e industria pesquera, que contribuyen al aumento de nutrientes disueltos en el agua. Estos resultados concuerdan con los obtenidos en el análisis de agrupamiento, y a su vez explican porqué el estado de Veracruz se caracteriza por poseer hábitats heterogéneos a lo largo de toda su línea de costa, resultando en ambientes formados por playas arenosas. Algunas de ellas con praderas de Thalassia testudinum, áreas rocosas, areno-rocosas, plataformas con pozas intermareales (Garduño-Solórzano et al., 2005). Por lo tanto, esta variedad de ambientes puede explicar la mayor diversidad en localidades como Barra de Cazones, Punta Delgada-Boca Andrea-Los Muñecos, Villa Rica y Punta Puntilla, sitios caracterizados por ser principalmente rocosos.
Las playas rocosas por sí mismas son zonas con una gran estabilidad, ya que las rocas permanecen a lo largo del tiempo permitiendo que los organismos también persistan (Salazar-Vallejo y González, 1990). Por otro lado, la diversidad α también evidenció que las localidades con la menor diversidad son Tuxpan, Lechuguillas, El Canal-Escollera de Alvarado y Coatzacoalcos-Barrillas-Jicacal; es decir, aquellas que presentan sustratos artificiales, contrario a lo que mencionó Taylor (1960) al señalar que sustratos como las escolleras, exhiben una alta diversidad algal. Esta discordancia puede deberse a diversos factores, entre ellos, el esfuerzo de muestreo y la accesibilidad a los sitios de recolecta como indicaron Landa-Cansigno et al. (2019).
Factores como salinidad, temperatura, iluminación, sustrato, pH y actividades antrópicas, entre ellas la sobrepesca o desarrollo urbano frente a las costas, afectan de manera temporal el desarrollo de las comunidades algales (Hughes, 1994; Ortegón Aznar y Aguilar Perera, 2014). La mayor riqueza y composición de especies se registró en la temporada de lluvias (269), resultado que coincide con los de Ortega et al. (2001) y Callejas-Jiménez et al. (2005). En ambos trabajos se indica que existe una mayor disponibilidad de luz (Lalli y Parson, 1997), debido a que en el verano los días son más largos y las mareas vivas ocurren en la mañana y en la noche (Mendoza-González et al., 1994), hay aguas más cálidas, transparentes y muy poca o nula turbulencia debida al oleaje (Ortegón Aznar y Aguilar Perera, 2014).
La temporada de nortes se caracteriza por un incremento en la movilidad de las masas de agua hacia la línea de costa, turbulencia, poca visibilidad subacuática y baja radiación solar (Lalli y Parson, 1997; Mateo-Cid et al., 2013). Características que afectan el crecimiento de muchas especies que carecen de buena sujeción (Ortegón y Aguilar, 2014), y solo aquellas que estén bien arraigadas al fondo pueden mantenerse, como ocurre con el género Caulerpa (Garduño-Solórzano et al., 2005). En contraste, Mateo-Cid et al. (2013) registraron la mayor riqueza específica para el litoral de Campeche en la temporada de secas. En el caso de Veracruz no fue así, una probable explicación es que en esta temporada las mareas vivas ocurren desde el mediodía hasta al atardecer, esto implica que las macroalgas quedan expuestas en los momentos del día en que la radiación solar es mayor y esto se traduce en condiciones estresantes; por lo tanto, en una baja riqueza específica (Mendoza-González et al., 1994).
Finalmente, con respecto a los taxones encontrados en las tres temporadas climáticas, resulta importante mencionar que el hecho de hallarlos en cualquier temporada permite considerar la posibilidad de explotarlos económicamente o evaluarlos como bioindicadores de la calidad del agua. Tal es el caso de Sargassum cymosum C. Agardh, Ulva lactuca, U. compressa L., Gracilaria apiculata P. Crouan & H. Crouan y G. blodgettii, que como en el caso de las especies de Ulva reportadas en este estudio, ya han sido utilizadas como indicadoras de materia orgánica rica en nitrógeno, fósforo, cloruros, así como tolerantes a los desechos domésticos ricos en ellos (de la Lanza Espino y Hernández-Pulido, 2000); además, Sargassum y Gracilaria, son géneros potencialmente productores de alginato y agar, respectivamente.
Sustrato
La naturaleza física del sustrato influye en el establecimiento, distribución y composición de algas marinas (Santelices, 1977; Garduño-Solórzano et al., 2005). En el presente estudio la mayor riqueza específica se encontró en rocas (179 especies), seguido de las epífitas (67), en sustratos diversos (57) y arenoso (10). Diversos autores (Cetz-Navarro et al. (2008), Mateo-Cid et al. (2013), Dreckmann y Sentíes (2014), García-López et al. (2017) y Quiroz-González et al. (2017, 2018)) concuerdan con la gran riqueza presente en el sustrato rocoso para el litoral del Golfo de México, ya que este favorece el desarrollo de muchas especies de Heterokontophyta, Rhodophyta y Chlorophyta (Apéndice, Fig. 6). Asimismo, Taylor (1960) señaló que las rocas expuestas al oleaje son sitios que albergan una gran diversidad, propiciando el establecimiento de las comunidades algales. Otros autores como Garduño-Solórzano et al. (2005) también señalan que la mayor riqueza específica se encuentra en sustratos rocosos y arenosos; además, ubican una menor diversidad en aquellos de origen animal, vegetal y artificial. Mención especial merecen las Ulvophyceae, particularmente las algas verdes sifonadas como son Caulerpa, Codium y Halimeda, que desarrollan largos rizoides o estolones mediante los cuales forman una matriz estabilizadora del sedimento que les permite fijarse fuertemente al sustrato (Ortegón y Aguilar, 2014).
En cuanto al sustrato artificial, su presencia es propiciada por influencia antrópica que cada vez es mayor, debido a la construcción de escolleras y muelles en donde especies como Chaetomorpha antennina, Cladophora laetevirens (Dillwynn) Kützing, Ulva flexuosa, U. compressa y U. lactuca, han conseguido adaptarse (Garduño-Solórzano et al., 2005).
Biogeografía
Los taxones encontrados en el área de estudio representan una ficoflora mixta (Cuadro 3), en la cual conviven elementos que tienen una distribución tropical predominante entre ellos: Hypnea spinella (C. Agardh) Kützing, Grateloupia gibbesii Harvey, Heterosiphonia crispella (C. Agardh) M.J. Wynne, Jania capillacea Harvey, Lithophyllum stictiforme (Areschoug) Hauck, Liagora ceranoides J.V. Lamouroux, Gayliella transversalis (F.S. Collins y Hervey) T.O. Cho & Fredericq, Ulva lactuca, U. compressa, Cladophora vagabunda, Chaetomorpha antennina, Dictyota ciliolata Sonder ex Kützing, Padina boergesenii Allender & Kraft y Colpomenia sinuosa (Mertens ex Roth) Derbès & Solier, entre otros (Mateo-Cid et al., 2013; García-García et al., 2020, 2021); con algunos cuya distribución ocurre en aguas más norteñas, como son: Halymenia floridana, Herponema tortugense y Streblonema invisibile (Schneider y Searles, 1991).
Es importante resaltar que los resultados aquí presentados contrastan con lo sugerido por Garduño-Solórzano et al. (2005) en su trabajo de distribución geográfica y afinidad por el sustrato de algas verdes en el Atlántico mexicano. En él, refieren que a lo largo de las costas de la vertiente existen dos provincias: la Caribeña, que corresponde a la ficoflora tropical de las costas de Quintana Roo hasta Veracruz, y la provincia Caroliniana, cuya flora tiene afinidad con aguas subtropicales y es pobre en especies; siendo Cabo Rojo, Veracruz, la frontera que separa la costa tropical y subtropical de México (Garduño-Solórzano et al., 2005).
En el presente estudio, Barra de Cazones, localidad ubicada en el norte de Veracruz, registró el mayor número de taxones del litoral. Además, hay más similitud florística de los taxones ubicados en Veracruz con localidades de la región caribeña de México. Por ejemplo, en un trabajo de algas rojas para el Atlántico de México, García-García et al. (2020) señalaron que de las 451 especies catalogadas únicamente 101 se encuentran en el Golfo de México, mientras que 115 se distribuyen solo en el Caribe mexicano y las 247 restantes están en ambas regiones. Eso sugiere un considerable intercambio florístico que atribuyen a la corriente que pasa por el canal de Yucatán como la fuente proveedora de especies al litoral de Veracruz desde Quintana Roo; por ello, ambos estados son florísticamente afines (García-García et al., 2020).
Finalmente, García-García et al. (2021) comentaron que 62% de las especies de algas pardas han sido registradas tanto en el Golfo de México como en el Caribe mexicano, mientras que 23% son exclusivas del Golfo y 15% solo están en el Caribe, por lo que el alto porcentaje de taxones compartidos entre ambas regiones sugiere nuevamente un elevado intercambio florístico, así como una mayor diversidad de algas pardas en Quintana Roo y Veracruz. Por lo anterior, es posible inferir que las algas marinas bentónicas que habitan el litoral de Veracruz pueden ser consideradas como un conjunto ficoflorístico en el que se sobreponen taxones tropicales y caribeños, principalmente.
Reproducción
En el presente estudio, de 48 especies documentadas de Phaeophyceae, 42 se encontraron en estado reproductivo, hecho que coincide con lo registrado por Mendoza-González et al. (2000), Mateo-Cid et al. (2000, 2013) y Ávila-Ortiz et al. (2011). Estudios experimentales y observaciones de campo sugieren que la luz y la temperatura, o la combinación de ambas, a menudo inducen la fertilidad en las algas marinas (Liu et al., 2017).
Con relación a la fenología reproductiva del orden Dictyotales, la proporción y distribución temporal de los gametofitos generalmente se considera muy reducida (Phillips, 1988). Tronholm et al. (2008) encontraron también una dominancia de esporofitos en Dictyota dichotoma (Hudson) J.V. Lamouroux, mencionando que, en algunas estaciones del año, los gametofitos podían constituir hasta 30% de las poblaciones. En ese mismo trabajo, solo una especie de Dictyotales presentó fase gametofítica, mientras que en 19 se encontraron esporofitos. Este hallazgo concuerda con otros estudios (Phillips, 1988; Montañés et al., 2006; Ávila-Ortiz et al., 2011).
De los 175 taxones de Rhodophyta registrados en el presente estudio, 123 estaban en fase tetrasporofítica. Esto indica que es la etapa reproductiva mejor representada en las especies aquí documentadas; además, coincide con los resultados obtenidos por Mateo-Cid y Mendoza-González (1991) y Mateo-Cid et al. (2013, 2019). Mendoza-González y Mateo-Cid (1992), al igual que Magalhães y de Castro-Nunes (2002), mencionaron que la dominancia de una fase reproductiva puede estar influenciada por los cambios temporales de factores ambientales a nivel local. Estos datos permiten considerar que la generación esporofítica tiene una supervivencia más larga con respecto a la gametofítica y a otros mecanismos de reproducción, como la propagación vegetativa o la apomeiosis (Ardito y Gómez, 2005). Las etapas sexuales estuvieron poco representadas en Rhodophyta, pues solo se encontraron 19 especies con espermacios y ocho con carpogonios. De acuerdo con Santelices (1977), la reproducción asexual tiene la ventaja de requerir un menor gasto de energía para la formación de esporas y su diseminación rápida, en comparación con los gametos, que solo están presentes cuando las condiciones del medio son adversas.
Referente a las 93 especies de Chlorophyta, 66 de ellas se encontraron en estado vegetativo, coincidiendo con los resultados de Saad-Navarro y Riosmena-Rodríguez (2005) y Mateo-Cid et al. (2013), quienes reportaron una mayor proporción de Ulvophyceae en fase vegetativa que en estado reproductivo, para las costas de Baja California Sur y Campeche, respectivamente. Esto se debe a que las algas de la clase Ulvophyceae cuentan con fases sexuales con un periodo de vida corto, por lo que los eventos reproductivos de manera sexual son efímeros (Mateo-Cid et al., 2013). Asimismo, las estructuras de reproducción son poco evidentes y su formación se lleva a cabo rápidamente; además, a partir de estas ocurre una pronta liberación de gametos móviles (Cocquyt et al., 2010). Incluso algunos de los taxones ubicados en el presente estudio podrían haberse encontrado en estadios juveniles.
Epifitismo
El Phylum Rhodophyta resaltó por tener la mayor cantidad de algas epífitas con 46 especies (Fig. 11); esto coincide con diversos estudios previos (Borowitzka et al., 2006; Mateo-Cid et al., 2015; Quiroz-González et al., 2023), particularmente en la temporada de lluvias, ya que aumenta la cantidad de luz clara, factor que influye en la abundancia de epífitas (Borowitzka et al., 2006); también la poca accesibilidad a ella, ya que las algas rojas tienen la capacidad de desarrollarse en condiciones de poca luz. Lo anterior no sucede con las especies de Heterokontophyta debido a que el mayor número de epífitas de este grupo se hallaron durante la temporada de secas, cuando hay mayor disponibilidad de luz. La dominancia de algas rojas epífitas en las tres temporadas climáticas (Fig. 12) refiere también el equilibrio en los factores bióticos y abióticos presentes en el área de estudio; de otra forma se podría inferir la influencia de condiciones inusuales como el enriquecimiento de nutrientes que resulta en la abundancia de especies de Chlorophyta o Cyanobacteria (Borowitzka et al., 2006).
En el presente estudio se determinó que la morfología de los talos epífitos de Rhodophyta es filamentosa, lo cual coincide con los resultados obtenidos por Arrontes (1990) y Quiroz-González et al. (2023), quienes mencionaron que las rodofitas presentan crecimiento rápido, reproducción temprana, tallas pequeñas y ciclo de vida corto (Ortuño-Aguirre y Riosmena-Rodríguez, 2007), características que las hacen competitivas en la adquisición de un sustrato (Kasim et al., 2020).
Estudios como el de Garduño-Solórzano et al. (2005) también indican un alto grado de epifitismo de géneros de la familia Cladophoraceae; además de especies como Phaeophila dendroides (P.L. Crouan y H.M. Crouan) Batters y Ulvella lens P.L. Crouan y H.M. Crouan, las cuales también fueron encontradas como epífitas en el presente trabajo. Se ha observado que el establecimiento de algas epífitas sobre diferentes forofitos o basibiontes depende tanto de factores climáticos estacionales como de aspectos biológicos; entre ellos, el tipo de superficie, rugosa o lisa, o la producción de sustancias extracelulares como estrategia de defensa ante la herbivoría, que las vuelven poco atractivas para las epífitas (Round, 1981).
En otros estudios (Dreckmann y Sentíes, 1994; Mateo-Cid et al., 2013, 2015; Quiroz-González et al., 2018, 2023), también se reporta un alto grado de epifitismo en algas rojas como Digenea mexicana G.H. Boo & D. Robledo (como D. simplex (Wulfen) C. Agardh en Mateo-Cid et al. (2013)), la cual fue encontrada en este estudio como basibionte de especies pertenecientes a los géneros Chaetomorpha, Cladophora, Rhizoclonium, Dictyota, Feldmannia, Polysiphonia, Gayliella y Centroceras. El alto grado de epifitismo puede atribuirse a que la mayoría de las epífitas crecen sobre macroalgas como Sargassum cymosum C. Agardh, Padina gymnospora, Palisada perforata (Bory) K.W. Nam, Alsidium triquetrum (S.G. Gmelin) Trevisan y Codium taylorii P.C. Silva, entre otras. Por esto, Santelices (1977) sugirió que la longevidad del basibionte debe ser suficientemente amplia para permitir a las epífitas completar su ciclo de vida.
La importancia biológica de las algas epífitas radica en que participan en la cadena y redes tróficas de diversos organismos marinos que habitan en los litorales intermareales (Ramírez-Rodríguez y Blanco-Pérez, 2011). Además, la interacción epífita-basibionte presenta efectos negativos como la reducción de energía lumínica y, por tanto, de la actividad fotosintética del hospedero (Ortuño-Aguirre y Riosmena-Rodríguez, 2007).
Conclusiones
El análisis y la integración de estudios previos con los resultados obtenidos en el presente trabajo permiten inferir la importancia de realizar inventarios ficoflorísticos en regiones del litoral mexicano poco o ya estudiadas, ya que posibilitan conocer aspectos ecológicos de las comunidades de algas registradas anteriormente, utilizando herramientas como análisis moleculares que facilitan la resolución de identidad de algunas especies registradas en el litoral veracruzano. Es necesario realizar monitoreos a corto y mediano plazo de las poblaciones de algas marinas como una estrategia que ayude a determinar las posibles variaciones de la ficoflora, ya sea por condiciones climáticas naturales tales como huracanes, períodos de lluvias o sequías intensos, los efectos del incremento de la temperatura en el mar, las actividades de turismo, pesquerías y urbanización en las zonas costeras para establecer programas de conservación y aprovechamiento.











 nueva página del texto (beta)
nueva página del texto (beta)