Introducción
La simbiosis micorrízica arbuscular es aquella asociación que establecen los hongos glomeromicetos con plantas vasculares de la mayoría de las familias botánicas mediante la colonización intraradical de la corteza de la raíz por medio de estructuras especializadas (Delavaux et al., 2019). La importancia de los Hongos Micorrízicos Arbusculares (HMA) en los ecosistemas radica en la tolerancia al estrés abiótico que promueven en las plantas (Begum et al., 2019), dada su capacidad de incrementar la absorción de agua y nutrientes, entre otros efectos (Zhang et al., 2020). Actualmente se tiene el registro de 346 especies de HMA a nivel mundial, de las cuales 56 pertenecen al género Glomus Tul. & C. Tul. (Schüβler, 2023). En México se han reportado 162 especies de HMA (Polo-Marcial et al., 2021, 2022; Chimal-Sánchez et al., 2021), de las cuales 46% de las especies pertenecen al género Glomus (Polo-Marcial et al., 2021). Considerando la posición geográfica del país, la variedad de ecosistemas y las especies vegetales, hipotéticamente se esperaría un reservorio importante de HMA en el país interactuando con especies vegetales (Montaño et al., 2012).
En cuanto a la diversidad de HMA y fitobiontes con los que se asocian en México, el bosque tropical caducifolio es una de las comunidades vegetales que junto con algunos sistemas agrícolas han sido mayormente investigados (Montaño et al., 2012). A la fecha se han documentado 53 especies de HMA en los bosques tropicales del país, lo cual representa 33% de la diversidad total de HMA presente en México (Polo-Marcial et al., 2021). Sin embargo, se recomienda la constante exploración en vegetaciones naturales con el fin de seguir documentando la riqueza de HMA e incrementar los estudios taxonómicos a fin de generar un mayor conocimiento biológico de la simbiosis micorrízica en el país (Chimal-Sánchez et al., 2016). Por ello, la presente investigación tuvo como objetivo contribuir al conocimiento de la riqueza taxonómica de HMA en México, a través del registro y descripción de Glomus nanolumen Koske & Gemma encontrada en muestras de suelo procedentes de un bosque tropical caducifolio del estado de Guanajuato, México.
Materiales y Métodos
El área de estudio (Fig. 1) corresponde a un bosque tropical caducifolio, ubicado en el municipio León, Guanajuato, México, en las coordenadas 21°05'38.0''N, 101°44'40.0''W a 1830 m s.n.m. El clima es semicálido con temperatura media anual de 18 °C y precipitación media anual de 650 mm (CONAGUA, 2023); el suelo corresponde a un Pelic Vertisol de acuerdo con la clasificación de la International Union of Soil Sciences (IUSS) Working Group WRB (WRB, 2015). La vegetación corresponde a un bosque tropical caducifolio, con mayor presencia de Ipomoea arborescens (Humb. & Bonpl. ex Willd.) G. Don., Mimosa monancistra Benth. e Isolatocereus dumortieri (Scheidw.) Backeb.
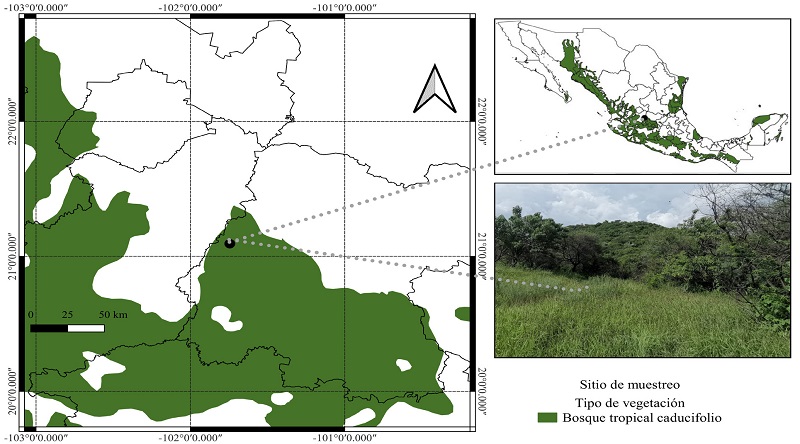
Figura 1: Bosque tropical caducifolio (CONABIO, 2018) y área de estudio en el municipio León, Guanajuato, México. Mapa elaborado a partir de verificación en campo.
El muestreo de suelo para recolectar esporas se realizó en la época de lluvias de agosto de 2021 en una ladera con orientación en barlovento. Se estableció un transecto de 1 km con dirección al norte sobre la pendiente. Ahí, cada 200 m se tomó una submuestra de suelo a una profundidad de 0-30 cm, para así generar una muestra compuesta. La caracterización del suelo se realizó mediante la metodología de la NOM-021-RECNAT-2000 (SEMARNAT, 2002). El suelo presenta una textura franca arenosa, con un pH neutro (7.1), fuertemente salino (8.4 mS cm-1), materia orgánica alta (4.7%), nitrógeno inorgánico bajo (5.9 kg ha-1), fósforo extraíble alto (255 kg ha-1) y potasio alto (2891 kg ha-1).
La extracción de esporas de HMA se realizó por el método de tamizado húmedo y decantación (Gerdermann y Nicolson, 1963), seguido de una centrifugación (centrifuga C-40 SOL-BAT, Puebla, México) de sacarosa con agua al 70% a 2000 rpm (Daniels y Skipper, 1982). Las esporas se montaron en preparaciones semi-permanentes con alcohol polivinílico-lacto-glicerol (PVLG) y PVLG + reactivo de Melzer (INVAM, 2013).
La identificación se basó en las características morfológicas de las esporas como lo sugieren Walker (1983) y Morton (1988). Se registraron el tamaño de las esporas y las características de su pared incluida su reacción con Melzer, así como la hifa de sostén. Todo se observó bajo un microscopio óptico Zeiss Primo Star (Jena, Alemania) con iluminación fija Koehler. Las mediciones de las características de las esporas se realizaron en fotografías tomadas con el software de microscopía ZEN blue v. 3.4 (Zeiss, 2021). Lo anterior, usando la escala calibrada en objetivos 40× y 100×. La descripción de la estructura de la espora sigue la metodología de Koske y Gemma (1989), y su coloración se determinó mediante la carta de colores de Kornerup y Wanscher (1983).
Los resultados obtenidos del material mexicano estudiado se contrastaron con la descripción original de la especie, y con descripciones de las especies de Glomeromycota conocidas para el género, que están disponibles en el sitio de Phylogeny Arbuscular Mycorrhizal Fungi (AMF, 2023) y Taxonomy of Arbuscular Fungi (Blaszkowski, 2003). Preparaciones fijas de las esporas del material estudiado fueron depositadas como referencia en el herbario SLPM (Thiers, 2024) del Instituto de Zonas Áridas, de la Universidad Autónoma de San Luis Potosí, México.
Resultados
Taxonomía
Glomeromycota
Glomeromycetes
Glomerales
Glomeraceae
Glomus nanolumenKoske & Gemma, Mycologia 81(6): 935 (1989). Fig. 2.
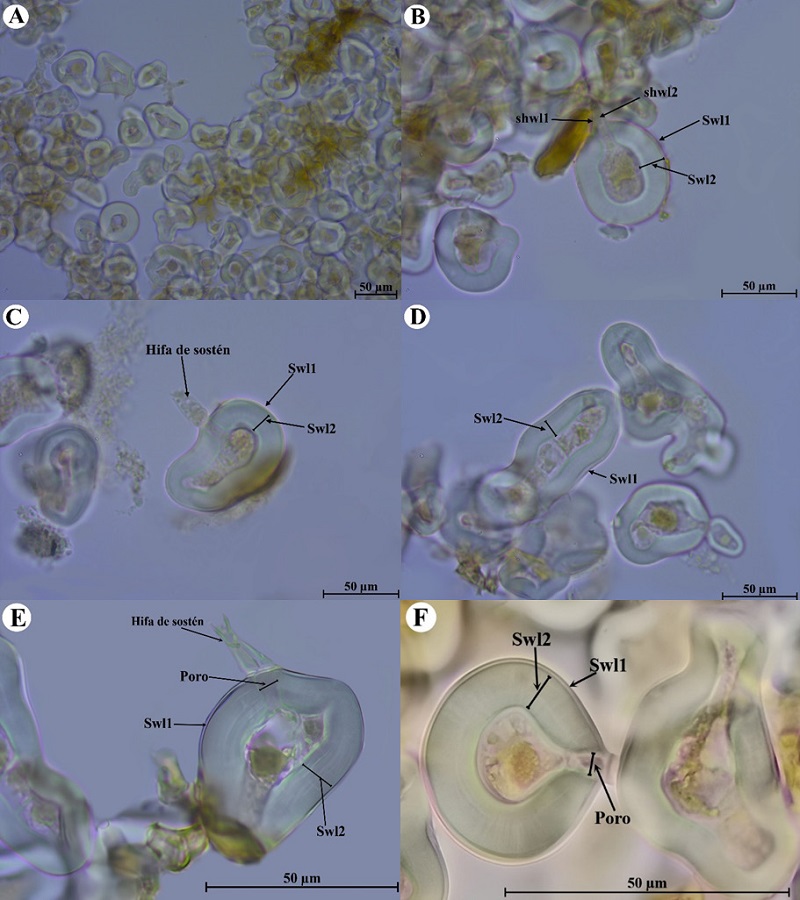
Figura 2: Estructura subcelular de Glomus nanolumen Koske & Gemma. A. esporas en esporocarpo (40×); B. esporas con restos de esporocarpo, paredes de la capa externa de la espora (Swl1-2), capas externas de la hifa de sostén (shwl1-2) (100×); C. capas externas de la pared de la espora (Swl1-2) e hifa de sostén (100×); D. capas externas de la pared de la espora con forma tipo elipsoidal irregular (Swl1-2) (100×); E. capas externas de la pared (Swl1-2), hifa de sostén y poro de la espora (100x); F. capas externas de la pared de la espora (Swl1-2) y poro de la espora (100×).
TIPO: HAWÁI. Dunas calcáreas del parque estatal Polihale de Kauai, entre raíces de Scaevola serícea, 24.XI.1987, KG 649 (holotipo: OSC). Mycobank: 125543.
Esporocarpos 90-250 µm de diámetro (Fig. 2 A,B), esporas ovoides o irregulares, hialinas o, blanco amarillentas (1A2) a amarillo pálidas (4A3), (15-) 33(-54) µm de diámetro; en esporas elipsoidales tamaño promedio de 26.8 × 67.3µm (Fig. 2D); pared esporal (Swl) de dos capas (Swl1-2; Fig. 2 B-F); la capa 1 (Swl1) forma la superficie de la espora y su color varía de hialina a amarillo pálido, (0.5-)0.7(-1.6) µm de grosor; la capa 2 (Swl2) es laminada, hialina, (3.7-)6.0(-14) µm de grosor; en determinadas regiones de la pared puede diferir el grosor en 2-3 veces su tamaño llegando a medir hasta 20 µm; la pared es difícil de romper al aplicar presión, sin embargo, con frecuencia se agrieta o logran aparecer líneas de fractura; ambas capas no reaccionan al reactivo de Melzer; la hifa de sostén es hialina tornándose a blanco amarillenta, puede ser recta o de forma acampanada (Fig. 2 B, C, E), (7.5-)11.5(-17) µm de ancho en la base de la espora; la pared (shw) es hialina a blanco amarillenta, con probabilidad de tener dos capas (shwl1 y shwl2; Fig. 2B), ambas continuas con Swl1 y Swl2 en la base de la espora; el poro (1.7-)3.2(-4.3) µm de diámetro en la base de la espora (Fig. 2 E, F).
Hábitat y distribución: Glomus nanolumen fue descrita de Hawái, asociada a vegetación de dunas calcáreas (Koske y Gemma, 1989; 1996). Se ha registrado en suelos pantanosos en la India (D'Souza y Rodrigues, 2013; Shekhar y Basu, 2017), bosques ribereños de Irán (Moradi Behbahani et al., 2017) y diversas áreas en Brasil (Stürmer y Siqueira, 2011; de Assis et al., 2018; Caproni et al., 2018). En México se registra en bosque tropical caducifolio.
Material examinado: MÉXICO. León, Guanajuato, 21°05'38.0''N, 101°44'40.0''W, 1788 m s.n.m, 20.VII.2021, Hipólito-Piedras s.n., CH-SLPM-183 (SLPM).
Discusión
El espécimen estudiado de Glomus nanolumen se encuentra entre la variación morfológica descrita por Koske y Gemma (1989). Estos autores describieron por vez primera la especie de dunas calcáreas de Kauai, Hawái, asociada a las raíces de Scaevola sericea Vahl. e Ipomoea stolonifera (Cirillo) J. F. Gmel. Posteriormente G. nanolumen se registró en el parque estatal de Polihale en dunas de Kauai, Hawái (Koske y Gemma, 1996).
Fuera de la isla de Hawái, G. nanolumen se reportó en el continente asiático en suelos pantanosos del rio Terekhol en la India, con presencia de especies de Acanthus ilicifolius L., Excoecaria agallocha L. y Rhizophora mucronata Poir. (D´Souza y Rodrigues, 2013), y en Allahabad, India, colonizando a la planta ornamental Calendula officinalis L. (Shekhar y Basu, 2017). En Irán se registró la presencia de G. nanolumen en un bosque ribereño en el río Maroon en Behbahan, en el que se observó asociado a Populus euphratica Olivier (Moradi Behbahani et al., 2017). En América se registró en la región amazónica, en un suelo dedicado a la agroforestería en el municipio Bejamin Constant, Amazonas, Brasil (Stürmer y Siqueira, 2011), además en un bosque húmedo tropical en Chapada do Araripe, Ceará, Brasil (de Assis et al., 2018) y en zonas degradadas por minería en territorio amazónico ubicado en Porto Trombetas, Pará, Brasil (Caproni et al., 2018). Nuestro registro corresponde al primero de la especie en México.
En cuanto a los esporocarpos, Glomus nanolumen es similar a G. cerebriforme McGee, Rhizophagus prolifer (Dalpé & Declerck) C. Walker & A. Schüßler, Rhizoglomus fasciculatum (Thaxt.) Sieverd., G.A. Silva & Oehl y Rhizoglomus microaggregatum (Koske, Gemma & P.D. Olexia) Sieverd., G.A. Silva & Oehl. Todas carecen de peridio y mantienen la coloración hialina a blanco amarillenta. Sin embargo, G. cerebriforme y R. microaggregatum desarrollan dos capas hialinas flexibles que no superan 2 y 4 µm de grosor, respectivamente, en tanto que G. nanolumen tiene dos capas de más de 10 µm que además del grosor y la rigidez de la capa swl2, que le otorga una peculiaridad de no quebrarse en láminas como otras especies del género Glomus, se agrieta o bien aparecen fracturas radiales en regiones de la pared esporal. Rhizoglomus fasciculatum presenta tres capas en donde la capa media reacciona al reactivo Melzer, contrario a G. nanolumen que presenta dos capas que no reaccionan con este reactivo. La particularidad de esporas irregulares y ovoides de G. nanolumen es similar a Rhizoglomus custos (C. Cano & Dalpé) Sieverd., G. A. Silva & Oehl; no obstante, las esporas de R. custos desarrollan cuatro paredes delgadas, mientras que G. nanolumen solo presenta dos paredes.
El último registro en México de una especie perteneciente al género Glomus fue G. trufemii B. T. Goto, G. A. Silva & Oehl, encontrado en una sabana tropical (Álvarez-Lopeztello et al., 2018), por lo cual la presente investigación con el registro de G. nanolumen incrementa a 163 la riqueza total de especies de HMA en México que corresponde a 48% de las 56 especies del género Glomus descritas mundialmente.
Contribución de autores
RPHP y HMC conceptualizaron la idea original. RPHP colectó las muestras de suelo en campo, y realizó la extracción y montaje de esporas. RPHP y HMC, se encargaron de la identificación taxonómica y tomaron las fotografías. RPHP realizó la lustración de leyendas de imágenes y preparó el manuscrito. HMC, HMRT y VOP revisaron, editaron y aprobaron el manuscrito final.











 nueva página del texto (beta)
nueva página del texto (beta)



