Introducción
El síndrome de ovario poliquístico (SOP) constituye una alteración endocrinológica compleja cuyo diagnóstico presenta desafíos significativos1, con una prevalencia global del 6-20%1-4.
A pesar de la existencia de diversos criterios para su diagnóstico, los más ampliamente aceptados son los de Rotterdam, actualizados en el año 2023 que se muestran en la tabla 15. Sin embargo, es crucial destacar que estos criterios no abordan la resistencia a la insulina (RI), una condición presente en el 50 al 80% de las mujeres con SOP4-7.
Tabla 1 Criterios diagnósticos del síndrome de ovario poliquístico de acuerdo con la guía basada en evidencia 2023
| Dos o más de los siguientes criterios |
|---|
| Oligo-ovulación o anovulación |
| Progesterona sérica < 4 ng/dl o ciclos menstruales irregulares definidos como: |
| 1 a 3 años posmenarca: < 21 días o > 45 días |
| 3 años después de la menarquia < 21 o > 35 días o < 8 ciclos por año |
| 1 año después de la menarquia > 90 días para cualquier ciclo |
| Amenorrea primaria a los 15 años o > 3 años después de la telarquia |
| Evidencia clínica o bioquímica de hiperandrogenismo Clínico |
| Hirsutismo: Ferriman Gallwey modificada > 6 |
| Bioquímico: se debe utilizar testosterona total y libre medida por espectofotometría de masas, si no se cuenta con estás técnicas de laboratorio se puede estimar mediante el índice de andrógenos libres |
| Morfología del ovario poliquístico por ultrasonido |
| Más de 20 folículos de 2-9 mm en al menos un ovario |
| El abordaje transvaginal es el más preciso para el diagnóstico |
| En la ecografía transabdominal se debe utilizar el volumen ovárico mayor de 10 ml en al menos un ovario |
| Exclusión de otras causas de exceso de andrógenos: hipotiroidismo, hiperprolactinemia, hiperplasia suprarrenal congénita de inicio tardio, síndrome de Cushing y tumores adrenales |
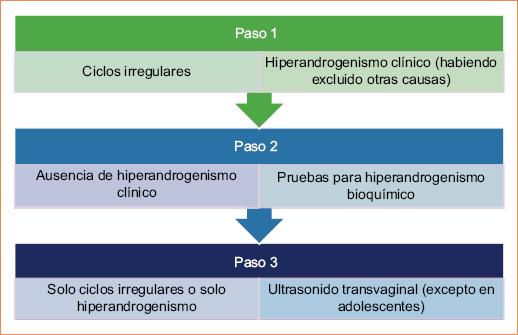
En la actualización realizada en 2023, se recomienda seguir el algoritmo para el diagnóstico que se muestra en la figura 15.
El SOP representa un problema significativo de salud pública con implicaciones reproductivas, metabólicas y psicológicas8. Se asocia con comorbilidades como obesidad, síndrome metabólico, diabetes tipo 2 y subfertilidad8. En México se estima que el 80% de las mujeres con obesidad y SOP presenta RI9.
La RI se define como una respuesta inapropiada a la insulina en los tejidos metabólicamente activos, generando un catabolismo anormal de glucosa y lípidos, así como a una reducción en la cantidad circulante de globulina fijadora de hormonas sexuales (SHBG, por su siglas en inglés), favoreciendo la liberación de andrógenos libres10. La evidencia científica actual sugiere que los pacientes con RI tienen un mayor riesgo de desarrollar enfermedades crónicas degenerativas con el tiempo, subrayando la importancia de un diagnóstico y tratamiento oportunos5,10.
En este contexto, se consideró pertinente realizar una reunión de expertos para revisar los criterios diagnósticos del SOP y la RI, con el objetivo de proporcionar un respaldo científico actualizado sobre el SOP, analizar la viabilidad de los diversos métodos diagnósticos de la RI en nuestro país, determinar el manejo integral de pacientes con SOP que presentan RI y abordar la prevención de las consecuencias metabólicas y cardiovasculares asociadas a la RI.
El objetivo principal fue ofrecer una guía efectiva y práctica sobre cómo manejar el SOP y la RI para profesionales como ginecólogos, obstetras, endocrinólogos, biólogos de la reproducción, nutriólogos y médicos generales. Como resultado, se elaboró un consenso actualizado sobre el SOP y la RI.
Método
El grupo de consenso se formó en respuesta a la creciente necesidad de un enfoque integral para abordar el SOP y su asociación con la RI que tiene un impacto en la salud pública. Con la visión de desarrollar estrategias de diagnóstico y tratamiento actualizadas, el grupo de expertos incluyó a especialistas mexicanos en ginecología, obstetricia y biología de la reproducción. Cada miembro aporta una perspectiva y experiencia en áreas específicas relacionadas con el SOP y la RI, permitiendo un enfoque multidisciplinario. Desde la creación del grupo de expertos se han realizado reuniones regulares para revisar los criterios de diagnóstico existentes, analizar las últimas investigaciones y compartir casos clínicos.
Estrategia de búsqueda
Dos revisores, un experto en información y un investigador independiente, realizaron una búsqueda de la literatura en las principales bases de datos, incluyendo PubMed, ScienceDirect, Embase, Google Scholar e IMBIOMED. Los términos de búsqueda MESH utilizados incluyeron: "síndrome de ovario poliquístico", "PCOS", "resistencia a la insulina", "SOP", "edad reproductiva" y "calidad ovocitaria", de 1990 a 2023. Además, se analizaron las referencias de los estudios reconocidos para identificar estudios adicionales, resolviendo cualquier discrepancia en la extracción de datos mediante consenso mutuo. Se realizó una reunión de dos días en diciembre del 2021 y dos días en diciembre del 2023, durante la cual cada experto presentó sus perspectivas sobre la información recopilada. Esta información fue sometida a discusión y consenso mediante un cuestionario de evaluación, posteriormente referenciado y admitido como evidencia. Los expertos fueron seleccionados en función de sus contribuciones científicas en el área.
Criterios de inclusión
Los estudios fueron clasificados según los criterios de Oxford11, se incluyeron los estudios que cumplieron con los siguientes criterios: a) estudios transversales, de casos y controles o de cohortes que incluyeron mujeres con SOP de 15 a 55 años y controles emparejados por edad de cualquier etnia; b) estudios donde el diagnóstico de SOP fueron los criterios de Rotterdam, Institutos Nacionales de Salud (NIH) y/o Sociedad de Exceso de Andrógenos (AES); c estudios originales, y d) publicaciones en texto completo escritas en inglés o español.
Parte 1. Definición y diagnóstico de resistencia a la insulina
La RI se define como un trastorno caracterizado por una menor actividad de la insulina a nivel celular, manifestándose en diferentes vías metabólicas, especialmente en el metabolismo de los carbohidratos, lípidos y proteínas12-14. Es importante destacar que la RI no debe considerarse una enfermedad en sí misma, sino más bien como un factor de riesgo cardiometabólico12. Este fenómeno se vincula a obesidad abdominal, acantosis nigricans, hiperglucemia e hipertrigliceridemia12.
Existen métodos diagnósticos directos e indirectos para evaluar la RI13. Aunque el clamp hiperglucémico-euglucémico se considera el método de referencia según las guías de la Asociación Americana de Diabetes, su uso principal es para fines de investigación13,14. Por otro lado, para aplicaciones clínicas habituales se recomiendan el modelo homeostásico para evaluar la resistencia a la insulina [HOMA-IR, por sus siglas en inglés) y el índice triglicéridos y glucosa (TgyGlu)15,16, así como otros que no han sido validados para la población mexicana: el índice cuantitativo de sensibilidad a la insulina (QUICKI), el índice de Matsuda y el índice de sensibilidad a la insulina (ISI)17,18]. Las pruebas de tolerancia a la glucosa e insulina con carga de 75 g no han sido validados para el diagnóstico de RI en nuestra población19.
No obstante la prevalencia en aumento de la RI en el mundo, hasta el momento no se han desarrollado guías que establezcan que alguna prueba subrogada es superior en especificidad y sensibilidad sobre las otras. Por lo tanto, es necesario combinar la información del examen físico con pruebas de laboratorio adecuadamente seleccionadas para la población20. En México contamos con dos métodos validados para nuestra población:
- El índice de HOMA-IR se basa en las concentraciones de glucosa e insulina en ayuno, con puntos de corte específicos por sexo, etnia y edad. Presenta una buena correlación con el clamp (r: 0.88)12-15 y se ha establecido un punto de corte para la población mexicana (HOMA-IR > 2.5 = RI)14,21. La precisión diagnóstica del HOMA-IR se ha probado en varios estudios, sin embargo su confiabilidad disminuye en presencia de alteraciones en las células beta15,16,22. Se calcula con la siguiente fórmula:
HOMA-IR = glucosa sérica en ayuno (mg/dl) x insulina en ayuno (mUI/L)/405 (Tabla 2)15.
- El TgyGlu se fundamenta en la asociación entre hipertrigliceridemia y RI, interfiriendo con el metabolismo muscular de la glucosa y disminuyendo la sensibilidad a la insulina16,22-24. Utilizando las concentraciones de triglicéridos y glucosa en ayuno16,22, presenta un punto de corte para la población mexicana (> 8.6), con sensibilidad del 85.7% y especificidad del 32.5%. La correlación con el clamp es buena (r: 0.68) y la precisión diagnóstica se ha probado en varios estudios16,23,24. Se calcula con la siguiente fórmula:
Tabla 2 Métodos de mayor utilidad para el diagnóstico de resistencia a la insulina en la práctica diaria
| HOMA-IR | TgyGlu |
|---|---|
| HOMA-IR=glucosa sérica en ayuno (mg/dl) x insulina en ayuno (mUI/l)/405 Punto de corte para definir resistencia a la insulina en población mexicana: > 2.5 | TgyGlu=Logaritmo natural (TG [mg/dl] x glucosa [mg/dl]/2 Punto de corte para definir resistencia a la insulina en población mexicana: > 8.6 No requiere determinación de insulina |
HOMA-IR: modelo homeostásico para evaluar la resistencia a la insulina; TgyGlu: índice triglicéridos y glucosa. Adaptada de Andrade et al., 201613, Reyes-Muñoz et al., 201714, Sharma et al., 202015, Park et al., 202121, Almeda-Valdés et al., 201822, Unger et al., 201423 y Tahapary et al., 202224.
TgyGLu = Ln (triglicéridos [mg/dl] x glucosa [mg/dl]/2 donde Ln es logaritmo natural. Ambas opciones son de utilidad diagnóstica de RI y se detallan en la tabla 2.
La guía basada en la evidencia del 20235 reconoce a la RI como una característica clave del SOP, sin embargo las evaluaciones de RI disponibles habitualmente son inexactas, por lo que no recomienda la medición clínica como parte del diagnóstico, pero sí debe evaluarse para el tratamiento de mujeres con SOP.
La RI se asocia con un mayor riesgo de enfermedad cardiovascular (ECV), por su asociación con comorbilidades como diabetes tipo 2, hipertensión, dislipidemia, obesidad y síndrome metabólico, por lo que se exhorta que como parte de la valoración se incluya una curva de tolerancia a la glucosa oral y perfil del lípidos5,25-27.
Parte 2. Resistencia a la insulina y síndrome de ovario poliquístico
Un estudio en México reveló una prevalencia variable de RI en mujeres con SOP, dependiente del índice de masa corporal (IMC): 19.3% en aquellas con peso normal, 56.2% en mujeres con sobrepeso y 78.2% en aquellas con obesidad9. Aproximadamente la mitad de las pacientes diagnosticadas con SOP experimentan algún grado de alteración en la RI, generando hiperinsulinemia compensatoria, un componente significativo de la fisiopatología del SOP25-28.
La hiperinsulinemia aumenta la producción ovárica de andrógenos, ocasionando defectos en la maduración folicular y anovulación28,29. Esto se relaciona con el incremento de la pulsatilidad de la hormona liberadora de gonadotropina, que se traduce en aumento de la secreción de hormona luteinizante (LH) sin modificar las concentraciones de hormona foliculoestimulante (FSH)29. Estos cambios afectan el desarrollo folicular, aumentando el catabolismo del ovocito y contribuyendo a la morfología poliquística del ovario. Además, la RI afecta a tejidos sensibles a la insulina como el músculo esquelético, el hígado y el tejido adiposo, generando desequilibro metabólicos. En el tejido adiposo aumentan las citocinas proinflamatorias y a nivel hepático disminuye la producción de SHBG, aumentando las concentraciones de testosterona libre29.
Factores epigenéticos, ambientales, estilo de vida, dieta alta en carbohidratos y grasas saturadas se relacionan con la exacerbación de las manifestaciones clínicas de la RI. En particular, el sobrepeso u obesidad complican el manejo del SOP, especialmente durante la pubertad29,30, situación relevante en la población mexicana, en la cual la prevalencia de sobrepeso y obesidad supera el 70%, especialmente en mujeres en edad reproductiva31.
Es fundamental tener en cuenta que la RI conlleva como consecuencia principal la aparición de diabetes mellitus tipo 228. Los estudios coinciden en que la RI antecede al desarrollo de la diabetes tipo 2 en un periodo que oscila entre 10 y 15 años, a menos que se implementen intervenciones preventivas17.
Punto clave: en pacientes diagnosticadas con SOP, la evaluación temprana de los criterios clínicos y/o bioquímicos para la RI es esencial. Este enfoque facilita un abordaje terapéutico oportuno y adecuado, considerando la complejidad de las interacciones metabólicas involucradas en el SOP y RI.
Resistencia a la insulina y síndrome de ovario poliquístico en adolescentes
En la adolescencia se producen cambios fisiológicos en el organismo que incluyen un incremento en los niveles de la hormona de crecimiento, factor de crecimiento similar a la insulina 1 y leptina, así como cambios en la composición corporal e incremento de la adiposidad32,33. Estos cambios dan lugar a un aumento transitorio en los niveles de insulina, denominado «resistencia fisiológica a la insulina de la pubertad»; es por esto que un punto de corte de HOMA > 2.5 para definir RI no es aplicable durante la adolescencia34.
El incremento de insulina asociado a la pubertad influye en la reducción de los niveles de SHBG, aumento de las concentraciones de andrógenos libres, así como en la estimulación de la esteroidogénesis adrenal y ovárica, con el subsecuente incremento fisiológico de la producción de andrógenos observado en la adolescencia y que se traduce clínicamente en la presencia de acné o hirsutismo leve32.
En mujeres con sobrepeso, obesidad, RI y/u otros factores de riesgo para desarrollar SOP, el incremento de insulina asociado a la pubertad puede precipitar la aparición de las manifestaciones clínicas del SOP, como lo son en las adolescentes (hirsutismo persistente y progresivo, acné grave o comedoniano, amenorrea o irregularidades menstruales), que deberán distinguirse de los cambios fisiológicos propios de la adolescencia, lo cual hace más complejo el diagnóstico en esta etapa de la vida29-30.
Para el diagnóstico de SOP durante la adolescencia se requiere la presencia de oligomenorrea o irregularidades menstruales más hiperandrogenismo clínico o bioquímico5. El uso de ultrasonido en los primeros ocho años posmenarca se desaconseja como criterio diagnóstico, debido a la alta prevalencia de morfología ovárica poliquística en adolescentes sanas5,29. Aquellas mujeres que solo reúnen un criterio diagnóstico (oligomenorrea o hiperandrogenismo) y en las que se han descartado diagnósticos diferenciales pueden considerarse como «en riesgo» de SOP, iniciar tratamiento de acuerdo con sus síntomas y riesgo metabólico, y reevaluar a una edad posmenarca mayor5.
El tratamiento en estas adolescentes consistirá en un plan de alimentación saludable, 60 minutos de actividad física vigorosa diaria, búsqueda de comorbilidades como alteraciones en el metabolismo de la glucosa, dislipidemia, ansiedad o depresión entre otros; y en el caso de aquellas con sobrepeso, obesidad o alteraciones en el metabolismo de glucosa, considerar el uso de sensibilizadores a la insulina como metformina (MET) y/o mioinositol (MI)5,33,34.
Punto clave: el diagnóstico de SOP en adolescentes requiere la presencia de oligomenorrea o irregularidades menstruales más hiperandrogenismo clínico o bioquímico. El uso de ultrasonido pélvico en los primeros ocho años posmenarca se desaconseja como criterio diagnóstico.
Parte 3. Tratamiento de la resistencia a la insulina en síndrome de ovario poliquístico
Los objetivos del tratamiento con SOP implican implementar cambios en el estilo de vida para alcanzar el peso ideal o al menos perder entre el 5 y 10% del peso inicial, corregir trastornos sistémicos, como aquellos trastornos hormonales que repercuten en la regularidad del ciclo, prevenir complicaciones metabólicas y cardiovasculares, abordar el hiperandrogenismo, trastornos psicológicos y mejorar la calidad de vida5,35-38.
Modificaciones en el estilo de vida
Las modificaciones en el estilo de vida representan el tratamiento de primera línea para todas las pacientes con SOP5,35,36,39,40. La modificación de la dieta, la práctica de ejercicio físico regular y cambios en el comportamiento han demostrado mejorías significativas en los parámetros endocrinos y metabólicos, incluyendo la reducción en las concentraciones de testosterona circulantes, disminución de las concentraciones de insulina y glucosa en ayuno, del inhibidor del activador del plasminógeno 1, la presión arterial diastólica y mejoría en la RI35.
Las modificaciones en el estilo de vida que se recomiendan en SOP son5-35,36,39,40:
-
- Nutrición saludable, sostenible y aceptada por la paciente. Sin restricciones nutricionales ni nutrición desequilibrada.
No restringir más allá de 700 kcal del requerimiento basal de las necesidades calóricas individuales5.
Apoyo de personal especializado en nutrición.
-
- Ejercicio moderado de 150-300 minutos a la semana o 75-150 de actividad vigorosa por semana.
- Cambios de comportamiento como la reducción de los factores estresantes psicosociales, la identificación y corrección de conductas alimentarias erróneas, así como el desarrollo de estrategias de afrontamiento como alternativas para el estrés, la depresión y la baja autoestima.
La prescripción de anticonceptivos orales combinados, antiandrógenos, sensibilizadores a la insulina y otros como la vitamina D son parte del tratamiento farmacológico5,35.
Sensibilizadores a la insulina en el tratamiento del síndrome de ovario poliquístico
Los sensibilizadores a la insulina ganan relevancia al incidir en la etiología del SOP, reduciendo la RI, normalizando el metabolismo de la glucosa y disminuyendo las concentraciones de andrógenos, mejorando la tasa de ovulación5,41-48. Entre los sensibilizadores a la insulina más utilizados para tratar el SOP se encuentran la MET, las tiazolidinedionas, los agonistas del péptido similar al glucagón tipo 1 (GLP-1) y los inositoles41-48. De estas opciones terapéuticas la MET y el MI son las más comúnmente utilizadas.
METFORMINA
La MET actúa a nivel hepático y en los tejidos periféricos, ejerciendo efectos sobre la esteroidogénesis ovárica. Su acción abarca la reducción de marcadores de riesgo aterogénico mediante la influencia directa en el metabolismo hepático de los ácidos grasos libres o, de manera indirecta, al disminuir la hiperinsulinemia41-44. Específicamente, el mecanismo de acción de la MET en la RI consiste en:
- La MET mejora la eliminación de glucosa, la respuesta aguda de la insulina y la disminución de la producción hepática de glucosa debido a la inhibición del transporte de electrones del complejo respiratorio mitoncondrial I y la reducción de glucosa hepática dependiente de glucagón mediante la disminución de la producción de AMPc43,44.
- Estudios in vitro más recientes agregan que el mecanismo de acción también está mediado por los cambios en la expresión y activación de los mediadores de la vía de señalización de la insulina a través de la proteína cinasa activada por adenosina 5'-monofosfato y mediadores de la translocación del transportador de glucosa GLUT-444.
- Se han demostrado los beneficios metabólicos del uso de MET, sobre todo en pacientes con IMC elevado. Sin embargo, no se cuenta con suficiente evidencia para la mejoría de resultados clínicos en ciclos menstruales regulares, adolescentes e infertilidad41,42.
- A pesar de su amplio uso, los eventos adversos gastrointestinales son frecuentes y a menudo motivo de abandono41-46.
Las dosis sugeridas son 1,500 a 1,700 mg/día, dosis máxima de 2,500 mg en adultos y 2,000 mg en adolescentes47,48. Se recomienda inicio con dosis bajas, con incrementos graduales de 500 mg cada 1-2 semanas de acuerdo con la tolerancia hasta alcanzar las metas terapéuticas. Las formulaciones de acción prolongada pueden utilizarse para disminuir los efectos adversos y mejorar la adherencia5.
Su uso es seguro a largo plazo, sin embargo se ha asociado con disminución de los niveles de vitamina B12 en situaciones de riesgo: diabetes, posterior a cirugía bariátrica, anemia perniciosa y dieta vegana48.
COMBINACIONES
Algunas poblaciones con mayor riesgo metabólico como aquellas con un IMC > 30, factores de riesgo para diabetes, intolerancia a la glucosa o grupos con alto riesgo étnico, se verán beneficiadas de su uso en conjunto con anticonceptivos orales combinados5.
Su prescripción en conjunto con MI ha demostrado una respuesta terapéutica eficaz que permite reducir las dosis de MET, con efecto positivo en la ciclicidad menstrual49. En un ensayo clínico aleatorizado se demostró que la combinación tenía superioridad con respecto a la monoterapia con MET en cuanto ciclicidad menstrual y calidad de vida50.
MIOINOSITOL
Actualmente existe evidencia sobre el papel de los inositoles en el tratamiento de la RI asociada al SOP51-55. El MI activa las vías de señalización de la insulina, facilitando la unión insulina-proteína G para crear un receptor acoplado. Esto actúa como segundo mensajero, permitiendo la activación de la glucógeno sintasa, tanto directa como indirectamente a través de la fosfatidilinositol 3-cinasa53. Asimismo, el MI controla el metabolismo oxidativo de la glucosa oxidativo de la glucosa al activar la enzima piruvato deshidrogenasa en la mitocondria53.
En las mujeres sin deseo reproductivo, la suplementación con MI ha demostrado beneficios, incluyendo el aumento de la sensibilidad a la insulina y la tolerancia a la glucosa, mejoría en la función ovárica, disminución de las medidas antropométricas, así como disminución de la testosterona total y libre, triglicéridos, colesterol total y una ligera reducción en la tensión arterial55. Estos efectos mejoran las manifestaciones clínicas del hiperandrogenismo51-55.
La disminución del contenido intracelular de MI se vincula con la RI y el desequilibrio de inositoles empeora con el aumento de la RI53-55. Los inositoles han demostrado ser eficaces en el tratamiento de SOP con RI, mejorando la función ovulatoria, la calidad ovocitaria y la ciclicidad menstrual54,55. Varios estudios respaldan que en pacientes con SOP y RI, el uso de MI, d-chiro-inositol (DCI) o la combinación de ambos (40:1) puede mejorar la RI, los niveles séricos de andrógenos y el hiperandrogenismo, así como la antropometría de las usuarias54.
La suplementación con MI mejora la captación de glucosa y optimiza la vía de señalización de la FSH, mientras que su isómero DCI controla la síntesis de glucógeno y andrógenos mediada por insulina56. El MI desempeña un papel crucial en el ovocito, como lo indica su alta presencia en el líquido folicular (99%)56.
El panel de expertos recomienda la suplementación con MI en pacientes con SOP y RI para reducir el HOMA-IR, disminuir las concentraciones de triglicéridos y aumentar el colesterol vinculado a las lipoproteínas de alta densidad, reducir las concentraciones de andrógenos e incrementar la SHBG circulante sin los efectos adversos asociados a otros sensibilizadores a la insulina.
La dosis segura y efectiva de MI se ha establecido a lo largo de diversos estudios clínicos54-57. Existen dos presentaciones farmacéuticas respaldadas por sólida evidencia, que establecen la dosis de 2 g de MI en polvo y 600 mg de MI en cápsula de gelatina blanda administradas cada 12 horas, media hora antes de los alimentos. La bioequivalencia de ambas presentaciones y su biodisponibilidad se ha demostrado en estudios de farmacocinética, con mayor biodisponibilidad de MI con la forma farmacéutica de cápsula de gelatina blanda de 600 mg58. Esto permite disminuir significativamente la dosis de la presentación en polvo sin comprometer los resultados terapéuticos58.
La cápsula de gelatina blanda ofrece ventajas adicionales, como mejorar la capacidad para deglutir el fármaco, enmascarar olores y sabores desagradables, y protege el compuesto encapsulado contra el oxígeno y la luz. Este método de administración es ideal para vehículos no acuosos farmacéuticamente aceptables, mejorando la absorción de manera más rápida y uniforme58-60. Un estudio realizado en población mexicana reportó que 600 mg de MI en cápsula de gelatina blanda es efectiva en mujeres con SOP, presentando mejoría en los parámetros metabólicos y hormonales después de 12 semanas de tratamiento59.
Punto clave: se recomienda la suplementación de MI para el tratamiento de la RI, no obstante, las guías internacionales no recomiendan una dosis, las revisiones sistemáticas actuales sugieren 4 g al día en polvo o 1,200 mg en cápsulas en gelatina blanda dividido en dos dosis al día en mujeres adultas o adolescentes con SOP.
Efectos del MI más alfa-lactoalbúmina
El MI no siempre resulta eficaz en el manejo del SOP, especialmente en condiciones de anovulación. Esta falta de eficacia se relaciona con las respuestas individuales a la misma terapia y algunos autores sugieren que la resistencia a la ovulación podría ser atribuible a una absorción insuficiente de MI en este grupo de pacientes60.
La absorción intestinal del MI se ve afectada por varios factores, como la disbiosis, obesidad, diabetes mellitus, hiperandrogenismo, enfermedades intestinales y una dieta alta en carbohidratos, entre otros58. La alfa-lactoalbúmina (α-LA), una proteína del suero de la leche compuesta por 123 aminoácidos, es un excelente transportador de iones (Ca, Fe) y vitamina D58. Esta proteína exhibe actividades enzimáticas, aumenta la absorción de los nutrientes, estimula el crecimiento celular y modula el sistema inmunitario: en presencia de α-LA se incrementa la absorción intestinal de MI al disminuir la resistencia eléctrica transepitelial, abriendo las uniones estrechas celulares y facilitando el transporte pasivo de MI58.
Un estudio realizado en mujeres italianas y mexicanas demostró que la combinación de MI y α-LA aumentó la absorción intestinal de MI, reduciendo la inflamación crónica asociada con el SOP59. Esta combinación condujo a mejoras significativas en los parámetros metabólicos, disminuyendo la glucosa y el índice HOMA-IR después de tres y seis meses del tratamiento, con efectos que perduraron al finalizar este59. En cuanto a los parámetros hormonales, la LH y la FSH mostraron concentraciones normales, mientras que la testosterona total, la testosterona libre y la androstenediona experimentaron reducciones significativas. Las concentraciones de progesterona lútea aumentaron de forma significativa a los tres meses de tratamiento y se mantuvieron a los seis meses59.
El panel de expertos concluyó que la combinación de MI y α-LA mejoran de manera eficiente los parámetros bioquímicos y clínicos en pacientes con SOP, caracterizados por un perfil metabólico diferente, a pesar de que las mujeres mexicanas presentan un mayor IMC y una RI más grave en comparación con las pacientes italianas.
Agonistas del receptor GLP-1
Son una alternativa para el tratamiento del SOP con RI. Entre los más utilizados son exenatida y liraglutida, ambos pueden reducir el IMC y potencialmente mejorar la ciclicidad menstrual61,62. Sin embargo su impacto en la reducción de niveles de andrógenos es discreto y no se ha demostrado que tengan efecto sobre el perfil lipídico o la presión arterial.
Estos agonistas del receptor GLP-1 generalmente presentan pocos efectos adversos, aunque en algunos casos pueden provocar náuseas, vómitos y distensión abdominal61.
Parte 4. Comorbilidades
El objetivo principal de un diagnóstico oportuno y una terapia individual adecuada en mujeres con RI es prevenir complicaciones como obesidad, síndrome metabólico, diabetes mellitus tipo 2, enfermedad de hígado graso no alcohólico, ECV y RI leve hasta aquellos con eventos cardiovasculares y alto riesgo de morbimortalidad63.
Se recomienda hacer la búsqueda específica de las comorbilidades más comunes asociadas a RI, como se muestra en la tabla 3, dado que son las mujeres con mayor riesgo de complicaciones cardiometabólicas a largo plazo5,35.
Tabla 3 Evaluación y manejo de comorbilidades más frecuentes en el síndrome de ovario poliquístico
| Anormalidad metabólica | Implicaciones en la salud | Tamizaje | Manejo |
|---|---|---|---|
| Alteraciones en la glucosa | Diabetes tipo 2 Riesgo para enfermedad cardiovascular Riesgo para hiperplasia endometrial | CTOG HbA1c Niveles de insulina en ayuno o en CTGO | Control de peso Ejercicio y cambios en hábitos alimenticios Sensibilizadores de insulina Incretinas |
| Anormalidades de lípidos | Riesgo de enfermedad cardiovascular Riesgo de accidente cerebrovascular | Perfil de lípidos en ayuno | Control de peso Ejercicio y cambios en hábitos alimenticios Hipolipemiantes Aspirina a dosis bajas |
| Inflamación | Riesgo para enfermedad cardiovascular | Proteína C reactiva | |
| Síndrome metabólico | Aumento importante en el riesgo de enfermedad cardiovascular, aumento en la mortalidad, y riesgo de cáncer | Perfil de lípidos en ayuno Glucosa en ayuno Medición de la presión arterial Perímetro de cintura | Cambios en el estilo de vida, control de peso, antihipertensivos, hipolipemiantes e hipoglucemiantes |
CTOG: curva de tolerancia oral a la glucosa; HbA1c: hemoglobina glucosilada.
Discusión y recomendaciones
El consenso de expertos sobre el SOP y la RI tiene importantes implicaciones prácticas que afectarán a la práctica médica y al contexto de la salud de las mujeres. A continuación se destacan algunas de las principales implicaciones prácticas derivadas de este consenso:
- La actualización de los criterios de Rotterdam en 2023 para el diagnóstico de SOP que incluyen: oligo-ovulación o anovulación, hiperandrogenismo clínico y/o bioquímico y morfología poliquística del ovario mediante ultrasonido endovaginal solo en casos en los que no se cumplan los dos criterios clínicos. Reconocen la importancia de abordar la RI, una condición presente en una gran proporción de mujeres con SOP.
- En la población mexicana se calcula que el 80% de las pacientes con SOP y obesidad tiene RI. Por lo que se destaca la importancia de validar métodos de diagnóstico específicos para la población mexicana, como el índice de HOMA-IR > 2.5 y el TgyGlu > 8.6.
- Para el diagnóstico de SOP en adolescentes se requiere la presencia de oligomenorrea o irregularidades menstruales más hiperandrogenismo clínico o bioquímico, el ultrasonido pélvico se desaconseja como criterio diagnóstico. Las adolescentes con solo un criterio se consideran en «riesgo de SOP» y deberán ser reevaluados posteriormente.
- Como primera línea de tratamiento se recomienda un tratamiento integral que incluya cambios en el estilo de vida, especialmente para alcanzar un peso saludable o al menos perder el 7% del peso inicial y abordar trastornos sistémicos. Las modificaciones en la dieta, el ejercicio regular y la atención a la salud mental son recomendaciones clave para mejorar los parámetros endocrinos y metabólicos.
- El consenso destaca el papel de sensibilizadores de insulina como la MET y el MI en el tratamiento del SOP y la RI. En cuanto a la MET, las dosis sugeridas son 1,500 a 1,700 mg/día dosis máxima de 2,500 mg en adultos y 2,000 mg en adolescentes. Para MI 4 g en polvo o 1,200 mg en cápsulas. La combinación de MET con MI ha mostrado mejorar la eficacia terapéutica y reducir efectos adversos. Estrategias como el uso de α-LA para mejorar la absorción del MI y evitar las resistencias.
- Es de especial importancia el diagnóstico oportuno y el tratamiento adecuado para prevenir complicaciones a largo plazo, como obesidad, diabetes tipo 2, ECV y otras comorbilidades asociadas con la RI.
- En la RI cobra especial importancia tener un diagnóstico oportuno en todas las pacientes con diagnóstico o sospecha de SOP, para un tratamiento adecuado que pueda prevenir las complicaciones metabólicas asociadas al SOP.
- El SOP es una patología que debe de ser tratada por un grupo multidisciplinario que incluya ginecólogos, endocrinólogos, nutriólogos y psicólogos para permitir un tratamiento integral.
Conclusiones
- El SOP es la patología endocrina más frecuente en la edad reproductiva.
- Los criterios de la guía internacional basada en evidencia 2023 deben utilizarse para el diagnóstico de SOP.
- La RI afecta a un 70-80% de las mujeres con SOP.
- El manejo de RI debe incluir cambios en el estilo de vida, sensibilizadores de la insulina (MET, MI y d-quiro-inositol) y análogos del GLP-1.











 nueva página del texto (beta)
nueva página del texto (beta)