Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.30 no.1a Ensenada feb. 2004
Artículos
Caracterización bioquímica del pasto marino Zostera marina en el límite sur de su distribución en el Pacífico Norte
Biochemical characterization of the eelgrass Zostera marina at its southern distribution limit in the North Pacific
Alejandro Cabello-Pasini1, Raquel Muñiz-Salazar1 y David H. Ward2
1 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California. Apartado postal 453 Ensenada, Baja California 22800, México. E-mail: acabello@uabc.mx
2 U.S. Geological Survey, Alaska Science Center. 1011 E. Tudor Rd. Anchorage, Alaska 99503, USA.
Recibido en octubre de 2002;
Aceptado en marzo de 2003.
Resumen
El pasto marino Zostera marina L. se distribuye a lo largo de la península de Baja California (México) y está expuesto a un amplio rango de irradiancias y temperaturas que podrían modificar su composición bioquímica. En consecuencia, el objetivo de este estudio fue el de caracterizar las variaciones en la concentración de clorofila, carbohidratos, proteínas, fibra, ceniza y calorías en los haces de Z. marina de poblaciones del norte (San Quintín) y el sur (Laguna Ojo de Liebre y Laguna San Ignacio) de Baja California, México. En las lagunas costeras del sur, la temperatura de la columna de agua fue aproximadamente 5-6°C más alta que en la laguna del norte de la península. Al igual que la temperatura, la irradiancia in situ fue dos veces mayor en las lagunas del sur que en la laguna del norte. Como resultado de los menores niveles de irradiancia, los niveles de clorofila en las hojas de Z. marina fueron aproximadamente dos veces mayores en las poblaciones del norte (1.7 mg gPH-1) que en las del sur (0.8 mg gPH-1) de Baja California. Al igual que la clorofila, los niveles de carbohidratos solubles en las hojas fueron mayores en las poblaciones del norte que en las del sur, lo cual sugiere que los altos niveles de clorofila son suficientes para compensar los bajos niveles de irradiancia en la laguna del norte, y mantener un balance de carbono positivo. Por el contrario, los niveles de proteínas en las hojas de Z. marina de la laguna costera del norte de la península fueron ligeramente menores que en las del sur. En general los resultados sugieren que las diferentes condiciones ambientales a las que están expuestas las poblaciones de Z. marina en Baja California impactan su composición bioquímica.
Palabras clave: Zostera marina, Baja California, composición química, clorofila, estacionalidad.
Abstract
The eelgrass Zostera marina L. is distributed along the Baja California Peninsula (Mexico) where it is exposed to a wide range of irradiances and temperatures that could promote changes in its biochemical composition. Consequently, the objective of this study was to characterize the variations in the levels of chlorophyll, carbohydrates, proteins, fiber, ash and calories in the shoots of Z. marina from the north (San Quintín) and south (Ojo de Liebre and San Ignacio lagoons) of the peninsula. Temperature in the southern lagoons was 5-6°C higher than in the northern lagoon; likewise, in situ irradiance was two-fold greater in the south than in the north. As a result of the lower irradiance levels, the concentration of chlorophyll in the shoots of Z. marina was twice as high (1.7 mg gWW-1) in the northern lagoon than in the southern ones (0.8 mg gWW-1). Similar to chlorophyll levels, the concentration of soluble carbohydrates in the shoots was greater in the northern lagoon than in the southern ones, suggesting that the high levels of chlorophyll are enough to compensate for the low irradiance levels and to maintain a positive carbon balance at San Quintín. On the other hand, the levels of proteins in the shoots from the north of the peninsula were slightly lower than those from the southern populations. In general, these results suggest that the different environmental conditions to which Z. marina is exposed along the peninsula impact its biochemical composition.
Key words: Zostera marina, Baja California, chemical composition, chlorophyll, seasonality.
Introducción
Zostera marina L. es uno de los pastos con más amplia distribución y mayor abundancia en el litoral del Pacífico mexicano (Ibarra-Obando, 1989). En la península de Baja California, Z. marina habita lagunas costeras y zonas costeras semiprotegidas desde Ensenada (30°N) hasta Bahía Magdalena (24°N) (Cabello-Pasini, 1984; Riosmena-Rodríguez y Sánchez-Lizaso, 1996; Cabello-Pasini et al., 2002; Cabello-Pasini et al., 2003). Estas praderas están distribuidas discontinuamente a lo largo de la península formando poblaciones fenotípica y genotípicamente bien diferenciadas (Cabello-Pasini et al., 2003; Muñiz-Salazar et al., en prensa).
La morfología, densidad de haces, crecimiento, esfuerzo reproductor y características fotosintéticas varían en pastos expuestos a rangos amplios de temperatura e irradiancia (Keller y Harris, 1966; Backman y Barilotti, 1976; McMillan, 1978; Alcoverro et al., 1999; Meling-López e Ibarra-Obando, 1999). El norte de la península de Baja California se caracteriza por ser una región templada y estar influenciada por eventos de surgencia recurrentes, mientras que el sur de la península es una región tropical con una importante influencia de Aguas Superficiales Ecuatoriales caracterizadas por sus altas temperaturas (Castro et al., 2000). Lo anterior provoca que la temperatura del agua de mar en el sur de Baja California sea de 7°C a 15°C más alta que en las aguas de la región norte (Castro et al., 2000; Durazo-Arvizu et al., 2001). Por otro lado, la irradiancia incidente en el norte de la península es aproximadamente dos veces menor que en el sur (Cabello-Pasini et al., 2003). Las concentraciones de nutrientes en la columna de agua son también más elevadas en la región norte que en el sur. Como resultado de estas variaciones en las condiciones ambientales, Z. marina se ha aclimatado o adaptado para sobrevivir a lo largo de su rango de distribución en Baja California. Los pastos del norte, por ejemplo, están expuestos a menores niveles de irradiancia, y son de dos a tres veces más largos y dos veces más anchos que los de las lagunas del sur, con lo cual aumentan su exposición a la irradiancia incidente (Cabello-Pasini et al., 2003).
Las praderas de Z. marina juegan un papel crítico en la ecología de estuarios y lagunas costeras del mundo entero. En Baja California, además de modificar la química de la columna de agua y estabilizar los sedimentos, las praderas de Z. marina son hábitat y alimento de invertebrados y vertebrados marinos. Las hojas de este pasto, por ejemplo, son consumidas por tortugas (Felger et al., 1980; Brand-Gardner et al., 1999), mientras que la lapa Tectura depicta consume la región epitelial y epífitas de las hojas en California (Zimmerman et al., 1996) y Baja California (A. Cabello-Pasini, obs. pers.). Además, decenas de miles de brantas negras (Branta bernicla) dependen exclusivamente del consumo de Z. marina para sobrevivir durante su migración invernal de Alaska y Canadá hacia las lagunas de Baja California (Reed et al., 1998). En consecuencia, las variaciones en la composición bioquímica de Z. marina podrían ser críticas para la fisiología de los organismos que pastorean sobre este vegetal marino.
Al igual que la fisiología, la composición bioquímica de pastos y otros vegetales marinos está regulada en gran medida por parámetros ambientales tales como intensidad y calidad de luz, fotoperiodo, temperatura, nutrientes y pastoreo. Una reducción > 80% de la irradiancia por unas semanas debido a la resuspensión de sedimento, por ejemplo, resultó en la disminución de dos a cuatro veces la concentración inicial del contenido de carbohidratos solubles en las hojas de Z. marina (Burke et al., 1996; Cabello-Pasini et al., 2002). Por otro lado, la reducción experimental del fotoperiodo provocó un incremento en los niveles de clorofila en las hojas en Z. marina (Dennison y Alberte, 1985). En vegetales marinos de Baja California también se han observado cambios en los niveles de lípidos, proteínas, fibra y otros constituyentes químicos como resultado de cambios estacionales de temperatura e irradiancia en la columna de agua (Rodríguez-Montesinos y Hernández-Carmona, 1991). No obstante que existen diferencias en la temperatura e irradiancia incidente en el norte y sur de la península (Cabello-Pasini et al., 2003), se desconoce si estas variaciones afectan la composición bioquímica de los pastos en Baja California. Por lo tanto, el objetivo de este estudio fue el de caracterizar las variaciones en la concentración de clorofila, carbohidratos, proteínas, fibra, ceniza y calorías en los haces de Z. marina del norte (San Quintín) y del sur (lagunas Ojo de Liebre y San Ignacio) de Baja California. Las diferencias en la composición metabólica fueron relacionadas con los cambios latitudinales y estacionales de irradiancia y temperatura en las diferentes lagunas.
Métodos
Áreas de estudio
Se muestrearon praderas de Z. marina de Bahía San Quintín (SQ), Laguna Ojo de Liebre (OL) y Laguna San Ignacio (SI), en la península de Baja California, aproximadamente cada dos meses de febrero de 1999 a marzo de 2000 (fig. 1). San Quintín se localiza cerca del límite norte de la distribución de Z. marina en Baja California, mientras que las praderas de OL y SI se encuentran localizadas cerca del límite sur de su distribución en la península, así como del límite sur de su distribución en la costa del Pacífico del Hemisferio Norte. San Quintín tiene un área aproximada de 42 km2, mientras que OL y SI tienen un área de aproximadamente 430 y 230 km2, respectivamente.
La temperatura de la columna de agua en las praderas de Z. marina de las lagunas costeras fue monitoreada cada 0.5 h a lo largo del periodo de estudio utilizando termistores submarinos programables (Onset Computers, EE.UU.). Los termistores submarinos fueron previamente calibrados en el laboratorio contra termómetros digitales. La radiación fotosintéticamente activa fue monitoreada cada 0.5 h en los sitios a lo largo del periodo de estudio utilizando sensores radiométricos submarinos 4 π (LI-193SA, LI-COR, EE.UU.). En las tres lagunas costeras, los sensores fueron fijados justo sobre el dosel de las praderas de los pastos. Cada dos meses se limpió la acumulación de pequeñas cantidades de bioincrustación de los sensores, sin embargo, no se observó un efecto de estos depósitos sobre las mediciones de luz. La irradiancia sobre las praderas de Z. marina fue integrada diariamente del amanecer al atardecer, y calculada como mol cuanta m-2 d-1.
Caracterización bioquímica
Se recolectaron manualmente haces de Z. marina durante marea baja aproximadamente cada dos meses en SQ, OL y SI. En cada laguna se recolectaron haces sin raíces ni rizomas de la profundidad intermedia de distribución de las praderas. Los haces fueron colocados en hieleras con agua de mar a aproximadamente 17°C y transportados al laboratorio en Ensenada, Baja California. Los análisis de clorofilas, carbohidratos solubles y proteínas se realizaron en el laboratorio con tejido fresco 24-48 h después de la recolección del material. El resto del material fue deshidratado a 60°C, y posteriormente, se realizaron los análisis de ceniza, fibra y calorías.
El contenido de clorofila en las hojas de Z. marina se evaluó por medio de extracción con acetona. Aproximadamente 0.1 g de tejido (n = 6) de la hoja no. 2 se pulverizó con un homogeneizador de tejido de vidrio y 5 mL de acetona al 90% (v/v). El homogeneizado se centrifugó a 2000 x g por 15 min, y los niveles de clorofila a + b se determinaron espectrofoto-métricamente utilizando las ecuaciones descritas por Jeffrey y Humphrey (1975).
El contenido de cenizas en tejido de los haces de Z. Marina de las tres zonas de estudio se evaluó cada dos meses. Se deshidrataron aproximadamente 0.5 g de tejido de haces (n = 5) a 60°C hasta obtener peso constante en navecillas de aluminio previamente pesadas (~72 horas). Las muestras se incineraron en una mufla a 500°C por 4 h. La cantidad de ceniza obtenida por la diferencia entre el peso antes y después de la combustión fue expresada como porcentaje de peso seco de la muestra.
Los carbohidratos solubles se extrajeron de las hojas de Z. marina (n = 6) mediante la homogeneización de aproximadamente 0.1 g de tejido de la hoja no. 2 en un homogeneizador de vidrio y etanol al 90% (v/v). La muestra se centrifugó a 2000 x g se separó el sobrenadante. El homogeneizado se extrajo dos veces más con etanol al 90% (v/v) a 80°C por 15 min y los sobrenadantes se mezclaron en un solo tubo. La extracción etanólica se evaporó a temperatura ambiente con una bomba de vacío y los azúcares se resuspendieron en 1 mL de agua destilada. La concentración de azúcar (sucrosa + glucosa + fructosa) se determinó espectrofotométricamente con antrona de acuerdo con la metodología descrita por Yemm y Willis (1954). La concentración de azúcares fue determinada utilizando glucosa como estándar. El almidón se extrajo de la fracción insoluble del homogeneizado añadiendo 1 mL de KOH 0.1 Me incubando por 12 h. La concentración de almidón (equivalentes de glucosa) fue determinada con antrona de acuerdo con la metodología previamente mencionada.
El contenido de fibra ácida (celulosa) y neutra (lignina) en el tejido de Z. marina de las zonas de estudio fue evaluado de acuerdo con Tejada-Hernández (1992). Se secaron las muestras de haces (n = 6) en un horno a 60°C hasta obtener peso constante y después se molieron en un molino de tejido de acero inoxidable. El contenido de fibra ácida en el tejido de los haces se obtuvo al reducir aproximadamente 0.25 g de muestra deshidratada en 25 mL de una solución 1 N de H2SO4, 50 mM de bromuro de cetil trimetil amonio (CTAB, por sus siglas en inglés) y una gota de agente antiespumante. La mezcla se hirvió con reflujo por 1 h y se filtró a través de un filtro Whatman GC de fibra de vidrio previamente incinerado a 530°C por 3 h y pesado. El filtrado se enjuagó dos veces con aproximadamente 50 mL de agua destilada hirviendo, y posteriormente con suficiente acetona para eliminar todos los pigmentos. El filtro con la muestra se deshidrató en horno a 105°C hasta obtener peso constante. El contenido de fibra ácida se calculó utilizando las ecuaciones propuestas por Tejada-Hernández (1992). El contenido de fibra neutra en el tejido de los haces se obtuvo al incubar aproximadamente 0.25 g de muestra deshidratada en 25 mL de una solución 100 mM de SDS, con 50 mM de EDTA, 100 mM de NaOH, 35 mM de Mg2B4O7, 30 mM de Na2HPO4 al 1% (v/v) y una gota de agente antiespumante. La mezcla se hirvió con reflujo por 1 h y se filtró a través de un filtro Whatman GC de fibra de vidrio precombustionado a 530°C por 3 h y prepesado. El filtrado se enjuagó dos veces con aproximadamente 50 mL de agua destilada hirviendo y posteriormente con suficiente acetona para eliminar todos los pigmentos. El filtro conteniendo la muestra se deshidrató en horno a 105°C hasta obtener peso constante. El contenido de fibra ácida se calculó utilizando las ecuaciones propuestas por Tejada-Hernández (1992).
El contenido calórico de los haces se evaluó por medio de combustión total de acuerdo a Tejada-Hernández (1992). Se deshidrataron los haces de Z. marina (n = 5) a 60°C hasta obtener peso constante y se maceraron en un molino hasta obtener partículas de aproximadamente 2 o 3 mm. Las partículas fueron prensadas en un empastillador y colocadas en una bomba calorimétrica (Parr Instrument Co., EE.UU.) con 30 atm de oxígeno y 2000 ± 0.25 g de agua destilada. La temperatura de la bomba fue monitoreada cada 0.25 s con un termómetro digital acoplado a un sistema de adquisición de datos (DATAQ-190, EE.UU.). La bomba fue calibrada con pastillas de 1 g de ácido benzóico. Los residuos de la combustión fueron inicialmente titulados con una solución 0.0725 N de Na2CO3. Sin embargo, el contenido calórico de esta titulación representó menos del 0.5% del contenido calórico total de la muestra y fue omitido posteriormente.
Las proteínas totales e hidrosolubles fueron extraídas de aproximadamente 0.1 g de tejido de la hoja no. 2 (n ≥ 6) con un homogeneizador de vidrio y una solución tampón que contenía 0.1 M de fosfato (pH 6.8), 2 mM de DTT, 5 mM de EDTA y 0.5 mM de AEBSF. El homogenizado fue incubado por 30 min a 4°C y las proteínas totales fueron evaluadas espectrofotométricamente de acuerdo con Bradford (1976) usando suero de albúmina bovina como estándar. El homogeneizado fue posteriormente centrifugado a 10,000 x G por 15 min a temperatura ambiente y las proteínas hidrosolubles fueron evaluadas en el sobrenadante utilizando la metodología descrita anteriormente.
Análisis estadístico
Se evaluaron las diferencias temporales y espaciales en la concentración de clorofila, ceniza, carbohidratos, fibra, contenido calórico y proteínas en las hojas de Z. marina mediante un análisis de varianza de dos vías (sitio x tiempo) después de probar normalidad y homoscedasticidad en los datos (Sokal y Rohlf, 1981). Los datos que no se ajustaron a los criterios de normalidad y homoscedasticidad fueron transformados con una función log. Todas las comparaciones múltiples fueron realizadas con pruebas Tukey estableciendo el nivel de significancia en P < 0.05.
Resultados
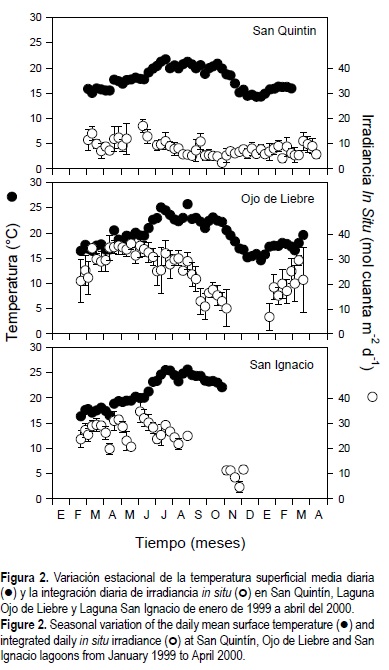
La temperatura media diaria del agua varió a lo largo del año en las tres lagunas (fig. 2). Las mayores temperaturas observadas durante el verano fueron de 22°C, 25°C y 27°C en SQ, OL y SI, respectivamente. Las menores temperaturas observadas durante el invierno fueron de 15°C en el norte y de 16°C en las lagunas del sur. En general, la irradiancia in situ integrada diariamente fue dos veces mayor en las lagunas del sur de la península que en la laguna del norte. Los valores de irradiancia in situ integrada diaria presentó un clásico patrón sinusoidal en OL y SI; sin embargo, en la laguna costera del norte la irradiancia in situ no varió significativamente a lo largo del año (fig. 2). Los valores máximos de irradiancia incidente para el norte (15 mol cuanta m-2 d-1) y el sur (35 mol cuanta m-2 d-1) de Baja California se registraron en marzo. En las tres lagunas, las irradiancias máximas se presentaron aproximadamente tres a cuatro meses antes que las mayores temperaturas en el campo.
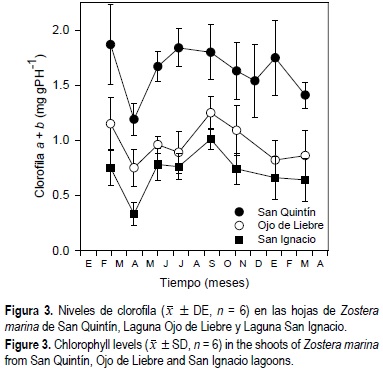
En las lagunas costeras del sur los niveles de clorofila en las hojas de Z. marina fueron estadísticamente similares (P > 0.05) a lo largo del año, excepto en abril de 1999, y fueron aproximadamente dos veces más bajos que en los pastos de la laguna del norte de la península (tabla 1, fig. 3). La concentración de clorofila a + b en las hojas de Z. marina mostraron diferencias estadísticas (P < 0.05) en función de la época del año, el sitio de estudio y la interacción entre tiempo y sitio de estudio (tabla 1). En los tres sitios de estudio, los máximos niveles de clorofila fueron observados durante verano, y los mínimos durante primavera e invierno.
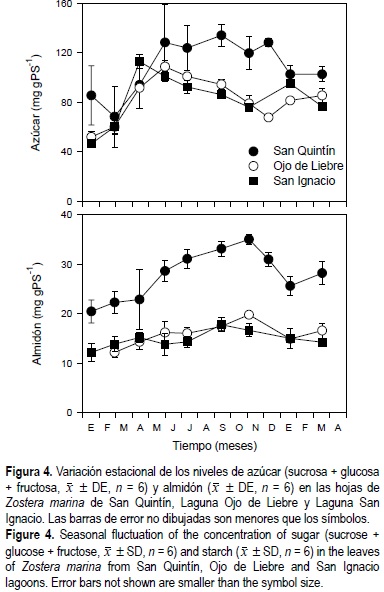
Los niveles de azúcar en las hojas de Z. marina durante el invierno fueron similares en las tres lagunas; sin embargo, en el verano los niveles de carbohidratos fueron aproximadamente el doble (P < 0.05) para los pastos de SQ con respecto a los pastos de las lagunas del sur (fig. 4). A diferencia del azúcar, los niveles de almidón en los pastos de SQ a lo largo del año fueron dos veces más altos que los de los pastos del sur de la península. En general, los niveles de azúcar en los haces de Z. marina fueron aproximadamente cinco veces mayores que los niveles de almidón. La concentración de azúcar y almidón en las hojas de Z. marina mostraron diferencias estadísticas (P < 0.05) en función de la época del año, el sitio de estudio, y la interacción entre el tiempo y el sitio de estudio (tabla 1).
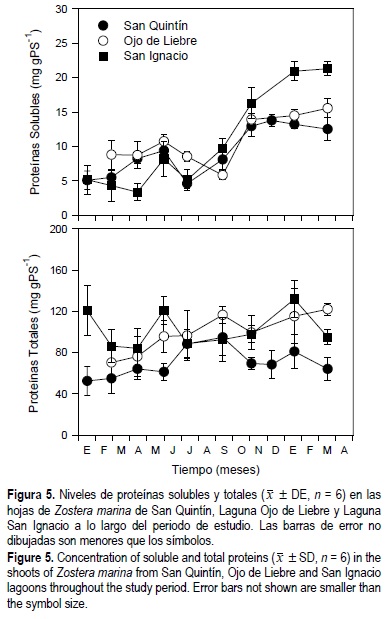
La concentración de proteínas solubles y totales en las hojas de Z. marina mostraron diferencias significativas (P < 0.05) en función de la época del año, el sitio de estudio, y la interacción entre tiempo y sitio de estudio (fig. 5, tabla 1). Los niveles de proteínas solubles fueron similares en los pastos de las tres lagunas durante casi todo el año (aprox. 7 mg gPS-1); sin embargo, la concentración de proteínas aumentó a aproximadamente el doble durante el invierno de 1999 y la primavera de 2000. Los niveles de proteínas totales en las hojas de Z. marina mostraron patrones diferentes en los tres sitios de estudio. En SQ los máximos valores se observaron en el verano y disminuyeron hacia el invierno, mientras que en OL los niveles aumentaron desde principios de 1999 hasta la primavera de 2000. En SI los niveles de proteínas totales en los haces no mostraron un patrón claro.
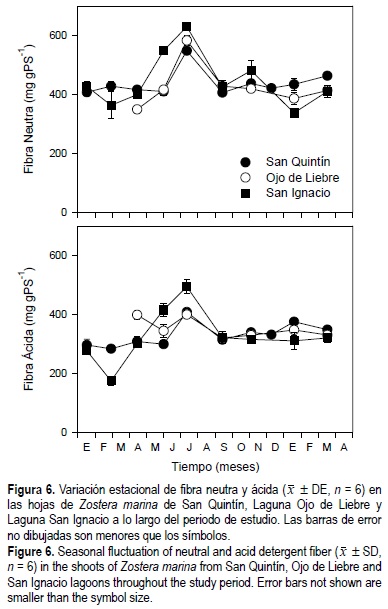
Las concentraciones de fibra neutra y fibra ácida fueron de 400 y 350 mg gPS-1, respectivamente, a lo largo del año para los pastos de las tres lagunas, excepto durante junio y julio, cuando los valores aumentaron en aproximadamente 30% (fig. 6). Los niveles de fibra neutra en las hojas de Z. marina mostraron diferencias estadísticas (P < 0.05) en función de la época del año, y de la interacción entre tiempo y sitio de estudio, pero no con relación al sitio de estudio, mientras que los niveles de fibra ácida mostraron diferencias estadísticas (P < 0.05) en función de la época del año, el sitio de estudio y la interacción entre tiempo y sitio de estudio (tabla 1). En las tres lagunas los niveles de fibra ácida representaron aproximadamente el 75% de los la fibra neutra en los haces de Z. marina.
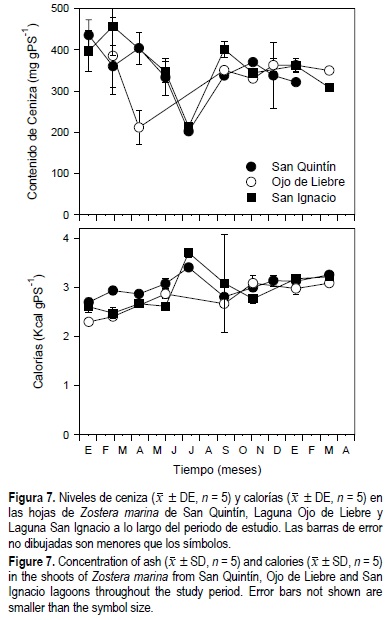
En las tres lagunas el contenido de ceniza en los haces de Z. marina disminuyó de invierno (400 mg gPS1) a primavera y verano (200 mg gPS-1) (fig. 7). Se observó además una disminución general del 10% del contenido de ceniza en los pastos de las tres lagunas estudiadas. Por otro lado, el contenido calórico de los haces de Z. marina se incrementó de aproximadamente 2.5 kcal gPS-1 en enero de 1999 a aproximadamente 3 kcal gPS-1 en marzo de 2000. Contrario a la disminución de los niveles de ceniza, se observó un incremento general del contenido calórico de las hojas de Z. marina de los tres sitios estudiados. La concentración de ceniza y calorías en los haces de Z. marina mostraron diferencias estadísticas (P < 0.05) en función de la época del año, el sitio de estudio y la interacción entre tiempo y sitio de estudio (tabla 1).
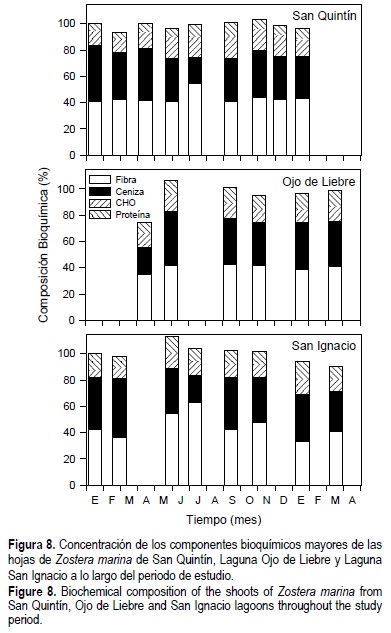
Las composiciones de fibra neutra, proteínas totales, carbohidratos (azúcar + almidón) y ceniza mostraron un comportamiento similar en los pastos de las tres lagunas a lo largo del año (fig. 8). En general, estos compuestos representaron el 100% de la composición metabólica de los haces a finales de la primavera y principios del verano, disminuyendo hacia el invierno. Los niveles de clorofila representaron menos del 1% del contenido de materia orgánica en las hojas de Z. marina.
Discusión
Baja California abarca regiones tropicales y templadas, consecuentemente, existe una gran variación en los niveles de irradiancia y temperatura a los que están expuestos los organismos distribuidos a lo largo de esta península. Los resultados de este estudio revelan que, a lo largo del año, los pastos que habitan las lagunas del sur de la península están expuestos a temperaturas medias de 5-6°C más altas e irradiancias dos veces mayores que los pastos del norte de Baja California. No obstante que los niveles de constituyentes orgánicos son similares a los reportados previamente para otras poblaciones (Dawes y Lawrence, 1979; Brand-Gardner et al., 1999), existen diferencias en los niveles de clorofila, azúcar, almidón, proteínas y otros metabolitos entre los haces del pasto marino Z. marina del norte y los del sur. En consecuencia, estas diferencias posiblemente impacten el metabolismo de los herbívoros que habitan las diferentes lagunas costeras de Baja California.
Los niveles de clorofila en el tejido de vegetales marinos responden a fluctuaciones estacionales de irradiancia en el campo (Mazzella y Alberte, 1986; Lindqvist y Lignell, 1997; Cabello-Pasini et al., 2002). Generalmente, los niveles de clorofila a y pigmentos accesorios aumentan en épocas del año con irradiancias o fotoperíodos menores (Lewey y Gorham, 1984). De igual manera, los niveles de pigmentos son generalmente más elevados en Z. marina de zonas con menores niveles de irradiancia (Zimmerman et al., 1995). En la laguna del norte de la península (SQ), los haces de Z. marina probablemente responden a las bajas irradiancias in situ aumentando la concentración de clorofilas con respecto a los pastos de las lagunas del sur. De hecho, los pastos de las lagunas del sur de Baja California se encuentran establecidos a aproximadamente 1 m más de profundidad que los pastos del norte. Cabello-Pasini et al. (2003) han especulado que la colonización de zonas más profundas por Z. marina en las lagunas del sur es el resultado de una mayor disponibilidad de luz en la columna de agua con respecto a la laguna del norte. Los niveles mayores de pigmentos en las hojas de los pastos en la laguna del norte probablemente sean también el resultado de la mayor disponibilidad de nutrientes en la región norte con respecto a la región sur de la península.
No obstante que los niveles de irradiancia son menores en SQ con respecto a las lagunas del sur, se observó una mayor acumulación de carbohidratos durante el verano en los pastos de SQ. Por otro lado, las características fotosintéticas de Z. marina resultaron ser similares en las tres lagunas a lo largo de un ciclo anual (Cabello-Pasini et al., 2003). Lo anterior sugiere que los niveles elevados de pigmentos en los pastos de la laguna del norte están compensando los bajos niveles de irradiancia a las que estos pastos están expuestos, con respecto a los pastos del sur. Por otro lado, la disminución en los niveles de azúcar en los haces de Z. marina del sur de la península es consistente con la disminución de la irradiancia in situ en esta zona. Esta disminución en la irradiancia in situ probablemente está asociada con el incremento de la turbidez debido al aumento de la velocidad del viento durante el verano. Se ha demostrado que un aumento en la turbidez de la columna de agua puede ser responsable de la reducción de los niveles de azúcar en las hojas de Z. marina, especialmente en poblaciones submareales (Cabello-Pasini et al., 2002). Es probable que la mayor concentración de pigmentos y la posición más alta en el mesolitoral de los pastos en la laguna del norte sean suficientes para mantener altas tasas fotosintéticas y altas tasas de producción de azúcares.
Durante el periodo de estudio no fue clara la razón de la tendencia anual del aumento del contenido de proteínas y carbohidratos (azúcar + almidón + fibra). Sin embargo, el inicio de la serie de muestreo se caracterizó por ser el final de un evento de El Niño caracterizado por anomalías de hasta 4°C en la temperatura superficial, mientras que 1999 y 2000 se caracterizaron por presentar una anomalía de la temperatura superficial del agua de aproximadamente -1°C, como resultado de un fuerte año La Niña (Ladah et al., 1999; Durazo-Arvizu et al. , 2001). De hecho a lo largo de este estudio, la temperatura del agua en las tres lagunas presentó una disminución general de 1°C. Como en otros lugares del mundo, la abundancia de vegetales marinos en Baja California disminuye como consecuencia del incremento de la temperatura y de la disminución de los nutrientes durante fenómenos El Niño (Gerard, 1984; Ladah et al., 1999). De igual manera, la fisiología de estos vegetales se ve afectada como resultado de las anomalías térmicas. El contenido de nitrógeno y proteínas en el tejido de la Phaeophyta Macrocystis pyrifera, por ejemplo, disminuyó al incrementarse la temperatura durante El Niño de 1983/84 (Gerard, 1984). Es probable que los bajos niveles de proteínas y carbohidratos en las hojas de Z. marina al inicio del estudio hayan sido el resultado de la anomalía térmica sobre la fisiología del pasto y/o de la disminución en la disponibilidad de nutrientes provocadas por El Niño.
El incremento en los niveles de calorías en los pastos de las tres lagunas a lo largo del año es atribuible al aumento durante el mismo periodo de los niveles de proteínas y carbohidratos, y la disminución en el contenido de ceniza en el tejido. Los contenidos calóricos de proteínas y carbohidratos de vegetales son de 5.73 y 4.18 kcal g-1, respectivamente. A lo largo del año se observó un aumento de 30.88 ± 12.02 mg gPS-1 en el nivel de proteínas totales en los haces de Z. marina de las tres lagunas estudiadas, representando un incremento de 0.18 kcal gPS-1. De manera similar, el aumento de 40.71 ± 0.15 mg gPS-1 en los niveles de carbohidratos (azúcar + almidón + fibra) representa un incremento de 0.17 kcal gPS-1. De manera conjunta, el incremento de proteínas y carbohidratos representó un aumento de 0.35 kcal gPS-1. Lo anterior sugiere que el aumento de los niveles de carbohidratos y proteínas a lo largo del año es responsable del incremento de aproximadamente 53% del contenido calórico del tejido de Z. marina. El resto del contenido calórico en las hojas de los pastos debe ser explicado por cambios en los niveles de lípidos, pigmentos, ácidos orgánicos, etc. Aunque los lípidos tienen un contenido calórico más alto que los carbohidratos y proteínas (Gnaiger, 1983), el contenido de lípidos en las hojas de pastos marinos y otros macrofitos marinos es bajo y varía desde < 1% hasta 2% del peso seco (Dawes y Lawrence, 1979; Westermeir y Gomez, 1996). Por lo anterior, los lípidos y pigmentos podrían ser tan sólo responsables de un cambio de aproximadamente 15% del contenido calórico.
El contenido de fibra, carbohidratos (azúcar + almidón), proteína y ceniza son responsables de más del 95% de la composición bioquímica del tejido de las hojas de Z. marina a lo largo del año. Esto es inconsistente con lo observado en las hojas de Thalassia testudinum en las que estos mismos componentes representan sólo el 50% del peso seco del tejido. Por otro lado, los niveles de pigmentos en las hojas de Z. marina son responsables de menos del 0.8% del peso seco. Lo anterior sugiere que fibra, carbohidratos (azúcar + almidón), proteína y ceniza son los componentes más abundantes del tejido de Z. marina.
Una serie de herbívoros marinos dependen de la calidad, cantidad y disponibilidad de plantas para satisfacer sus requerimientos calóricos. Cualquier cambio en estos parámetros podría afectar la capacidad de sobrevivencia y reproducción de los organismos. Por ejemplo, tanto la población de brantas de Europa (B. b. bernicla) con la del este de Norteamérica (B. b. horta) disminuyeron drásticamente, directamente por inanición e indirectamente por la reducción del éxito reproductivo y del reclutamiento después de que la enfermedad conocida como wasting causara el abatimiento de los mantos de Z. marina en el Atlántico Norte a principios de los años treinta (Reed et al., 1988). Igualmente, los mismos herbívoros pueden influenciar la dinámica de los pastos marinos y posiblemente la composición bioquímica del tejido de Z. marina como se ha demostrado en herbivoría de sistemas terrestres (McNaughton, 1979). Este estudio revela diferencias en los contenidos de proteínas, carbohidratos solubles e insolu-bles y ceniza en las hojas del pasto marino Z. marina a lo largo del año en las diferentes lagunas de Baja California; sin embargo, se desconoce si las variaciones en la concentración de estos metabolitos afectan la fisiología de los herbívoros que habitan en ellas.
Agradecimientos
Agradecemos a Eduardo Carrera, Richard y Dorothy Wheeler, Kuyimá, Danielle Mather, Adrian Gall, Dan Rizoli, Fernando Heredia, Edmundo Elorduy, Edgar Arroyo y Adrián López por su ayuda en el campo. Este estudio fue apoyado con fondos de Ducks Unlimited de México (DUMAC), Exportadora de Sal, S.A. (ESSA), CONACYT (I26655), Universidad Autónoma de Baja California (4023, 4078-13), U.S. Fish and Wildlife Service-North American Conservation Act, y U.S. Geological Survey-Alaska Science Center.
Referencias
Alcoverro, T., Zimmerman, R.C., Kohrs, D.G. and Alberte, R.S. (1999) . Resource allocation and sucrose mobilization in light-limited eelgrass Zostera marina. Mar. Ecol. Prog. Ser., 187: 121-131. [ Links ]
Backman, T.W. and Barilotti, D.C. (1976). Irradiance reduction: effects on standing crops of the eelgrass Zostera marina in a coastal lagoon. Mar. Biol., 34: 33-40. [ Links ]
Bradford, M.M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., 72: 248-254. [ Links ]
Brand-Gardner, S.J., Lanyon, J.M. and Limpus, C.J. (1999). Diet selection by immature turtles Chelonias mydas, in subtropical Moreton Bay, south-east Queensland. Aust. J. Zool., 47: 181-191. [ Links ]
Burke, M.K., Dennison, W.C. and Moore, K.A. (1996). Non-structural carbohydrate reserves of eelgrass Zostera marina. Mar. Ecol. Prog. Ser., 137: 195-201. [ Links ]
Cabello-Pasini, A. (1984). Transplantes de Zostera marina L. en el Estero de Punta Banda, Baja California, México, durante el verano de 1983 y su comportamiento a través de otoño e invierno. Tesis de licenciatura, Universidad Autónoma de Baja California, Baja California, México, 40 pp. [ Links ]
Cabello-Pasini, A., Lara-Turrent, C. and Zimmerman, R.C. (2002). Effect of storms on photosynthesis, carbohydrate content and survival of eelgrass populations in a coastal lagoon and the adjacent open ocean. Aquat. Bot., 74: 149-164. [ Links ]
Cabello-Pasini, A., Muñiz-Salazar, R. and Ward, D.H. (2003). Annual variations of biomass and photosynthesis in Zostera marina L. along the Pacific coast of Baja California, Mexico. Aquat. Bot., in press. [ Links ]
Castro, R., Mascarenhas, A.S., Durazo-Arvizu, R. and Collins, C. (2000) . Seasonal variation of the temperature and salinity at the entrance to the Gulf of California, Mexico. Cien. Mar., 26: 561-583. [ Links ]
Dawes, C.J. and Lawrence, J.M. (1979). Effect of blade removal on the proximate compositon of the rhizome of the seagrass Thalassia testudinum Banks ex Koning. Aquat. Bot., 7: 255-266. [ Links ]
Dennison, W.C. and Alberte, R.S. (1985). Role of daily light period in the depth distribution of Zostera marina (eelgrass). Mar. Ecol. Prog. Ser., 25: 51-61. [ Links ]
Durazo-Arvizu, R., Baumgartner, T., Bograd, S., Collins, C., de la Campa de Guzmán, S., García, J., Gaxiola-Castro, G., Huyer, A., Hyrenchbach, K., Loya, D., Lynn, R.J., Schwing, F.B., Smith, R., Sydeman, W. and Wheeler, P.A. (2001). The state of the California Current, 2000-2001: A third straight La Niña year. CalCOFI Rep., 42: 29-60. [ Links ]
Felger, R., Moser, M. and Moser, E. (1980). Seagrasses in Seri Indian Culture. In: R.C. Phillips and C.P. McRoy (eds.), Handbook of Seagrass Biology: An Ecosystem Perspective. Garland STPM Press, New York, pp. 261-276. [ Links ]
Gerard, V.A. (1984). Physiological effect of El Niño on giant kelp in southern California. Mar. Biol. Lett., 5: 317-322. [ Links ]
Gnaiger, E. (1983). Calculation of energetic and biochemical equivalents of respiratory oxygen consumption. In: E. Graiger and H. Forstner (eds.), Polarographic Oxygen Sensors. Springer-Verlag, New York, pp. 337-345. [ Links ]
Ibarra-Obando, S.E. (1989). Las praderas de pastos marinos del Pacífico mexicano con énfasis en Zostera marina Linneo. En: J. Rosa-Vélez y F. González-Farías (eds.), Temas de Oceanografía Geológica en México. Universidad Autónoma de Baja California, Ensenada, pp. 337. [ Links ]
Jeffrey, S.W. and Humphrey, G.F. (1975). New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochem. Physiol. Pflanzen, 167: 191-194. [ Links ]
Keller, M. and Harris, S.W. (1966). The growth of eelgrass in relation to tidal depth. J. Wildlife Management, 30: 280-285. [ Links ]
Ladah, L.B., Zertuche-González, J.A. and Hernández-Carmona, G. (1999). Giant kelp (Macrocystis pyrifera, Phaeophyceae) recruitment near its southern limit in Baja California after mass disappearance during ENSO 1997-1998. J. Phycol., 35: 1106-1112. [ Links ]
Lewey, S.A. and Gorham, J. (1984). Pigment composition and photosynthesis in Sargassum muticum. Mar. Biol., 80: 109-115. [ Links ]
Lindqvist, K. and Lignell, R. (1997). Intracellular partitioning of 14CO2 in phytoplankton during a growth season in the northern Baltic. Mar. Ecol. Prog. Ser., 152: 41-50. [ Links ]
Mather, R., Montgomery, W. and Portig, A. (1998). Exploitation of intertidal Zostera species by brent geese (Branta bernicla Hrota): Why dig for you dinner? Biology and Environment: Proc. R. Irish Acad., 98B: 147-152. [ Links ]
Mazzella, L. and Alberte, R. S. (1986). Light adaptation and the role of autotrophic epiphytes in primary production of the temperate seagrass, Zostera marina L. J. Exp. Mar. Biol. Ecol., 100: 165-180. [ Links ]
McMillan, C. (1978). Morphogeographic variation under controlled conditions in five seagrasses, Thalassia testudinum, Halodule wrightii, Syringodium filiforme, Halophila engelmannii, and Zostera marina. Aquat. Bot., 4: 169-189. [ Links ]
Meling-López, A.E. and Ibarra-Obando, S.E. (1999). Annual life cycles of two Zostera marina L. populations in the Gulf of California: contrasts in seasonality and reproductive effort. Aquat. Bot., 65: 59-69. [ Links ]
Reed, A., Ward, D.H., Derksen, D.V. and Sedinger, J.S. (1998). Brant: Branta bernicla. The Birds of North America, 337: 1-32. [ Links ]
Riosmena-Rodríguez, R. and Sánchez-Lizaso, J.L. (1996). The southern distributional limit of Zostera marina L. and Phyllospadix torreyi Watson for northwestern Mexico. Oceanides, 11: 45-48. [ Links ]
Rodríguez-Montesinos, Y.E. and Hernández-Carmona, G. (1991). Seasonal and geographic variations of Macrocystis pyrifera chemical composition at the western coast of Baja California. Cien. Mar., 17: 91-107. [ Links ]
Sokal, R.R. and Rohlf, F.J. (1981). Biometry. W.H. Freeman and Co., New York, 859 pp. [ Links ]
Tejada-Hernández, I. (1992). Control de Calidad y Análisis de Alimento para Animales. Secretaría de Educación Pública, Mexico, D.F., 397 pp. [ Links ]
Westermeir, R. and Gomez, I. (1996). Biomass, energy contents and major organic compounds in the brown alga Lessonia nigrescens (Laminariales, Phaeophyceae) from Mehuin, South Chile. Bot. Mar., 39: 553-559. [ Links ]
Yemm, E.W. and Willis, A.J. (1954). The estimation of carbohydrates in plant extracts by anthrone. Biochem. J., 57: 508-514. [ Links ]
Zimmerman, R.C., Reguzzoni, J.L. and Alberte, R.S. (1995). Eelgrass (Zostera marina L.) transplants in San Francisco Bay: Role of light availability on metabolism, growth and survival. Aquat. Bot., 51: 67-86. [ Links ]
Zimmerman, R.C., Kohrs, D.G. and Alberte, R.S. (1996). Top-down impact through a bottom-up mechanism: The effect of limpet grazing on growth, productivity and carbon allocation of Zostera marina L. (eelgrass). Oecologia, 107: 560-567. [ Links ]














