Introducción
Los síndromes neurocutáneos o facomatosis son un grupo heterogéneo de enfermedades de carácter hereditario con afectación multisistémica que incluye lesiones a nivel cutáneo y del SNC.1 Entre el grupo de las facomatosis más comunes se encuentran la esclerosis tuberosa, la neurofibromatosis tipo 1 y 2, el síndrome de Von Hippel-Lindau y la enfermedad de Sturge-Weber.2
El complejo esclerosis tuberosa (CET) es una enfermedad genética, autosómica dominante con expresividad variable; la prevalencia a nivel mundial es de 6.8-12.4 por 100,000 personas, su incidencia al nacimiento es de uno en 5,000 a 10,000 recién nacidos vivos, no encontrándose diferencias entre sexos o etnias.3 Fue descrita hace más de 150 años por Von Recklinghausen, quien describió por primera vez los esclerodemas del cerebro; sin embargo, Bourneville en 1880 publica la primera descripción de la enfermedad relacionándola con lesiones cerebrales y en la piel de la cara.1
Recientemente se han localizado dos genes causantes: el gen TSC1 (ubicado en el cromosoma 9q34, encargado de codificar la hamartina) y el gen TSC2 (ubicado en el cromosoma 16p 13.3, que codifica la tuberina). Estas proteínas actúan como supresores en el crecimiento de tumores, regulan la diferenciación y proliferación celular.4
El diagnóstico se basa en una serie de criterios clínicos y radiológicos, los cuales se agrupan en los criterios mayores y menores de acuerdo con lo señalado en la Tabla 1.5
Tabla 1: Criterios diagnósticos del complejo esclerosis tuberosa.
| Criterios de diagnóstico clínico | |
| • Diagnóstico definitivo: dos criterios mayores o uno mayor con ≥ 2 menores | |
| • Diagnóstico posible: un criterio mayor o ≥ 2 menores | |
| Criterios mayores | Criterios menores |
| ≥ 3 angiofibromas o placa cefálica fibrosa | Lesiones cutáneas “confeti” |
| ≥ 2 fibromas ungueales | > 3 fosas de esmalte dental |
| Parche Shagreen | ≥ 2 fibromas intraorales |
| Hamartomas retinianos múltiples | Parche acromático de retina |
| Displasias corticales (incluye tubérculos y líneas de migración radial de la sustancia blanca cerebral) | Quistes renales múltiples |
| Nódulos subependimarios | Hamartomas no renales |
| Astrocitoma de células gigantes subependimarias | |
| Rabdomioma cardiaco | |
| LAM (la combinación de LAM y ≥ 2 angiomiolipomas no cumple con los criterios para un diagnóstico definitivo) | |
| ≥ 2 angiomiolipomas (la combinación de LAM y ≥ 2 angiomiolipomas no cumple con los criterios para un diagnóstico definitivo) |
LAM: linfangioleiomiomatosis.
Modificado de: Northrup H et al.5
A nivel cerebral se observan malformaciones causadas por alteraciones en la histogénesis, proliferación y migración de las neuronas y células gliales, donde se incluyen los nódulos subependimarios, túberes corticales, subcorticales y astrocitomas subependimarios de células gigantes (SEGA).6 Estas lesiones estructurales suelen estar asociadas a alteraciones neurológicas, como epilepsia, trastornos del espectro autista, de la conducta y la discapacidad intelectual.7
Debido a lo limitado de la información en América Latina, el objetivo del presente trabajo es describir las características clínicas e imagenológicas de 12 pacientes pediátricos con diagnóstico de complejo esclerosis tuberosa.
Material y métodos
Se revisaron los casos de los pacientes con diagnóstico de CET entre 2010 y 2020, valorados por el Servicio de Neurología Pediátrica del Hospital Militar Central ubicado en la ciudad de Bogotá, Colombia. Este hospital corresponde a un tercer nivel de atención, el cual es un centro de referencia en el régimen especial (Fuerzas Militares), con cobertura total en el sistema de salud.
Se incluyeron pacientes con diagnóstico definitivo de CET, de acuerdo con los criterios del consenso internacional de 2012, con presencia de dos criterios mayores, o bien uno mayor y dos menores.5
Se recogieron las siguientes variables clínicas: edad, sexo, edad de diagnóstico del CET, edad actual, edad de inicio de epilepsia, tipo de crisis, lesiones dermatológicas, fármacos antiepilépticos que recibían, alteraciones neurológicas asociadas, trastornos del comportamiento, antecedentes familiares y prenatales. Además, se analizaron los hallazgos en el examen físico, de la exploración neurológica, de la resonancia magnética cerebral, ecografía renal, ecocardiograma y fondo de ojo.
En general, la valoración de los pacientes descritos ha sido interdisciplinaria por parte de los servicios de dermatología, nefrología, cardiología, oftalmología, psiquiatría infantil, genética médica y neurología pediátrica.
Análisis estadístico: los datos se presentan como estadística descriptiva.
Aspectos éticos. Siguiendo los protocolos establecidos por el hospital, se solicitó a los responsables de los pacientes la autorización para la publicación y estudio de datos clínicos, quienes aceptaron firmando un consentimiento informado.
Resultados
Se identificaron 12 pacientes con diagnóstico de CET, cinco corresponden al sexo masculino y siete al femenino. Diez de los 12 pacientes (83%) fueron diagnosticados antes de los dos años, el promedio fue de 16 meses, siendo la variación desde recién nacidos hasta los 72 meses.
Ninguno de los pacientes fueron hijos de padres consanguíneos. Pese al patrón de herencia autosómico dominante, sólo tres (25%) tenían un familiar de primer grado con la misma entidad.
En la Tabla 2 se describen las características de los pacientes incluidos. De todos, seis presentaron entre dos y tres criterios mayores, cinco presentaron cuatro criterios o más. Mientras que sólo un caso tuvo un criterio mayor.
Tabla 2: Descripción de los 12 casos con complejo esclerosis tuberosa.
| Caso | Edad diagnóstico/sexo | Edad actual | Datos clínicos | Antecedentes de importancia |
|---|---|---|---|---|
| 1 | 6 años/masculino | 7 años | Cefalea pulsátil con poca respuesta a los analgésicos | Bisabuelos maternos con fibromas faciales |
| Cuadros de agresividad y terrores nocturnos | ||||
| Cuatro máculas hipomelanóticas de 0.5 cm, con dos lesiones subependimarias nodulares | ||||
| 2 | 1 mes/femenino | 5 meses | Espasmos infantiles | Ninguno |
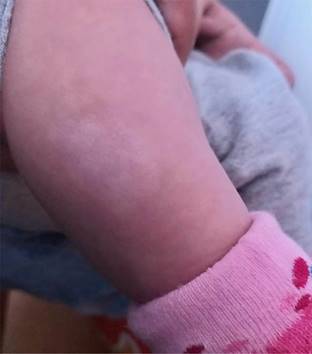
| Nueve máculas hipomelanóticas de 4 a 5 mm (Figura 1) | ||||
| Displasias focales corticales transmanto y nódulos subependimarios bilaterales | ||||
| Rabdomioma cardiaco de 0.3 cm en el ventrículo derecho | ||||
| 3 | 1 año/femenino | 16 años | Epilepsia focal refractaria, asociado a cuadros de auto- y heteroagresión; discapacidad cognitiva grave. Angiofibromas faciales. Máculas hipomelanóticas. Hamartoma retiniano en ojo derecho | Abuelo paterno con epilepsia focal, padre con CET |
| Nódulos subependimarios y hamartomas corticales supratentoriales | ||||
| 4 | 1 año/masculino | 7 años | Discapacidad cognitiva | Hermana con CET, abuelo paterno con epilepsia focal |
| Fibromas ungueales | ||||
| Epilepsia focal estructural | ||||
| 5 | 2 años/femenino | 7 años | Retardo mental | Pretérmino, por hidropesía fetal |
| Epilepsia focal. Microcefalia | ||||
| Parche acrómico de retina | ||||
| > 9 máculas hipomelanóticas. Displasia en lóbulos frontal, parietal y temporal bilateral, además de nódulos subependimarios | ||||
| 6 | 3 años/femenino | 8 años | Trastorno del espectro autista, retraso del lenguaje expresivo | Ninguno |
| > 5 máculas hipomelanóticas | ||||
| 7 | 6 meses/femenino | 17 años | Discapacidad cognitiva moderada | Ninguno |
| Máculas hipopigmentadas | ||||
| Angiofibromas faciales | ||||
| Fibromas ungueales | ||||
| Tuberosidad cortical en la región frontal y del vértice bilateral, y nódulos subependimarios calcificados | ||||
| 8 | 1 año/masculino | 7 años | Retardo mental | Ninguno |
| Epilepsia focal | ||||
| Hamartomas corticales, nódulos subependimarios en corona radiada y centros semiovales | ||||
| 9 | Nacimiento/femenino | 9 años | Rabdomiomas cardiacos | Ninguno |
| Trastorno de conducta | ||||
| Placa de Shagreen en región frontal. Angiofibromas en cara y dorso de la nariz | ||||
| Nódulos en uñas de los pies | ||||
| Túberes cerebrales | ||||
| 10 | 4 meses/masculino | 16 años | Espasmos infantiles, epilepsia focal | Ninguno |
| Trastorno generalizado del desarrollo | ||||
| Angiofibromas en cara | ||||
| Placa de Shagreen en región lumbar | ||||
| Mancha en hoja de fresno | ||||
| Múltiples túberes corticales | ||||
| Parche retiniano | ||||
| Nódulos de Köenen | ||||
| 11 | 1 año/masculino | 18 años | Retardo mental, trastorno de la conducta | Ninguno |
| Epilepsia focal | ||||
| Máculas hipomelanóticas | ||||
| Múltiples túberes corticales | ||||
| Angiomiolipoma renal | ||||
| Hipertensión arterial | ||||
| Nódulos en encías | ||||
| Placa de Shagreen | ||||
| 12 | 2 meses/femenino | 4 meses | Manchas en hoja de fresno | Ninguno |
El signo clínico más frecuente fueron las manchas hipomelanóticas que se observaron en todos los pacientes; 7/12 (58%) presentaban crisis epilépticas, con una edad media de inicio a 2.3 años, de los cuales 5/7 eran refractarios al manejo antiepiléptico; 10/12 (83%) de los pacientes tenían algún tipo de alteración cognitivo-conductual, entre los que se destacan trastornos del comportamiento, agresividad y trastorno del espectro autista.
Con respecto a otras manifestaciones, hubo dos pacientes con rabdomiomas (16%), 5/12 (41%) presentaron alteraciones oftalmológicas y una cuarta parte con fibromas ungueales. En los estudios de imagen se evidenciaron nódulos subependimarios y displasias corticales en 11/12 (91%) pacientes.
En la actualidad, todos se encuentran en manejo interdisciplinario con las diferentes especialidades pediátricas, terapia física, ocupacional y del lenguaje. Se brindó a los padres ayuda psicológica y asesoramiento genético.
Discusión
El CET se caracteriza por el desarrollo y crecimiento inusual de hamartomas en el cerebro, piel y otros órganos.8 Las manifestaciones multisistémicas pueden variar ampliamente, lo que resulta un reto diagnóstico para el clínico, dada que es una condición rara.9 A nivel de América Latina no se ha establecido claramente la epidemiología de esta entidad; sin embargo, un estudio desarrollado en Brasil determinó una incidencia de uno por 10,000 a 50,000 nacidos vivos.10
En el Hospital Nacional Cayetano Heredia de Perú se describieron 19 casos con una edad promedio al momento del diagnóstico de 5.3 años; de éstos, 88% debutaron con convulsiones antes de los 11 meses y las lesiones encontradas con mayor frecuencia fueron máculas hipocrómicas (81%) y angiofibromas faciales (56%). Dentro de los hallazgos imagenológicos por resonancia magnética del SNC se encontraron nódulos subependimarios en 92% de los casos y tuberosidades corticales en 31%.11
El CET es un trastorno autosómico dominante con penetrancia casi completa de expresividad variable; de nuestros pacientes un tercio presentan historia familiar. Se han identificado variantes patogénicas causantes de esta entidad en los genes TSC1 y TSC2. Estas proteínas en su estado normal funcionan en un complejo que inhibe la proliferación celular.12 El complejo hamartina-tuberina interviene en múltiples vías de señalización celular, en las que se incluyen las reguladoras del tráfico, crecimiento, proliferación, adhesión y migración celular.13
Los casos sin antecedentes familiares pueden representar variantes patogénicas espontáneas o incluso mosaicismos somáticos.14 Es importante recalcar que se han identificado casi tres mil variantes patogénicas diferentes que causan CET y una fracción significativa (≈15%) no tiene una mutación identificada por pruebas genéticas convencionales, por lo que un resultado normal no excluye el diagnóstico de CET.15
El diagnóstico de CET se ha basado en manifestaciones clínicas y radiológicas. Se utilizan una serie de criterios clínicos diagnósticos, revisados en el año 2012, donde se propone un diagnóstico definitivo con dos criterios mayores, o bien uno mayor más dos menores; mientras que un diagnóstico posible cuando se identifica un criterio mayor o dos o más criterios menores.5,16 En la población estudiada, 11 de los 12 pacientes tuvieron un diagnóstico definitivo con más de dos criterios mayores, y sólo uno presentó un posible diagnóstico con un criterio mayor, sin que se pueda descartar que, en el transcurso del tiempo, vaya a presentar otros datos compatibles con CET llevando a un diagnóstico definitivo. Algunos autores proponen estratificar los criterios según el grupo etario, ya que la expresión de síntomas aumenta conforme la edad, lo que explicaría que en la presente serie de casos algunos de los criterios estaban ausentes.17
La presentación clínica de la CET varía entre los individuos, incluso entre las familias, siendo importante conocer las principales manifestaciones en diferentes órganos o sistemas.18 Por ejemplo, se reporta que las manifestaciones dermatológicas están presentes en aproximadamente 90% de los pacientes (en la presente serie todos los pacientes las tuvieron); las manchas hipomelanóticas (Figura 1) se caracterizan por adoptar un patrón lineal sobre tronco o miembros, con una configuración oval con un extremo puntiagudo, lo cual se denomina “hojas de Fresno”.14
Los angiofibromas faciales pueden afectar aproximadamente a 75% de los pacientes, por lo general entre los cuatro a cinco años, aumentado en número y tamaño a lo largo de la adolescencia y adultez; se definen como hamartomatosis del tejido vascular y conectivo, de localización principal en nariz y región malar,19 como se observó en 4/12 de nuestros pacientes. En dos de estos casos se identificaron parches de Shagreen, causados por fibrosis subepidérmica, que aparecen durante la primera década de la vida. Estos consisten en áreas de piel engrosada, con superficie irregular y textura de cáscara de naranja, a menudo ubicados en la cara dorsal del tronco.14,19
Durante la segunda década aparecen los fibromas ungueales, llamados tumores de Köenen, que suelen aumentar de tamaño con los años, los cuales se identificaron en una cuarta parte de los pacientes de la presente serie, quienes se encontraban en la etapa escolar o adolescente.19
Las manifestaciones neurológicas son la principal causa de morbilidad y mortalidad en pacientes con CET, incluyendo las displasias corticales, las cuales se definen como trastornos de la migración neuronal durante el desarrollo embrionario. De los pacientes aquí reportados, la mayoría presentó hamartomas glioneuronales corticales, nódulos subependimarios o líneas de migración radial en la sustancia blanca (Figura 2).20
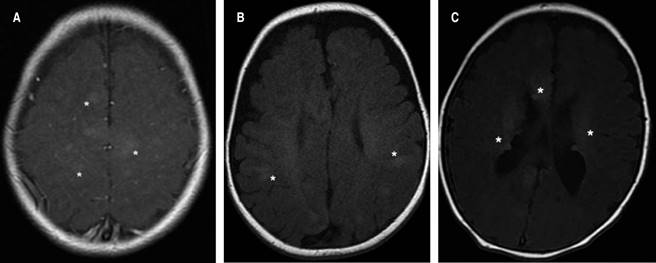
Figura 2: Imágenes de las alteraciones a nivel del sistema nervioso central en el complejo esclerosis tuberosa, señaladas por los asteriscos: A) Túberes corticales multifocales. B) Líneas de migración radial en la sustancia blanca. C) Nódulos subependimarios calcificados.
Con respecto al SEGA, los presentan de 5-20% de los pacientes con CET; son tumores benignos, de crecimiento lento que surgen en el área periventricular.6,21 Su detección suele ser después de la segunda década de la vida, causando compromiso neurológico grave, incluyendo hidrocefalia obstructiva, por lo cual se recomienda realizar estudios de imagen de resonancia magnética (IRM) de manera anual o cada tres años; ninguno de los pacientes en esta serie lo presentaron. Por otro lado, con IRM también es posible encontrar lesiones en la sustancia blanca como nódulos, quistes y áreas de gliosis e hipomielinización.22
Se ha reportado epilepsia entre 79-90% de los pacientes, cuyo inicio suele ser entre los tres y ocho meses de edad. Los espasmos infantiles son el tipo de convulsiones más común (hasta en 69%); además, se han descrito crisis focales y tónico-clónicas generalizadas.5 En nuestra serie, el electroencefalograma (EEG) en la mitad de los pacientes presentó anomalías epileptiformes, incluyendo descargas multifocales, focales y anormalidades generalizadas tipo hipsarritmia. El tipo de epilepsia en la presente correspondió a epilepsia focal y espasmos infantiles, en concordancia con lo publicado en la literatura.5,23
El déficit cognitivo es una característica principal del CET; se ha asociado con trastorno del espectro autista, trastorno de déficit de atención e hiperactividad, al igual que otras comorbilidades como depresión, trastorno bipolar, ansiedad, esquizofrenia y psicosis. En nuestros pacientes después del déficit cognitivo predominaron los trastornos conductuales, del espectro autista y cuadros de agresividad. Según la literatura, la prevalencia de estos problemas oscila entre 50-90% de los pacientes, lo que concuerda con la proporción encontrada en nuestro reporte.24
Por otra parte, el rabdomioma cardiaco es una de las características del CET, es considerado el tumor cardiaco primario más común en la infancia temprana, e incluso pueden ser diagnosticados prenatalmente.25 Alrededor de 90% de los pacientes con rabdomioma cardiaco tienen esclerosis tuberosa.26 En el grupo de nuestros pacientes sólo dos lo presentaron; en una se detectó en ecografía fetal y se confirmó al nacimiento. Su transformación maligna es mínima e incluso puede haber regresión, por lo que no es necesario algún tratamiento; sin embargo, podrían causar complicaciones como obstrucción intracavitaria, disminución de función miocárdica y arritmias. Se recomienda realizar seguimiento ecocardiográfico cada uno a tres años.27
Los problemas renales suelen diagnosticarse en la infancia. Los más frecuentes son angiomiolipomas (75-85%), aunque es posible encontrar quistes, linfangiomas y carcinoma de células renales, sobre todo en la edad adulta. Las manifestaciones clínicas incluyen hematuria, dolor lumbar, hipertensión arterial, enfermedad renal crónica y aneurismas.28 Sólo uno de los pacientes de esta serie presentó alteraciones renales, pero es importante mantener la vigilancia, ya que este tipo de alteraciones pueden presentarse a mayor edad.29
Algunos adultos, predominantemente mujeres entre la tercera y cuarta década de la vida, pueden desarrollar enfermedad pulmonar conocida como linfangioleiomiomatosis (LAM); caracterizada por proliferación e infiltración anormal de las células musculares lisas y una destrucción quística del pulmón. Otro hallazgo pulmonar es la hiperplasia neumocitaria micronodular multifocal, la cual se caracteriza por múltiples nódulos pulmonares compuestos de neumocitos tipo II.
Se considera que hasta la mitad de los pacientes puede presentar manifestaciones oftalmológicas. Los hamartomas retinianos corresponden al hallazgo más común, los cuales pueden ser lesiones planas lisas no calcificadas, lesiones elevadas, multinodulares, calcificada y opacas;30 en esta serie 5/12 (41%) pacientes presentaron alteraciones oftalmológicas, tres con hamartomas retinianos y dos con parches acrómicos de retina.
Conclusiones
Por último, es importante destacar que, aunque las principales manifestaciones clínicas de los pacientes con CET son problemas dermatológicos y neurológicos, se pueden presentar otras lesiones en otros órganos y sistemas que se presentan a lo largo de la vida, por lo que se requiere manejo y vigilancia de diferentes especialistas.31











 nueva página del texto (beta)
nueva página del texto (beta)