Introducción
La enfermedad de Camurati-Engelmann (ECE) (MIM 31300, ORPHA: 1328, CIE-10: Q783) está relacionada con mutaciones en el factor de crecimiento transformante β1 (TGFB1), el cual participa en la proliferación ósea. La mayoría (82.2%) de las mutaciones ocurren en el exón 4, que codifica la región en el péptido asociado a la latencia TGFB1 que rodea los residuos responsables de la homodimerización (Cys223 y Cys225).1 El segundo exón más afectado es el exón 1 y los tres alelos mutantes más frecuentes son: p.Arg210Cys, p.Arg218His, y p.Cys225Arg.2
Bajo condiciones fisiológicas TGFB1 estimula la formación de hueso y suprime el hueso por reabsorción. Por lo tanto, la interrupción de la función de los osteoblastos y los osteoclastos conduce a la hiperostosis a lo largo de la diáfisis de los huesos largos y la esclerosis del esqueleto, produciendo los síntomas característicos de la enfermedad.1-3
La frecuencia de la ECE se estima en un caso por millón de personas; hasta el momento se calcula que hay 300 casos reportados en todo el mundo.1,3 El inicio de la enfermedad es en la niñez, progresando durante la adolescencia, pero en la edad adulta su curso puede ser estacionario o lentamente progresivo. Los huesos afectados en orden de frecuencia son: fémur, tibia, peroné, húmero, cúbito y radio.3 Es posible realizar un diagnóstico prenatal cuando se ha identificado la mutación causante de la enfermedad en la familia.4
Las principales características clínicas de la ECE se reportan en la Tabla 1, en la que se compara el caso presentado con otros reportados en la literatura. En una revisión de 100 casos de la enfermedad realizada por Janssens y cols., en 2006, se evidenció que 94% de los pacientes con el defecto molecular en TGFB1 presentó síntomas radiológicos, siendo el engrosamiento cortical de las diáfisis de los huesos largos la primera manifestación. El cráneo y la pelvis fueron otros sitios involucrados. Asimismo, describen que 74% es sintomático, 55% con síntomas de gravedad leve a moderada. Los síntomas más comunes fueron dolor en las extremidades en 68%, un modo peculiar de caminar en 48%, fatiga fácil en 44% y debilidad muscular en 39%. La reducción de la grasa subcutánea se presentó en 21% y la pérdida auditiva en 15%. En la revisión se describen las diferentes variantes genéticas: 28_36 dup y 241T>C en el exón 1; 463C>T en el exón 2; 653G>A, 652C>T, 664C>G, 667T>C, 667T >G y 673T >C en el exón 4.5
Tabla 1: Síntomas clínicos de la enfermedad de Camurati-Engelmann del caso estudiado y reportados en la literatura.
| Síntomas clínicos | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estudio | Variante ADN | Variante proteica | DE | FF | DM | MP | PA | GR | PV | DC | I | S | Otros |
| Caso actual 2020 | 466C>T | A156C | x | x | x | ||||||||
| Simsek S et al, 2005 | 466C>T | A156C | x | x | x | Osteomielitis crónica | |||||||
| Janssens et al, 2006 | |||||||||||||
| Familia Bélgica | 673T>C | C225R | x | x | x | Hipertermia | |||||||
| Familia Iraq | 653G>A | R218H | x | x | x | x | x | x | x | Hepatoesplenomegalia, estatura pequeña, compresión de nervio craneal | |||
| Familia Reino Unido | 652C>T | R218C | x | x | x | x | ESR y CRP aumentada | ||||||
| Familia Italia | 28_36dup | L10-L12dup | x | x | |||||||||
| Familia Bélgica | 241T>C | Y81H | x | x | x | x | x | Estatura pequeña | |||||
| Familia Bélgica | 241T>C | Y81H | x | x | x | x | |||||||
| Familia Italia | 653G>A | R218H | x | x | x | x | x | ||||||
| Familia Alemania | 653G>A | R218H | x | x | x | x | |||||||
| Familia Reino Unido | 653G>A | R218H | x | x | |||||||||
| Familia Oceanía | 653G>A | R218H | x | Proptosis | |||||||||
| Familia Marruecos | 463C>T | R156C | x | x | x | x | ESR y CRP aumentada | ||||||
| Familia Bélgica | 673T>C | C225R | x | x | x | x | x | ||||||
| Familia España | 652C>T | R218C | x | x | x | x | Esplenomegalia leve, parálisis facial, hipertensión | ||||||
| Familia Alemania | 664C>G | H222D | x | x | x | x | x | Pubertad tardía, estatura baja | |||||
| Familia Israel | 652C>T | R218C | x | NR | x | x | NR | Inhabilidad para correr rápidamente | |||||
| Familia Japón | 673T>C | C225R | x | NR | x | x | x | NR | Hábito marfanoide, parálisis del nervio facial, pubertad tardía | ||||
| Familia Portugal | 653G>A | R218H | x | x | x | x | NR | x | Apetito escaso, pubertad tardía | ||||
| Familia Francia | 652C>T | R218C | x | x | x | x | NR | NR | Apetito escaso | ||||
| Familia Bélgica | 673T>C | C225R | x | x | x | x | NR | NR | |||||
| Familia 20 Francia | 673T>C | C225R | x | x | x | x | NR | NR | x | Apetito escaso | |||
| Familia Australia | 673T>C | C225R | x | x | x | x | NR | NR | x | Apetito escaso | |||
| Familia Francia | 652C>T | R218C | x | x | x | x | NR | NR | Apetito escaso | ||||
| Familia Francia | 652C>T | R218C | x | x | x | x | NR | NR | x | Apetito escaso | |||
| Familia EUA | 653G>A | R218H | x | x | x | x | x | x | Vértigo, pubertad tardía | ||||
| Collet C et al, 2013 | 466C>T | A156C | x | x | Esclerosis, diáfisis de huesos largos | ||||||||
| Vega RA et al, 2013 | No reporta | No reporta | x | Diáfisis de huesos largos | |||||||||
| Restrepo JP et al, 2016 | No reporta | No reporta | x | x | x | ||||||||
| Ge DH et al, 2018 | No reporta | No reporta | x | x | Esclerosis, artrosis, diáfisis de huesos largos | ||||||||
| Hughes P et al, 2019 | 653G>A | R218H | x | x | x | x | x | x | Bajo peso, parálisis del nervio facial | ||||
| Abdulla MC et al, 2019 | 652C>T | R218C | x | x | Hábito marfanoide, diáfisis de huesos largos | ||||||||
NR = no reporta, DE = dolor en extremidades, FF = fatiga fácil, DM = debilidad muscular, MP = marcha de pato, PA = pérdida auditiva, GR = grasa subcutánea reducida, PV = pérdida de visión, DC = dolor de cabeza, I = insomnio, S = sobrepeso, ESR = velocidad de sedimentación globular, CRP = proteína C reactiva.
Collet y cols. reportaron la variante c.466C>T, p.Arg156Cys, en Francia, en una familia de 10 integrantes afectados por una forma atípica de la ECE, caracterizada por signos radiológicos leves limitados a la tibia y asociados con sobrepeso u obesidad. Los pacientes presentaron hiperostosis tibial diafisaria aislada, conocida también como enfermedad de Ribbing y una edad de inicio tardía, (personas mayores de 30 años). Esta mutación se había informado previamente en una familia marroquí,6,7 con un fenotipo similar, lo que sugiere una posible relación fenotipo/genotipo.
En 2019, Hughes y cols. analizaron 10 casos de una familia de Nueva Zelanda (la mitad eran asintomáticos), encontrando la mutación R218H en el gen TGFB1.8 En Colombia, Vega-Caicedo y su equipo reportaron un paciente de 11 años con hallazgos radiológicos y clínicos sugestivos de la enfermedad, con una fractura patológica subtrocantérica como complicación.9 También, Restrepo y cols. presentaron el caso de una mujer de 54 años con ECE, quien solamente tenía compromiso tibial, sin otra sintomatología;4 sin embargo, en estos dos estudios no se describen las variantes genéticas.
La bioinformática es una disciplina que tiene como objetivo la aplicación de tecnologías computacionales y estadísticas para la gestión de datos biológicos. Ha permitido comprender los fundamentos de las enfermedades, especialmente en el campo de la genética, constituyéndose en la principal herramienta de análisis de datos masivos que puede ser aplicada en la clínica.10 Una de las tecnologías más utilizadas en la actualidad es la secuenciación de próxima generación (NGS). Por medio de esta técnica contribuyen a la consejería genética.
El tratamiento para la ECE consiste en el empleo de glucocorticoides que limitan el aumento de la formación ósea, al disminuir la masa ósea mediante la apoptosis de osteoblastos, proliferación de osteoclastos y disminución de la absorción de calcio. Otros medicamentos son bifosfonatos y antiinflamatorios no esteroideos.11
Los diagnósticos diferenciales de la ECE son displasia craneodiafisaria, síndrome de Kenny-Caffey, enfermedad de Paget juvenil, displasia hematodiafisaria de Ghosal, osteoesclerosis autosómica dominante de tipo Worth, esclerosteosis y la hiperostosis cortical.
Este estudio tiene como objetivo describir clínica y molecularmente una lactante colombiana con ECE; buscando contribuir al reconocimiento temprano, entendimiento y diagnóstico de esta condición.
Presentación del caso
Lactante femenino de 22 meses, producto del primer embarazo de padres no consanguíneos sin historia familiar de enfermedades. Nació por parto vaginal, a las 32 semanas de gestación, con requerimiento de oxígeno por mascarilla y con múltiples hospitalizaciones por traqueítis. Al mes de vida se le realiza gastrostomía y a los dos meses traqueostomía por disposición de distractores faciales, lo cual estaba asociado a debilidad en extremidades, contractura muscular, dificultad y alteración en la marcha, coxa valga, genu valgo y pies planos; por lo que se sospechó de displasia ósea. Por ecocardiograma, no se detectó cardiopatía congénita. Mientras que radiológicamente se confirma deformidad en pie equino varo bilateral y luxación congénita de cadera izquierda (Figura 1).
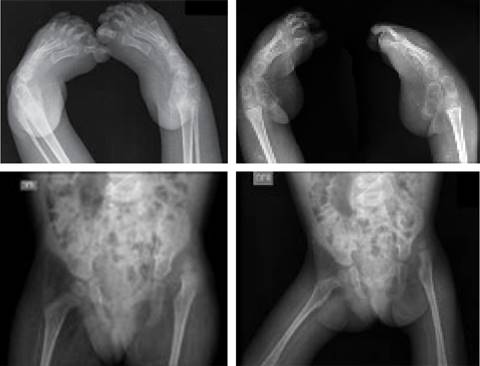
Figura 1: Informe radiológico que confirma deformidad en pie equino varo bilateral y luxación congénita de cadera izquierda.
Se realizó secuenciación de exoma completo, utilizando la tecnología Illumina a partir de sangre venosa, todas las regiones seleccionadas tienen una profundidad mayor o igual a 32.2 x y un umbral de confianza mínimo de mapeo de Q30 con una lectura total de 27,320,632 bibliotecas Nexteratm Illumina. Las lecturas se alinearon con la secuencia de referencia (GRCh37) y se realizó llamado de variantes.
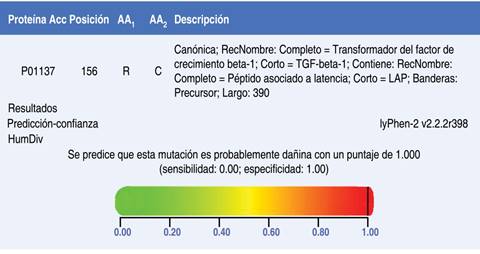
Análisis in silico: para analizar las variantes reportadas se utilizaron diferentes tipos de software: Mutation Taster (http://www.mutationtaster.org/), PROVEAN (http://provean.jcvi.org/index.php), el predictor UMD (http://umd-predictor.eu/), POLYPHEN (http://genetics.bwh.harvard.edu/pph2/) y Clinvar (https://www.ncbi.nlm.nih.gov/clinvar/).
Resultados
El análisis de secuencia del gen del factor de crecimiento transformante β1 (TGFB1) reveló una mutación missense (c.466C>T; p.Arg156Cys), que consiste en una transición de citosina a timina en la posición 466, la cual modifica en la proteína el aminoácido, arginina por cisteína en la posición 156. Con los software de predicción, se estableció un significado clínico patogénico de la variante identificada (Figura 2).
Discusión
El gen TFGB1 se localiza en el brazo largo del cromosoma 19 (19q13.2), codifica la proteína TFGB1, la cual desencadena señales que regulan diversas actividades celulares, incluyendo el crecimiento y proliferación, diferenciación, motilidad y la apoptosis celular. Se encuentra en todo el organismo, pero es particularmente abundante en el esqueleto, donde ayuda a la formación, crecimiento de hueso y cartílago. También está involucrada en la formación de vasos sanguíneos, desarrollo de tejido muscular, grasa corporal, la cicatrización de heridas, los procesos inflamatorios y la prevención de crecimiento tumoral. Las mutaciones en el gen TFGB1 dan lugar a una ganancia de función de TGFB1. Esta actividad anormal en la proteína provoca un aumento en la transducción de la señal, lo que da lugar a una mayor formación ósea.
Anteriormente, el diagnóstico del síndrome de ECE se basaba principalmente en sus manifestaciones clínicas y en las alteraciones radiográficas.12 Sin embargo, se requiere la confirmación molecular.13
Se ha descrito que los individuos gravemente afectados muestran un fenotipo caracterizado por macrocráneo con frente prominente, exoftalmia, extremidades delgadas con huesos gruesos y masa muscular escasa. Suelen presentar un aspecto grácil, hábito marfanoide, marcha anadeante con ampliación de la base de sustentación, disminución de la fuerza con reflejos osteotendinosos exaltados, piernas arqueadas, pies planos y valgos, lordosis lumbar y escoliosis.2,3
En los sujetos con ECE es importante la prevención de complicaciones secundarias, por lo tanto, su detección temprana es fundamental. En estudios a largo plazo se han observado anemia, hepatoesplenomegalia, compresión de pares craneales.2
La mutación missense (c.466C>T; p.Arg156Cys) encontrada en la paciente del presente reporte, es la misma mutación del estudio de Collet y cols. y en la familia marroquí, mencionados anteriormente. Ésta es una forma atípica de la ECE, se caracteriza por signos radiológicos leves limitados a la tibia (Tabla 1).











 nueva página del texto (beta)
nueva página del texto (beta)