INTRODUCCIÓN
El hemangiopericitoma (HPC) fue descrito por primera vez en 1942 por Arthur P. Stout y Margaret R. Murray como un tumor de tejidos blandos, presumiblemente de origen pericítico, con una población monomórfica de células compactas poligonales o fusiformes y un patrón vascular del estroma ramificado con forma de “asta de ciervo”, es un tumor raro que varía en cuanto a su malignidad y su pronóstico es reservado.
Según la clasificación de tumores del sistema nervioso central de la Organización Mundial de la Salud (OMS) 2016, estas lesiones pueden clasificar- se según la hipercelularidad, necrosis y presencia de mitosis en grado I, considerados tumores benignos y con <1 mitosis en 10 campos a seco fuerte, grado II con 2 a 3 mitosis en 10 campos a seco fuerte o grado III (anaplásico) con 4 o más mitosis en 10 campos a seco fuerte1, los tumores de grados II y III son considerados malignos y a mayor grado histológico, mayor tasa de recurrencia y de realizar metástasis fuera del sistema nervioso central (SNC), típicamente al hígado, pulmones y hueso2 (presentes en el 20% de los casos).
La edad de mayor incidencia de estos tumores es en la cuarta década de vida, la localización más frecuente en el SNC es supratentorial (90%) y solo 10% ocurren en la médula espinal.
Clínicamente, la sintomatología es variable dependiendo de la localización y el tamaño del tumor. Los síntomas más frecuentes son: convulsiones, cefalea, déficit neurológico focal y síntomas relacionados con el aumento de la presión intracraneal.
El acercamiento diagnóstico inicial es la tomografía computarizada que aporta datos de sospecha, sin embargo, la resonancia magnética constituye el pilar diagnóstico, ya que aporta datos importantes que se vuelven más significativos con el uso de secuencias funcionales como la tractografía, ésta última genera información con relación en los trac- tos cerebrales, con lo que se observa la afección de algún tipo en el trayecto de los mismos3.
CASO CLÍNICO
Hombre de 24 años con carga genética para diabetes mellitus por parte de los padres. Niega antecedentes personales patológicos de importancia.
Inició su padecimiento actual 2 semanas previas a su ingreso con cuadro caracterizado por monoparesia de miembro pélvico izquierdo, la cual progresó a debilidad del miembro torácico izquierdo acompañado de parálisis facial ipsilateral, además de hipoestesia braquiocrural del mismo lado.
Posteriormente presentó cefalea holocraneana de moderada a severa intensidad de tipo opresivo, 7/10 en escala de escala visual analógica (EVA) que cedía parcialmente con la administración de analgésicos, la cual se acompañaba algunas veces de náusea y vómito.
Fue valorado por el servicio de neurocirugía, quienes en la exploración neurológica encontraron funciones mentales conservadas, con disminución marcada de la fuerza muscular del hemicuerpo izquierdo, por lo que se solicitó tomografía de cráneo como abordaje diagnóstico inicial (figura 1).
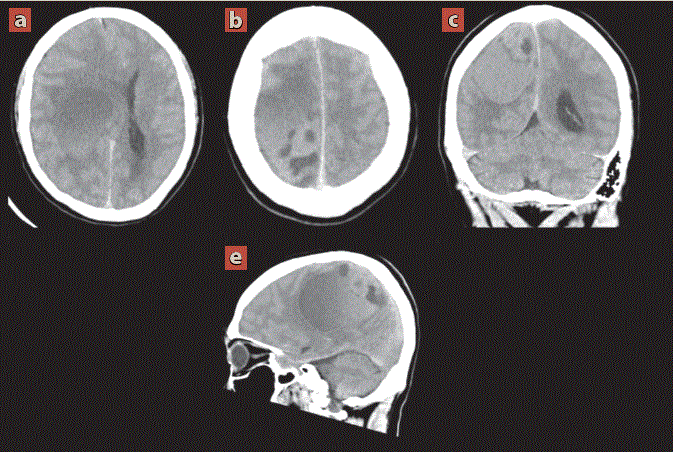
Imagen: Díaz Escareño et al.
Cortes axiales (a, b) con reconstrucciones multiplanares coronal (c) y sagital (d). Se aprecia lesión aparentemente extraaxial frontoparietal derecha, ovalada, heterogénea de predominio hipodenso (20 UH) al parenquima cerebral con dimensiones de 87 x 62 x 50 mm en sus eje longitudinal, anteroposterior y transverso respectivamente, que condiciona efecto de masa sobre el cuerpo calloso, núcleos de la base y talamo ipsilateral con desplazamiento de la línea media de hasta 20 mm.
Figura 1 Tomografía computarizada de cráneo simple
Ante los hallazgos se realizó resonancia magnética (figura 2) como complementación diagnóstica y para planeación quirúrgica, con secuencia adicional de tractografía (figura 3).
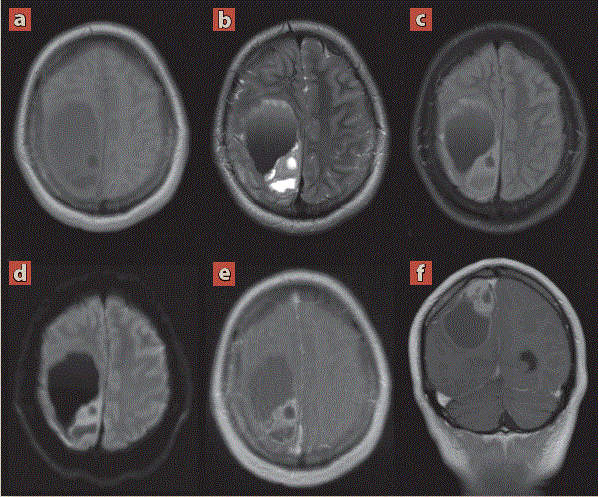
Imagen: Díaz Escareño et al.
Cortes transversales ponderados en T1 (a), T2 (b), FLAIR (c), difusión (d), T1 + Contraste (e) y T1 + Contraste en reconstrucción coronal (f). Muestran lesión supratentorial aparentemente extraaxial de localización frontoparietal derecha, amorfa, con medidas de 85 x 66.9 x 47.4 mm en sus ejes longitudinal, anteroposterior y transverso respectivamente, la cual es de comportamiento heterogéneo con áreas solido quísticas, con niveles liquido-liquido asociado a áreas de hemorragia predominantemente hipointensa en T1 e hiperintensa en T2/FLAIR, en difusión muestra áreas de restricción de localización periférica y tras la administración del medio de contraste muestra reforzamiento periférico y de la porción sólida. Se asocia efecto de masa sobre el lóbulo frontal, ganglios basales y tálamo ipsilaterales con desviación de la línea media hacia contralateral de hasta 20 mm y herniación transtentorial descendente (desplazamiento de las estructuras mediales del lóbulo temporal a través del borde libre de la tienda del cerebelo).
Figura 2 Resonancia magnética de encéfalo convencional
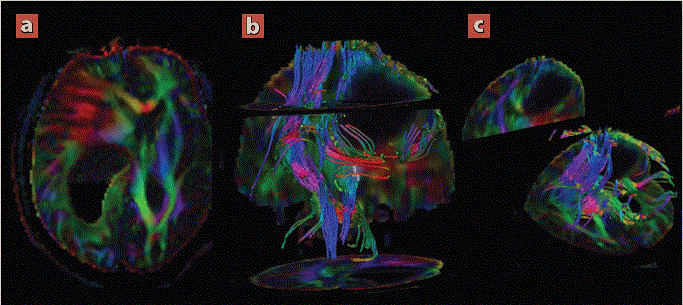
Imagen: Díaz Escareño et al.
En corte transversal (a) y reconstrucciones volumétricas coronal (b) y sagital (c). Se observa un compromiso de tipo II y tipo III; desplazamiento e interrupción de los tractos.
Figura 3 Resonancia magnética de encéfalo con tractografía
Se decidió tratamiento quirúrgico con resección completa extensa y se envió pieza quirúrgica al servicio de anatomía patológica con el resultado final de hemangiopericitoma maligno (figura 4).
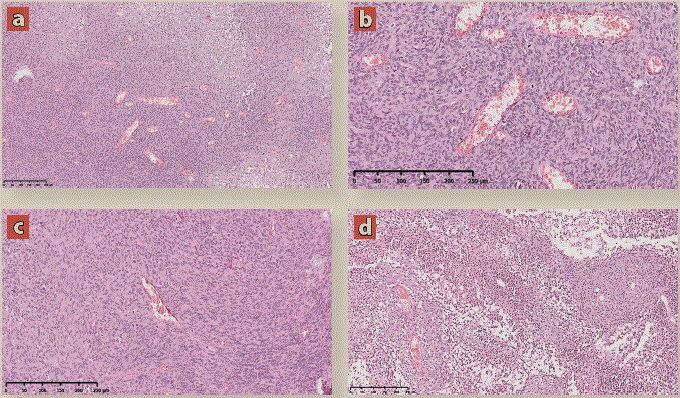
Imagen: Díaz Escareño et al.
(a) Microfotografía HE 10X. Neoplasia hipercelular, con patrón vascular acentuado en “astas de ciervo”. (b) microfotografía HE 40X. Neoplasia mesenquimatosa muy vascularizada, con células de núcleos ovalados y citoplasma amplio eosinófilo, mal delimitado, dispuestas en pequeños haces que se entrelazan entre si. (c) microfotografía HE 20X. Vaso característico con forma de “asta de ciervo”, hipercelular y con abundantes mitosis atípicas. (d) Microfotografía HE 10X. La neoplasia muestra áreas hipocelulares y zonas de necrosis.
Figura 4 Imágenes de patología
Con evolución favorable del cuadro, fue egresado a su domicilio con orden de seguimiento y tratamiento con radioterapia adyuvante.
Se realizó resonancia magnética de control postquirúrgico temprano (figura 5) 24 horas posteriores a la cirugía, en la cual se observaron algunos cambios esperados por el procedimiento quirúrgico, sin evidencia de remanente tumoral.
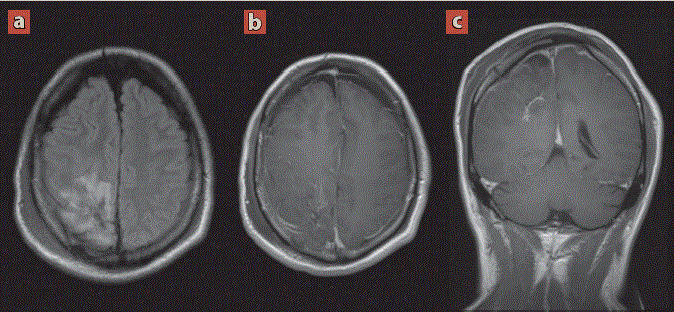
Imagen: Díaz Escareño et al.
Cortes transversales T2 (a), T1 + Contraste (b) y T1 + Contraste en reconstrucción coronal (c). Se observan cambios quirúrgicos por craneotomia parietal derecha. Se identifica hematoma subgaleal en tejidos blandos adyacentes a sitio de la incisión. En lecho quirúrgico de identifica área de edema asociada a imágenes amorfas de comportamiento heterogéneo de predominio isointenso en T1, hipointenso en T2/FLAIR en relación con zonas discretas de hemorragia, tras la administración de medio de contraste presenta un realce dural reactivo, sin evidencia de tumoración residual. Adicionalmente se observa neumoencefalo como cambio postquirúrgico inicial.
Figura 5 Resonancia magnética de encéfalo de control postquirúrgico
DISCUSIÓN
Los tumores del sistema nervioso central representan 2% de todas las neoplasias. Constituyen un grupo heterogéneo de neoplasias que incluye desde lesiones bien diferenciadas y benignas, hasta lesiones altamente invasivas y poco diferenciadas4.
Los hemangiopericitomas corresponden a <1% de los tumores primarios del sistema nervioso central, son tumores hipervasculares, infrecuentes que se derivan de las células fusiformes perivasculares llamadas pericitos de Zimmermann.
Fue reconocido como un tumor mesenquimatoso de base dural en 1993. En el año 2007 la OMS consideraba el hemangiopericitoma y el tumor fibroso solitario como entidades diferentes, se demostró que ambos comparten una inversión en 12q13 que fusiona los genes NAB2 y STAT6, causando una expresión nuclear de SAT 6, que puede ser detectada por inmunohistoquimica, por lo que en el año 2016 la OMS los agrupó como hemangiopericitoma/tumor fibroso solitario5.
Las hemangiopericitomas comparten similitudes clínicas y radiológicas con los meningiomas y es el estudio histopatológico (morfológico e inmunohistoquimico) el que los diferencia definitivamente.
Macroscópicamente los hemangiopericitomas son tumores sólidos, de consistencia firme, elástica y de apariencia lobulada, al corte es grisáceo y de aspecto carnoso y francamente hemorrágico. Histológicamente se caracterizan por una combinación de áreas hipercelulares con áreas hipocelulares, separadas por haces densos de colágena con cambios de hialinización, las células neoplásicas tienen núcleos redondos, ovalados o fusiformes, con cromatina fina granular y ocasionalmente nucléolos pequeños visibles con escaso citoplasma eosinófilo, el número de mitosis y presencia de necrosis es variable dependiendo del grado histológico, el estroma muestra variable cantidad de vasos de pared delgada con forma de “astas de ciervo”, ocasionalmente se puede ver invasión a parénquima cerebral no neoplásico. El índice de proliferación celular (Ki67) es variable, con un promedio para los tumores benignos del 5%.
Con el uso de inmunohistoquímica, estos tu- mores típicamente tienen una reacción positiva con la vimentina (95-100%), CD34 (33-100%), Bcl-2 (85%) y CD99 (95%); son positivos focalmente con desmina, actina de musculo liso, EMA, citoqueratina y claudina, los tumores malignos pierden la expresión para CD34 o muestran solo positividad focal13. Los tumores son negativos para la proteína S100 y CD31. La combinación de estos anticuerpos tiene alta sensibilidad, pero poca especificidad, ya que comparten el patrón con varios tumores de tejido liso6,7.
Estas neoplasias ocurren más comúnmente en tejidos blandos y representa menos del 0.4% de todos los tumores del SNC. Su localización más común es supratentorial hacia la convexidad y parasagital y ocurren preferentemente en varones (1.4/1) y en edades comprendidas entre 38 y 42 años8.
Los síntomas ocasionados por un tumor primario del sistema nervioso central se dividen en 2 grandes grupos: síntomas focales y síntomas generalizados. Los síntomas más frecuentes en la presentación de un tumor de rápido crecimiento como son los tumores malignos o poco diferenciados, son cefalea, náusea o vómito, así como crisis convulsivas.
El abordaje diagnóstico, después de una sospecha clínica requiere evaluación forzosa por un estudio de imagen. Los estudios de neuroimagen proporcionan información importante; inicialmente se pueden aportar datos que reducen las posibilidades diagnósticas y señalan hacia una etiología probable, aunque finalmente el diagnóstico definitivo lo da el estudio histopatológico. Otro tópico importante en relación con los estudios de imagen, es la utilidad para la planeación quirúrgica.
La tomografía computarizada es útil como abordaje diagnóstico inicial; generalmente se identifica la lesión, su localización, su morfología y es de especial ayuda en situaciones de infiltración ósea, cuando se necesita de urgencia la obtención de la imagen o cuando el paciente tiene contraindicación para la resonancia magnética.
La resonancia magnética se compone de distintas secuencias que proporcionan información capaz de reducir las opciones diagnósticas, siendo el estudio de elección para un tumor del sistema nervioso central.
Presentan un comportamiento similar a los meningiomas, casi siempre son solitarios y están unidas a una base dural3,9.
En contraposición a los meningiomas, los HPC presentan erosión del hueso adyacente y generalmente sin calcificaciones; en cambio, el meningioma provoca hiperostosis en el hueso y se acompaña en mayor medida de calcificaciones.
Típicamente son isointensas a la sustancia gris en secuencias ponderadas en T1/T2 y puede haber vacíos de señal, debido a su naturaleza vascular, mejoran con avidez, aunque a veces de forma heterogénea con el medio de contraste. Cuando se ve una base estrecha en la duramadre “acumulación en hongos”, con bordes irregulares y lobulados favorece más el diagnostico a HPC sobre el de meningioma10.
La espectroscopia se ha vuelto muy útil en los últimos años ya que permite mejorar la diferenciación de tumores infiltrantes mediante el análisis de la composición química de alguna parte del tumor; el N-acetilaspartato (NAA) es un marcador de la integridad celular neuronal por lo que se encuentra disminuido en los tumores de alto grado de malignidad; la colina, que es un componente de las membranas celulares, aumenta y el lactato se eleva cuando existe necrosis. Específicamente en el HPC la espectroscopia denota un aumento del metabolito mionisitol en el HPC10,11.
La tractografía que utiliza el mismo principio de la imagen por difusión, permite distinguir la relación espacial entre el límite del tumor y la sustancia blanca a través de la visualización de las fibras. Es una secuencia muy útil para la planeación preoperatoria con el fin de evitar comprometer el tejido funcional y los tractos nerviosos.
La relación entre los tractos y tumores se clasifica en 3 tipos: tipo I o desplazamiento simple, tipo II desplazamiento con interrupción y tipo III interrupción simple; de modo que la tractografía permitió la visualización exacta de los tumores relevantes para tractos elocuentes, siendo beneficiosa en la planeación neuroquirúrgica y evaluación postoperatoria12.
En cuanto al pronóstico, se sabe que el comportamiento de este tipo de tumores es tradicionalmente benigno, siempre que se pueda lograr una resección total y no existan características histológicas atípicas; aunque la importancia pronóstica de la atipia focal versus la atipia generalizada, al igual que el compromiso de los senos óseos y durales, no es completamente clara.
Se ha observado que, incluso después de la re-sección total macroscópica, los tumores con el fenotipo del hemangiopericitoma tienen una alta tasa de recurrencia mayor de 75% en pacientes seguidos durante más de 10 años; además, el 20% de los pacientes desarrollan metástasis extracraneales, especialmente en los huesos, los pulmones y el hígado13.
El tratamiento para el hemangiopericitoma maligno es la resección tumoral total, la cuál afecta favorablemente la recurrencia y supervivencia; siendo la embolización preoperatoria útil para evitar hemorragia durante el acto quirúrgico. También se ha recomendado la radioterapia adyuvante para reducir la incidencia de recurrencia14.











 nueva página del texto (beta)
nueva página del texto (beta)



