Antecedentes
La enfermedad renal crónica (ERC) constituye un desafío de salud pública, con incremento significativo en las últimas dos décadas.1 La estimación precisa de la prevalencia de ERC es complicada debido a que la detección de la enfermedad radica en la alteración de biomarcadores que no se determinan de forma universal en la población y cuya interpretación con frecuencia es errónea por los profesionales de la salud.2 Con base en censos estadounidenses, como la Encuesta Nacional de Examen de Salud y Nutrición,3 se estima que 7 % de la población tiene una tasa de filtración glomerular menor a 60 mL/minuto/1.73 m2 y que el riesgo de desarrollar ERC es superior a 50 %.4 La diabetes y la hipertensión son las causas más frecuentes de ERC,5 sin embargo, la relación entre ERC e hipertensión es compleja, dado que la hipertensión puede ser una consecuencia de la ERC,6 lo que imposibilita determinar cuál de las dos condiciones ocurrió primero. En algunas regiones, la causa de la ERC permanece desconocida y se ha asociado a la actividad agrícola.7 Por otro lado, existen enfermedades hereditarias que producen ERC en jóvenes, pero su estudio es limitado.
La detección temprana de ERC, diabetes e hipertensión es crucial, ya que el tratamiento temprano mejora los desenlaces cardiovasculares y ralentiza la progresión de la enfermedad.8 Sin embargo, incluso en países desarrollados, menos de 10 % de las personas con ERC en etapas tempranas tiene conocimiento de ello, lo que dificulta el inicio del tratamiento oportuno.9
La falta de registros nacionales dificulta estimar la carga de ERC. En un estudio en México se encontró que entre 1998 y 2014, 4.8 % de las muertes estaban relacionadas con ERC, la mayoría se atribuía a nefropatía diabética (47.9 %).10 Según el estudio Global Burden of Disease (GBD),11 en 2019 aproximadamente 10 % de los adultos en el mundo padecía ERC, por la cual ocurrieron 1.4 millones de muertes y se perdieron 41.5 millones de años de vida saludable.12 En México, la ERC representa un desafío significativo, aunque no existe un registro específico. Según datos del GBD, la prevalencia de ERC en México se estimó en 13.8 % en 2019, con lo que constituyó la tercera causa de muerte.12 Sin embargo, no disponemos de datos actuales sobre la carga de la ERC. La publicación de los datos del GBD en 2021 brinda una oportunidad única para actualizar la información sobre la ERC en México, especialmente en el contexto de la pandemia de COVID-19.13
El presente análisis tuvo como objetivo resumir los hallazgos del GBD 2021 sobre la epidemiología de la ERC en México y los estados del país, así como las causas por grupo de edad y sexo entre 1990 y 2021, información que puede orientar la formulación de políticas públicas para la detección temprana, asignación de recursos y tratamiento oportuno que permita reducir la frecuencia, prevalencia y letalidad de la ERC.
Material y métodos
Los métodos aplicados para estimar la carga de la ERC en el GBD han sido publicados con anterioridad.14 GBD realiza una evaluación sistemática y comparativa de 371 enfermedades y lesiones, 288 causas de muerte y 88 factores de riesgo por grupo de edad y sexo para 204 países y territorios desde 1990 hasta 2021.15 Además, utiliza diversos métodos para estimar la carga de ERC en términos de mortalidad, incidencia, prevalencia, años perdidos por muerte prematura (APMP), años vividos con discapacidad (AVD) y años de vida saludables perdidos. El presente, se enfoca principalmente en mortalidad por ERC, prevalencia, AVD y APMP.
Para la estimación de la mortalidad por ERC en México, se utilizaron los datos de defunciones publicados por el Instituto Nacional de Estadística y Geografía (INEGI) durante el período de 1980 a 2019.16 Los datos de mortalidad se codificaron de acuerdo con la Novena y Décima Revisión de la Clasificación Internacional de Enfermedades (CIE).17 Las muertes registradas con códigos inespecíficos o imprecisos se corrigieron mediante algoritmos para reasignarlas a causas más específicas y útiles para el estudio.18-20 La ERC se definió como una tasa de filtración glomerular estimada (TFGe) < 60 mL/minuto/1.73m2, una relación de albúmina/creatinina > 30 mg/g o ambas. Adicionalmente, la ERC se clasificó de acuerdo con cinco causas: diabetes tipo 1, diabetes tipo 2, glomerulonefritis, hipertensión y causas no especificadas.
Los resultados se presentan en tasas de mortalidad (por cada 100 000 habitantes) y prevalencia para todas las edades y ajustadas por edad, las cuales se calcularon con la población estándar mundial del GBD,20 cuyas estimaciones y métodos están disponibles públicamente en el sitio web del Instituto para la Métrica y Evaluación de la Salud, así como en las herramientas de visualización GBD Compare 2021.21 GBD cumple con la Declaración de Directrices para la Presentación de Estimaciones de Salud Precisas y Transparentes (GATHER, por sus siglas en inglés).12 Por último, realizamos análisis de correlación entre las tasas de mortalidad cruda por estado y el indicador de proporción de pobreza según CONEVAL 2022.22
Resultados
De acuerdo con estimaciones del GBD, la prevalencia de ERC en México para todas las edades y ambos sexos en 2021 fue de 9184.9 por 100 000 habitantes (intervalo de incertidumbre de 95 % [II 95 %] = 8588.29-9668.62). El estado con mayor prevalencia fue la Ciudad de México, con 10 902 casos (II 95 % = 10 153-11 577) por 100 000 habitantes en todas las edades, mientras que Quintana Roo mostró la menor prevalencia, 7341 (II 95 % = 6840-7812) por 100 000 (Figura S1A del Material Suplementario). Los diagnósticos más frecuentemente registrados como origen de ERC fue “otras causas” y “causas no especificadas”, mientras que un gran número de casos se clasificaron como ERC debido a diabetes (Figura S1B del Material Suplementario). En cuanto al sexo, la prevalencia en mujeres fue de 8936.13 casos (II 95 % = 8339.51-9442.09) por 100 000, la cual resultó ser 5 % menor que la prevalencia en hombres.
En 2021, la ERC ocasionó 69 052 muertes (II 95 % = 60 412-77 991) en todos los grupos de edad en el país. La tasa de mortalidad nacional por ERC se situó en 53.41 (II 95 % = 46.73-60.33) por 100 000 personas de todas las edades. Además, se observó que la mortalidad por ERC en hombres fue 6 % mayor que en mujeres, resultando en 54.96 muertes (II 95 %= 46.92-64.93) por 100 000 en todas las edades. La ERC fue la quinta causa de muerte en el país, después de cardiopatía isquémica, diabetes, COVID-19 y complicaciones asociadas a COVID-19. En el mundo, México ocupó el lugar 17 en mortalidad ajustada por edad y el puesto 11 en todos los grupos de edad debido a ERC (Figura 1). De las 25 localidades en el mundo con mayor mortalidad por ERC, nueve son estados de la República Mexicana (Figura 2). La tasa de mortalidad en todas las edades por ERC presentó un incremento continuo desde 1995 hasta 2015. En 2019, se observó por primera vez una disminución en la tasa de mortalidad (49.09 por 100 000, II 95 % = 47.64-50.08); sin embargo, en 2021 se incrementó nuevamente y alcanzó una mortalidad de 53.41 por 100 000 (II 95 % = 46.73-53.41), como se aprecia en la Figura 3A. La misma tendencia se observó en los APMP, la cual alcanzó 1385.09 por 100 000 habitantes (II 95 % = 1186.43-1596.03) en 2021 (Figura 3B). En el período de 1990 a 2021, se observó un incremento de aproximadamente tres veces en la tasa de mortalidad y APMP. En cambio, los AVD secundarios a ERC fueron considerablemente menores, con una tasa de 140.63 (II 95 % = 100.70-182.14), la cual se incrementó 1.8 veces de 1990 a 2021 (Figura 3B).
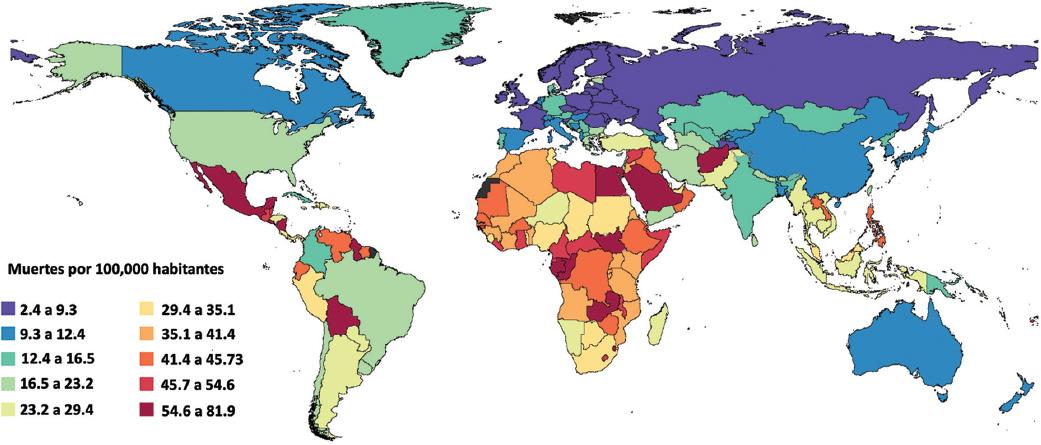
Figura 1 Mapa de calor de la tasa de mortalidad secundaria a enfermedad renal crónica en todas las edades y ambos sexos. Panorama mundial.
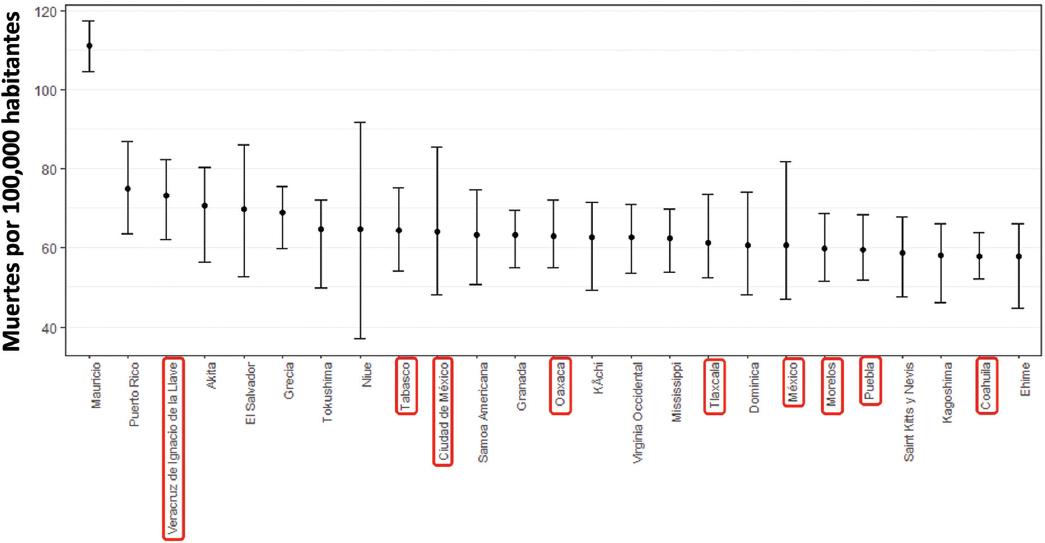
Figura 2 Primeras 25 localidades en el mundo con mayor tasa de mortalidad por enfermedad renal crónica de acuerdo con el GBD 2021. Se presenta la tasa de mortalidad por 100 000 con su intervalo de incertidumbre de 95 % para cada localidad.
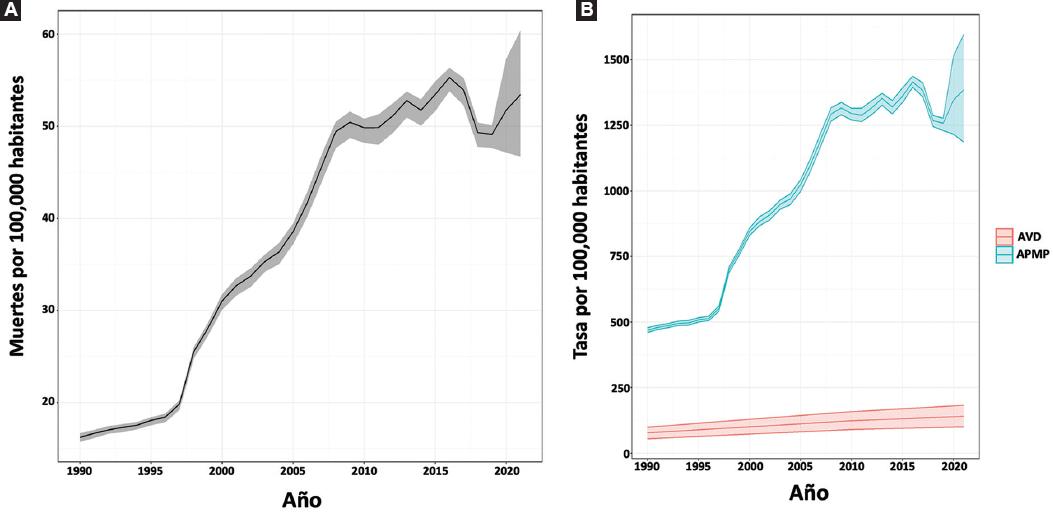
Figura 3 A: tasa de mortalidad en México por enfermedad renal crónica de 1990 a 2021 con intervalo de incertidumbre de 95 %. B: tasa de años perdidos por muerte prematura (APMP) y años vividos con discapacidad (AVD) por enfermedad renal crónica en México de 1990 a 2021 con intervalo de incertidumbre de 95 %.
Los cinco estados de la república con mayor tasa de mortalidad en todas las edades por ERC fueron Veracruz (73.14 por 100 000, II 95 % = 62.03-82.38), Tabasco (64.35 por 100 000, II 95 % = 54.01-75.21), Ciudad de México (64.12 por 100 000, II 95 % = 48.20-85.40), Oaxaca (62.90 por 100 000, II 95 % = 54.99-72.21) y Tlaxcala (61.20 por 100 000, II 95 % = 52.42-73.38). Aquellos con la menor tasa de mortalidad por ERC fueron Quintana Roo (30.31 por 100 000, II 95 % = 26.10-35.18), Baja California Sur (31.21 por 100 000, II 95 % = 26.34-35.28), Sinaloa (37.23 por 100 000, II 95 % = 32.51-41.98), Sonora (39.55 por 100 000, II 95 % = 34.16-44.29) y Baja California (40.18 por 100 000, II 95 % = 34.59-47.25), como se aprecia en la Figura 4A. Se observó una correlación moderada entre la tasa de mortalidad por ERC por estado y el porcentaje de la población que se encuentra en situación de pobreza (R = 0.46, IC 95 % = 0.13-0.69, p = 0.009). En cuanto a las causas de ERC a nivel nacional en todas las edades, la tasa de mortalidad por ERC secundaria a glomerulonefritis fue la más alta (13.19 muertes por 100 000, II 95 % = 9.85-16.52), seguida de diabetes tipo 2 (12.78 muertes por 100 000, II 95 % = 9.80-15.67) y ERC de etiología no especificada (12.52 muertes por 100 000, II 95 % = 9.81-15.44); en tanto, la tasa de mortalidad secundaria a ERC por diabetes tipo 1 fue la menor (3.15 muertes por 100 000, II 95 % = 2.23-4.42). Esta misma relación se observó en la tasa de APMP (Figura 4B).
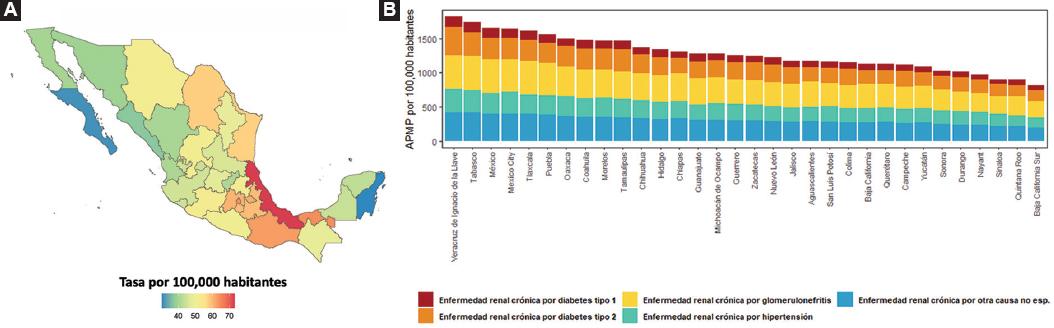
Figura 4 A: mapa de calor de mortalidad por enfermedad renal crónica con su intervalo de incertidumbre de 95 % en 2021 en los diferentes estados de la República Mexicana en todas las edades y ambos sexos. B: gráfica de barras de mortalidad por enfermedad renal crónica en 2021 en los diferentes estados de la República Mexicana en todas las edades y ambos sexos además de las causas de enfermedad renal crónica.
Discusión
Presentamos datos que indican una gran carga de ERC en México, con una tasa de mortalidad que la ubica en el décimo segundo lugar del mundo. En particular, el estado de Veracruz se encuentra en el cuarto lugar de mortalidad por ERC en el mundo. La carga de ERC se ha incrementado considerablemente desde 1990 y aunque en 2019 se registró una disminución en la mortalidad, en 2021 presentó un aumento importante. La pandemia de COVID-19 probablemente influyó, ya que la infección por SARS-CoV-2 acelera la progresión de ERC23 y los pacientes con ERC son más susceptibles a la infección y a mortalidad por COVID-19.24 Antes de 2021, la ERC ocupaba el tercer lugar en mortalidad en el país, pero en ese año fue desplazada al quinto lugar debido a COVID-19 y sus desenlaces asociados.
La ERC presenta elevada carga nacional, sesgada hacia la mortalidad y la pérdida prematura de años de vida, pero con poca contribución a la discapacidad, lo que refleja la historia natural de la enfermedad, la cual es poco reconocida en etapas tempranas tanto por los pacientes como por el personal médico.9 En Estocolmo, Suecia, solo 12 % de los pacientes con ERC tiene diagnóstico en su historial clínico y solo 23 % es referido al nefrólogo.25 La supervivencia de los pacientes con ERC avanzada que requieren terapia sustitutiva renal, como diálisis peritoneal o hemodiálisis, es considerablemente corta.26 En México, el acceso limitado a la terapia sustitutiva renal parece influir en la alta mortalidad por ERC,27 especialmente en estados con mayor pobreza, debido a los costos elevados de ese tratamiento.
La detección temprana de ERC se dificulta aún más ya que depende de biomarcadores imperfectos. La creatinina sérica es el marcador más ampliamente utilizado para estimar la tasa de filtrado glomerular.28 Sin embargo, este biomarcador puede presentar variabilidad debido a otros factores como la masa muscular, la dieta, el uso de medicamentos y la coexistencia de otras enfermedades crónicas como cáncer, cirrosis o falla cardiaca.29-32 Por su parte, el biomarcador cistatina C también cuenta con determinantes no dependientes del filtrado glomerular, como el índice de masa corporal y la inflamación.33,34 Por esa razón, la ERC se suele diagnosticar hasta que se presenta en etapas avanzadas. Lo anterior es desafortunado, ya que existe evidencia de que el tratamiento de la obesidad35,36 y la diabetes,37 y el uso de medicamentos que modifican la hemodinámica intraglomerular38,39 pueden retrasar la progresión de la ERC por más de 15 años.40
Destaca que la primera causa de muerte por ERC es la glomerulonefritis y la segunda es la ERC de etiología no determinada. Sin embargo, son más numerosos los pacientes con diabetes tipo 2 que mueren por ERC. La razón más probable de esta discrepancia es que cuando alguien muere de glomerulonefritis o de ERC de causa desconocida, en el certificado de defunción se asienta la propia ERC, pero cuando la muerte por ERC ocurre en pacientes con diabetes, la diabetes misma y la enfermedad cardiovascular que la acompaña son anotadas en el certificado de defunción antes que la ERC.
Los resultados establecen que existen numerosos pacientes con ERC en quienes la causa no se encuentra definida, lo cual representa una gran oportunidad para el establecimiento de políticas públicas encaminadas a mejorar la codificación del diagnóstico de base y aumentar el acceso a pruebas diagnósticas. En México, se conocen al menos dos regiones endémicas de ERC de etiología desconocida. Reportes iniciales provenientes del Instituto Nacional de Cardiología “Ignacio Chávez” describieron más de 50 pacientes referidos a esa institución por enfermedad renal de origen desconocido con características muy similares: hombres jóvenes, trabajadores agrícolas sin factores de riesgo tradicionales para ERC, provenientes de Tierra Blanca, Veracruz.41 Posteriormente, se investigó la prevalencia de ERC en esa región mediante cuantificación de creatinina y proteinuria. Se encontró que en personas menores de 60 años, la prevalencia de ERC probable fue de 25 %, del cual 44 % se clasificó como ERC de etiología desconocida.41 Es posible que la prevalencia en esta región esté sobrestimada al tratarse de un estudio que definió la ERC con una sola estimación de TFGe y de proteinuria.
En la presente investigación, se observó una gran carga de enfermedad en trabajadores agrícolas, en quienes uno de cada 11 presentaron una tasa de filtrado glomerular < 60 mL/min/1.73 m2. Aproximadamente, 25 % de los pacientes en la lista de espera de trasplante renal de Veracruz provenía de la región de Tierra Blanca, lo cual es sorprendente, dado que Tierra Blanca representa solo 1.3 % de la población del Estado.42 Otra región donde se han encontrado numerosos casos de ERC de etiología desconocida es Aguascalientes. Desde 2012, en ese estado se estableció un registro estatal de ERC que incluye información de biopsias renales.43 Este registro reporta una prevalencia muy elevada de pacientes con terapia sustitutiva renal (1997 por millón de habitantes). De estos, la mayoría se debe a ERC de etiología desconocida (54 %), seguida de ERC secundaria a diabetes tipo 2 (24.2 %).44
Aunque algunos factores ambientales pudieran explicar la gran cantidad de casos de ERC de etiología desconocida a nivel nacional, es posible que en algunos el origen sea genético. Recientemente, mediante estudios de secuenciación completa de exomas se ha identificado que 17 % de los pacientes con diagnóstico clínico de ERC de etiología desconocida tiene en realidad una enfermedad genética previamente no identificada.45 Esta información cobrará relevancia en el futuro próximo, ya que el advenimiento de tratamientos dirigidos a enfermedades renales genéticas específicas es prometedor.46,47
Conclusiones
México presenta una gran carga de ERC que continúa en ascenso, que coincide con el incremento de la prevalencia de diabetes, hipertensión y obesidad,48,49 las cuales constituyen a su vez los factores de riesgo más comunes de ERC. Las políticas públicas deben encaminarse a redoblar esfuerzos para lograr el control metabólico y la detección oportuna de ERC que permitan iniciar tratamientos tempranos. La creación de registros estatales que ha permitido identificar poblaciones con alta incidencia de ERC de etiología desconocida debe ser emulada en el ámbito nacional para favorecer el entendimiento de los factores ambientales y así establecer medidas de prevención. Además, con el advenimiento de tratamientos dirigidos a enfermedades genéticas específicas, el país deberá comenzar a invertir en herramientas de diagnóstico genético de ERC.
Dada la predominancia de mortalidad y APMP como carga de ERC en México, el acceso universal a la terapia de reemplazo renal es la intervención que tendría el mayor impacto para reducir dicha carga dada su clara asociación con la supervivencia del paciente con ERC en etapas avanzadas.











 nueva página del texto (beta)
nueva página del texto (beta)


