Servicios Personalizados
Revista
Articulo
Indicadores
 Citado por SciELO
Citado por SciELO Accesos
Accesos
Links relacionados
 Similares en SciELO
Similares en SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.42 no.4 Ciudad de México oct./dic. 2011
Artículo de revisión
Etiología, patogénesis, diagnóstico y tratamiento de osteocondrosis (OC)
Etiology, pathogenesis, diagnosis and treatment of osteochondrosis (OC)
Gustavo Hernández Vidal* Francisco A. Mora Valdez** Luis E. Rodríguez Tovar* Rafael Ramírez Romero*
* Cuerpo Académico de Patobiología. Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León, calle Francisco Villa s/n Ex–Hacienda El Canadá, Escobedo, Nuevo León, 66050, México.
** Hospital Veterinario La Silla, Antiguo Camino al Diente núm. 3333, La Estanzuela, Monterrey, Nuevo León, 64988, México. Tel.: (81) 81550140.
Responsable de correspondencia:
Gustavo Hernández Vidal.
Tel.: (81) 13404393.
Correo electrónico: ghernandez@fmvz.uanl.mx.
Recibido el 18 de diciembre de 2010.
Aceptado el 28 de julio de 2011.
Abstract
Osteochondrosis (OC) is a term used to describe a wide range of different skeletal lesions between different species. Osteochondrosis is a problem that affects fast growing animals and it has been defined as a failure in the endochondral ossification of the articular–epiphyseal cartilage. This failure leads to cartilage thickening and retention, basal necrosis, subchondral bone damage and loose bone fragments in the articular joint. Osteochondrosis is a multifactorial disease in which nutritional, hereditary, endocrine factors, biomechanical influences, and failures of blood supply to growth cartilage play an important role. The aim of this review is to offer an updated approach to the knowledge of the mechanisms that intervene in the pathogenesis of osteochondrosis, as well as alternatives to its diagnosis and treatment.
Key words: horse, osteochondrosis, OC, dyschondroplasia, etiology, pathogenesis.
Resumen
El término osteocondrosis (OC) se refiere a una gran variedad de lesiones esqueléticas en diferentes especies. La osteocondrosis es un problema que afecta a los animales de rápido crecimiento y se ha definido como una falla en la osificación endocondral del cartílago articular epifiseal. Dicha falla provoca un engrosamiento y retención del cartílago, necrosis basal, daño al hueso subcondral y desprendimiento de fragmentos óseos en la cavidad articular. La osteocondrosis es una enfermedad de etiología multifactorial donde factores nutricionales, hereditarios, biomecánicos, endocrinos, así como la falla en el aporte sanguíneo del cartílago en crecimiento juegan un papel importante. La finalidad de esta revisión es ofrecer un acercamiento al conocimiento de los mecanismos que intervienen en la patogénesis de la osteocondrosis, así como a las alternativas para su diagnóstico y tratamiento.
Palabras clave: caballo, osteocondrosis, OC, discondroplasia, etiología, patogénesis.
Introducción
La osteocondrosis (OC) es una patología común del cartílago en desarrollo tanto en humanos como en los animales domésticos.1 Este padecimiento se ha registrado en diversas especies domésticas, como cerdos,2 perros,3 vacas,4 gatos,5 ratas6 y caballos.7 La OC se ha determinado como la principal causa de debilidad esquelética de las extremidades en cerdos8 y de claudicación en caballos jóvenes de alto rendimiento.7 Al nacer el potro, sólo parte de su esqueleto está osificado; durante el desarrollo fetal temprano, el esqueleto primario está formado por estructuras cartilaginosas que se osifican a partir de los centros de osificación, los cuales se localizan en la parte central de la diáfisis de los huesos largos (centro de osificación primario) y en la epífisis (centro de osificación secundario) (Figura 1).
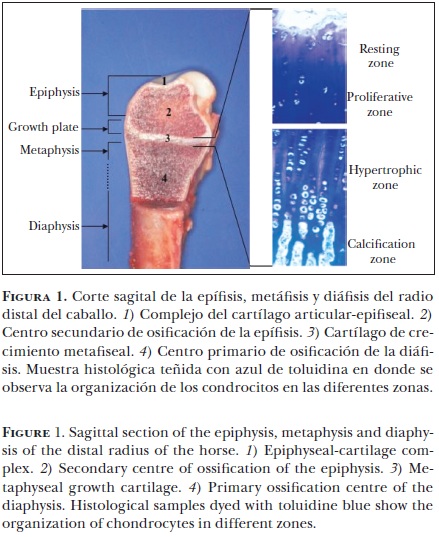
El proceso de osificación en el caballo es más eficiente que en otras especies. En el potro, al nacer existe una cantidad considerable de cartílago en la zona de transición llamada fisis, situada entre la diáfisis y epífisis así como en el complejo del cartílago articularepifiseal; estas áreas son las encargadas del crecimiento. La fisis o placa de crecimiento es responsable del desarrollo longitudinal de los huesos largos. El cartílago epifiseal debajo de la superficie del cartílago articular, permite el aumento del tamaño de la articulación mediante el proceso de formación cartilaginosa y subsiguiente osificación.7
El proceso de osificación endocondral es muy activo durante la etapa temprana de vida del animal; esta actividad disminuye gradualmente durante el desarrollo y se detiene cuando se osifican las placas fisiarias y termina el crecimiento. Esto ocurre generalmente en la fisis proximal del hueso del húmero y el fémur, los cuales se cierran en el potro entre los 24 y 26 meses de edad.
La etiología de la OC ha sido investigada ampliamente; sin embargo, dichos esfuerzos han sido obstaculizados por la confusión en cuanto a la definición de la enfermedad y a la falta de entendimiento de su patogénesis, especialmente, en cuanto a la formación de las lesiones iniciales. Ello se debe a que la mayoría de los investigadores han enfocado sus estudios en la etapa crónica o proceso degenerativo secundario, más que en el proceso inicial.9 Esta etapa crónica de la enfermedad es radiográficamente visible y causa signos clínicos.
Se han realizado estudios orientados en la caracterización bioquímica y molecular del tejido afectado en las lesiones de osteocondrosis.10–14 Se han tomado muestras de tejido lesionado y comparado con tejido de apariencia normal obtenido del mismo sitio. La finalidad de estos estudios ha sido proveer un mejor entendimiento de la patogénesis de la enfermedad; sin embargo, estas lesiones visibles son crónicas por definición y el tejido obtenido representa la última fase del proceso de la enfermedad. Los resultados de estos estudios deben ser analizados cuidadosamente, ya que es probable que se obtenga evidencia de una sobrerregulación de factores proinflamatorios, catabólicos y anabólicos que reflejen el proceso de degradación del cartílago necrótico y la formación del tejido de reparación.9
Definición de la osteocondrosis (OC)
Köning15 fue el primero en emplear el término osteocondritis disecante (OCD) para describir las condiciones patológicas del cartílago epifiseal, las cuales producían fragmentos osteocondrales en la articulación de humanos jóvenes, sin una artritis o un trauma de consideración. Anteriormente, las hipótesis más aceptadas en cuanto al origen de estos fragmentos incluían el trauma, la proliferación de tejido periarticular y la necrosis espontánea localizada en el cartílago articular.16 El término osteocondritis disecante (OCD) es considerado por muchos como común, pero inapropiado, 17 prefiriéndose el término de osteocondrosis (OC),18 debido a que la inflamación no es el elemento principal de la lesión inicial.
La osteocondrosis se ha definido como una condición idiopática, caracterizada por una disrupción en la osificación endocondral,19,20 que provoca: engrosamiento y retención del cartílago, necrosis de las capas basales del cartílago articular retenido, defectos en hueso subcondral y fractura subcondral y producción de fragmentos óseos, que conducen a defectos biomecánicos.
El término osteocondrosis fue empleado para describir la lesión conocida inicialmente como artrosis crónica deformante, asociada a la debilidad de la pierna en cerdos.21 Grøndalen22 aplicó este término al disturbio local, no inflamatorio, del proceso de osificación endocondral de las placas epifisiarias sin lesión superficial en cartílago articular. Sin embargo, fue Reiland23 quien estableció que la OC es una enfermedad caracterizada por un daño en la osificación endocondral, lo cual fue aceptado ampliamente y aplicado a las lesiones del cartílago articular epifiseal y cartílago de crecimiento fiseal en muchas especies.
El término OC fue descrito por primera vez en el caballo por Nilsson en 1947;24 sin embargo, llegó a ser de interés clínico hasta los años setenta. En el caballo, el término osteocondritis disecante (OCD) se emplea cuando existe un fragmento libre en la articulación y, osteocondrosis (OC), cuando aún no hay presencia de los fragmentos.
La osteocondrosis es una condición hueso–cartílago, que afecta al cartílago en desarrollo (endocondral) y al proceso de osificación endocondral. Dicha condición puede presentarse en muchos sitios en el mismo individuo y producir lesiones bilateralmente simétricas.
Proceso de osificación endocondral
En los extremos de los huesos largos se encuentran dos áreas de cartílago especializado, las cuales juegan un papel importante durante el periodo de crecimiento y desarrollo esquelético del animal. La osificación endocondral se desarrolla en las placas de crecimiento y en el cartílago epifiseal. La placa de crecimiento, responsable del desarrollo longitudinal, se encuentra a ambos lados del centro primario de osificación (Figura 1). El cartílago epifiseal, responsable de darle forma a los extremos de los huesos largos, está ubicado entre el centro secundario de osificación y el cartílago articular (complejo del cartílago articular–epifiseal) (Figura 2). En ambas áreas el cartílago disminuye, dando paso a la formación de hueso mediante la proliferación celular, la síntesis de la matriz extracelular, la hipertrofia celular, la invasión vascular y la mineralización de la matriz.25 En el caballo, durante el proceso de desarrollo, la osificación endocondral es mayor en el cartílago articular epifiseal, donde hay una disminución considerable del volumen del cartílago.26
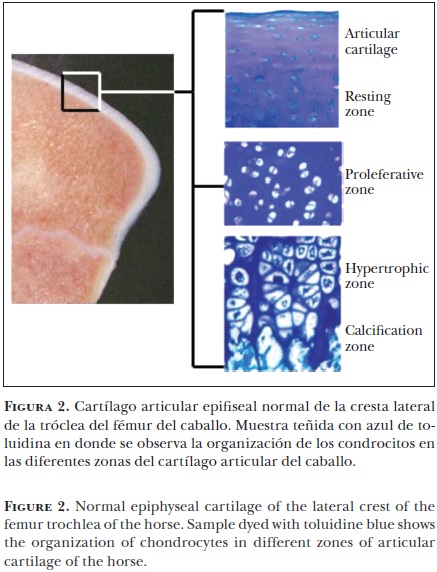
Es complicado controlar el proceso de osificiación endocondral, ya que involucra una gran variedad de factores endógenos y sistémicos, estimulantes de la diferenciación y proliferación condrocítica. Histológicamente, los condrocitos se encuentran organizados en cuatro zonas diferentes, tanto en el cartílago de crecimiento epifiseal como en el fiseal (Figura 1 y 2). En el cartílago fiseal la zona distal a la metáfisis se conoce como zona de reposo; junto a ésta se ubica la zona proliferativa, donde los condroblastos se dividen. Estas células pasan a la zona hipertrófica, donde se organizan en columnas perpendiculares a la superficie articular (Figura 1). Durante esta etapa, los condrocitos se encuentran rodeados por una gran cantidad de matriz extracelular, cuya función es promover la conversión del cartílago a hueso mediante los osteoblastos. Las columnas de condrocitos son invadidas por vasos sanguíneos metafiseales y el hueso se forma en las columnas del cartílago calcificado, dando como resultado una mezcla de cartílago calcificado y hueso inmaduro, que es remodelado gradualmente para producir el hueso maduro de la metáfisis.27 En el cartílago de crecimiento epifiseal el proceso se lleva a cabo del centro a la periferia de condrocitos (Figura 2).
Los condrocitos hipertróficos producen el factor de crecimiento del endotelio vascular (FCEV), el cual es necesario para el desarrollo vascular en la placa de crecimiento.28 La invasión del cartílago por vasos sanguíneos es esencial para la osificación endocondral, ya que una disrupción genética o biomecánica de la angiogénesis produce un engrosamiento de la placa de crecimiento epifiseal.29,30
La velocidad a la que la diferenciación celular y el crecimiento progresa y el tiempo en el que el proceso termina, son afectados por factores genéticos, hormonales, nutricionales, metabólicos y mecánicos. Estudios de la mecanobiología del cartílago mediante modelos computacionales,31,32 han demostrado que el crecimiento y osificación del cartílago es acelerado por la tensión, e inhibido por la presión hidrostática.
La proliferación de los condrocitos en la placa de crecimiento es regulada por la síntesis de tres moléculas señal: 1) La proteína relacionada con la parathormona (PTHrP), la cual facilita la proliferación continua de condrocitos en la placa de crecimiento e inhibe su hipertrofia,33 manteniendo un área de células proliferativas y evitando una diferenciación prematura.34 2) La proteína del gen del erizo indio (IHH), es una molécula producida y secretada por los condrocitos hipertróficos, la cual emite señales para mantener la expresión de PTHrP al final del desarrollo óseo.35 3) El factor transformador de crecimiento beta (TGF–beta), es producido por células pericondrales en respuesta al IHH y actúa tanto en éstas como en las células periarticulares, aumentando la síntesis de PTHrP.36 El TGFbeta puede actuar directamente en condrocitos para inhibir la hipertrofia. Aunque estas moléculas parecen ser el regulador primario de la proliferación celular en la placa de crecimiento, no se descarta que esta red reguladora sea modulada por otras moléculas señal.36–38
Se ha sugerido como causa patológica en el proceso de osificación endocondral, transtornos moleculares tales como: disfunción endocrina,39 alteraciones vasculares,40–42 defectos en el proceso de maduración de condrocitos,43 alteraciones en las moléculas de la matriz44–46 y alteración en la función de enzimas implicadas en la transición de la matriz del cartílago en matriz ósea.47–50
Mecanismo patológico
Histológicamente, la matriz del cartílago de crecimiento epifiseal difiere de la matriz del cartílago articular, debido a la presencia de vasos del plexo pericondral que invaden al cartílago de crecimiento formando canales51 (Figura 3). La función de los canales no es clara, pero se cree que participan en la nutrición de los condrocitos, en la formación y mantenimiento de los centros de osificación secundaria52 y en el abastecimiento tanto al hueso como al cartílago de células madres mesenquimales.53 El cartílago articular maduro carece del suministro de sangre y los canales fetales desaparecen durante el proceso de osificación. En el caballo se ha informado que los canales desaparecen alrededor de los siete meses de edad.54

Estudios moleculares de la osteocondrosis indican un aumento en la degradación del colágeno55 y en la actividad de algunas metaloproteinasas y enzimas proteolíticas. Se han identificado diferencias en la distribución de las catepsinas B, D56–58 y L59 e incremento en su expresión50 y en la actividad enzimática60 de la catepsina B, en condrocitos de animales con OC.
Es difícil el estudio de la osteocondrosis por su carácter dinámico en animales jóvenes y por la gran variedad de factores etiológicos involucrados. La OC en el caballo se observa frecuentemente en las articulaciones tarsocrurales y femoropatelares, pero también es común en las articulaciones metacarpofalángicas y metatarsofalángicas.
Estudios radiológicos han demostrado que las lesiones pueden ser recurrentes en potros. En la articulación tarsocrural los defectos son visibles durante el primer mes de edad y estos pueden desaparecer a los cinco meses. En la articulación femoropatelar no se observan alteraciones durante los primeros meses de vida; éstas se hacen evidentes a los tres meses y aumentan su frecuencia a los seis meses.61 Estas observaciones indican que en presencia de la enfermedad intervienen dos procesos: el etiológico, que induce a la formación de la lesión; y el proceso de reparación, el cual es incompleto. Después de cierto tiempo, y dependiendo del tipo de articulación, las lesiones que aún existan persistirán, causando eventualmente el desarrollo de manifestaciones clínicas. Dicho desarrollo de las lesiones se presenta cuando éstas son lo suficientemente grandes para no corregirse con el tiempo. Los análisis bioquímicos han demostrado un proceso de reparación anabólico similar en el cartílago articular de caballos con OC por causas naturales, y el de una fractura osteocondral experimental.9
Manifestación de osteocondrosis
Los cambios en el cartílago en desarrollo incluyen una lesión focal durante el proceso de osificación endocondral; es decir, un área del cartílago del crecimiento no experimenta la calcificación de la matriz extracelular e invasión vascular y, por tanto, no se convierte en hueso.62 Esto ocurre frecuentemente junto a la superficie de la articulación en el cartílago epifiseal produciendo un engrosamiento o retención del cartílago acompañada por una unión osteocondral irregular (Figura 4).
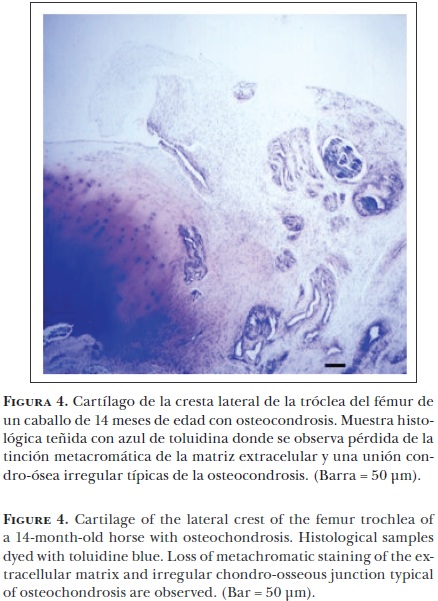
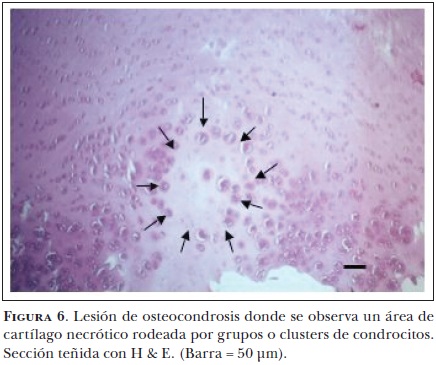
Histológicamente, las lesiones osteocondróticas tempranas se caracterizan por una falla en el proceso de maduración de los condrocitos a células hipertróficas43 y por una baja o nula calcificación de la matriz extracelular. Además, se encuentran áreas de condronecrosis adyacentes a los vasos sanguíneos.63 Ytrehus et al.64 clasificaron como osteocondrosis latens al área de necrosis focal presente sólo en el cartílago epifiseal y como osteocondrosis menifesta a la falla focal de la osificación endocondral visible radiográficamente. El estrés físico puede causar una fisura en el cartílago necrótico y su extensión a través del cartílago articular puede producir el desprendimiento de fragmentos cartilaginosos en la cavidad articular. A este proceso se le conoce como osteocondrosis dissecans, el cual causa generalmente dolor y claudicación en el caballo (Figura 5).
La falla en la osificación endocondral en el complejo del cartílago articular epifiseal es el resultado de la necrosis cartilaginosa65 (Figura 6), mientras que en la placa fiseal se debe a la persistencia y alteración de los condrocitos hipertróficos.66 La región de la placa fiseal cercana a la epífisis, recibe suministro sanguíneo de la médula ósea a través de los vasos que contienen los canales que atraviesan el cartílago. Es en la placa fiseal en donde se manejan dos teorías vasculares, las cuales explican cómo se forma la lesión en esta región. Una establece que en la placa fiseal se presenta una interrupción localizada del suministro de sangre por los canales cartilaginosos, provocando una necrosis isquémica. Conforme el hueso crece en dirección epifiseal, la línea de osificación alcanza al cartílago anormal, el cual resiste la invasión de los vasos sanguíneos, evitando la osificación normal del cartílago. Algunos estudios histológicos sugieren que la oclusión de los canales cartilaginosos epifiseales ocasiona la formación de cartílago anormal e impide la invasión de los vasos metafiseales.67

Por otro lado los micro traumas de los vasos sanguíneos metafiseales pueden provocar una interrupción focal del aporte sanguíneo de la línea de osificación, impidiendo la osificación normal del cartílago viable ocasionando la permanencia del cartílago fiseal engrosado. Esta teoría se basa en diversos estudios en aves,68 conejos69 y cerdos.70
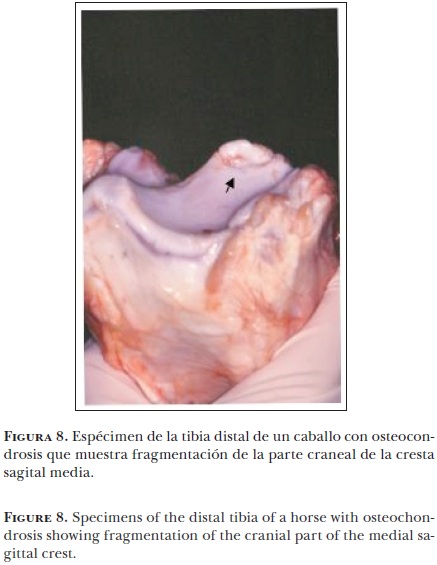
En caballos jóvenes la osteocondrosis es causa frecuente de claudicación;7 su presencia se ha observado en casi todas las articulaciones sinoviales, incluyendo las articulaciones de las facetas intervertebrales, lo cual se ha relacionado con la espondilomielopatía cervical (Síndrome de Wobbler).71 La gran mayoría de las investigaciones se han enfocado a los aspectos del diagnóstico clínico y tratamiento de la osteocondrosis. No hay mucho adelanto en los aspectos de prevención y tratamiento porque no se ha identificado la patogénesis de la lesión en su fase temprana.72 Es bien aceptado que la lesión inicial ocurre en la zona proliferativa o hipertrófica del cartílago articular epifiseal, por lo que el término "osteocondrosis" no está bien empleado para estas lesiones; el término apropiado sería "discondroplasia". Desafortunadamente los términos osteocondrosis y osteocondritis disecante han sido usados indiscriminadamente para referirse a la gran variedad de lesiones esqueléticas en caballos jóvenes y en algunas instancias en caballos adultos, sin diferenciar en su etiología, patogénesis y características clínicas.73 En el caballo, las lesiones clasificadas como osteocondrosis se presentan en la región posterior de la superficie proximal de la articulación humeral, en la parte medial del cóndilo del húmero y en la cresta troclear lateral del fémur (Figura 7), en el cóndilo medial del fémur, en la cresta sagital media de la tibia distal (Figura 8), en la cresta troclear lateral del astrágalo y en la parte dorsal del metacarpo y metatarso distal.7,73

En contraste, en el cerdo los sitios de predilección de la osteoncondrosis articular incluyen la parte media y cresta sagital del cóndilo distal del húmero, el cóndilo medial del fémur, la región semilunar del cúbito y la fisis distal cubital.74 Las lesiones frecuentemente ocurren en ambos miembros en forma simétrica y se pueden presentar en diversas regiones anatómicas en un mismo animal. Las características anatómicas parecen ser importantes en la etiología de la osteocondrosis; sin embargo, debido a los cambios que ocurren durante la evolución de la enfermedad, es difícil determinar la predisposición anatómica.
Etiología
La etiología de la osteocondrosis no se ha definido exactamente. Se cree que se debe a un problema multifactorial62,75causado por el grado de crecimiento, nutrición, predisposición genética, fallas endocrinas, factores biomecánicos72 y defectos en el flujo vascular epifiseal del cartílago.
Grado de crecimiento
La osteocondrosis se ha identificado no sólo en animales de talla grande, sino también en animales de rápido crecimiento. En algunas especies se han hecho investigaciones donde se ha demostrado una correlación positiva entre el rápido crecimiento y la prevalencia de osteocondrosis.76 Por ejemplo, estudios en perros han revelado que el rápido crecimiento aumenta la incidencia de enfermedades esqueléticas incluyendo la osteocondrosis.77
En el caballo, los patrones del promedio de ganancia diaria (PGD) comprenden cuatro fases del crecimiento: 1) del nacimiento a un mes de edad; 2) de 1 a 12 meses; 3) de 12 a 15 meses y, 4) de 15 a 20 meses. Otros estudios han demostrado que los potros de talla grande entre 6 a 16 meses de edad y con mayor promedio de ganancia diaria son más propensos a la osteocondrosis.78 Las dietas altas en energía aumentan la insulina y disminuyen la tiroxina circulantes, produciendo una falla en la maduración e hipertrofia de los condrocitos.79 De acuerdo con esta hipótesis, los condrocitos afectados por el aumento de insulina y disminución de los niveles de tiroxina permanecen como cartílago indiferenciado. Subsecuentemente, este carsistílago indiferenciado retenido se necrosa debido a factores biomecánicos.79 La morfología de la lesión inicial de la osteocondrosis articular, caracterizada por áreas de condrocitos necróticos en el cartílago epifiseal, refuta esta teoría.65 La formación de núcleos de cartílago retenido causada por la resistencia del cartílago necrótico al proceso de mineralización y vascularización.
Predisposición genética
Sin duda, los factores genéticos juegan un papel importante en la presencia de la osteocondrosis en diversas especies. Las diferencias en la prevalencia de osteocondrosis entre diferentes razas de cerdos,76,80 perros81 y caballos82 demuestran que existe el factor hereditario. Muchos investigadores sugieren que dicho factor está asociado con la predisposición al aumento del grado de crecimiento. Ytrehus et al.64 determinaron que los factores hereditarios tienen efectos considerables en la prevalencia, severidad y localización de la osteocondrosis, sin encontrar una correlación entre el rápido crecimiento y las lesiones de OC.
El grado de crecimiento es determinado tanto por factores nutricionales como genéticos y la respuesta hormonal a dietas altas en energía puede también estar influida genéticamente. La conformación anatómica se ha sugerido como un factor hereditario tanto en cerdos83 como en perros.84 Estudios genéticos en el caballo85 y el perro86 indican que la osteocondrosis es hereditaria con características poligenéticas.
La mayoría de las investigaciones se han enfocado a la fase crónica de la enfermedad. Existe evidencia contundente que señala la herencia como una etiología importante en la osteocondrosis; sin embargo, su estudio es complicado debido al carácter subclínico de la enfermedad durante su fase inicial (osteocondrosis latens).
Factores biomecánicos
Los factores biomecánicos juegan un papel relevante en la patogénesis de la osteocondrosis. El trauma ha sido propuesto como uno de los causantes de osteocondrosis en diversas especies.1,62 Los sitios de predilección tienden a estar en áreas de estrés biomecánico. En el humano, el aumento de la actividad atlética aumenta la severidad y prevalencia de lesiones osteocondrales.1 Estudios experimentales en cerdos registran un aumento en la frecuencia de osteocondrosis dissecans debido al trauma.87 Una de las teorías más aceptables en cuanto a la conversión de las lesiones subclínicas de osteocondrosis manifesta a osteocondrosis dissecans, es la presencia del trauma. De hecho, el inicio de los signos clínicos en la mayoría de los casos de osteocondrosis es acelerado por la presencia de un trauma menor, el cual no causaría la enfermedad en una articulación normal. Además, la influencia biomecánica es la única explicación al hecho de que existen sitios de predilección bien definidos en las articulaciones afectadas. Por ejemplo, dentro de las articulaciones frecuentemente afectadas en el caballo destacan: la tibiotarsal (cresta sagital media de la tibia distal, cresta tróclear lateral del astrágalo y maléolo medio de la tibia), la femorotibiopatelar (cresta tróclear lateral del fémur) y la metacarpo–falángica (aspecto dorsoproximal de la cresta sagital del tercer metacarpiano).
Los efectos del ejercicio siempre han sido objeto de controversia en relación con la presencia y severidad de las lesiones producidas por la osteocondrosis. Algunos investigadores lograron demostrar que el ejercicio reducía notablemente la prevalencia de osteocondrosis en el caballo y favorecía la regeneración del tejido.88 El estrés mecánico es un regulador importante del metabolismo condrocítico. Estudios de pruebas de impacto en cartílago articular realizadas por el grupo de la presente revisión, demostraron que la matriz reacciona produciendo cambios fisicoquímicos que influyen en la actividad de los condrocitos.
Nutrición
Los factores nutricionales y su relación con la osteocondrosis se han investigado ampliamente. Existen varios aspectos nutricionales que deben considerarse. El desequilibrio en la suplementación de calciofósforo, deficiencia de vitaminas A, C y D, y, deficiencia de biotina entre otros, han sido propuestos como factores etiológicos de osteocondrosis en algunas especies.74 Como ya se mencionó, la osteocondrosis es una enfermedad que afecta a los animales de rápido crecimiento.89,90 Estudios en perros con dietas altas en calcio mostraron un retraso focal en el proceso de la osificación endocondral.91
La osteocondrosis articular se ha atribuido a la deficiencia de cobre en muchas especies, como el venado, 92,93 el bisonte94 y el caballo.95–97 Las lesiones en bisontes y caballos con deficiencia de cobre se caracterizan por micro fracturas del hueso subcondral, pobre formación de la esponjosa primaria y, adelgazamiento y erosión del cartílago articular.94,96 Las lesiones son causadas principalmente por la deficiencia de cobre o la exposición a factores que inhiben su absorción o metabolismo.93 Mediante dietas bajas en cobre, se produjeron experimentalmente lesiones de osteocondrosis en potros.98 En estudios dosis–respuesta se ha registrado una disminución en lesiones de osteocondrosis en potros alimentados con niveles altos de cobre.96,97 Pearce et al.99 demostraron que la suplementación con cobre en yeguas en su última etapa de gestación, disminuye la incidencia de osteocondrosis en los potros. Van Weeren et al.100 encontraron que las lesiones de osteocondrosis eran significativamente menores en número y severidad en potros con un nivel alto de cobre al nacer. Entre otros minerales, el calcio ha demostrado tener poco o nulo efecto en la incidencia de osteocondrosis. Los niveles de fósforo hasta cuatro veces lo recomendado por el NRC, producen un aumento en el número de lesiones.101
La velocidad de crecimiento está fuertemente relacionada con el consumo de energía en el caballo. Savage et al.102 mostraron que animales alimentados con dietas altas en aceite y carbohidratos presentaban más lesiones de osteocondrosis que los alimentados con niveles convencionales. Esto indica que dietas con un alto contenido energético causan predisposición a la osteocondrosis39 y, que la alimentación excesiva en los potros destinados a la venta, es probablemente dañina para el desarrollo esquelético y puede producir problemas clínicos. Se piensa que el efecto de las dietas altas en energía en la producción de osteocondrosis, se debe a la hipersinsulinemia pospandrial estimulada por una ración con alto contenido de carbohidratos fácilmente digestibles. También se ha observado que la alimentación alta en energía y en carbohidratos digestibles tiene una importante influencia en el metabolismo y en la función de la insulina como factor de crecimiento (IGF–1 y 2) en el proceso de osificación endocondral.103
Diagnóstico
El diagnóstico clínico se basa en los signos que presenta el animal. El examen radiológico ha sido el método más empleado para la confirmación del diagnóstico; sin embargo, durante la fase temprana, la osteocondrosis no produce daño óseo subcondral significativo que pueda ser visualizado radiográficamente. Otros métodos incluyen el análisis del líquido sinovial, el uso de la ecografía, la gamagrafía, la tomografía computarizada, la resonancia magnética104 y otros procedimientos invasivos como la artroscopia. 105 Recientemente se han establecido métodos no invasivos, como el análisis de biomarcadores para el estudio de los problemas degenerativos de la articulación.
Biomarcadores de los cambios metabólicos de la articulación
Se han llevado a cabo investigaciones para identificar las moléculas que pueden servir como marcadores de irregularidades metabólicas tempranas en OC en el caballo.106 Las concentraciones de estos marcadores se pueden determinar en la sangre, orina y líquido sinovial. Los biomarcadores durante la síntesis y degradación del hueso pueden ser de importancia para determinar la fase evolutiva de la enfermedad ósea, pronosticar posibles fracturas y observar los cambios del hueso durante el proceso degenerativo de la articulación.107
La proteína diferente a la colágena sintetizada por los osteoblastos (osteocalcina) es un biomarcador del proceso de mineralización y formación ósea.106 Los niveles séricos de la osteocalcina han mostrado una correlación significativa con la severidad de la osteocondrosis en potros durante el primer año. Mediciones de estos niveles durante las primeras semanas de vida podrían anticipar el riesgo del desarrollo de OC.108 Las metaloproteinasas (MMP) son consideradas biomarcadores de la remodelación fisiológica y patológica de la matriz extracelular del cartílago articular.109 Se registraron altos niveles en la actividad de MMP–1 en líquido sinovial fetal normal, obtenido de la articulación metacarpofalángica. Después del nacimiento, estos niveles disminuyen con el desarrollo del potro, coincidiendocon el fin del crecimiento y la remodelación del tejido en el animal adulto. Elevados niveles en la actividad de MMP–1 en articulaciones con osteoartritis reflejan la degradación de la matriz y, por ello, el uso de este biomarcador en el estudio diagnóstico y terapéutico de enfermedades articulares degenerativas.109
La fosfatasa alcalina específica del hueso es un biomarcador de formación ósea.110 Este biomarcador se ha encontrado en concentraciones altas en el líquido sinovial de caballos con osteoartritis111 y osteocondrosis. 112 La correlación positiva entre los niveles de esta glicoproteína en el líquido sinovial y el daño en el cartílago articular, validan su uso como biomarcador en la predicción del daño osteocondral.
Un elemento importante del cartílago articular es el colágeno de tipo II, del cual se ha observado un aumento en su degradación en osteoartritis.113 En caballos con OC, se han encontrado altos niveles de fragmentos degradados del colágeno tipo II (C2C) en líquido sinovial.114 Ello indica que el análisis de C2C en líquido sinovial es importante para evaluar lesiones articulares. El carboxipropéptido del colágeno tipo II (CPII) es un marcador de la síntesis del colágeno tipo II.106 En potros de un año de edad con OC se han registrado altos niveles en suero del CPII. Se considera que el CPII es un indicador constante en potros que tengan o desarrollen OC.1115El CS–846 es un epítope del sulfato de condroitina, el cual se encuentra normalmente en el cartílago fetal y osteoartrítico.107 Los anticuerpos monoclonales permiten identificar en el cartílago, epítopes de la región del agrecán, ricos en sulfato de condroitina, lo cual permite diferenciar los cambios en los niveles de expresión sinoviales y urinarios del epítope CS–846, entre animales sanos y aquéllos que presentan alguna alteración en la articulación, como la presencia de fragmentos osteocondrales.116 De igual forma, mediante el uso del anticuerpo monoclonal (12C4) contra la proteína oligomérica de la matriz del cartílago (COMP), se registraron elevados niveles séricos de COMP en caballos con osteoartritis y osteocondrosis.117
Estos estudios muestran que el análisis de los biomarcadores puede ayudar a la detección temprana, evaluación de la severidad y prevención de los problemas metabólicos de la articulación.
Signos clínicos
Los signos clínicos de la osteocondrosis no son fáciles de identificar debido a la gran variedad de lesiones y sitios afectados. Además, la discondroplasia no siempre desarrolla una osteocondrosis y produce signos clínicos. Los signos clínicos pueden comenzar con una claudicación moderada, pero si existe un trauma biomecánico, la articulación afectada presenta dolor, claudicación marcada y pérdida de la funcionalidad.
El origen del dolor en la osteocondrosis es una incógnita, ya que los caballos pueden presentar severos cambios patológicos sin mostrar mucho dolor o estrés. El signo más común de la osteocondrosis en caballos es la distensión de la articulación afectada, la cual puede no presentar dolor. Una claudicación marcada no es necesariamente característica de la osteocondrosis, aunque se presenta en algunos sitios anatómicos.
Terapia y manejo
El manejo de los casos clínicos de osteocondrosis depende del sitio y de la severidad de la lesión. En caballos jóvenes (< de 12 meses) con lesiones leves, es recomendable darles descanso y moderar el ejercicio, aunque en ciertos casos el éxito es limitado.118 Los casos severos de osteocondrosis en el caballo son tratados quirúrgicamente,119 siempre tomando en cuenta la edad. La capacidad de recuperación del cartílago articular es alta en animales jóvenes y ésta disminuye rápidamente con la edad.120 Es recomendable no realizar ningún procedimiento quirúrgico en el potro antes del primer año de edad, al menos que se presenten lesiones graves y éstas provoquen problemas clínicos severos. Los casos quirúrgicos son tratados por artroscopia. Este procedimiento se ha venido utilizando exitosamente en la mayoría de las regiones anatómicas afectadas, especialmente en la articulación tarsocrural, donde el éxito del tratamiento es mayor al 80%.121 El porcentaje de éxito del tratamiento registrado para la articulación femoropatelar es de 75%122 y de 90% para la articulación metacarpo–falángica/metatarsofalángica.123
Conclusiones
En medicina veterinaria se ha establecido que la osteocondrosis es una enfermedad caracterizada por un daño en la osificación endocondral.23 Este término se ha empleado en forma general para describir una gran variedad de lesiones esqueléticas en diferentes especies, sin precisar diferencias en su etiología, patogénesis, etapas y características clínicas, por lo que es recomendable ampliar el término con los descriptores latents, manifesta y dissecans. La patogénesis de la osteocondrosis fiseal aún no se ha esclarecido, sin embargo, se han sugerido como factores desencadenantes, la fragilidad del cartílago y del hueso,96 la discondroplasia primaria20 y, la necrosis isquémica focal del cartílago de crecimiento.62
Es difícil determinar la causa específica de la osteocondrosis y su patogénesis; sin embargo, existen estudios científicos actualizados que se acercan cada vez más al esclarecimiento del problema. Es importante dirigir las futuras investigaciones al entendimiento del proceso patológico inicial, a los cambios progresivos de éste y a su etiología multifactorial.
References
1. BOHNDORF K. Osteochondritis (osteochondrosis) dissecans: a review and new MRI classification. Eur Radiol 1998; 8:103–112. [ Links ]
2. DEWEY C.Diseases of the nervous and locomotor system. In: STRAW B, D'ALLAIRE, MENGELING W, TAYLOR D, editors. Diseases of swine, 8th ed. Oxford, UK: Blackwell Science, 1999: 861–883. [ Links ]
3. MORGAN JP, WIND A, DAVIDSON AP. Introduction. In: MORGAN JP, WIND A, DAVIDSON AP, editors. Hereditary bone and joint diseases in the dog: Osteochondroses, hip dysplasia, elbow dysplasia. Hannover, Germany: Schlütersche GmbH & Co. KG Verlag, und Druckerei, 1999: 1–19. [ Links ]
4. JENSEN R, PARK RD, LAUERMAN LH, BRADDY PM, HORTON DP, FLACK DE et al. Osteochondrosis in feedlot cattle. Vet Pathol 1981; 18: 529–535. [ Links ]
5. RALPHS SC. Bilateral stifle osteochondritis dissecans in a cat. J Am Anim Hosp Assoc 2005; 41: 78–80. [ Links ]
6. KATO M, ONODERA T. Early changes of osteochondrosis in medial femoral condyles from rats. Vet Pathol 1987; 24: 80–86. [ Links ]
7. MCILWRAITH CW. Diseases of joints, tendons, ligaments, and related structures. In: STASHAK TS, editor. Adams' lameness in horses, 5th ed. Baltimore, MD: Lippincott Williams & Wilkins, 2002: 459–644. [ Links ]
8. JØRGENSEN B, ARNBJERG J, AASLYNG M. Pathological and radiological investigations on osteochondrosis in pigs, associated with leg weakness. Zentralbl Veterinärmed A 1995; 42: 489–504. [ Links ]
9. BERTONE AL, BRAMLAGE LR, MCILWRAITH CW, MALEMUD CJ. Comparison of proteoglycan and collagen in articular cartilage of horses with naturally developing osteochondrosis and healing osteochondral fragments of experimentally induced fractures. Am J Vet Res 2005; 66: 1881–1890. [ Links ]
10. KUROKI K, COOK JL, STOKER AM, TURNQUIST SE, KREEGER JM, TOMLINSON JL. Characterizing osteochondrosis in the dog: potential roles for matrix metalloproteinases and mechanical load in pathogenesis and disease progression. Osteoarthr Cartil 2005; 13: 225–234. [ Links ]
11. LAVERTY S, IONESCU M, MARCOUX M, BOURÉ L, DOIZÉ B, POOLE AR. Alterations in cartilage type–II procollagen and aggrecan contents in synovial fluid in equine osteochondrosis. J Orthop Res 2000; 18: 399– 405. [ Links ]
12. LAVERTY S, OKOUNEFF S, IONESCU M, REINER A, PIDOUX I, WEBBER C et al. Excessive degradation of type II collagen in articular cartilage in equine osteochondrosis. J Orthop Res 2002; 20: 1282–1289. [ Links ]
13. SEMEVOLOS SA, STRASSHEIM ML, HAUPT JL, NIXON AJ. Expression patterns of hedgehog signalling peptides in naturally acquired equine osteochondrosis. J Orthop Res 2005; 23: 1152–1159. [ Links ]
14. TOMLINSON JL, COOK JL, KUROKI K, KREEGER JM, ANDERSON MA. Biochemical characterization of cartilage affected by osteochondritis dissecans in the humeral head of dogs. Am J Vet Res 2001; 62: 876–881. [ Links ]
15. KÖNIG F. [Freely bodies in the joints]. Uber frei körper in den gelenken. Dtsch Z Klim Chir 1887; 27: 90–109. [ Links ]
16. NAGURA S. The so–called osteochondritis dissecans of König. Clin Orthop 1960; 18: 100–121. [ Links ]
17. BARRIE HJ. Osteochondritis dissecans 1887–1987. A centennial look at König's memorable phrase. J Bone Joint Surg Br 1987; 69: 693–695. [ Links ]
18. HOWALD H. [The knowledge of osteochondrosis dissecans] Zur kenntnis der osteochondrosis dissecans (osteochondritis dissecans). [Arch Orthop Trauma Surg] Arch Orthop Unfallchir 1942; 41: 730–788. [ Links ]
19. STRÖMBERG B. Osteochondrosis dissecans of the stifle joint in the horse. A clinical, radiographic and pathologic study. Vet Radiol Ultrasound 1976; 17: 117– 123. [ Links ]
20. OLSSON SE, REILAND S. The nature of osteochondrosis in animals. Summary and conclusions with comparative aspects on osteochondritis dissecans in man. Acta Radiol Suppl Stockh 1978; 358: 299–306. [ Links ]
21. LJUNGGREN G, REILAND S. Osteochondrosis in adolescent animals: an endocrine disorder? Calcif Tissue Res 1969; 6: 150–151. [ Links ]
22. GRONDALEN T. Ostechondrosis and artrosis in pigs. II. Incidente in breeding animals. Acta Vet Sacand 1974; 15: 26–42. [ Links ]
23. REILAND S. Osteochondrosis in the pig (Ph.D. dissertation). Stockholm, Sweden: The royal veterinary college, 1975. [ Links ]
24. NILSSON F. [Gonitis in the horse] Hästens goniter. Svensk Vetidn 1947; 52: 1–14. [ Links ]
25. LEFEBVRE V, SMITS P. Transcriptional control of chondrocytes fate and differentiation. Birth Defects. Res C Embryo Today 2005; 75: 200–212. [ Links ]
26. FIRTH EC, GREYDANUS Y. Cartilage thickness measurements in foals. Res Vet Sci 1987; 42: 35–46. [ Links ]
27. BRIGHTON CT. Structure and function of the growth plate. Clin Orthop 1978; 136: 22–32. [ Links ]
28. GERBER HP, VU TH, RYAN AM, KOWALSKI J, WERB Z, FERRARA N. VEGF couples hypertrophic cartilage remodelling, ossification and angiogenesis during endochondral bone formation. Nat Med 1999; 5: 623–628. [ Links ]
29. COLNOT C. Cellular and molecular interactions regulating skeletogenesis. J Cell Biochem 2005; 95: 688–697. [ Links ]
30. HALL AP, WESTWOOD FR, WADSWORTH PF. Review of the effects of anti–angiogenic compounds on the spiphyseal growth plate. Toxicol Pathol 2006; 34: 131–147. [ Links ]
31. CARTER DR, WONG M. Modelling cartilage mechanobiology. Philos Trans R Soc Lond B Biol Sci 2003; 358: 1461–1471. [ Links ]
32. CARTER DR, BEAUPRÉ GS, WONG M, SMITH RL, ANDRIACCHI TP, SCHURMAN DJ. The mechanobiology of articular cartilage development and degeneration. Clin Orthop Relat Res 2004; 427(Suppl): 69–77. [ Links ]
33. JUPPNER H. Role of parathyroid hormone–related peptide and Indian hedgehog in skeletal development. Pediatr Nephrol 2000; 14: 606–611. [ Links ]
34. GOLDRING MB, TSUCHIMOCHI K, IJIRI K. The control of chondrogenesis. J Cell Biochem 2006; 97: 33–44. [ Links ]
35. SHUM L, COLEMAN CM, HATAKEYAMA Y, TUAN RS. Morphogenesis and dysmorphogenesis of the appendicular skeleton. Birth Defects Res C Embryo Today 2003; 69: 102–122. [ Links ]
36. BALLOCK RT, O'KEEFE RJ. Physiology and pathophysiology of the growth plate. Birth Defects Res C Embryo Today 2003; 69: 123–143. [ Links ]
37. KRONENBERG HM. Developmental regulation of the growth plate. Nature 2003; 423: 332–336. [ Links ]
38. PROVOT S, SCHIPANI E. Molecular mechanisms of endonchondral bone development. Biochem Biophys Res Commun 2005; 328: 658–665. [ Links ]
39. GLADE MJ, BELLING TH. A dietary etiology for osteochondrotic cartilage. J Equine Vet Sci 1986; 6: 151–155. [ Links ]
40. KINCAID SA, ALLHANDS RV, PIJANOWSKI GJ. Chondrolysis associated with cartilage canals of the epiphyseal cartilage of the distal humerus of growing pigs. Am J Vet Res 1985; 46: 726–732. [ Links ]
41. CARLSON CS, HILLEY HD, HENRIKSON CK, MEUTEN DJ. The ultrastructure of osteochondrosis of the articular–epiphyseal cartilage complex in growing swine. Calcif Tissue Int 1986; 38: 44–51. [ Links ]
42. WOODARD JC, BECKER HN, POULOS PW Jr. Articular cartilage blood vessels in swine osteochondrosis. Vet Pathol 1987; 24: 118–123. [ Links ]
43. FARNUM CE, WILSMAN NJ, HILLEY HD. An ultrastructural analysis of osteochondrotic growth plate cartilage in growing swine. Vet Pathol 1984; 21: 141–151. [ Links ]
44. EKMAN S, RODRIGUEZ MH, PLÖEN L. Morphology of normal and osteochondrotic porcine articularepiphyseal cartilage. A study in the domestic pig and minipig of wild hog ancestry. Acta Anat Basel 1990;139: 239–253. [ Links ]
45. CHEN Q, GIBNEY EP, LEACH RM, LINSENMAYER TF. Chicken tibial dyschondroplasia: a limb mutant with two growth plates and possible defects of collagen crosslinking. Dev Dyn 1993;196: 54–61. [ Links ]
46. HENSON FM, DAVIES ME, JEFFCOTT LB. Equine dyschondroplasia (osteochondrosis)–histological findings and type VI collagen localization. Vet J 1997;154: 53–62. [ Links ]
47. GAL S, WILLINGHAM MC, GOTTESMAN MM. Processing and lysosomal localization of a glycoprotein whose secretion is transformation stimulated. J Cell Biol 1985;100: 535–544. [ Links ]
48. EKMAN S, RIDDERSTRÂLE Y. Carbonic anhydrase localization in normal and osteochondrotic joint cartilage of growing pigs. Vet Pathol 1992; 29: 308–315. [ Links ]
49. FARQUHARSON C, WHITEHEAD C, RENNIE S, THORP B, LOVERIDGE N. Cell proliferation and enzyme activities associated with the development of avian tibial dyschondroplasia: an in situ biochemical study. Bone 1992; 13: 59–67. [ Links ]
50. HERNÁNDEZ–VIDAL G, VALDÉS MA, MORA–VALDÉZ F, KAWAS–GARZA J, RAMÍREZ–ROMERO R, DAVIES E et al. Inmunolocalización de catepsina B en condrocitos y osteoclastos en discondroplasia (osteocondrosis) equina. Vet Méx 2002; 33: 395–407. [ Links ]
51. LUTFI AM. Model of growth, fate and functions of cartilage canals. J Anat 1970; 106: 135–145. [ Links ]
52. YAMAGUCHI T, HAYASHI K, TAYAMA N, SUGIOKA Y. The role of cartilage canals: experimental study using rabbit's femoral heads. Nippon Seikeigeka Gakkai Zasshi 1990; 64: 1105–1110. [ Links ]
53. WILSMAN NJ, VAN SICKLE DC. The relationship of cartilage canals to the initial osteogenesis of secondary centers of ossification. Anat Rec 1979; 168: 381–391. [ Links ]
54. FORTIER LA, KORNATOWSKI MA, MOHAMMED HO, JORDAN MT, O'CAIN LC, STEVENS WB. Agerelated changes in serum insulin–like growth factor–I, insulin–like growth factor–I binding protein–3 and articular cartilage structure in Thoroughbred horses. Equine Vet J 2005; 37: 37–42. [ Links ]
55. GANGL M, SERTEYN D, LEJEUNE JP, SCHNEIDER N, GRULKE S, PETERS F et al. A type II–collagen derived peptide and its nitrated form as new markers of inflammation and cartilage degradation in equine osteochondral lesions. Res Vet Sci 2007; 82: 68–75. [ Links ]
56. HERNANDEZ–VIDAL G, DAVIES ME, JEFFCOTT LB. Localization of cathepsins B and D in equine articular cartilage. Pferdeheilkunde 1996; 12: 371–373. [ Links ]
57. HERNANDEZ–VIDAL G, JEFFCOTT LB, DAVIES ME. Cellular heterogeneity in cathepsin D distribution in equine articular cartilage. Equine Vet J 1997; 29: 267–273. [ Links ]
58. HERNANDEZ–VIDAL G, JEFFCOTT LB, DAVIES ME. Immunolocalization of cathepsin B in equine dyschondroplastic cartilage. Vet J 1998;156: 193–201. [ Links ]
59. GLÄSER KE, DAVIES ME, JEFFCOTT LB. Differential distribution of cathepsins B and L in articular cartilage during skeletal development in the horse. Equine Vet J 2003; 35: 42–47. [ Links ]
60. HERNANDEZ–VIDAL G, MORA–VALDEZ F, KAWASGARZA J, RAMIREZ–ROMERO R, SALINAS–MELENDEZ JA, RODRIGUEZ–TOVAR LE et al. Localization of cathepsin B enzymatic activity in equine articular cartilage, skin fibroblasts and phenotypically modulated and dyschondroplastic chondrocytes. J Anim Vet Adv 2008; 7: 493–501. [ Links ]
61. DIK KJ, ENZERINK EE, VAN WEEREN PR. Radiographic development of osteochondral abnormalities, in the hock and stifle of Dutch Warmblood foals, from age 1 to 11 months. Equine Vet J Suppl 1999; 31: 9–15. [ Links ]
62. EKMAN S, CARLSON CS. The pathophysiology of osteochondrosis. Vet Clin North Am Small Anim Pract 1998; 28:17–32. [ Links ]
63. CARLSON CS, HILLEY HD, MEUTEN DJ. Degeneration of cartilage canal vessels associated with lesions of osteochondrosis in swine. Vet Pathol 1989; 26: 47–54. [ Links ]
64. YTREHUS B, GRINDFLEK E, TEIGE J, STUBSJOEN E, GRØNDALEN T, CARLSON CS et al. The effect of parentage on the prevalence, severity and location of lesions of osteochondrosis in swine. J Vet Med A Physiol Pathol Clin Med 2004; 51: 188–195. [ Links ]
65. CARLSON CS, CULLINS LD, MEUTEN DJ. Osteochondrosis of the articular–ephyseal cartilage complex in young horses: evidence for a defect in cartilage canal blood supply. Vet Pathol 1995; 32: 641–647. [ Links ]
66. HILL MA, RUTH GR, HILLEY HD, HANSGEN DC. Dychondroplasias, including osteochondrosis, in boars between 25 and 169 days of age: histologic changes. Am J Vet Res 1984; 45: 903–916. [ Links ]
67. THORP BH, DUFF SR. Effect of unilateral weightbearing on pelvic limb development in broiler fowls: vascular studies. Res Vet Sci 1988; 44: 164–174. [ Links ]
68. RIDDEL C. Studies on the pathogenesis of tibial dyschondroplasia in chickens. I. Production of similar defect by surgical interference. Avian Dis 1975; 19: 483– 489. [ Links ]
69. TRUETA J, TRIAS A. The vascular contribution to osteogenesis. IV. The effect of pressure upon the epiphyseal cartilage of the rabbit. J Bone Joint Surg Br 1961; 43B: 800–813. [ Links ]
70. GRØNDALEN T, GRØNDALEN J. Osteochondrosis and arthrosis in pigs. II. Incidence in breeding animals. Acta Vet Scand 1974; 15: 26–42. [ Links ]
71. WAGNER PC, GRANT BD, WATROUS BJ, APPELL LH, BLYTHE LL. A study of the heritability of cervical vertebral malformation in horses. Proc Am Assoc Equine Pract 1985; 31: 43–50. [ Links ]
72. JEFFCOTT LB. Osteochondrosis in the horsesearching for the key to pathogenesis. Equine Vet J 1991;23: 331–338. [ Links ]
73. POOL RR. Difficulties in definition of equine osteochondrosis; differentiation of developmental and acquire lesions. Equine Vet J Suppl 1993; 16: 5–12. [ Links ]
74. NAKANO T, BRENNAN JJ, AHERNE FX. Leg weakness and osteochondrosis in swine: a review. Can J Anim Sci 1987; 67: 883–901. [ Links ]
75. HURTIG MB, POOL RR. Pathogenesis of equine osteochondrosis. In: MCILWRAITH CW, TROTTER GW, editors. Joint diseases in the horse, Philadelphia, USA: WB Saunders Co, 1996: 362–383. [ Links ]
76. JØRGENSEN B, ANDERSON S. Genetic parameters for osteochondrosis in Danish Landrace and Yorkshire boars and correlations with leg weakness and production traits. Anim Sci 2000; 71: 427–434. [ Links ]
77. RICHARDSON DC, ZENTEK J. Nutrition and osteochondrosis. Vet Clin North Am Small Anim Pract 1998; 28: 115–135. [ Links ]
78. SANDGREN B, DALIN G, CARLSTEN J, LUNDEHEIM N. Development of osteochondrosis in the tarsocrural joint and osteochondral fragments in the fetlock joints of Standardbred trotters. II. Body measurements and clinical findings. Equine Vet J 1993; 25;S16: 48–53. [ Links ]
79. JEFFCOTT LB, HENSON FM. Studies on growth cartilage in the horse and their application to aetiopathogenesis of dyschodroplasia (osteochondrosis). Vet J 1998; 156: 177–192. [ Links ]
80. VAN DER WAL PG, VAN DER VALK PC, GOEDEGEBUURE SA, VAN ESSEN G. Osteochondrosis in six breeds of slaughter pigs. II. Data concerning carcass characteristics in relation to osteochondrosis. Tijdschr Diergeneeskd 1980; 2: 42–47. [ Links ]
81. LAFOND E, BREUR GJ, AUSTIN CC. Breed susceptibility for developmental orthopedic diseases in dogs. J Am Anim Hosp Assoc 2002; 38: 467–477. [ Links ]
82. GRØNDAHL AM, DOLVIK NI. Heritability estimations of osteochondrosis in the tibiotarsal joint and of bony fragments in the palmar/plantar portion of the metacarpo– and meatatarsophalangeal joints of horses. J Am Vet Med Assoc 1993; 203: 101–104. [ Links ]
83. YTREHUS B, EKMAN S, CARLSON CS, TEIGE J, REINHOLT FP. Focal changes in blood supply during normal epiphyseal growth are central in the pathogenesis of osteochondrosis in pigs. Bone 2004; 35: 1294–1306. [ Links ]
84. SKELLY CM, McALLISTAR H, DONNELLY WJ. Avulsion of the tibial tuberosity in a litter of Greyhound puppies. J Small Anim Pract 1997; 38: 445–449. [ Links ]
85. PHILIPSSON J. Pathogenesis of osteochondrosis genetic implications. In: MCILWRAITH CW, TROTTER G, editors. Joint disease in the horse, Philadelphia, PA, USA: WB SAUNDERS, 1996: 359– 362. [ Links ]
86. PADGETT GA, MOSTOSKY UV, PROBST CW, THOMAS MW, KRECKE CF. The inheritance of osteochondritis dissecans and fragmented coronoid process of the elbow joint in labrador retrievers. J Am Anim Hops Assoc 1995; 31: 327–330. [ Links ]
87. NAKANO T, AHERNE FX. Involvement of trauma in the pathogenesis of osteochondritis dissecans in swine. Can J Vet Res 1988; 52: 154–155. [ Links ]
88. VAN WEEREN PR, BARNEVELD A. Study design to evaluate the influence of exercise on the development of the musculoskeletal system of foals up to age 11 months. Equine Vet J Suppl 1999; 31: 4–8. [ Links ]
89. OLSSON SE. General and local etiologic factors in canine osteochondrosis. Vet Q 1987; 268–278. [ Links ]
90. STROMBERG B. A review of the salient features of osteochondrosis in the horse. Equine Vet J 1979; 11: 211–214. [ Links ]
91. SCHOENMAKERS I, HAZEWINKEL HA, VOORHOUT G, CARLSON CS, RICHARDSON D. Effects of diets with different calcium and phosphorus contents on the skeletal development and blood chemistry of growing Great Danes. Vet Rec 2000; 147: 652–660. [ Links ]
92. HANDELAND K, BERNHOFT A. Osteochondrosis associated with copper deficiency in a red deer herd in Norway. Vet Rec 2004; 155: 676–678. [ Links ]
93. THOMPSON KG, AUDIGÉ L, ARTHUR DG, JULIAN AF, ORR MB, MCSPORRAN KD et al. Osteochondrosis associated with copper deficiency in young farmed red deer and wapiti x red deer hybrids. N Z vet J 1994; 42: 137–143. [ Links ]
94. WOODBURY MR, FEIST MS, CLARK EG, HAIGH JC. Osteochondrosis and epiphyseal bone abnormalities associated with copper deficiency in bison calves. Can Vet J 1999. 40: 878–880. [ Links ]
95. BRIDGES CH, WOMACK JE, HARRIS ED, SCRUTCHFIELD WL. Considerations of copper metabolism in osteochondrosis of suckling foals. J Am Vet Med Assoc 1984; 185:173–178. [ Links ]
96. HURTIG M, GREEN SL, DOBSON H, MIKUNITAKAGAKI Y, CHOI J. Correlative study of defective cartilage and bone growth in foals fed a low–copper diet. Equine Vet J 1993; 16: 66–73. [ Links ]
97. KNIGHT DA, WEISBRODE SE, SCHMALL LM, REED SM, GABEL AA, BRAMLAGE LR et al. The effects of copper supplementation on the prevalence of cartilage lesions in foals. Equine Vet J 1990; 22: 426–432. [ Links ]
98. BRIDGES CH, HARRIS ED. Experimentally induced cartilaginous fractures (osteochondritis dissecans) in foals fed low–copper diets. J Am Vet Med Assoc 1988;193:215–21. [ Links ]
99. PEARCE SG, GRACE ND, WICHTEL JJ, FIRTH EC, FENNESSY PF. Effect of copper supplementation on copper status of pregnant mares and foals. Equine Vet J 1998; 30: 200–203 [ Links ]
100. VAN WEEREN PR, KNAAP J, FIRTH EC. Influence of liver copper status of mare and newborn foal on the development of osteochondrotic lesions. Equine Vet J 2003;35:67–71. [ Links ]
101. SAVAGE CJ, MCCARTHY RN, JEFFCOTT LB. Effects of dietary phosphorus and calcium on induction of dyschondroplasia in foals. Equine Vet J Suppl 1993: 16: 80–83. [ Links ]
102. SAVAGE CJ, MCCARTHY RN, JEFFCOTT LB. Effects of dietary energy and protein on induction of dyschondroplasia in foals. Equine Vet J Suppl 1993; 16:74–79. [ Links ]
103. RALSTON SL. Hyperglycaemia / hyperinsulinaemia after feeding a meal of grain to young horses with ostechondritis dissecans (OCD) lesions. Pferdeheilk 1996; 12: 320–322. [ Links ]
104. STEEL CM. Equine synovial fluid analysis. Vet Clin North Am Equine Pract 2008;24:437–454. [ Links ]
105. MCILWRAITH CW. Arthroscopic surgery for osteochondral chip fragments and other lesions not requiring internal fixation in the carpal and fetlock of the equine athlete: What have we learned in 20 years? Clin Tech Equine Prac 2002; 1: 200–210. [ Links ]
106. BILLINGHURST RC, BRAMA PAJ, VAN WEEREN PR, KNOWLTON MS, MCILWRAITH CW. Evaluation of serum concentrations of biomarkers of skeletal metabolism and results of radiography as indicators of severity of ostechondrosis in foals. Am J Vet Res 2004; 65: 143–150. [ Links ]
107. MCILWRAITH CW. Use of synovial fluid and serum biomarkers in equine bone and joint disease: a review. Equine Vet J 2005; 37: 473–482. [ Links ]
108. DONABÉDIAN M, VAN WEEREN PR, PERONA G, FLEURANCE G, ROBERT C, LEGER S et al. Early changes in biomarkers of skeletal metabolism and their association to the occurrence of osteochondrosis (OC) in the horse. Equine Vet J 2008; 40: 253–259. [ Links ]
109. BRAMA PA, VAN DEN BOOM R, DEGROOTT J, KIERS GH, VAN WEEREN PR. Collagenase–1 (MMP–1) activity in equine synovial fluid: influence of age, joint pathology, exercise and repeated arthrocentesis. Equine Vet J 2004; 36: 34–40. [ Links ]
110. HENSON FMD, DAVIES ME, SKEPPER JN, JEFFCOTT LB. Localization of alkaline phosphatase in equine growth cartilage. J Anat 1995; 187: 151–159. [ Links ]
111. FULLER CJ, BARR AR, SHARIF M, DIEPPE PA. Cross–sectional comparison of synovial fluid biochemical markers in equine osteoarthritis and the correlation of these markers with articular cartilage damage. Osteoarthritis Cartilage 2001; 9: 49–55. [ Links ]
112. TRUMBLE TN, BROWN MP, MERRIT KA, BILLINGHURTS RC. Joint dependant concentrations of bone alkaline phosphatase in serum and synovial fluids of horses with osteochondral injury: an analytic and clinical validation. Osteoarthritis Cartilage 2008; 16: 779–786. [ Links ]
113. POOLE AR, KOBAYASHI M, YASUDA T, LAVERTY S, MWALE F, KOJIMA T et al. Type II collagen degradation and its regulation in articular cartilage in osteoarthritis. Ann Rheum Dis 2002; 61: 78–81. [ Links ]
114. TRUMBLE TN, SCARBROUGH AB, BROWN MP. Ostechondral injury increases type II collagen degradation products (C2C) in synovial fluid of Thoroughbred racehorses. Osteoarthritis Cartilage 2009; 17: 371–374. [ Links ]
115. VAN DE LEST CH, BRAMA PA, VAN ELB, DEGROOT J, VAN WEEREN PR. Extracellular matrix changes in early osteochondrotic defects in foals: a key role for collagen? Arch Biochem Biophys 2004; 1690: 54–62. [ Links ]
116. FRISBIE DD, RAY CS, IONESCU M, POOLE AR, CHAPMAN PL, MCILWRAITH CW et al. Measurement of synovial fluid and serum concentrations of the 846 epitope of chondroitin sulfate and carboxy propeptides of type II procollagen for diagnosis of osteochondral fragmentation in horses. Am J Vet Res 1999; 60: 306–309. [ Links ]
117. MISUMI K, VILIM V, HATAZOE T, MURATA T, FUJIKI M, OKA T et al. Serum level of cartilage oligomeric matrix protein (COMP) in equine osteoarthritis. Equine Vet J 2002: 34: 602–608. [ Links ]
118. PEREMANS K, VERSCHOOTEN F. Results of conservative treatment of osteochondrosis of the tibiotarsal joint in the horse. J Equine Vet Sci 1997; 17: 322–326. [ Links ]
119. MCILWRAITH CW, BRAMLAGE LR. Surgical treatment of joint injury. In: MCILWRAITH CW, TROTTER GW, editors. Joint diseases in the horse. Philadelphia, PA, USA: WB Saunders Co, 1996: 292–317. [ Links ]
120. VAN WEEREN PR, BRAMA PAJ. Equine joint diseases in the light of new developments in articular cartilage research. Pferdeheilkunde 2003; 19: 336–344. [ Links ]
121. MCILWRAITH CW, FOERNER JJ, DAVIS DM. Osteochondritis dissecans of the tarsocrural joint: results of treatment with arthroscopic surgery. Equine Vet J 1991; 23: 151–152. [ Links ]
122. VATISTAS NJ, WRIGHT IM, DYSON SJ. Comparison of arthroscopy and arthrotomy for the treatment of osteochondrotic lesions in the femoropatellar joint of horses. Vet Rec 1995; 137: 629–632. [ Links ]
123. RICHARDSON DW. Diagnosis and management of osteochondrosis and osseous cyst–like lesions. In: ROSS MW, DYSON SJ, editors. Diagnosis and management of lameness in the horse. Philadelphia, PA, USA: WB Saunders Co, 2003:549–554. [ Links ]














