Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
 Similares en SciELO
Similares en SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.27 México abr. 2009
Anatomía floral de cinco especies de Opuntia (Opuntioideae, Cactaceae) de México
Floral anatomy of five Opuntia species (Opuntioideae, Cactaceae) of Mexico
Mireya Fuentes–Pérez1, Teresa Terrazas2 y Salvador Arias2
1 Programa de Botánica, Colegio de Postgraduados, Montecillo, Estado de México 56230, México
2 Instituto de Biología, Universidad Nacional Autónoma de México. México, DF 04510, México. Correo electrónico: tterrazas@ibiologia.unam.mx
Recibido: 19 junio 2008
Aceptado: 26 enero 2009
Resumen
Se describe y compara la anatomía floral de cinco especies de Opuntia de México con el objetivo de contribuir al conocimiento del género. Tres o más botones florales con tamaño antes de antesis y flores en antesis se fijaron y procesaron con la microtecnia convencional de inclusión en parafina. Entre los resultados más relevantes se confirma que las características anatómicas del pericarpelo son semejantes a las de los tallos vegetativos, pero hay diferencias entre especies en los rasgos de cutícula, epidermis e hipodermis. Los tépalos externos tienen una epidermis papilosa en O. cantabrigiensis, O. decumbens y O. stenopetala. Los filamentos son libres y tienen un haz vascular anficribal semejante a lo descrito para otros miembros de la familia. El nectario es del tipo hipantio. El estilo en Opuntia tiene una cavidad estilar abierta como se ha registrado para Pereskia, pero es diferente a otras dicotiledóneas; además, el lumen de las células epidérmicas de dicha cavidad está ocluido por taninos, carácter compartido con Pereskia y con otros géneros de Opuntioideae. Los resultados sugieren que es necesario estudiar un número mayor de miembros de este género para entender adecuadamente la variación interespecífica.
Palabras clave: anatomía floral, Opuntioideae, epidermis papilosa, estilo abierto.
Abstract
The floral anatomy of five species of Opuntia from Mexico is described and compared. Three to five floral buds (pre–anthesis) and flowers in anthesis were fixed and prepared using standard paraffin microtechnique. The most relevant results obtained confirm that the anatomical features of the pericar–pelo are similar to those of the vegetative stems; however, there are differences among species in the cuticle, epidermis and hypodermis. The external tepals in O. cantabrigiensis, O. decumbens and O. stenopetala have a papillose epidermis. The staminal filaments are free with an amphicribal bundle similar to that described for other members of the family. The nectary is of the hypanthial type. The Opuntia style has an open stylar cavity like that reported for Pereskia, but it is different from other dicotyledons. Moreover, epidermal cells of said cavity are occluded by tannins, a character shared with Pereskia and other genera of Opuntioideae. The results suggest it is necessary to study additional members of this genus to understand adequately the interspecific variation.
Key words: floral anatomy, Opuntioideae, papillose epidermis, open style.
INTRODUCCIÓN
Opuntia es el género de la familia Cactaceae mejor conocido en todo el mundo, con cerca de 190 especies nativas de América desde el sur del Canadá hasta el sur de Argentina. En México, se distribuyen 83 especies (Guzmán et al., 2003), de ellas 29 se encuentran en la Altiplanicie y otras son dominantes fisonómicas del matorral crasicaule. Las especies de Opuntia son conocidas en México como nopales y se caracterizan por sus cladodios distintivamente articulados, pequeñas hojas cilíndricas a cónicas, que tempranamente se pierden; así como por sus flores que nacen generalmente en el ápice de los cladodios; éstas son solitarias, comúnmente de color amarillo y pericarpelo globoso, sin un tubo conspicuo. De acuerdo con la evidencia molecular Opuntia se clasifica junto con Brasilopuntia, Consolea, Miquilopuntia, Tacinga y Tunilla en la tribu Opuntieae de la subfamilia Opuntioideae (Wallace y Dickie, 2002). Considerando su tamaño se podría pensar como un modelo para entender la variación de los otros miembros de esta tribu.
Las flores de Opuntia, al igual que otros miembros de Cactaceae son básicamente hermafroditas, aunque por atrofia en alguna estructura del androceo o gineceo pueden ser también unisexuales (Del Castillo y González–Espinosa, 1988; Pimienta–Barrios y Del Castillo, 2002; Diaz y Cocucci, 2003). Además de las descripciones de las estructuras florales en monografías y floras mexicanas (Bravo–Hollis, 1978; Arias et al., 1997; Scheinvar, 2004), hay diversos estudios sobre la biología floral de algunos miembros de la familia (Fleming et al., 1994; Valiente–Banuet et al., 1997; Clark–Tapia y Molina–Freaner, 2004), sobre la embriología (Hernández–García y García–Villanueva, 1991; Núñez–Mariel et al., 2001; Flores, 2005; Silva, 2007) o de anatomía y del desarrollo de los verticilos florales en esta familia (Ross, 1982; Fuentes–Pérez, 2004; Orozco, 2005).
En 1955, Tiagi describe la anatomía vascular de la flor de Mammillaria tenuis DC., Opuntia dillenii Haw., Pereskia bleo (Kunth) DC. y Rhipsalis baccifera (J.S.Mill.) Stearn. y concluye que Pereskia es el género más primitivo de la familia, resultado confirmado en un estudio filogenético para la familia utilizando caracteres moleculares (Nyffeler, 2002). Este autor señala que no existe una separación del haz carpelar del anillo de los haces vasculares internos en Pereskia. Boke (1963, 1966, 1968) estudia la anatomía y el desarrollo floral de varias especies de Pereskia, concluyendo que el ovario es fundamentalmente súpero y que el estilo es abierto.
Fuentes–Pérez (2004) realiza un estudio anatómico de los verticilos florales de siete especies representativas de la tribu Pachy–cereeae y encuentra que hay caracteres anatómicos que apoyan grupos monofiléticos en esta tribu. Por ejemplo, la presencia de taninos en las células epidérmicas del funículo y el tegumento externo dorsal para el clado formado por Escontria, Myrtillocactus, Polaskia y Stenocereus; la presencia de una epidermis papilosa para el clado donde se ubicaLophocereus schottii y el tejido del nectario con dos tipos celulares en el clado del género Neobuxbamia. Sin embargo se desconoce si un género tan amplio como Opuntia presenta una anatomía similar entre sus especies.
Con base en lo anterior, los objetivos de esta investigación son describir la anatomía de los verticilos florales de cinco especies de Opuntia que se distribuyen en México y compararla con la información disponible para la familia; además de explorar el valor sistemático de los caracteres analizados.
MATERIAL Y MÉTODO
Colecta. De tres a cinco botones florales con tamaño antes de antesis y de flores en antesis de Opuntia cantabrigiensis Lynch, Hidalgo (Terrazas 723, MEXU), O. decumbens Salm–Dyck, Chiapas (Arias 1603, MEXU); O. pilifera F.A.C.Weber, Oaxaca (Terrazas 737, MEXU), O. pubescens H.L.Wendl. ex Pfeiff., Oaxaca (Terrazas 729, MEXU) y O. stenopetala Engelm., Querétaro (Arias 1680, MEXU) fueron colectados en sus áreas de distribución natural. Se seleccionaron estas especies por tratarse de miembros del género con amplia distribución y ser representativos de la alta diversidad que hay en México. Todas las muestras se fijaron en una solución de formaldehído, ácido acético glacial y alcohol etílico (Ruzin, 1999) por 48 horas.
Laboratorio. Los botones florales y las flores en antesis se cortaron transversal y longitudinalmente. Cuando transversalmente, se hicieron segmentos de 0.50 cm a 1 cm de espesor, de la región proximal a la distal de la flor, teniendo de tres hasta siete segmentos dependiendo del tamaño de ésta. Para los cortes longitudinales, únicamente se dividió a la flor por la mitad. Todos los segmentos se colocaron en rejillas de plástico por separado y se etiquetaron. Se procedieron a lavar en alcohol etílico al 50% durante una semana y enseguida los tejidos fueron deshidratados con alcohol terbutílico (Ruzin, 1999) mediante inmersiones cada 12 h en un procesador de tejidos automático (modelo Leica TP1020). Posteriormente, se incluyeron en parafina líquida "Leica histowax 56°–58°" y una vez que solidificó la parafina, se realizaron cortes transversales y longitudinales con un micrótomo rotatorio, a un grosor de 12 ó 14 µm. Se colocaron en portaobjetos y se pegaron con adhesivo de Haup (Ruzin, 1999). Se continuó con inmersiones en diferentes concentraciones de xileno y alcohol etílico (de 100% a 50%) para eliminar la parafina. La tinción de los tejidos se realizó con safranina acuosa (0.05% con 2% de cloruro de sodio, disueltos en agua) y verde rápido (Ruzin, 1999). Posteriormente, se montaron con resina sintética; una vez secas y limpias se procedió a su observación.
Observaciones y mediciones. Para generar la descripción anatómica de los verticilos florales se observaron y registraron las características de los tejidos dérmico, fundamental y vascular del pericarpelo, gineceo, androceo y perianto (tépalos externos e internos). También se describen los idioblastos e inclusiones orgánicas y minerales.
Con fines comparativos se midieron el grosor de la cutícula y la pared periclinal externa de la célula epidérmica en los diferentes verticilos y se contó el número de estratos de la hipodermis en el pericarpelo y el número de haces vasculares en el estilo. Todas las mediciones se realizaron con un analizador de imágenes IMAGE – Pro Plus versión 3.1 (Media Cybernetics, 1997), adaptado a un microscopio Olympus BX–50. Además se tomaron fotografías en este equipo para ilustrar las diferencias anatómicas encontradas entre las especies estudiadas.
RESULTADOS
Pericarpelo. La epidermis del pericarpelo es simple y se interrumpe por los meristemos activos ubicados en la aréola (Fig. 1A), los cuales dan origen a las espinas, cerdas y el resto de las células epidérmicas, en dicha región se diferencian en tricomas. Además, la epidermis tiene una cutícula lisa, excepto en O. pilifera que es ligeramente rugosa (Fig. 1B), comúnmente delgada (< 1 µm) o hasta 3.21 µm en O. pilifera. Además las células epidérmicas son rectas (Fig. 1C) o ligeramente papilosas sólo en O. decumbens; el espesor de la pared periclinal externa varía de 1.20 µm en O. stenopetala a 4.11 µm O. pilifera. Los estomas paralelocíticos son escasos (Fig. 1D) y al mismo nivel que el resto de las células epidérmicas. Por debajo de la epidermis, se encuentra una hipodermis colenquimatosa lagunar de dos estratos en O. stenopetala hasta seis estratos en O. cantabrigiensis, con drusas, exclusivamente en el primer estrato de éste (Fig. 1B,C). Entre la hipodermis y el tejido vascular se encuentran células de parénquima semejantes en disposición a las del tallo. Las células de parénquima en empalizada se distinguen por presentar abundantes cloroplastos (Fig. 1B,C) y las del parénquima reservante son de forma isodiamétrica y de tamaño variable; además hay abundantes células de mucílago, drusas y haces vasculares corticales. Anatómicamente, el pericarpelo se encuentra delimitado del tejido que conforma el ovario por haces vasculares colaterales que forman un anillo (Fig. 1E) y en su mayoría presentan crecimiento secundario.
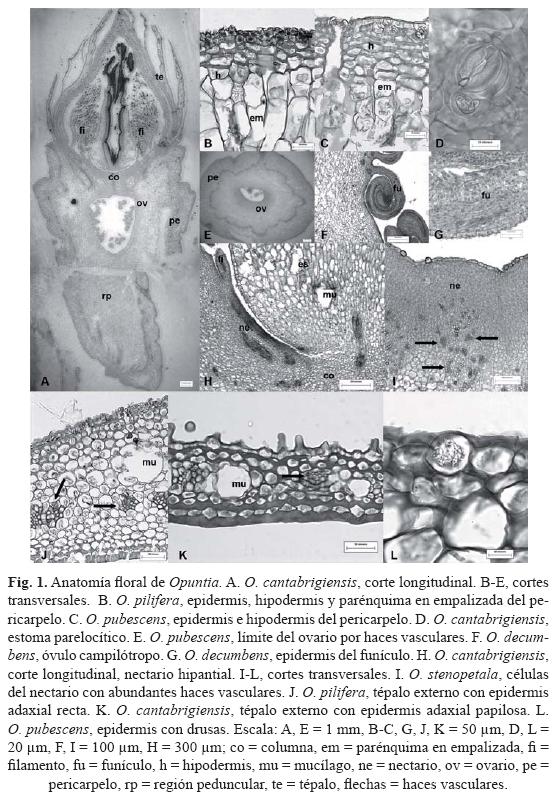
Gineceo. El ovario se encuentra embebido en el pericarpelo y la forma del lóculo es elíptica u ovada–depresa en O. cantabrigiensis (Fig. 1A) y O. pilifera, en corte longitudinal. Hacia el lóculo hay una epidermis simple con cutícula lisa y delgada, excepto en O. pubescens donde es ligeramente rugosa. Entre los contenidos que se observaron en la epidermis están las drusas y taninos en el funículo de O. pilifera. Subyacente a la epidermis se encuentra un parénquima muy compacto, en el que se presentan drusas y algunos granos de almidón en O. pilifera y O. pubescens. Los óvulos son campilótropos, bitégmicos, crasinucelados, con un funículo largo, encorvado sobre la calaza (Fig. 1F). La forma de las células de la epidermis del funículo es rectangular o cuadrada y papilosa en su parte más ventral (Fig. 1G).
La columna corresponde a la región de fusión y adelgazamiento de los carpelos que se encuentra sobre el ovario hasta donde se comienza a distinguir el estilo (Fig. 1A). Esta región se encuentra bajo la constricción que se da en el tubo floral en Opuntia. Esta región se constituye exclusivamente por células de parénquima con numerosas células de mucílago y drusas.
En corte longitudinal, el estilo y el estigma tienen forma obclaviforme con ensanchamiento hacia la base (Fig. 1A). En corte transversal, se aprecia el estilo con la cavidad estilar abierta (Fig. 2A). La epidermis externa tiene células de forma cuadrada con una cutícula delgada (< 1 µm) y lisa (Fig. 2D) y su pared periclinal externa muy variable de 3.72 µm en O. cantabrigiensis hasta 26.76 µm en O. pilifera. La epidermis de la cavidad estilar tiene células papilosas ocluidas completamente por taninos (Figs. 1A, 2A–C). Entre la cavidad estilar y la epidermis externa se distinguen células de parénquima con cloroplastos, algunas células de mucílago (Fig. 2A) y haces vasculares que varían en número de siete en O. pilifera hasta diez en O. pubescens.

Los haces vasculares son anficribales (Fig. 2E). Subyacente a la epidermis de la cavidad estilar se distingue el tejido de transmisión, compuesto por células pequeñas, compactas y con citoplasma denso (Fig. 2A–C) cuya distribución es circular en la región proximal del estilo, pero al aproximarse a la región distal, donde se separan los lóbulos del estigma, se observa lobulada. Notoriamente, hay de cuatro a cinco estratos celulares de parénquima entre el tejido de transmisión y la epidermis de la cavidad estilar (Fig. 2B, C).
Cada lóbulo del estigma se distingue en corte transversal por tener una forma triangular (Fig. 2F); la epidermis en las caras más largas es papilosa con el lumen ocluido por abundantes taninos y por debajo de ella se encuentra el tejido de transmisión. En la cara más corta, la epidermis tiene células no papilosas, sin taninos (Fig. 2F) y, subyacente a ésta se observa un paquete de células parenquimatosas que se extienden hasta rodear el haz vascular.
Nectario. En corte longitudinal y por abajo de la región de inserción de los filamentos más internos se distingue el nectario, el cual rodea la base del estilo (Fig. 1A, H) y se caracteriza porque subyacente a la epidermis hay varios estratos de células pequeñas, muy compactas, con núcleo y vacuola evidentes así como abundante tejido vascular (Fig. 1I). La epidermis continúa siendo simple con células de forma cuadrada a rectangular y de pared delgada, a veces con contenidos oscuros (Fig. 1I).
Androceo. En corte longitudinal se aprecian los numerosos filamentos libres que se insertan arriba de la región del nectario (Fig. 1A) y en corte transversal, los filamentos tienen forma redonda–elíptica (Fig. 2G), con una epidermis simple. La mayoría de las especies tienen la cutícula lisa o ligeramente estriada como en O. pilifera y O. pubescens, delgada (< 2 µm). Las células epidérmicas son cuadradas, excepto en O. pilifera con células de forma rectangular en sentido vertical y en O. stenopetala que son papilosas, con la pared periclinal externa variando de 0.38 µm en O. pubescens hasta 9.37 µm en O. pilifera. El parénquima llega a constituir cerca del 80% del filamento, con células de mucílago y haz vascular de tipo anficribal en el centro de éste (Fig. 2G).
Las anteras son tetrasporangiadas (Fig. 2H), con una epidermis simple y papilosa. El endotecio tiene un estrato de células con sus típicos engrosamientos helicoidales (Fig. 2H,I); mientras que el conectivo está conformado por células de parénquima con numerosas drusas (Fig. 2I) y el haz vascular de tipo anficribal termina en esta región.
Tépalos. Los tépalos se encuentran unidos por la base y tienen una forma elíptica con ápice apiculado y el margen liso. Los tépalos tienen una vena central gruesa y numerosas venas secundarias, las cuales se unen para formar areolas, quedando libres hacia el margen.
En corte transversal, los tépalos externos tienen una epidermis adaxial simple con una cutícula lisa o ligeramente estriada como en O. decumbens y delgada (< 2 µm), las células tienen forma rectangular o cuadrada y la pared periclinal externa es recta o papilosa como en O. cantabrigiensis, O. decumbens y O. pubescens (Fig. 1J, K). El grosor de la pared periclinal varía de 3.80 µm en O. decumbens a 9.78 µm en O. pilifera. Drusas ocluyen el lumen celular de algunas células epidérmicas exclusivamente en O. pubescens (Fig. 1L). La epidermis abaxial es semejante a la adaxial, con células más pequeñas y paredes ligeramente más delgadas, siendo no papilosa. Los estomas paralelocíticos están presentes en ambas superficies y se ubican al mismo nivel que el resto de las células epidérmicas. El mesofilo está compuesto de parénquima esponjoso, con cloroplastos y algunas células o todas son colenquimatosas (Fig. 1J, K). Hay abundantes células de mucílago y drusas, así como una acumulación de contenido de color oscuro en algunas células en O. pilifera. Los haces vasculares son colaterales y muestran un arreglo lineal dentro del tépalo. Los tépalos internos, en corte transversal son similares en su anatomía a los externos, excepto en que las células de la epidermis son de menor tamaño con paredes periclinales delgadas (< 2 µm) y el mesofilo de O. pilifera tiene exclusivamente células colenquimatosas.
DISCUSIÓN
Las flores de las cinco especies estudiadas de Opuntia comparten la mayoría de las características anatómicas aquí descritas. Sin embargo, existen diferencias principalmente en la epidermis de los diferentes verticilos que las distinguen. Por ejemplo, la cutícula del pericarpelo rugosa y gruesa (> 3 µm) de O. pilifera, la epidermis papilosa del pericarpelo de O. decumbens; la cutícula ligeramente estriada en el filamento de O. pilifera y de O. pubescens; la epidermis adaxial papilosa del tépalo externo de O. cantabrigiensis, O. decumbens y O. pubescens y las drusas depositadas en el lumen de la epidermis del tépalo externo de O. pubescens. El valor sistemático de estas características deberá confirmarse al estudiar un mayor número de especies del género Opuntia.
Los caracteres anatómicos
Pericarpelo. Buxbaum (1953) se refiere al pericarpelo como el tejido que se encuentra rodeando al ovario. Las características anatómicas del pericarpelo en la epidermis, hipodermis, córtex y tejido vascular de Opuntia son similares a lo descrito para el tallo de éste y otros géneros de Opuntioideae (Mauseth, 2005) y los haces vasculares de tipo colateral son similares a los registrados por Tiagi (1955) para Pereskia bleo, Mammillaria tenuis y Rhipsalis baccifera. De acuerdo a Dickison (1975) y a Endress (1994), las inclusiones minerales en la epidermis se consideran un carácter con valor diagnóstico, como es el caso de O. pubescens con drusas en la epidermis. Además, la hipodermis en las especies de Opuntia tiene drusas, carácter diagnóstico para el género y otros miembros de Opuntioideae (Monje y Baran, 2004).
Gineceo. Barthlott y Hunt (1993) indican que externamente el ovario está rodeado por el pericarpelo y limitado por un anillo de haces vasculares. Esta disposición se confirmó en las especies estudiadas, donde el parénquima del ovario se encuentra limitado por un anillo de haces vasculares de tipo colateral y con crecimiento secundario. En todas las especies estudiadas se observaron óvulos campilótropos, bitégmicos y crasinucelados con un funículo simple, largo y encorvado sobre la calaza, confirmando que este tipo de óvulos es el más común en Cactaceae (Boke, 1963; Hernández–García y García–Villanueva, 1991; Núñez–Mariel et al., 2001); así como la presencia de papilas en la porción más ventral del funículo (Boke, 1963; Núñez–Mariel et al., 2001; Strittmatter et al., 2002). La presencia de taninos en el funículo se registra exclusivamente en O. pilifera. Este carácter, Buxbaum (1953) lo llamó células perla del funículo y lo reporta para varios géneros de Pachycereeae de la subfamilia Cactoideae.
En las especies estudiadas de Opuntia se encontró un estilo con la cavidad estilar abierta similar a lo registrado para Pereskia (Boke, 1963, 1966, 1968) y para varios miembros de Cactoideae (Fuentes–Pérez, 2004). Este carácter es común en las monocotiledóneas, pero no en las dicotiledóneas (Hanf, 1935). El tejido de transmisión presenta células pequeñas y compactas, con un citoplasma denso y núcleo evidente en todas las especies estudiadas y rodea a la cavidad estilar como en otras angiospermas. La presencia de taninos que ocluyen el lumen celular de la epidermis papilosa de la cavidad estilar es un atributo que se comparte con Pereskia (Boke, 1963, 1966, 1968) y otras Cactoideae (Fuentes–Pérez, 2004), pero difiere de los registrado en Blossfelia y Mammillaria con estilo cerrado (Terrazas, datos sin publicar). De acuerdo con Buxbaum (1953) en un estilo abierto sería imposible que los granos de polen estuviesen en contacto con los óvulos sin la presencia de la epidermis papilosa del tejido de transmisión. Sin embargo, las células parenquimatosas entre el tejido de transmisión y la epidermis papilosa aquí descritas para Opuntia, no han sido observadas en otras cactáceas, por ello registrar su presencia en otras Opuntioideae e identificar su función sería importante para entender la variación del tejido de transmisión en la familia.
Las características estructurales y fisiológicas del estigma varían entre familias (Endress, 1994); no obstante como extensión del estilo, el estigma se encuentra organizado de manera muy similar con epidermis papilosa, parénquima, tejido de transmisión y haces vasculares. Los lóbulos en la mayoría de las familias tienen una epidermis papilosa (Esau, 1987) y una porción con epidermis lisa, en adición a una hipodermis que puede ser colenquimatosa. En las especies estudiadas se confirman dichas características en los estigmas lobados de Opuntia.
Nectario. Buxbaum (1953) indica que en las Opuntioideae "los estambres se insertan muy bajo y que el nectario se conserva como un embudo corto alrededor de la base del pistilo". En las especies de Opuntia estudiadas el nectario se encuentra abajo de la región de inserción de los filamentos más internos, rodeando la base del estilo y por ello consideramos corresponde a un nectario hipantial (Bernardillo, 2007; pág. 43). Para la familia Cactaceae, Buxbaum (1953) reconoce que el nectario puede ser de los tipos disco, embudo y cámara nectarial que corresponden a los nectarios receptacular, anular e hipantial. El tipo cámara nectarial está reportado para algunos géneros de Cactoideae como Cephalocereus, Cleistocactus, Denmoza y Neobuxbaumia (Buxbaum, 1953) y seguramente algunas especies de Tacinga (Opuntioideae) también presentan una cámara, como muestran las ilustraciones para T. funalis Britton & Rose y T. inamoena (K.Schumann) N.P.Taylor & Stuppy (Taylor et al., 2002, págs 113, 116), donde existen diferencias en forma y tamaño, las cuales posiblemente dependan de los verticilos involucrados. El nectario tipo "embudo" también se ha registrado para algunos géneros de Cactoideae como Acanthocalycium, Lophophora, Mammillaria, Strombocactus, Thelocactus y Turbinicarpus (Buxbaum, 1953). Sin embargo, las flores de estas especies sí tienen un tubo receptacular. Las observaciones aquí presentadas para Opuntia sugieren que no podemos utilizar el mismo término "embudo" para ambas subfamilias. Por ello, se requiere de un estudio comparativo del desarrollo de los nectarios en Cactaceae con la finalidad de definir este carácter con posible valor sistemático.
Comúnmente el tejido secretor del néctar puede estar restringido a la epidermis o en varios estratos celulares por debajo de la epidermis (Esau, 1987). Usualmente las células epidérmicas tienen un citoplasma denso y pueden o no modificarse en tricomas (Rudall, 1992) y subyacente a la epidermis, las células son pequeñas, con paredes delgadas, citoplasma granular denso y núcleos relativamente grandes (Fahn, 1979). Estas características de las células subyacentes a la epidermis se observaron en las especies estudiadas y son semejantes a otros miembros de las familias Caryophyllaceae (Fahn, 1979; Weberling, 1992), Leguminosae (Pascal et al., 2000), Ranunculaceae, Valerianaceae, Lauraceae y Passifloraceae (Fahn, 1979; Weberling, 1992).
Androceo. Las características de la epidermis del filamento permiten separar a O. pilifera y O. stenopetala de las otras especies. El haz vascular anficribal de cada filamento, ya había sido registrado para otras Cactaceae (Tiagi, 1955; Fuentes–Pérez, 2004); pero difiere de lo reportado para los géneros de otras familias como Commelinaceae (Hardy et al., 2000), Ericaceae (Hermann y Palser, 2000) y Hamamelidaceae (Mione y Bogle, 1990). Comúnmente se observa una o dos capas de células del endotecio, pero se pueden observar hasta cinco en algunas especies de la familia Buxaceae (Baltasar y Endress, 2002). En las especies de Opuntia estudiadas solamente se observó un estrato de células que conforman el endotecio, semejante a lo registrado en especies de Cactoideae (Fuentes–Pérez, 2004).
Perianto. De acuerdo a Tiagi (1955) los tépalos en la familia Cactaceae son hojas diferenciadas o bien brácteas derivadas que presentan modificaciones entre la serie de tépalos más externa y la interna. Esta aseveración se confirma en los taxones estudiados, ya que se observaron diferencias en cuanto al grosor de los tépalos externos y al espesor de la pared periclinal de ambas superficies. Notoriamente, la pared periclinal de las células epidérmicas puede ser gruesa y de naturaleza exclusivamente celulósica. Por ello se interpreta como una epidermis colenquimatosa (Haberlandt, 1914). La presencia de colénquima se hace evidente en las células de mesofilo de Opuntia y seguramente esta pared de celulosa ayude a la economía hídrica de la flor antes y durante la polinización.
La vascularización en los tépalos es similar a la de las hojas, razón por que se consideran hojas modificadas y a su vez extensiones del tallo aunque más simple (Dickison, 1993). En las especies estudiadas, los tépalos revisados cuentan con numerosas nervaduras secundarias que se derivan de una nervadura central, la cual se distingue del resto por ser de mayor tamaño. Las nervaduras se ramifican y tienen una distribución por la superficie del tépalo uniéndose para formar areolas, mismas que hacia el margen del tépalo se observan libres. Los haces vasculares son colaterales en ambas series de tépalos y concuerda con lo reportado por Tiagi (1955) y para los haces corticales y medulares de los tallos de Cactoideae (Terrazas y Mauseth, 2002).
CONCLUSIONES
Hay rasgos anatómicos florales que comparten las especies de Opuntia aquí estudiadas como son la forma de los filamentos redonda–elíptica o la presencia de drusas en el primer estrato de la hipodermis; sin embargo, las diferencias encontradas a nivel de la epidermis de los diferentes verticilos y la presencia de mesofilo colenquimatoso son rasgos que deberán de estudiarse en un mayor número de especies del género con la finalidad de evaluar la variación interespecífica. El estudiar la anatomía floral de otros miembros de Opuntioideae permitirá evaluar la importancia sistemática de la epidermis de los diferentes verticilos, así como aclarar el tipo de nectario presente en la subfamilia.
AGRADECIMIENTOS
La autora agradece al Consejo Nacional de Ciencia y Tecnología por la beca para realizar estudios de Maestría (No. 193077). También agradecemos a Julio César Montero Rojas por la elaboración digital de las figuras y a dos revisores anónimos por sus excelentes comentarios.
LITERATURA CITADA
Arias, S., Gama, S., y Guzmán–Cruz, L.U., 1997. "Cactaceae". In: Dávila, P., Villaseñor, J.L., Medina, R. y Téllez, O. (Eds.). Flora del Valle de Tehuacán–Cuicatlán, fascículo 14. Universidad Nacional Autónoma de México, México, DF. pp. 1–146. [ Links ]
Baltasar, V.M. y Endress K.P., 2002. "Reproductive structures and systematics of Buxaceae". Bot. J. Linn. Soc., 140: 193–228. [ Links ]
Barthlott, W. y Hunt, D.R., 1993. "Cactaceae". In: Kubitzki K., Rohmer, J.G. y Bittridi, V. (Eds.). The families and Genera of Vascular Plants. Springer–Verlag, Berlin. pp. 161–197. [ Links ]
Bernardello, G., 2007. "A systematic survey of floral nectaries". In: Nicolson, S.W., Nepi, M. y Pacini, E. (Eds.). Nectaries and Nectar. Springer, New York, New York. pp. 19–128. [ Links ]
Boke, H.N., 1963. "Anatomy and development of the flower and fruit of Pereskia pititache". Amer. J. Bot., 50: 843–858. [ Links ]
––––––––––, 1966. "Anatomy and development of the flower and fruit ofPereskia aculeate". Amer. J. Bot., 53: 534–542. [ Links ]
––––––––––, 1968. "Anatomy and development of the flower and fruit of Pereskia Diaz–Romeroana". Amer. J. Bot., 55: 1254–1260. [ Links ]
Bravo–Hollis, H., 1978. Las Cactáceas de México. Vol. I. Universidad Nacional Autónoma de México. México, DF. [ Links ]
Buxbaum, F., 1953. Morphology of Cacti. Section II: Flower. Abbey Garden Press, Pasadena, California. [ Links ]
Clark–Tapia, R. y Molina–Freaner F., 2004. "Reproductive ecology of the rare clonal cactus Stenocereus eruca in the Sonoran desert". Pl. Syst. Evol., 247: 155–164. [ Links ]
Del Castillo, R. y González–Espinosa, M., 1988. "Una interpretación evolutiva del polimorfismo sexual de Opuntia robusta (Cactaceae)". Agrociencia, 71: 185–196. [ Links ]
Díaz, L. y Cocucci, A.A., 2003 "Functional gynodioecy in Opuntia quimilo (Cactaceae), a tree cactus pollinated by bees and hummingbirds". Pl. Biol. 5: 531–539. [ Links ]
Dickison, W.C., 1975 "Studies on the floral anatomy of the Cunoniaceae". Amer. J. Bot., 62: 433–447. [ Links ]
––––––––––, 1993. "Floral and anatomy of the Styracaceae, including observations on intra–ovarian trichomes". Bot. J. Linn. Soc., 112: 223–255. [ Links ]
Endress, P.K., 1994. Diversity and Evolutionary Biology of Tropical Flowers. Cambridge University Press. Cambridge, Massachusetts. [ Links ]
Esau, K., 1987. Anatomía de las Plantas con Semilla. Ed. Hemisferio Sur S.A., Buenos Aires. [ Links ]
Fahn, A., 1979. Secretory Tissues in Plants. Academic Press, San Francisco. [ Links ]
Fleming, T.H., Maurice, S., Buchmann, S.L. y Tuttle, M.D., 1994. "Reproductive biology and relatives male and female fitness in a trioecious cactus, Pachycereus pringlei (Cactaceae)". Amer. J. Bot., 81: 858–867. [ Links ]
Flores R., L.H., 2005. Esterilidad masculina en Opuntia stenopetala (Cactaceae). Tesis de Maestría. Facultad de Ciencias. Universidad Nacional Autónoma de México. México, DF. [ Links ]
Fuentes–Pérez, M., 2004. Anatomía floral de siete especies de la tribu Pachycereeae (Cactaceae). Tesis de Licenciatura. Facultad de Estudios Superiores Iztacala. Universidad Autónoma de México. México, DF. [ Links ]
Guzmán–Cruz, U., Arias, S. y Dávila, P.D., 2003. Catálogo de Cactáceas Mexicanas. Universidad Nacional Autónoma de México y Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México, DF. [ Links ]
Haberlandt, G., 1914. Physiological Plant Anatomy. MacMillan Co., London. [ Links ]
Hanf, M., 1935. "Vergleichende and Cactaceae eitwichulungsgeschichtliche. Untersuchungen über Morphologie und Anatomie der Griffel und Griffelläste". Bei. Bot. Z. A., 54: 99–141. [ Links ]
Hardy, R.CH., Stevenson, M.W.D. y Kiss G.H., 2000. "Development of the gametophytes, flower, and vasculature in Dichorisandra thyrsiflora. (Commelinaceae)".Amer. J. Bot., 87: 1228–1239. [ Links ]
Hermann, M.P. & Palser, F.B., 2000. "Stamen development in the Ericaceae. I. Anther wall, microsporogenesis, inversion, and appendages". Amer. J. Bot., 87: 934–957. [ Links ]
Hernández–García, G. y García–Villanueva, E., 1991. "Anatomía comparada de óvulos y semillas de dos especies del género Mammillaria (Cactaceae)". Bol. Soc. Bot. México, 51: 25–38. [ Links ]
Mauseth, J.D., 2005. "Anatomical features, other than wood, in Opuntioideae (Cactaceae)". Haseltonia, 11: 113–125. [ Links ]
Media Cybernetics, 1997. Image Pro Plus, Reference Guide. Version 3.0 for Windows. Silver Spring, Maryland. [ Links ]
Mione, T. y Bogle, L.A., 1990. "Comparative ontogeny of the inflorescence and flower of Hamamelis virginiana and Loropetalum chinense (Hamamelidaceae)". Amer. J. Bot., 77: 77–91. [ Links ]
Monje, P.V. y Baran, E.J., 2004. "Complex biomineralization pattern in Cactaceae". J. Pl. Physiol., 161: 121–123. [ Links ]
Núñez–Mariel, C., Engleman M.E. y Márquez–Guzmán, J., 2001. "Embriología de Pachycereus militaris (Audot) Hunt (Cactaceae)". Bol. Soc. Bot. México, 51: 25–38. [ Links ]
Nyffeler, R., 2002. "Phylogenetic relationship in the cactus family (Cactaceae) based on evidence from trnK/matK and trnL–trnF sequences". Amer. J. Bot., 89: 312–326. [ Links ]
Orozco A., G., 2005. Clonación de TSL en STY en Opuntia stenopetala. Dos genes asociados al desarrollo del estilo y estigma. Tesis de Maestría. Facultad de Ciencias. Universidad Nacional Autónoma de México. México, DF. [ Links ]
Pascal, M.L., Motteflorac, F.E. y Mackey, B.D., 2000. "Secretory structures on the leaf rachis of Caesalpieae and Mimosoideae (Leguminosae): Implications for the evolution on nectary glands". Amer. J. Bot., 87: 327–338. [ Links ]
Pimienta–Barrios, E. y Del Castillo, R.F., 2002. "Reproductive biology". In: Nobel, P.S. (Ed.). Cacti: Biology and Uses. University of California Press. Berkeley. pp. 75–90. [ Links ]
Ross, R., 1982. "Initiation of stamens, carpels, and receptacle in the Cactaceae". Amer. J. Bot., 69: 369–379. [ Links ]
Rudall, P., 1992. Anatomy of Flowering Plant. Cambridge University Press. New York. [ Links ]
Ruzin, E.S., 1999. Plant Microtechnique and Microscopy. Oxford University Press, New York, New York. [ Links ]
Scheinvar, L., 2004. Flora cactológica del estado de Querétaro. Fondo de Cultura Económica. México, DF. [ Links ]
Silva M., J.A., 2007. Embriología de Opuntia robusta Wendland (Cactaceae). Tesis Licenciatura. Facultad de Ciencias. Universidad Nacional Autónoma de México. México, DF. [ Links ]
Strittmatter, L.I., Negrón–Ortiz, V. y Hickey, R.J., 2002. "Subdioecy in Consolea spinosissima (Cactaceae): breeding system and embryological studies". Amer. J. Bot., 89: 1373–1387. [ Links ]
Taylor, N.P., Stuppy, W. y Barthlott, W., 2002. "Realignment and revision of the Opuntioideae fo Eastern Brazil". In: Hunt, D. y Taylor, N. (Eds.). Studies in the Opuntioideae (Cactaceae). Succulent Plant Research vol. 6. Milborne Port Sherbone, England. pp. 99–132. [ Links ]
Terrazas, T. y Mauseth, D.J., 2002. "Shoot anatomy and morphology". In: Nobel, P. (Ed.). Cacti: Biology and Uses. California University Press, Los Angeles, Califormia. pp. 23–40. [ Links ]
Tiagi, D.Y., 1955. "Studies in floral morphology, II vascular anatomy of the flower of certain species of the Cactaceae". J. Indian Bot. Sci., 34: 408–428. [ Links ]
Valiente–Banuet, A., Rojas–Martínez, A., Casas, A., Arizmendi, M.C. y Dávila, P., 1997. "Pollination biology of two–winter–blooming giant columnar cacti in the Tehuacan valley, central Mexico". J. Arid Environ., 37: 331–341. [ Links ]
Wallace, R.S. y Dickie, S.L., 2002. "Systematic implications of chloroplast DNA sequence variation in subfa. Opuntioideae (Cactaceae)". In: Hunt, D. y Taylor, N. (Eds.). Studies in the Opuntioideae (Cactaceae). Succulent Plant Research vol. 6. Milborne Port Sherbone, England. pp. 9–24. [ Links ]
Weberling, F., 1992. Morphology of Flowers and Inflorescences. Cambridge University Press, Cambridge, Massachusetts. [ Links ]














