Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
 Similares en SciELO
Similares en SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.4b Ensenada dic. 2011
Estudio de la relación entre la producción total de huevos, la biomasa de hembras reproductoras y el reclutamiento del bacalao (Gadus morhua) de Flemish Cap*
Study of the relationship between total egg production, female spawning stock biomass, and recruitment of Flemish Cap cod (Gadus morhua)
A Pérez–Rodríguez1*, MJ Morgan2, RM Rideout2, R Domínguez–Petit1, F Saborido–Rey1
1 Instituto de Investigaciones Marinas, Eduardo Cabello 6, Vigo, Pontevedra 36208, Spain.* Corresponding author. E–mail: fonsilei@iim.csic.es
2 Northwest Atlantic Fisheries Centre, 80 East White Hills Road, St. John's, Newfoundland & Labrador, A1C 5X1, Canada.
Received May 2010
Accepted December 2010
RESUMEN
En los modelos de la relación población–reclutamiento, la biomasa de la población reproductora (SSB) se ha supuesto tradicionalmente como equivalente a la producción total de huevos (TEP); sin embargo, en la última década se han presentado una serie de estudios que apuntan a la necesidad de incluir una mayor complejidad biológica en las medidas de potencial reproductivo, abogando por el uso de TEP en lugar de SSB. Para estimar TEP se suele usar la relación entre la talla y la fecundidad. En este caso, las ecuaciones empleadas para estimar la biomasa de hembras reproductoras (FSSB) y TEP difieren sólo en los coeficientes que determinan la fecundidad y el peso en relación con la talla corporal de la hembra. En este estudio se estimaron TEP y FSSB del bacalao (Gadus morhua) en Flemish Cap en el periodo de 1978 a 2008. Se calculó TEP usando seis diferentes relaciones de talla y fecundidad aplicadas a toda la serie temporal. Una mayor diferencia entre los coeficientes alométricos de las relaciones talla–peso y talla–fecundidad resultó en una menor correlación entre FSSB y TEP. La serie temporal de TEP, usando el coeficiente alométrico más alto de la fecundidad, explicó una mayor proporción de la varianza del reclutamiento. A pesar de este patrón, la correlación entre FSSB y TEP fue siempre mayor que 0.96. Estos resultados apoyan la necesidad de obtener estimaciones anuales de la fecundidad potencial y estudiar su relación no sólo con la talla sino también con otras variables como la condición para obtener una mejora en la estimación de TEP como variable predictiva del reclutamiento.
Palabras clave: potencial reproductivo, reclutamiento, fecundidad, maduración, proporción de sexos.
ABSTRACT
In stock–recruitment relationships, spawning stock biomass (SSB) has traditionally been assumed to be equivalent to total egg production (TEP); however, in the last decade a number of studies have indicated the need to include more biological complexity in measures of reproductive potential and advocate the use of TEP instead of SSB. The relationship between fecundity and length is often used to estimate TEP. In that case, the equations used to estimate female spawning stock biomass (FSSB) and TEP only differ in the coefficients determining the fecundity and weight relationships with length. In the present paper, TEP and FSSB have been estimated for Flemish Cap cod (Gadus morhua) for the period from 1978 to 2008. Total egg production was calculated using six different fecundity–length relationships applied to the whole time series in each case. A greater difference between the allometric coefficient in the weight–length and fecundity–length relationships led to a lower correlation between FSSB and TEP. The TEP time series using higher fecundity allometric coefficients explained a greater proportion of recruitment variance. Despite this pattern, correlation between FSSB and TEP was always higher than 0.96. These results support the necessity of making annual estimates of potential fecundity and studying its relation not only to length but to other variables, such as fish condition, in order to really get an improvement of TEP over FSSB as a predictive variable in recruitment assessments.
Key words: reproductive potential, recruitment, fecundity, maturation, sex ratio.
INTRODUCCIÓN
Las formulaciones teóricas originales de los modelos de la relación población–reclutamiento usaron la producción total de huevos (TEP, por sus siglas en inglés) como un índice representativo de la parte poblacional de estos modelos. Posteriormente, TEP fue reemplazado por la biomasa de la población reproductora (spawning stock biomass, SSB) debido a una presunta proporcionalidad entre SSB y TEP, así como a la mayor facilidad de obtener estimaciones de SSB often exist, observations around such relationships are usually highly variable. Explanations for poor correlation include a lack of good quality data, autocorrelation in time series, environmentally induced variation in fertilization, and early life history success, or failure, of stock indices to accurately reflect the stock reproductive capacity (Kraus 2002). The proportionality between SSB and TEP has been challenged in recent years and in some cases alternative indices of stock reproductive potential (SRP) that are better related to recruitment than SSB have been developed (Marshall 1998, Trippel 1999, Marshall et al. 2003).
Aspectos tanto cualitativos como cuantitativos influyen en el potencial reproductivo de una población íctica (Trippel 1999), y es necesario entender ambos para lograr un manejo sustentable de las pesquerías (Köster et al. 2003, Marshall et al. 2003). Desde una perspectiva cualitativa, los diferentes atributos de la población adulta, como la diversidad de edades y la edad promedio de los individuos desovantes (Saborido–Rey et al. 2004, Scott et al. 2006), pueden afectar la probabilidad de supervivencia de los huevos y las larvas (Solemdal 1997, Marteinsdottir y Steinarsson 1998). El aspecto cuantitativo se refiere a los atributos que afectan la TEP, incluyendo parámetros individuales, como la condición y longitud corporal, así como aspectos poblacionales, como la razón de sexos y la proporción de hembras maduras por edades.
La TEP de una población se puede estimar como:

donde N es el número de individuos, SR es la razón de sexos (proporción de hembras a la edad), Mat es la proporción de individuos maduros y Fec es la fecundidad potencial. En general, la fecundidad potencial se relaciona con la longitud (L) mediante la siguiente ecuación:

donde a y b son los parámetros de la ecuación: el parámetro de escala y el coeficiente de alometría, respectivamente.
En este caso, se emplea la fecundidad potencial para estimar TEP ya que el bacalao presenta fecundidad determinada (desovante sincrónico por grupos; Murua y Saborido–Rey 2003). En el caso de las especies con fecundidad indeterminada, se usaría la fecundidad parcial, y un parámetro adicional que indica el número de puestas se introduciría en la ecuación.
Por otro lado, la biomasa de hembras reproductoras (FSSB) se puede estimar como:

donde W es el peso medio. El peso comúnmente se relaciona con la longitud mediante la siguiente ecuación alométrica:

A partir de las ecuaciones 1 y 3, se puede ver que:

Al sustituir Fec y W con las ecuaciones 2 y 4, entonces:

Con base en la ecuación 6, se puede concluir que si los coeficientes alométricos (parámetros b y b ) de ambas relaciones son muy similares, entonces TEP y FSSB serán similares y mostrarán curvas paralelas; por lo tanto, el análisis de estas ecuaciones puede proporcionar información sobre el potencial relativo de TEP y FSSB para predecir el reclutamiento.
El banco conocido como Flemish Cap se encuentra aislado del Gran Banco por el Flemish Pass (fig. 1). Este canal presenta profundidades superiores a los 1000 m y limita las migraciones hacia y desde el Gran Banco de las especies demersales de Flemish Cap, como el bacalao del Atlántico Gadus morhua (Templeman 1976, de Cárdenas–González 1996). En Flemish Cap un giro anticiclónico cuasi–permanente sirve para retener los huevos y las larvas y limita el intercambio con las poblaciones adyacentes durante la mayoría de los años (Konstantinov et al. 1985, Borovkov et al. 2006). Una intensa actividad pesquera comenzó después en Flemish Cap que en las zonas de pesca adyacentes, pero el establecimiento de una zona económica exclusiva de 200 millas por Canadá en 1978 resultó en un aumento drástico del esfuerzo de pesca y una disminución considerable de la abundancia de bacalao en este banco (Wells et al. 1984). A mediados de la década de los años noventa, la población de bacalao de Flemish Cap se colapsó y se impuso una moratoria en la pesca dirigida. Se estimó que la SSB se encontraba muy por debajo de la biomasa límite (Biim) en ese momento (Vázquez y Cerviño 2005); sin embargo, a partir de 2004 empezó a incrementar y desde 2005 contribuye a niveles de reclutamiento por encima del promedio (González–Troncoso y Fernández 2009). En 2009 se estimó que la biomasa de bacalao en Flemish Cap se encontraba por arriba de Biim por primera vez desde 1995 y en 2010 se volvió a abrir la pesquería dirigida al bacalao.

El presente trabajo tiene dos objectivos. El primero es evaluar la variabilidad anual del potencial reproductivo de la población de bacalao en Flemish Cap. Las estimaciones de TEP se comparan con FSSB y ambos parámetros se analizan en cuanto a su capacidad de predecir el reclutamiento a la edad 1. El segundo es examinar las similitudes en la forma de las relaciones fecundidad–longitud y longitud–peso y determinar cómo la variabilidad de estas relaciones afecta la habilidad relativa de TEP y FSSB para predecir el reclutamiento.
MATERIALES Y MÉTODOS
Los datos utilizados aquí provienen de dos campañas de investigación en Flemish Cap (fig. 1). El primero se realizó durante el invierno por el Departamento de Pesca y Océanos de Canadá y abarca los años de 1978 a 1985. El segundo inició en junio/julio de 1988 y continúa a la fecha como parte de un programa de muestreo de la Unión Europea, con la participación de España y Portugal. Por tanto, la serie de tiempo empleada en este estudio abarca el periodo de 1978 a 2008.
La TEP se determinó para cada año de la serie temporal como:

donde TEPa es la TEP a la edad a, estimada según la ecuación 1.
Asimismo, FSSB se calculó para cada año según:

donde FSSBa es la FSSB a la edad a, determinada según la ecuación 3.
Los números poblacionales a la edad se obtuvieron a partir de una evaluación de estas poblaciones basada en XSA para el periodo de 1978 a 1987 (Vázquez y Cerviño 2001, 2002) y en un modelo bayesiano para el periodo de 1988 a 2008 (González–Troncoso y Fernández 2009). La TEP y FSSB fueron estimadas para las edades de 1 a 8+, correspondiendo al intervalo de edades de la evaluación. El reclutamiento anual se definió como la abundancia estimada a la edad 1.
El peso y la talla medios a la edad se estimaron sólo para las edades con más de cinco individuos. En vista de que no había datos disponibles para 1986 y 1987, se utilizó el valor medio de años contiguos. Para la estimación de TEP y FSSB se usaron datos de longitud media y peso medio, respectivamente. Tales datos también se usaron para ajustar el modelo alométrico relacionando el peso y la longitud (ecuación 4).
El estado de madurez se determinó macroscópicamente en los muestreos canadienses e histológicamente en los muestreos europeos (Saborido–Rey y Junquera 1998). Los métodos supuestamente proporcionaron resultados consistentes para toda la serie de tiempo (Saborido–Rey et al. 2004). En el otoño de 1996, el muestreo canadiense en Flemish Cap se realizó usando el método macroscópico para determinar el estado de madurez, lo que permitió una comparación con el muestreo español de julio. Las estimaciones de la edad y la longitud a 50% de madurez (A50 y L50, respectivamente) en el periodo de desove de 1997 fueron similares para ambas campañas (A50: española 3.71, canadiense 3.98; L50: española 45.8, canadiense 46.2; las pequeñas diferencias probablemente se deben al crecimiento entre el verano y el otoño). Esto indica que los cambios de madurez en el tiempo son reales y no un resultado del cambio en metodología. El estado de madurez se modeló por cohorte usando modelos lineales generalizados con función de enlace (logit) y distribución de error binomial (McCullag y Nelder 1983). La edad se consideró una variable de clase. Los modelos resultantes fueron usados para estimar la probabilidad de ser maduro a cada edad en cada año, lo cual no fue posible para algunas edades de algunos años debido a lagunas en la serie de datos o porque algunas cohortes no se ajustaron significativamente al modelo. En tales casos, se usó el valor promedio de años contiguos.
La razón de sexos observada se calculó como la proporción de hembras a la edad. Estas proporciones fueron analizadas para efectos significativos de cohortes y edades usando modelos lineales generalizados con función de enlace (logit) y error binomial. En el ajuste se usaron sólo las combinaciones de cohorte y edad con al menos cinco observaciones, y sólo las edades de 1 a 9. La cohorte y la edad se modelaron como variables de clase. En este caso la edad se consideró una variable de clase por no existir una razón a priori para pensar que la razón de sexos cambiaría continuamente por edad. Los modelos ajustados se usaron para producir estimaciones de la razón de sexos por edad para cada cohorte. En el caso de las cohortes que no se ajustaron significativamente al modelo, se usó el promedio de las cohortes contiguas para obtener la proporción de hembras.
La relación entre la fecundidad y la longitud se analizó utilizando una forma linealizada de la ecuación 2 con base en datos transformados logarítmicamente. Los datos de fecundidad se estimaron mediante el análisis volumétrico de los ovarios recolectados durante los muestreos canadienses de 1979 y de 1982 a 1985 (Rideout y Morgan 2007); los parámetros a y b de las ecuaciones se muestran en la tabla 1.
Se ajustaron los modelos de Beverton y Holt (1957) y Ricker (1954) a las estimaciones de TEP y FSSB para evaluar su capacidad para predecir el reclutamiento.
RESULTADOS
La probabilidad de ser maduro resultó muy afectada por la edad en la mayoría de las cohortes examinadas (P < 0.001, fig. 2). Cada cohorte presentó un incremento notable en la probabilidad de ser maduro por edad, según lo demuestran el A50 de casi 6 años para la cohorte de 1972 y el valor de <3 años para la de 2002.
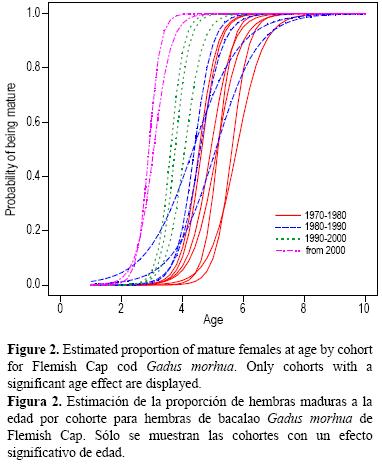
El efecto de edad en la proporción de hembras fue altamente significativo (χ2 = 35.2, g.l. = 8, P < 0.0001), la proporción de hembras generalmente incrementando con la edad (fig. 3). También se observó un efecto significativo de la cohorte en la proporción de hembras (χ2 = 70.8, g.l. = 24, P < 0.0001), con las cohortes más recientes presentando una mayor proporción de hembras. Un análisis preliminar mostró que el modelo no se ajustó a los datos de la cohorte de 1998, por lo que ésta no se incluyó en el análisis final.

Se observó un efecto significativo de la longitud sobre la fecundidad en cada año excepto 1982. Ya que el tamaño de muestra fue pequeño en varios años, se construyeron dos modelos nuevos incluyendo datos de 1979 a 1985 y de 1982 a 1985, los cuales también mostraron un incremento significativo con la longitud (tabla 1). Posteriormente se utilizaron los seis modelos significativos para estimar la TEP. Los coeficientes alométricos resultantes de estos modelos variaron de 3.19 a 4.42 (tabla 1).
La relación peso–longitud fue altamente significativa (P < 0.0001). La longitud total varió de 10.8 a 94 cm. Para este modelo, el coeficiente alométrico resultante (b = 3.29) fue ligeramente mayor que el menor coeficiente de fecundidad–longitud estimado (b = 3.19; tabla 1); sin embargo, en los demás modelos de fecundidad–longitud, los valores del coeficiente alométrico fueron mucho más altos.
La FSSB anual mostró fluctuaciones importantes durante el periodo de estudio (fig. 4). En promedio, la FSSB fue mayor que 10,000 t antes de 1996, pero menor que 2500 t desde entonces. La disminución más notable se presentó entre 1990 (17,300 t) y 1996 (1,700 t). El reclutamiento mostró un patrón similar, pero la disminución se observó más temprano, en 1992 (fig. 4). Se observó una gran diferencia en el número promedio de individuos reclutados antes (39.4 millones) y después (3.2 millones) de 1992.
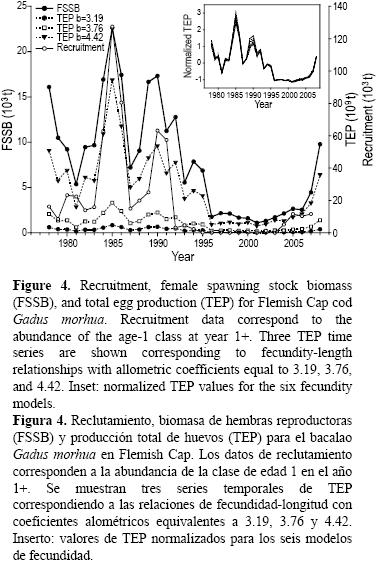
Se obtuvieron seis series de tiempo de TEP con base en las relaciones significativas de fecundidad–longitud. El patrón temporal descrito por las seis series fue similar (gráfica insertada en fig. 4, valores normalizados) ya que la mayor fluctuación en el periodo se debió a la abundancia y, por lo tanto, la biomasa. No obstante, la TEP difirió notablemente como lo demuestran los resultados de los tres modelos seleccionados, correspondiendo a las relaciones fecundidad–longitud con valores de coeficientes alométricos de 3.19, 3.76 y 4.42 (fig. 4), donde la TEP es hasta 20 veces mayor según el modelo de fecundidad empleado.
La FSSB y la TEP mostraron tendencias similares y reflejaron el patrón que se observó para el reclutamiento (fig. 4). El coeficiente de correlación de Pearson entre FSSB y TEP fue significativamente alto (tabla 2), mostrando que la variación temporal de TEP fue afectada por FSSB, i.e., la abundancia. A mediados de la década de los ochenta y a principios de los noventa se observaron picos de reclutamiento, TEP y FSSB; sin embargo, de 1992 a 1995, se observaron incrementos en TEP y FSSB pero no en reclutamiento. El reclutamiento, la TEP y la FSSB permanecieron bajos desde principios y mediados de los noventa hasta el final de la serie de tiempo, cuando los tres mostraron una tendencia al aumento.
La FSSB y las seis series temporales de TEP se ajustaron individualmente a los datos de reclutamiento usando los modelos de Beverton–Holt y Ricker. La proporción de varianza explicada aumentó al incluir TEP en el modelo en vez de FSSB, excepto en el caso del modelo de Ricker con un valor de b de 3.19 (tabla 2). El coeficiente de determinación mostró que la predicción de reclutamiento mejoró notablemente cuando la relación fecundidad–longitud se apartó más de la relación peso–longitud, i.e., en 1984 cuando los coeficientes alométricos fueron 4.42 y 3.29, respectivamente.
DISCUSIÓN
El patrón de maduración de G. morhua en Flemish Cap ha sufrido cambios, con los individuos actualmente madurando a menor edad que a principios de la serie de tiempo. En décadas recientes, varios estudios han descrito reducciones similares en la edad y la longitud de madurez en poblaciones explotadas de G. morhua (Saborido–Rey y Junquera 1998, Jergensen 1990, Trippel et al. 1997). Esta maduración temprana se ha relacionado con un componente ecológico que opera a través de la plasticidad fenotípica así como con un componente evolucionario que trabaja mediante la adaptación genética (Dieckmann y Heino 2007). En el caso de G. morhua en Flemish Cap, ambos factores podrían haber trabajado juntos para producir los cambios en la maduración, resultando en una población que madura a menor edad pero a una talla similar que a principios de la década de los años noventa (Pérez–Rodríguez 2010).
Asimismo, la razón de sexos varió a lo largo de la serie de tiempo. En las cohortes anteriores, la proporción de machos era mayor que la de hembras a las primeras edades, patrón que se ha invertido en las cohortes más recientes. También se han observado cambios en la razón de sexos en otras poblaciones de bacalao (Jakobsen y Ajiad 1999, Morgan y Brattey 2005). Según Jakobsen y Ajiad (1999), el mayor reclutamiento de machos podría resultar en la predominancia de éstos en la razón de sexos de jóvenes. Mediante una simulación, estos autores encontraron que el mejor ajuste a los datos observados se obtuvo bajo la suposición de una mayor mortalidad de machos que de hembras durante el desove. Esta observación combinada con el hecho de que los machos maduran aproximadamente un año antes que las hembras podría explicar el incremento en la proporción de hembras con la edad; sin embargo, en el caso del bacalao de Flemish Cap, se ha observado una mayor proporción de hembras no sólo en edades más avanzadas sino también en edades más tempranas desde principios de la década de los noventa. Aún se desconoce la razón de esto.
En el presente trabajo, cada serie temporal de TEP usó una sola relación fecundidad–longitud para todos los años. Esto supone que la fecundidad por longitud no ha cambiado en el tiempo. Aun con este supuesto, se evidenciaron cambios grandes en el potencial reproductivo del bacalao de Flemish Cap. Se observó una correlación alta entre FSSB y TEP, las cuales mostraron un incremento a mediados de la década de los ochenta y a principios de los noventa y los niveles más bajos a partir de finales de la década de los noventa. El reclutamiento mostró una tendencia similar y se correlacionó con tanto TEP y FSSB. La TEP estimada usando un exponente alométrico mayor que el de la relación peso–longitud explicó una proporción más alta de la variación del reclutamiento que FSSB, y esta diferencia en la capacidad explicativa aumentó con la diferencia entre exponentes.
A finales de la década de los años setenta, la Comisión Internacional para las Pesquerías del Atlántico Noroccidental inició un programa de investigación de las causas de variación en la fuerza de las clases de edad de peces demersales (Lilly 1986). La población de bacalao en Flemish Cap fue seleccionada para tal estudio debido, entre otras razones, a las fluctuaciones observadas en la fuerza de las clases anuales.
La fuerza del viento (Akenhead 1982), la temperatura del agua (Hayes et al. 1977) y la fuerza del giro anticiclónico fueron consideradas las variables ambientales que determinan el grado del reclutamiento anual de bacalao (Serebryakov et al. 1987). Se planteó que la emergencia de clases anuales muy fuertes se relaciona más con las condiciones hidrográficas que con la condición de la población desovante (Borovkov et al. 2006). No obstante, los resultados del presente estudio muestran que existe una relación población–reclutamiento usando tanto FSSB como TEP.
La alta correlación observada para las series de tiempo de TEP y FSSB se puede atribuir a varias causas. Una podría ser la similitud entre los valores de los parámetros b y b obtenidos en los modelos alométricos. Como se muestra en las ecuaciones 1 a 6, entre más cercano sea el valor del coeficiente alométrico que define la relación peso–longitud de la ecuación 4 (parámetro b') al que define la relación fecundidad–longitud de la ecuación 2 (parámetro b), mayor será la similitud entre los valores de TEP y FSSB. El valor de b obtenido para toda la serie de datos (b' = 3.289) estuvo dentro del intervalo de los valores de b obtenidos en el periodo de 1979 a 1985. Así, la relación alométrica de fecundidad y peso con longitud fue similar para varios años en este intervalo de tiempo, produciendo valores similares en ambos lados de la ecuación 6.
Otro factor que podría haber causado las similitudes entre las curvas de FSSB and TEP es el uso de una sola relación fecundidad–longitud para toda la serie de tiempo. Los modelos de la relación fecundidad–longitud mostraron una variabilidad alta del coeficiente alométrico entre años en el periodo de 1978 a 1985. Estudios anteriores han mostrado que la fecundidad dependiente de la talla es un parámetro muy variable del bacalao del Atlántico noroccidental. Pinhorn (1984) encontró que los valores de b para G. morhua de alrededor de Terranova variaron de 1.27 a 3.73. Para el bacalao de Banco Georges, Alonso–Fernández et al. (2009) determinaron un coeficiente alométrico de 4.04 para individuos muestreados de 2006 a 2008. Stares et al. (2007) encontraron que el valor de b podía variar de 2.500 a 3.885 para bacalao de la división 3NO y de 2.598 a 3.824 para bacalao de la división 3Ps. En el presente estudio, algunos de los modelos de fecundidad presentaron valores del coeficiente alométrico dentro de tales intervalos; sin embargo, los valores obtenidos para 1983 y 1984 fueron mayores. Se ha documentado un valor de coeficiente igual a 5.00 para bacalao del Atlántico cultivado (Skjaraasen et al. 2006), por lo que los valores altos observados en el presente estudio son factibles. El incremento en la correlación entre TEP y reclutamiento relacionado con el aumento en el valor de b sustenta la idea de un valor usualmente alto para este parámetro del bacalao de Flemish Cap. Por otro lado, se piensa que hasta 33% de las hembras de bacalao no desovaron (i.e., fecundidad = 0) durante el periodo de 1978 a 2004 (Rideout et al. 2006). La incorporación de tal variabilidad anual potencial en la fecundidad debería producir una estimación más realista de TEP y resultaría en un mayor desacoplamiento de la serie temporal de TEP en relación con FSSB. Desafortunadamente no se han recolectado datos de fecundidad para esta población en décadas recientes. Resulta incierto si el uso de tales datos mejoraría las predicciones de reclutamiento usando TEP en comparación con FSSB.
Otra razón que puede haber contribuido a las similitudes entre TEP y FSSB es el hecho de que la longitud por sí sola podría no ser el mejor predictor de la fecundidad. Estudios anteriores sobre el bacalao del Atlántico noroccidental han mostrado que la fecundidad es un parámetro muy variable en relación no sólo con la longitud sino también con el peso o la condición (Marshall 1998, Skjaraasen et al. 2006, Lambert y Dutil 1997, Lambert 2000, Alonso–Fernández et al. 2009). Se han observado gran cambios en la abundancia y estructura de la población de bacalao en Flemish Cap desde principios de la década de los años setenta. La densidad poblacional es un mecanismo importante que regula la dinámica de las poblaciones de peces marinos (Trippel 1995, Tyler et al. 1997) mediante procesos dependientes de la densidad (Rose et al. 2001), y afecta varios parámetros de historia de vida, como el crecimiento y la madurez (Roff 1984). En el momento que colapsó la población de bacalao en Flemish Cap, los parámetros reproductivos y la tasa de crecimiento mostraron cambios muy importantes (Saborido–Rey y Junquera 1998, 1999) que podrían atribuirse a cambios tanto en la plasticidad fenotípica como genéticos (Pérez–Rodríguez 2010). Acoplado a cambios de crecimiento, la condición de los individuos desovantes debería variar (Rijnsdorp 1990). Este cambio en la condición podría producir cambios en la fecundidad o hasta un fracaso en el desove (Marshall 1998, Rideout et al. 2006, Lambert y Dutil 1997, Blanchard et al. 2003).
A pesar de la importancia de las estimaciones de la fecundidad potencial para el manejo de pesquerías (Morgan 2008), pocas veces se han realizado de forma rutinaria para muchas poblaciones (Tomkiewicz et al. 2003), y sólo existen series temporales de estimaciones de fecundidad que pueden utilizarse para calcular la TEP para unas cuantas poblaciones. Sin embargo, las recientes mejoras en los sistemas de análisis de imágenes y el desarrollo del método autodiamétrico han resultado en métodos más rápidos y menos costosos para contar el número de huevos (Alonso–Fernández et al. 2009, Lambert 2008). En el periodo del año cuando se realizan los muestreos europeos en Flemish Cap, el bacalao se encuentra en la etapa de descanso, lo cual imposibilita la estimación de la fecundidad. La reapertura de la pesquería de bacalao en Flemish Cap permitirá el muestreo de individuos en el periodo de predesove y evaluar de forma rutinaria la fecundidad potencial usando nuevas técnicas.
Finalmente, la TEP abarca el aspecto cuantitativo del potencial reproductivo. Una posible ventaja de utilizar TEP en vez de otras medidas como FSSB es que estará fuertemente ligada al conocimiento de la fecundidad anual. Para una predicción más detallada de la fecundidad potencial individual probablemente será necesario contar con datos de la condición y peso. Juntar estos factores y otros parámetros demográficos que ya son comúnmente cuantificados para poblaciones ícticas explotadas permitirá una medición más precisa del potencial reproductivo y así mejorar la capacidad de predecir el reclutamiento.
AGRADECIMIENTOS
Este trabajo fue financiado y apoyado por el proyecto europeo "Fisheries–induced Evolution" (FinE, 044276) y por la acción COST "Fish Reproduction and Fisheries" (FRESH, FA0601). Se agradece a todas las personas involucradas en los muestreos y procesamiento de datos durante las campañas realizadas en Flemish Cap desde 1977, así como al comité editorial del I Simposio Iberoamericano de Ecología Reproductiva, Reclutamiento y Pesquerías (SIBECORP) el haber seleccionado nuestro estudio para su publicación en este número especial de Ciencias Marinas.
REFERENCIAS
Akenhead SA. 1982. Flemish Cap cod year class strength and environmental variables. NAFO SCR Doc. 82/VI/41. [ Links ]
Alonso–Fernández A, Carole Vallejo A, Saborido–Rey F, Murua H, Trippel EA. 2009. Fecundity estimation of Atlantic cod (Gadus morhua) and haddok (Melanogrammus aeglefinus) of Georges Bank: Application of the autodiametric method. Fish. Res. 99: 47–54. [ Links ]
Beverton RJH, Holt SJ. 1957. On the dynamics of exploited fish populations. Fish. Invest. Ser. 2 Mar. Fish, G.B. Minist. Agric. Fish. Food 19. [ Links ]
Blanchard JL, Kenneth TF, Simon JE. 2003. Effects of condition on fecundity and total egg production of eastern Scotian shelf haddock (Melanogrammus aeglefinus). Can. J. Fish. Aquat. Sci. 60: 321–332. [ Links ]
Borovkov VA, Vaskov AA, Karsakov AL. 2006. The impact of water circulation on the year–class abundance dynamics of redfish and cod on the Flemish Cap. J. Northwest Atl. Fish. Sci. 37: 127–134. [ Links ]
De Cárdenas–González E. 1996. Dynamics of the cod Gadus morhua L., 1758 population on Flemish Cap. Considerations regarding its isolation management. Ph.D. thesis, Complutense University of Madrid, 249 pp. [ Links ]
Dieckmann U, Heino M. 2007. Probabilistic maturation reaction norms: Their history, strengths, and limitations. Mar. Ecol. Prog. Ser. 335: 253–269. [ Links ]
González–Troncoso D, Fernández C. 2009. Assessment of the cod stock in the NAFO division 3M. NAFO SCR Doc. 09/34. [ Links ]
Hayes RM, Mountain DG, Wolfork TC. 1977. Physical oceanography and the abiotic influence on cod recruitment in the Flemish Cap region. NAFO SCR 77/VI/54. [ Links ]
Jakobsen T, Ajiad A. 1999. Management implications of sexual differences in maturation and spawning mortality of Northeast Arctic cod. J. Northwest Atl. Fish. Sci. 25: 125–131. [ Links ]
Jørgensen T. 1990. Long–term changes in age at sexual maturity of northeast Arctic cod (Gadus morhua L.). ICES J. Mar. Sci. 46: 235–248. [ Links ]
Konstantinov KG, Turuk TN, Plekhanova NA. 1985. Food links of some fishes and invertebrates on Flemish Cap. Sci. Counc. Stud. NAFO 8: 39–48. [ Links ]
Köster FW, Hinrichsen H–H, Schnack D, St. John MA, MacKenzie BR, Tomkiewicz J, Möllmann C, Kraus G, Plikshs M, Makarchouk A, Eero A. 2003. Recruitment of Baltic cod and sprat stocks: Identification of critical life stages and incorporation of environmental variability into stock–recruitment relationships. Sci. Mar. 67(Suppl. 1): 129–154. [ Links ]
Kraus G. 2002. Variability in egg production of cod (Gadus morhua) in the central Baltic Sea. Ph.D. thesis, University of Kiel, Germany, 91 pp. [ Links ]
Lambert Y. 2000. Energetic consequences of reproduction in Atlantic cod (Gadus morhua) in relation to spawning level of somatic energy reserves. Can. J. Fish. Aquat. Sci. 57: 815–825. [ Links ]
Lambert T. 2008. Why should we closely monitor fecundity in marine fish populations? J. Northwest Atl. Fish. Sci. 41: 93–106. [ Links ]
Lambert Y, Dutil J. 1997. Condition and energy reserves of Atlantic cod (Gadus morhua) during the collapse of the northern Gulf of St. Lawrence stock. Can. J. Fish. Aquat. Sci. 54: 2388–2400. [ Links ]
Lilly GR. 1986. A synopsis of research related to recruitment of cod and redfish on Flemish Cap. NAFO SCR Doc. 86/101. [ Links ]
Marshall T. 1998. Is spawner biomass a sensitive measure of the reproductive and recruitment potential of northeast Arctic cod? Can. J. Fish. Aquat. Sci. 55: 1766–1783. [ Links ]
Marshall T, O'Brien L, Tomkiewicz J, Köster F, Kraus G, Marteinsdottir G, Morgan J, Saborido–Rey F, Blanchard J, Secor D, Wright P, Mukhina N. 2003. Developing alternative indices of reproductive potential for use in fisheries management: Case studies for stocks spanning an information gradient. J. Northwest Atl. Fish. Sci. 33: 161–190. [ Links ]
Marteinsdottir G, Steinarsson A. 1998. Maternal influence on the size and viability of Iceland cod Gadus morhua eggs and larvae. J. Fish Biol. 52: 1241–1258. [ Links ]
McCullag P, Nelder JA. 1983. Generalized Linear Models. Chapman and Hall, London. [ Links ]
Morgan MJ. 2008. Integrating reproductive biology into scientific advice for fisheries management. J. Northwest Atl. Fish. Sci. 41: 37–51. [ Links ]
Morgan MJ, Brattey J. 2005. Effect of changes in reproductive potential on perceived productivity of three northwest Atlantic cod (Gadus morhua) stocks. ICES J. Mar. Sci. 62: 65–74. [ Links ]
Murua H, Saborido–Rey, F. 2003. Female reproductive strategies of marine fish species of the North Atlantic. J. Northwest Atl. Fish. Sci. 33: 23–31. [ Links ]
Pérez–Rodríguez A. 2010. Temporal trends in Flemish Cap demersal community. Implications in stock structure, dynamics and fisheries. Ph. D. thesis, University of Vigo, Spain. [ Links ]
Pinhorn AT. 1984. Temporal and spatial variation in fecundity of Atlantic cod (Gadus morua) in Newfoundland waters. J. Northwest Atl. Fish. Sci. 5: 161–170. [ Links ]
Ricker WE. 1954. Stock and recruitment. J. Fish. Res. Bd. Can. 11: 559–623. [ Links ]
Rideout R, Morgan MJ. 2007. Major changes in fecundity and the effect on population egg production for three species of northwest Atlantic flatfishes. J. Fish. Biol. 6: 1759–1779. [ Links ]
Rideout R, Morgan MJ, Lilly G. 2006. Variation in the frequency of skipped spawning in Atlantic cod (Gadus morhua) off Newfoundland and Labrador. Can. J. Fish. Aquat. Sci. 63: 1101–1110. [ Links ]
Rijnsdorp AD. 1990. The mechanism of energy allocation over reproduction and somatic growth in female North Sea plaice, Pleuronectes platesa L. Neth. J. Sea Res. 25: 279–290. [ Links ]
Roff DA. 1984. The evolution of life history parameters in teleost. Can. J. Fish. Aquat. Sci. 41: 989–1000. [ Links ]
Rose KA, Cowan JH, Winemiller KO, Myers RA, Hilborn R. 2001. Compensatory density dependence in fish populations: Importance, controversy, understanding and prognosis. Fish Fish. 2: 293–327. [ Links ]
Saborido–Rey F, Junquera S. 1998. Histological assessment of variations in sexual maturity of cod (Gadus morhua L) at the Flemish Cap (northwest Atlantic). ICES J. Mar. Sci. 55: 515–521. [ Links ]
Saborido–Rey F, Junquera S. 1999. Spawning biomass variation in Atlantic cod (Gadus morhua) in Flemish Cap in relation to changes in growth and maturation. J. Northwest Atl. Fish. Sci. 25: 83–90. [ Links ]
Saborido–Rey F, Morgan MJ, Domínguez R. 2004. Estimation of reproductive potential for Flemish Cap cod. NAFO SCR Doc. 04/61. [ Links ]
Scott BE, Marteinsdottir G, Begg GA, Wright PJ, Kjesbu OS. 2006. Effects of population size/age structure, condition and temporal dynamics of spawning on reproductive output in Atlantic cod (Gadus morhua). Ecol. Model. 191: 383–415. [ Links ]
Serebryakov VP, Astafjeva AV, Aldonov VK. 1987. USSR ichthyoplankton investigations on Flemish Cap. Sci. Counc. Stud. NAFO 11: 7–21. [ Links ]
Skjaraasen JE, Nilsen T, Kjesbu OS. 2006. Timing and determination of potential fecundity in Atlantic cod (Gadus morhua). Can. J. Fish. Aquat. Sci. 63: 310–320. [ Links ]
Solemdal P. 1997. Maternal effects, a link between the past and the future. J. Sea Res. 37: 213–227. [ Links ]
Stares JC, Rideout RM, Morgan MJ, Brattey J. 2007. Did population collapse influence individual fecundity of northwest Atlantic cod? ICES J. Mar. Sci. 64: 1338–1347. [ Links ]
Templeman W. 1976. Biological and oceanographic background of Flemish cap as an area for research on the reasons for year–class success and failure in cod and redfish. ICNAF Res. Bull. 12: 91–118. [ Links ]
Tomkiewicz J, Morgan MJ, Burnett J, Saborido–Rey F. 2003. Available information for estimating reproductive potential of northwest Atlantic groundfish stocks. J. Northwest Atl. Fish. Sci. 33: 1–21. [ Links ]
Trippel EA. 1995. Age at maturity as a stress indicator in fisheries. Bioscience 45: 759–771. [ Links ]
Trippel EA. 1999. Estimation of stock reproductive potential: History and challenges for Canadian Atlantic gadoid stock assessments. J. Northwest Atl. Fish. Sci. 25: 61–81. [ Links ]
Trippel EA, Kjesbu OS, Solemdal P. 1997. Effects of adult age and size structure on reproductive output in marine fishes. In: Chambers RC, Trippel EA (eds.), Early Life History and Recruitment in Fish Populations. Chapman and Hall, New York, pp. 31–62. [ Links ]
Tyler JA, Rose DA, Chambers RC. 1997. Compensatory responses to decreased young–of–the–year survival: An individual–based modelling analysis of winter flounder. In: Chambers C, Trippel E (eds.), Early Life History and Recruitment in Fish Populations. Chapman and Hall, London, pp. 391–422. [ Links ]
Vázquez A, Cerviño S. 2001. A review of the status of the cod stock in division 3M. NAFO SCR Doc. 01/60. [ Links ]
Vázquez A, Cerviño S. 2002. An assessment of the cod stock in NAFO division 3M. NAFO SCR Doc. 02/58. [ Links ]
Vázquez A, Cerviño S. 2005. A review of the status of cod stock in NAFO division 3M. NAFO SCR Doc. 05/38. [ Links ]
Wells R, Borges M, Vázquez A. 1984. Status of the cod stock in the division 3M. NAFO SCR Doc. 84/VI/94. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.
Traducido al español por Christine Harris.














