Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
 Similares en SciELO
Similares en SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.4b Ensenada dic. 2011
Producción potencial de huevos, reclutamiento y veda reproductiva de la anchoveta peruana (Engraulis ringens): Implicaciones en el manejo pesquero*
Potential egg production, recruitment, and closed fishing season of the Peruvian anchovy (Engraulis ringens): Implications for fisheries management
Á Perea*, C Peña, R Oliveros–Ramos, B Buitrón, J Mori
Instituto del Mar del Perú (IMARPE), Esq. Gamarra y Valle s/n Chucuito, Callao, Perú. * Corresponding author. E–mail: aperea@imarpe.pe.
Received May, 2010
Accepted September, 2011
RESUMEN
El éxito del reclutamiento de los recursos marinos, en especial de los de importancia comercial como la anchoveta peruana Engraulis ringens, está basado en la continua evaluación y toma de criterios de manejo pesquero. La estimación de la producción potencial de huevos (PPH) es una herramienta valiosa que, a diferencia de los índices reproductivos, cuantifica el desove incrementando la probabilidad de una mejor predicción del reclutamiento. Para el periodo 2000–2008 las hembras desovantes >14.0 cm de longitud total fueron las que tuvieron una mayor PPH, con 60% del total anual, aunque las hembras de 12.0–14.0 cm tuvieron una participación más importante debido a su mayor cantidad numérica durante los periodos de máxima actividad desovante. Durante los periodos de máximo desove se obtuvo 68% de la PPH total anual, donde cada grupo da talla aportó aproximadamente 50% de la puesta, mientras que durante el periodo de menor actividad fueron las hembras >14.0 cm las que mantuvieron el desove, llegando a contribuir 81% de la PPH en ese periodo. Los periodos de "veda reproductiva" protegieron 57% de la PPH, 22% en el verano y 35% en invierno–primavera constituyendo una eficaz medida de manejo que protege los periodos de máxima actividad reproductiva. Esta protección y un conocimiento cuantitativo del desove de la anchoveta, como el que proporciona la PPH, nos acercan cada vez más a la posibilidad de pronosticar el reclutamiento.
Palabras clave: Engraulis ringens, veda reproductiva, reclutamiento, manejo pesquero.
ABSTRACT
Recruitment success of commercially important marine resources, such as the Peruvian anchovy Engraulis ringens, is based on continuous assessment and fisheries management. Potential egg production (PEP) is a valuable tool that, unlike the reproductive índices, quantifies spawning activity and increases the likelihood of a better prediction of recruitment. From 2000 to 2008, spawning females >14.0 cm total length contributed largely to the annual PEP (more than 60%), while females ranging from 12.0 to 14.0 cm TL had a significant participation during peak spawning periods. During the main spawning periods, 68% of the total PEP was obtained, with each length group contributing 50% of this production, whereas during the period of low activity, females >14.0 cm were those that kept spawning, contributing 81% of PEP. The breeding–related closed fishing seasons protected 57% of PEP, 22% in summer and 35% in winter–spring; fishery closure is an effective management measure to protect the main reproductive activity. This protection and quantitative knowledge of the spawning of E. ringens, such as that provided by PEP, will help us to better understand the recruitment process and predict recruitment.
Key words: Engraulis ringens, closed season, recruitment, fishery assessment.
INTRODUCCIÓN
La anchoveta peruana, Engraulis ringens Jenyns 1842, es la especie que sustenta la pesquería monoespecífica más grande del mundo, considerada como la principal especie de mayor producción de pesca marina, con 7 millones de toneladas durante 2006 (FAO 2009), y la segunda en actividad extractiva generadora de divisas al Perú con un valor libre a bordo (FOB, por sus siglas en inglés), definido como el precio de venta que incluye el valor de la mercancía y los gastos de transporte y maniobra a nivel del comercio internacional, de 1456 millones de dólares americanos durante 2007 (INEI 2009). Debido a la gran importancia económica y social que implica la pesca de anchoveta, mantener niveles apropiados de biomasa es prioritario en su manejo pesquero.
Desde principios de la década de los cincuenta se dio inicio a la pesquería de anchoveta a gran escala. La anchoveta es una especie pelágica con longitud total (LT) máxima entre 20.0 y 20.5 cm (Jordán 1976, Palomares et al. 1987, Ñiquen et al. 2000, Bertrand 2005), de corta vida que alcanza aproximadamente los cuatro años (Palomares et al. 1987, Ñiquen et al. 2000, Bertrand et al. 2008), que se alimenta de plancton (Álamo 1989, Rojas de Mendiola 1989, Espinoza y Bertrand 2008), que vive formando agregaciones y/o cardúmenes de grandes densidades (Saetersdal y Valdivia 1964, Csirke 1989a, Bertrand et al. 2008) y presenta alta sensibilidad a la variabilidad ambiental (Jordán 1976, Chávez et al. 2003, Gutiérrez et al. 2007, Swartzman et al. 2008).
Los primeros estudios sobre la condición reproductiva de la anchoveta en el Perú se centraron en el conocimiento del periodo de desove de la especie, constituyendo ésta información básica sobre el estado del recurso. La anchoveta es una especie que desova parcialmente y presenta un máximo periodo de desove desde agosto hasta marzo (Santander y Flores 1983). La mayor intensidad del desove se produce en septiembre (Einarsson et al. 1966), durante el invierno austral, con un segundo máximo durante febrero y marzo (Saetersdal y Valdivia 1964, Csirke et al. 1996), correspondiente al verano austral.
El potencial reproductivo de la anchoveta presenta gran variabilidad temporal posiblemente debido a la composición de tamaños de la población presente durante el desove (Chirinos de Vildoso y Alegre de Haro 1969). El éxito de la reproducción depende de relaciones complejas entre una serie de factores ambientales y biológicos que interactúan entre sí (Jordán 1976).
Los indicadores del proceso reproductivo para la anchoveta comúnmente utilizados son el índice gonadosomático (IGS) y la fracción desovante (FD), correspondiendo esta última a un análisis histológico de ovarios que permite describir con precisión las fluctuaciones de la actividad reproductiva de la población de anchoveta (Buitrón y Perea 2000); sin embargo, éstos no son capaces de cuantificar el desove. La variabilidad en la puesta de la anchoveta repercute en la pesquería al ser uno de los factores más importantes en la determinación del ingreso de nuevas cohortes a la población o reclutamiento.
Desde los inicios de la pesquería industrial los modelos clásicos de Beverton y Holt (1957) y Ricker (1954) han intentado explicar la relación stock–reclutamiento (Sparre y Venema 1992). Sin embargo, a lo largo del tiempo se ha observado que la relación entre el tamaño del stock parental y el reclutamiento de las especies marinas no es significativa debido a que en el lapso entre ambos procesos existen cambios biológicos y ambientales que determinan el éxito o fracaso del reclutamiento (Csirke 1989b). En este sentido, el reclutamiento es una cadena de procesos y estadíos naturales que comienza con el desove y conituna con el proceso de fertilización, desarrollo de las fases de huevo, larvas, crecimiento y supervivencia de prereclutas y reclutas (Bakun y Broad 2002).
Con la finalidad de proteger el desove de la anchoveta y asegurar el futuro ingreso de individuos al stock pescable, con información del Seguimiento de la Pesquería del Instituto del Mar del Perú (IMARPE), se establecieron criterios para el ordenamiento de la pesquería de anchoveta (MIPE 1992) que incluyen dos periodos de cierre a la pesca al año denominados "veda reproductiva", en verano (febrero a marzo) e invierno–primavera (agosto a octubre).
El objetivo principal de este trabajo es el de cuantificar el desove y analizar la eficiencia de las vedas reproductivas sobre el éxito del reclutamiento y, por lo tanto, las implicaciones de este sistema de vedas en la ordenación pesquera de la anchoveta.
MATERIALES Y MÉTODOS
Datos y área de estudio
El estudio se realizó con información biológica–pesquera mensual de la población de anchoveta de la región norte–centro (5°–16° S) del Perú (Ñiquen et al. 2000) durante el periodo 2000–2008 (fig. 1). La información biológica fue obtenida de los muestreos mensuales de las capturas de anchoveta realizada en las principales áreas de pesca por los Laboratorios Costeros de IMARPE presentes en los puertos de Paita (5° S), Chimbote (9° S), Huacho (11° S), Callao (12° S) y Pisco (13° S).

Reconstrucción de la estructura poblacional
La información para la reconstrucción de la estructura poblacional mensual por tallas de anchoveta para el periodo 2000–2008 fue obtenida de cruceros de evaluación acústica (dos por año) y de la pesquería (muestreos mensuales). Se asume que la mortalidad natural y el crecimiento se aplican sobre cada pseudocohorte observada durante los cruceros (en clases de medio centímetro, entre 3.0 y 20.0 cm), y que la mortalidad por pesca corresponde al retiro de las capturas por la pesquería. La reconstrucción hacia adelante se realizó utilizando un modelo de decaimiento exponencial con capturas discretas
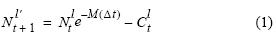
donde, para cada talla, Ntl'+1 es el número de peces de longitud l' en el tiempo t+1, Ntl es el número de peces de longitud l en el tiempo t, Ctl es la captura de individuos de longitud l durante el intervalo [t, t+1], M es la mortalidad natural con un valor de 0.8 año–1 (Ñiquen et al. 2000, IMARPE 2010) y l' es la longitud de los peces de longitud l luego de un paso de tiempo (un mes) dado según el modelo de crecimiento de von Bertalanffy (Sparre y Venema 1992):
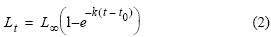
donde Lt es la longitud a la edad t, L∞, = 20.5 cm es la longitud asintótica de crecimiento (Jordán 1976, IMARPE 2010), k es la tasa de crecimiento mensual, k = 0.0717 mes–1 (Palomares et al. 1987, IMARPE 2010), y t0 = –0.14 mes es la edad teórica a la longitud 0 (IMARPE 2010). La reconstrucción hacia atrás se realizó de manera análoga, usando la ecuación:

En cada caso, l' fue aproximado a la marca de clase más cercana. De esta manera, iniciando con la biomasa y estructura por talla de un crucero, la población se reconstruye mensualmente a partir de dos subproyecciones, una hacia adelante mediante las ecuaciones 1 y 2, y una hacia atrás mediante las ecuaciones 2 y 3 hasta el siguiente crucero (seis meses). La estructura de tallas reconstruida se obtuvo tomando el valor máximo por longitud de las reconstrucciones hacia atrás y hacia adelante (para más detalles ver Peña 2010). La ventaja de este método es que utiliza directamente la información observada por los métodos directos de evaluación (crucero acústico y muestro biológico) e información de la pesquería, permitiendo reproducir la variabilidad observada en la población de anchoveta sin suposiciones paramétricas.
Durante el presente trabajo se utilizó información de biomasa/captura y tamaños de anchoveta proveniente de 20 cruceros de evaluación de recursos pelágicos (efectuados en verano e invierno) y 66 vectores de estructuras de tallas y capturas mensuales provenientes del Seguimiento de la Pesquería Pelágica. Considerando como punto de partida la estructura de tallas y biomasa acústica del crucero 9908–09 desarrollado durante agosto y setiembre de 1999, como punto final la información del crucero 0802–03 ejecutado de febrero a marzo de 2008 se contó también con datos de la pesquería entre cruceros.
De esta manera, se obtuvieron un total de 108 vectores mensuales de abundancia por tallas de anchoveta. Como la mayor parte de la población alcanza la madurez gonadal a partir de los 12.0 cm LT (Jordán 1976, Sharp y Csirke 1983, Pauly et al. 1989), cada vector fue separado en dos grupos, el primero formado por tallas de individuos jóvenes (≤11.5 cm) y el segundo por tallas de adultos (>12.0 cm).
El primer grupo, de ejemplares jóvenes de anchoveta (≤11.5 cm), fue subdividido en ejemplares reclutas o individuos que entran por primera vez a la pesquería, con un promedio de 8.0 cm de LT (IMARPE 1965), y prereclutas o individuos de 3.0 a 7.5 cm de LT. El segundo grupo, de adultos (≥12.0 cm), también fue subdividido por intervalos de talla, en uno de 12.0 a 14.0 cm y el otro de >14.0 cm, diferenciación de la fracción adulta que fue realizada por Lam (1968) para los estudios del contenido graso de la anchoveta, ya que existe una relación inversa entre éste y el desove; esta clasificación por grupos de talla ha sido extendida a los estudios reproductivos.
Proporción sexual y fracción desovante
La proporción sexual de hembras (cociente entre el número de hembras y el número total de individuos) fue calculada para cada talla de individuos adultos (≤12.0 cm) siguiendo la metodología de Bouchon et al. (2002) a partir de muestreos biológicos de rutina realizados en los principales puertos de desembarque. Basados en un muestreo aleatorio estratificado mensual por tallas realizado de 2000 a 2008, para la estimación de la fracción desovante se analizaron un total de 30,139 ovarios (284 mensuales en promedio) provenientes de anchovetas adultas (tabla 1). La fracción desaovante se obtuvo con hembras en condición de hidratación y, en base a análisis histológicos de ovarios, hembras que presentaron folículos postovulatorios de días 0 y 1 (Buitrón y Perea 2000). El proceso histológico consta de cortes de ovarios tratados mediante la técnica de infiltración en parafina (Humason 1979) y/o la técnica de congelación normalmente empleada en patología humana y animal, adaptada para la anchoveta utilizando un criostato portátil (Perea y Buitrón 2004, Perea et al. 2008), los cuales fueron observados bajo la luz de un microscopio compuesto. La fracción desovante (FD) se obtuvo mediante:
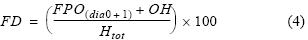
donde FD es la fracción desovante, FPO es el número de hembras con presencia de folículos post ovulatorios de días 0 y 1, OH es el número de hembras con ovarios hidratados y Htot el número total de hembras.
Con la información de los indicadores del proceso reproductivo índice gonadosomático (IGS) y FD se determinaron los periodos de menor y mayor actividad desovante de la anchoveta. Se consideró que las hembras se encontraban dentro de un máximo de desove cuando la FD superaba 19.8%, considerado como valor crítico, el cual corresponde a un punto de referencia para identificar un periodo principal de desove (Perea y Buitrón 1996).
Producción potencial de huevos
Se estimaron vectores mensuales de hembras desovantes por longitud mediante:

donde, HDi es número de hembras desovantes, Ni es el número total de individuos, PSi la proporción sexual de hembras y FDi es la fracción de hembras desovantes, todos referidos al intervalo de longitud.
Paralelamente se estimó la fecundidad parcial (E) utilizando el método descrito por Hunter y Goldberg (1980) en E. mordax y por Santander et al. (1984) en E. ringens. Para estimar este parámetro se utilizaron muestras de los cruceros de evaluación (tabla 2) realizados durante el invierno, cuando se registran los desoves principales. Con los valores reales de cada ovario se ajustaron los modelos de E para cada año. El modelo de fecundidad obtenido fue supuesto como valor único por año y permitió estimar valores de fecundidad por talla y mes para cada año. Finalmente, la producción potencial de huevos (PPH) mensual por tamaño se obtuvo mediante:

donde PPH es la producción potencial de huevos total de la población, Ei es la fecundidad parcial y HDi el número de hembras desovantes en cada intervalo con marca de clase l, respectivamente. Adicionalmente, se calculó la PPH para los individuos con tallas entre 12.0 y 14.0 cm y para individuos mayores a 14.0 cm.
Relación entre producción potencial de huevos y reclutamiento
Se realizó un análisis de correlación cruzada entre las series de PPH y las estimaciones mensuales de reclutas y prereclutas a fin de cuantificar la correlación entre ambas variables y el desfase con el cual se maximiza dicha correlación. Sólo se consideraron los desfases con correlaciones positivas al ser PPH la variable que explicaría los reclutamientos futuros.
Vedas reproductivas
Utilizando la información de los periodos de cierre de la pesquería de anchoveta por "veda reproductiva", establecidos mediante regulaciones del Ministerio de la Producción (PRODUCE) bajo la asesoría del IMARPE (tabla 3), se diferenció la serie de PPH en los periodos (1) de protección, correspondiente al desove durante la temporada de veda de verano e invierno–primavera y denominada PPH protegida, y (2) sin protección, o huevos producidos durante temporadas de pesca, llamada PPH sin protección.
Con el objetivo de determinar el efecto de la protección de la PPH mediante las vedas reproductivas sobre el posterior reclutamiento (fig. 2) se planteó un escenario en el cual a los meses con cierre de pesca por desove se les asignaron capturas medias mensuales iguales a las que se producen durante los meses de pesca suponiendo que se pierde el total de la PPH debido a la captura de los desovantes durante ese mes "sin" veda. La PPH resultante durante estos periodos de mayor actividad desovante fue sustraída, lo que repercutió luego en el ingreso de nuevos ejemplares reclutas a la pesquería.
RESULTADOS
Mediante el modelo de decaimiento exponencial se estimó la biomasa poblacional de anchoveta adulta (>12.0 cm) durante el periodo 2000–2008 con un promedio mensual de 356 millones de individuos, un valor máximo durante marzo de 2001 y un mínimo en enero de 2002.
Durante este periodo se registró un mayor número de machos (60%) en relación a las hembras (40%), observándose que esta diferencia varió anual y estacional–mente. Del total de hembras en la población sólo 15% en promedio se encontró en desove, con valores máximos durante los meses de invierno–primavera austral (fig. 3a).
La fracción desovante según intervalo de tallas mostró que hembras mayores de 14.0 cm tuvieron mayor proporción de desovantes, con 0.20 en promedio, respecto a individuos de 12.0 a 14.0 cm que mostraron un promedio de 0.14 (fig. 3b). Sin embargo, la superioridad numérica de este segundo grupo, que se incorpora durante los periodos de mayor actividad reproductiva, generó una mayor abundancia de hembras desovantes (53%) respecto a las mayores a 14.0 cm (fig. 3c).
El promedio de la PPH mensual durante el periodo evaluado fue de 2.5 × 1011, con un máximo de 9.5 × 1011 durante febrero de 2000 (fig. 4a). Las hembras >14.0 cm tuvieron una mayor PPH contribuyendo 60% al total anual, mientras que las hembras de 12.0–14.0 cm (a pesar de sus bajos valores de fecundidad parcial y FD respecto a las >14.0 cm) tuvieron una importante participación durante los periodos de máxima actividad desovante, principalmente en enero y febrero (verano) y de agosto a octubre (invierno), como resultado de su mayor cantidad numérica en estos periodos (fig. 4b).
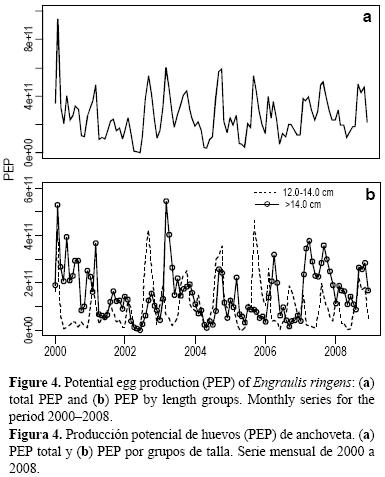
El análisis de correlación cruzada con la PPH mostró correlaciones significativas con los prereclutas con un desfase de 2 a 4 meses, con un máximo a los 3 meses (fig. 5a), pero no se encontraron correlaciones significativas con los reclutas (fig. 5b). Sin embargo, el mismo análisis considerando por separado la PPH de verano e invierno mostró correlaciones significativas tanto para prereclutas como para reclutas (fig. 5c–f). Con los prereclutas se observaron correlaciones significativas con retrasos de 9 y 10 meses en verano (fig. 5c) y 8 meses en invierno (fig. 5e); con los reclutas se observaron correlaciones significativas con retrasos de 9–15 meses en invierno (fig. 5f) y 10–13 meses en verano (fig. 5d), mostrando un máximo con retrasos de 14 meses en invierno y 11 meses en verano. Sin embargo, a pesar de encontrarse correlaciones más altas en las comparaciones por estaciones, los desfases con los que se encuentran las correlaciones más altas son posteriores a lo que se podría suponer a partir del crecimiento de la anchoveta y la definición de reclutas y pre–reclutas usada. Estos resultados nos hacen pensar que considerar por separado los huevos producidos en cada estación y su relación con los reclutamientos subsiguientes es algo que debe ser explorado con más detalle.
Cuando se analizó la PPH durante los ciclos reproductivos a través de las variaciones de los índices IGS y FD se encontró que 68% de la PPH se produjo durante los periodos de mayor actividad desovante, de febrero a marzo (verano) y de agosto a octubre (invierno), cuando cada grupo de hembras (12.0 a 14.0 cm y >14.0 cm) aportó aproximadamente 50% de esta puesta, mientras que durante los periodos de menor actividad (abril a julio y noviembre a enero) fueron las hembras >14.0 cm las que mantuvieron el desove, llegando al 81% de la PPH (tabla 4). Los valores máximos de PPH durante los periodos de actividad desovante se presentaron en 2000 y 2007 con 24.3 y 24.1 × 1011 huevos, respectivamente (tabla 4), mientras que durante los periodos de menor actividad los valores más bajos de PPH se obtuvieron en 2002 y 2004.
La variación mensual de PPH de 2000 a 2008 fue clasificada en periodos de protección (veda de verano e invierno–primavera) y periodo sin protección (temporada de pesca). Durante los periodos de cierre de la pesquería por veda reproductiva se protegió 57% de la PPH total, 22% en verano y 35% en invierno–primavera. La mayor PPH durante el desove principal de invierno–primavera fue aportada por individuos de 12.0 a 14.0 cm con el 54%, a diferencia del desove de verano cuando 64% de la PPH correspondió a individuos >14.0 cm (tabla 5). En este sentido, es de señalar que con los cierres actuales se protege 67% de la producción de huevos de las hembras de 12.0 a 14.0 cm, mientras que la protección de los huevos producidos por las hembras >14.0 cm sólo alcanzó el 50% debido a que su época de puesta y producción es mayor en periodos de menor intensidad de puesta (tabla 5).
Los mayores valores de la serie mensual de PPH se registraron de julio a noviembre (43%, fig. 6a). Aunque durante este periodo se desarrolló una temporada de pesca que afectó a la población, también existió un periodo de veda reproductiva durente el desove principal de invierno–primavera, de alrededor de tres meses de duración, en el que 35% de la PPH fue protegida. Si bien la protección no es total, resulta importante mostrar que en un escenario sin vedas reproductivas y suponiendo que no existiera protección alguna al desove el reclutamiento se vería definitivamente afectado (fig. 6b).
DISCUSIÓN
El desarrollo sostenible de la actividad pesquera requiere de una serie de exigencias en el manejo como una mejor información sobre la pesca y su entorno, sistemas de seguimiento, control y aplicación, medidas ante la variabilidad de los recursos naturales y la dinámica del ecosistema (FAO 2000). En este sentido Perú cuenta con una vasta información sobre la biología y pesquería de la anchoveta proveniente de un sistema diario de seguimiento que permite evaluar y tomar decisiones para el mejor uso del recurso, para lo cual la protección del desove y su futuro reclutamiento resulta un aspecto fundamental de manejo.
En la mayoría de los peces, la proporción sexual tiende a ser equilibrada, es decir, de 1 a 1 entre hembras y machos, aunque puede variar de año en año dentro de una misma población e inclusive puede experimentar cambios con el período reproductivo y con los grupos de tallas (Franco 1992). Si bien la proporción de sexos fue equilibrada en la serie, durante los periodos de desove se detectó la dominancia de machos. Hunter y Goldberg (1980) mencionan que durante los desoves los cardúmenes de anchoveta desovantes se ven dominados por individuos machos que serían capaces de proporcionar una suficiente oferta de semen que asegure la fecundación luego de los desoves. Estudios de proporción sexual según tallas realizados en anchoveta peruana por Jordán (1959), Einersson et al. (1966) y Alheit (1984), encontraron una dominancia de hembras, lo cual fue confirmado por Miñano (1969) aunque indicando que entre los individuos de 12.0 a 14.0 cm predominan los machos sobre las hembras al igual que lo encontrado en el presente trabajo.
El análisis de la proporción de hembras desovantes mostró que los individuos de mayor talla (>14.0 cm) mantienen una prolongada actividad reproductiva en comparación a las hembras desovantes pequeñas (12.0 a 14.0 cm, fig. 3b). Sin embargo, durante los periodos de mayor actividad reproductiva (de agosto a marzo) la abundancia de hembras desovantes pequeñas que se incorporan permite equiparar los aportes de ambos grupos desovantes a la PPH a pesar de tener éstas menos fecundidad parcial que las hembras más grandes (tabla 4, fig. 3c). Contrariamente, durante los periodos denominados de inactividad son los adultos de mayor talla los que mantienen el desove (tabla 4). La literatura ha reportado que las hembras grandes registran valores de fracción desovante sobre el nivel crítico aún durante los periodos de menor actividad desovante (Buitrón y Perea 2000), lo cual también ha sido descrito para otros peces pelágicos (Hunter y Macewicz 1985, Parrish et al. 1986, Trippel et al. 1997). Sin embargo, los estimados de PPH que cuantifican el desove demuestran que el aporte de las desovantes pequeñas a la PPH para el caso de la anchoveta peruana durante la época de mayor actividad reproductiva es igualmente importante; esto, más que una estrategia de la especie se explica por el constante ingreso de nuevos ejemplares que desovan por primera vez y renuevan la población adulta. Cabe mencionar que los estimados de PPH por cada grupo de desovantes muestra sólo el número potencial de huevos producidos por grupo. Los aspectos de calidad del huevo incluyendo el efecto maternal que éstos puedan tener, aún no han sido explorados y tienen un papel igualmente importante en la sobrevivencia y posterior reclutamiento. Recientemente se demostró que para la anchoveta peruana existe una correlación positiva y directa entre el tamaño de las hembras y el volumen de sus ovocitos (datos no publicados), lo cual podría estar ligado a una mayor probabilidad de éxito en el desarrollo y supervivencia del huevo y la larva proveniente de hembras de mayor talla. Estudios realizados en otras especies también mencionan la relación directa entre tamaño del progenitor y tamaño del ovocito, como por ejemplo en Gadus morhua (Vallin y Nissling 2000) y Merluccius hubbsi (Macchi et al. 2006). De esta manera, luego de la cuantificación del desove con la PPH, el siguiente paso sería explorar los aspectos ligados a la calidad de los ovocitos y huevos.
Los índices reproductivos FD e IGS no cuantifican el desove sino que sólo describen su variabilidad temporal, por lo cual no presentaron correlación significativa con los reclutamientos. Aunque la PPH sí cuantifica el desove, con este trabajo aún no es posible asegurar que un alto valor de PPH originará buenos reclutamientos. Sin embargo, la correlación cruzada encontrada con los prereclutas muestra indicios de que, explorando estadios más cercanos al reclutamiento y ajustando los parámetros apropiados, éstos podrían aportar mayores elementos para una mejor predicción. Por ende, su aplicación a la evaluación del recurso será de utilidad en las medidas de manejo.
En particular, la diferencia de correlaciones entre PPH y reclutamiento para los desoves asociados a diferentes estaciones (invierno y verano) sugieren que también existen procesos con variación estacional que deben ser incluidos en el estudio de la relación entre desove y reclutamiento. Por ejemplo, las temporadas de pesca afectan de manera distinta a los jóvenes de las diferentes cohortes dentro del año, y las diferencias estacionales en el crecimiento pueden tener tendencias opuestas para una misma cohorte en su estado de prerecluta y recluta.
Los resultados muestran que el desove producido durante invierno–primavera aportó valores de PPH superiores al resto del año, confirmándose que este recurso tiene su máximo desove entre agosto y octubre (Chirinos de Vildoso y Alegre de Haro 1969, Jordán 1980, Peña et al. 1989). La mayor magnitud del desove durante estos meses se debió tanto a la condición reproductiva de las hembras >14.0 cm como a la incorporación de hembras de 12.0 a 14.0 cm que desovan por primera vez y que, aunque contribuyen relativamente menos a la PPH, su abundancia es muy superior en relación a las hembras >14.0 cm.
Los resultados mostraron que durante el tiempo de actividad desovante se produjo en promedio 68% de la PPH anual, por lo que la ejecución de vedas reproductivas durante los meses de mayor actividad desovante son medidas regulatorias apropiadas que incrementan la probabilidad de tener buenos reclutamientos (tabla 5). Teniendo en cuenta ambas vedas reproductivas se protege alrededor de 67% del PPH producido por hembras de 12.0 a 14.0 cm mientras que la protección disminuye a 50% del PPH producido por las hembras más grandes. Sabiendo que la PPH tiene un aporte importante de los individuos >14.0 cm especialmente en época de menor actividad de puesta, ¿es éste acaso más importante que el de adultos de menor talla? Según Trippel et al. (1997) se debe tomar en cuenta la importancia de la talla de las hembras en el éxito del reclutamiento, ya que las hembras grandes comúnmente inician el desove antes que las pequeñas, se mantienen en actividad reproductiva por mayor tiempo y producen ovocitos más viables. Los resultados presentados en este estudio corroboran esos hallazgos ya que hembras más grandes mantienen la actividad reproductiva durante mayor tiempo y tienen una producción de huevos anual mayor (tablas 4, 5). Por lo tanto, las vedas reproductivas de la anchoveta protegen una gran proporción del desove del recurso, ya que al no verse afectado por la pesca, éste se realiza sin perturbaciones antropogénicas, que en el caso de la anchoveta peruana son muy intensas considerando que existen aproximadamente 1200 embarcaciones que se dedican a la captura del recurso (Fréon et al. 2008). Este impacto, aunque aún no es cuantificable, constituye una variable que afecta las agregaciones de cardúmenes en puesta al dispersar el recurso (Fréon y Misund 1999).
Luego del incremento del esfuerzo pesquero durante las décadas de los setentas y ochentas, actualmente 80% de las poblaciones mundiales de peces han sido registradas como plenamente explotadas o sobreexplotadas (FAO 2009). En la mayoría de países las normas de protección corresponden a limitar el esfuerzo pesquero, determinar límites de captura, regular las áreas de pesca y proteger a los jóvenes (European Commission 2010). En algunos casos no se toma en cuenta el periodo de desove, como en la pesquería de anchoveta en el mar Egeo, donde los picos de desove coinciden con la época de mayor presión pesquera (Kallianotis 1996). En este sentido, la aplicación de medidas de regulación del esfuerzo pesquero, sobre todo cuando la flota se incrementa ostensiblemente, contribuye a la recuperación de un recurso (Csirke et al. 1996, Uriarte et al. 1996) tal como sucedió con la recuperación de la anchoveta después de El Niño 1982–1983 al implantar normas que limitaron la mortalidad por pesca permitiendo su recuperación.
Considerando que la biomasa de peces pelágicos pequeños de vida corta, como la anchoveta, es altamente dependiente del éxito reproductivo (Bakun y Broad 2003), la aplicación de una "veda reproductiva” durante los periodos de máximo desove, como medida regulatoria de manejo en la pesquería de la anchoveta en el Perú, es eficaz para la protección del recurso.
REFERENCIAS
Alamo A. 1989. Stomach contents of anchoveta (Engraulis ringens), 1974–1982. In: Pauly D, Muck P, Mendo J, Tsukayama I (eds.), The Peruvian Upwelling Ecosystem: Dynamics and Interactions. ICLARM Conference Proceedings 18, pp. 105–108. [ Links ]
Alheit J, Alarcón VH, Macewicz BJ. 1984. Spawning frequency and sex ratio in the Peruvian anchovy, Engraulis ringens. CalCOFI Rep. 25: 43–52. [ Links ]
Bakun A, Broad K (eds.). 2002. Climate and Fisheries: Interacting Paradigms, Scales, and Policy Approaches. The IRI–IPRC Pacific Climate–Fisheries Workshop, Honolulu, Hawaii, 14–17 November 2001. [ Links ]
Bakun A, Broad K. 2003. Environmental "loopholes" and fish population dynamics: Comparative pattern recognition with focus on El Niño effects in the Pacific. Fish. Oceanogr. 12(4/5): 458–473. [ Links ]
Bertrand S. 2005. Analyse comparee des dynamiques spatiales des poissons et des pecheurs: Mouvements et distributions dans la pecherie D'anchois (Engraulis ringens) du Perou. PhD thesis, École Nationale Supérieure Agronomique de Rennes, 2004 pp. [ Links ]
Bertrand A, Gerlotto F, Bertrand S, Gutiérrez M, Alza L, Chipollini A, Díaz E, Espinoza P, Ledesma J, Quesquen R, Peraltilla S, Chávez F. 2008. Schooling behaviour and environmental forcing in relation to anchoveta distribution: An analysis across multiple spatial scales. Prog. Oceanogr. 79: 264–277. [ Links ]
Beverton RJH, Holt SJ. 1957. On the dynamics of exploited fish populations. Fish. Invest. Minist. Agric. Fish. Food GB (2 Sea Fish) 19: 533 pp. [ Links ]
Bouchon M, Ñiquen M, Mori J, Echevarría A, Cahuín S. 2002. Manual de muestreo de la pesquería pelágica. Inf. Progr. Inst. Mar Perú No. 157. [ Links ]
Buitrón B, Perea A. 2000. Aspectos reproductivos de la anchoveta peruana durante el periodo 1992–2000. Bol. Inst. Mar Perú 19: 45–54. [ Links ]
Chávez F, Ryan J, Lluch–Cota S, Ñiquen M. 2003. From anchovies to sardines and back: Multidecadal change in the Pacific Ocean. Review. Science, 299(5604): 217–221. [ Links ]
Chirinos de Vildoso A, Alegre de Haro A. 1969. La madurez sexual de la anchoveta (Engraulis ringens J.) en los periodos reproductivos 1961–1968. Bol. Inst. Mar Perú 2: 109–125. [ Links ]
Csirke J. 1989a. Changes in the catchability coefficient in the Peruvian anchoveta (Engraulis ringens) fishery. In: Pauly D, Muck P, Mendo J, Tsukayama I (eds.), The Peruvian Upwelling Ecosystem: Dynamics and Interactions. ICLARM Conference Proceedings 18, pp. 207–219. [ Links ]
Csirke J. 1989b. Introducción a la dinámica de poblaciones de peces. FAO, Documentos Técnicos de Pesca No. 192, 82 pp. [ Links ]
Csirke J, Guevara–Carrasco R, Cárdenas G, Ñiquen M, Chipollini A. 1996. Situación de los recursos anchoveta (Engraulis ringens) y sardina (Sardinops sagax) a principios de 1994 y perspectivas para la pesca en el Perú, con particular referencia a las regiones norte y centro de la costa peruana. Bol. Inst. Mar Perú 15: 1–23. [ Links ]
Einarsson H, Rojas de Mendiola B, Santander H. 1966. El desove de peces en aguas peruanas durante 1961–1964. Memoria del Primer Seminario Latinoamericano del Océano Pacífico Oriental, Lima. [ Links ]
Espinoza P, Bertrand A. 2008. Revisiting Peruvian anchovy (Engraulis ringens) trophodynamics provides a new vision of the Humboldt Current system. Prog. Oceanogr. 79: 215–227. [ Links ]
European Commission. 2010. Fishing Rules, http://ec.europa.eu/fisheries/cfp/fishing_rules/index_en.htm (last update 10/06/2010). [ Links ]
FAO. 2000. Indicadores para el desarrollo sostenible de la pesca de captura marina. FAO, Orientaciones Técnicas para la Pesca Responsable No. 8, 68 pp. [ Links ]
FAO. 2009. El estado mundial de la pesca y la acuicultura 2008. Departamento de Pesca y Acuicultura, FAO, pp. 6–13. [ Links ]
Franco L. 1992. Maduración sexual y fecundidad del carite (Scomberomorus maculatus) de las costas del estado Falcón, Venezuela. Zootecnia Trop. 10: 157–169. [ Links ]
Fréon P, Bouchon M, Mullón C, García C, Ñiquen M. 2008. Interdecadal variability of anchoveta abundance and overcapacity of the fishery in Peru. Prog. Oceanogr. 79: 401–412. [ Links ]
Fréon P, Misund O. 1999. Dynamics of Pelagic Fish Distribution and Behaviour: Effects on Fisheries and Stock Assessment. Blackwell Science, Oxford, 348 pp. [ Links ]
Gutiérrez M, Swartzman G, Bertrand A, Bertrand S. 2007. Anchovy (Engraulis ringens) and sardine (Sardinops sagax) spatial dynamics and aggregation patterns in the Humboldt Current ecosystem, Peru, from 1983–2003. Fish. Oceanogr. 16: 155–168. [ Links ]
Humason GL. 1979. Animal Tissue Techniques. 4th edition. WH Freeman, San Francisco, 661 pp. [ Links ]
Hunter JR, Goldberg S. 1980. Spawning incidence and batch fecundity in northern anchovy, Engraulis mordax. Fish. Bull. US 77: 641–652. [ Links ]
Hunter JR, Macewicz B. 1985. Measurements of spawning frequency in multiple spawning fish. In: Lasker R (ed.), An Egg Production Method for Estimating Spawning Biomass of Pelagic Fish: Application to the Northern Anchovy, Engraulis mordax. NOAA Tech. Rep. NMFS 36: 79–94. [ Links ]
IMARPE. 1965. Efectos de la pesca en el stock de anchoveta. Inf. Inst. Mar Perú No. 7, 16 pp. [ Links ]
IMARPE. 2010. Informe sobre la quinta reunión de expertos en dinámica de población de la anchoveta peruana. Bol. Inst. Mar. Perú [ Links ].
INEI. 2009. Compendio estadístico 2008. Sistema de Estadística Nacional. Instituto Nacional de Estadística e Informática del Perú. CD/Exportaciones. [ Links ]
Jordán R. 1959. Observaciones sobre la biología de la anchoveta (Engraulis ringens J.) de la zona pesquera de Huacho. Bol. Cía. Adm. Guano. XXXV(11): 15–21. [ Links ]
Jordán R. 1976. Biología de la anchoveta. Parte I: Resumen del conocimiento actual. FAO Tech. Rep. 185: 359–399. [ Links ]
Jordán R. 1980. Biology of the anchoveta. I: Summary of the present knowledge. Proceedings of the Workshop on the Phenomenon known as "El Niño", Guayaquil, Ecuador, 4–12 December 1974, pp. 249–276. United Nations Educational, Scientific and Cultural Organization, Paris. [ Links ]
Kallianotis A. 1996. The anchovy fishery in the Aegean Sea. A flourishing industry or lost affair? Sci. Mar. 60 (Suppl. 2): 287–288. [ Links ]
Lam R. 1968. Estudio sobre la variación del contenido de grasa en la anchoveta peruana (Engraulis ringens J.). Inf. Inst. Mar Perú No. 24: 29 pp. [ Links ]
Macchi GJ, Pájaro M, Militelli MI, Rodavani N, Rivas L. 2006. Influence of size, age and maternal condition on the oocyte dry weight of Argentine hake (Merluccius hubbsi). Fis. Res. 80: 345–349. [ Links ]
Miñano J. 1969. Estudio de la fecundidad y ciclo sexual de la anchoveta. Bol. Inst. Mar. I(9): 507–533. [ Links ]
MIPE. 1992. Resolución Ministerial No. 463–91–PE, Ministerio de Pesquería, Lima, 27 December 1991. In: El Peruano, 2 January 1992. [ Links ]
Ñiquen M, Espino M, Bouchon M. 2000. Análisis de la población de anchoveta peruana durante el periodo 1961–1999. Bol. Inst. Mar Perú 19: 103–107. [ Links ]
Palomares ML, Muck P, Mendo J, Chuman E, Gómez O, Pauly D. 1987. Growth of the Peruvian anchoveta (Engraulis ringens), 1953 to 1982. In: Pauly D, Tsukayama I (eds.), The Peruvian Anchoveta and its Upwelling Ecosystem: Three Decades of Change. ICLARM Studies and Reviews 15, pp. 117–141. [ Links ]
Parrish RH, Mallicoate DL, Klingbeil RA. 1986. Age dependent fecundity number of spawning per year, sex ratio and maturation stage in northern anchovy. US Fish Bull. 84: 503–517. [ Links ]
Pauly D, Jarre A, Luna S, Sambilay VJR, Rojas de Mendiola B, Alamo A. 1989. On the quantity and types of food ingested by Peruvian anchoveta, 1953–1982. In: Pauly D, Tsukayama I (eds.), The Peruvian Anchoveta and its Upwelling Ecosystem: Three Decades of Change. ICLARM Studies and Reviews 15, pp. 109–124. [ Links ]
Peña N, Mendo J, Pellón J. 1989. Sexual maturity of Peruvian anchoveta (Engraulis ringens), 1961–1987. In: Pauly D, Tsukayama I (eds.), The Peruvian Anchoveta and its Upwelling Ecosystem: Three Decades of Change. ICLARM Studies and Reviews 15, pp. 132–142. [ Links ]
Perea A, Buitrón B. 1996. Valores críticos en ovarios desovantes y en recuperación de anchoveta (Engraulis ringens) y sardina (Sardinops sagax) en las épocas de desove. Inf. Prog. Inst. Mar Perú 44: 3–17. [ Links ]
Perea A, Buitrón B. 2004. Aplicación del método de congelación de ovarios para estimar la distribución espacial de los cardúmenes desovantes de anchoveta. Inf. Inst. Mar Perú 32: 123–126. [ Links ]
Perea A, Roque C, Buitrón B. 2008. Distribución espacial de cardúmenes desovantes y estado de madurez gonadal de anchoveta y vinciguerria durante primavera 2003. Inf. Inst. Mar Perú 35: 279–283. [ Links ]
Ricker W. 1954. Stock and recruitment. J. Fish. Res. Bd. Canada 11: 553–623. [ Links ]
Rojas de Mendiola B. 1989. Stomach contents of anchoveta (Engraulis ringens), 1953–1974. In: Pauly D, Muck P, Mendo J, Tsukayama I (eds.), The Peruvian Upwelling Ecosystem: Dynamics and Interactions. ICLARM Conference Proceedings 18, pp. 97–104. [ Links ]
Saetersdal G, Valdivia J. 1964. Un estudio del crecimiento, tamaño y reclutamiento de la anchoveta (Engraulis ringens J) basado en datos de frecuencia de longitudes. Bol. Inst. Invest. Recurs. Mar. Callao I(4): 85–136. [ Links ]
Santander H, Flores R. 1983 Los desoves y distribución larval de cuatro especies pelágicas y sus relaciones con las variaciones del ambiente marino frente al Perú. FAO Fish. Rep. 291(3): 835–867. [ Links ]
Santander H, Alheit J, Smith P. 1984. Estimación de la biomasa desovante de anchoveta peruana Engraulis ringens en 1981 por aplicación del Método de Producción de Huevos. Bol. Inst. Mar Perú 8: 213–250. [ Links ]
Sharp G, Csirke J (eds.). 1983. Proceedings of the Expert Consultation to Examine Changes in Abundance and Species Composition of Neritic Fish Resources. San José, Costa Rica, 18–29 April 1983. FAO Fish. Rep. Ser. 291, Vol. 2, 553 pp. [ Links ]
Sparre P, Venema S. 1992. Introduction to tropical fish stock and assessment. Part 1: Manual. FAO Fish. Tech. Pap. No. 306.1, Rev. 1, Rome, 376 pp. [ Links ]
Swartzman G, Bertrand A, Gutierrez M, Bertrand S, Vasquez L. 2008. The relationship of anchovy and sardine to water masses in the Peruvian Humboldt Current System from 1983 to 2005. Prog. Oceanogr. 79 (2008) 228–237. [ Links ]
Trippel EA, Kjesbu OS, Solemdal P. 1997. Effects of adult age and size structure on reproductive output in marine fishes. In: Chambers RC, EA Trippel EA (eds.), Early Life History and Recruitment in Fish Populations. Chapman and Hall, London, pp. 31–62. [ Links ]
Uriarte A, Prouzet P, Villamor B. 1996. Bay of Biscay and Ibero Atlantic anchovy populations and their fisheries. Sci. Mar. 60 (Suppl. 2): 237–255. [ Links ]
Vallin L, Nissling A. 2000. Maternal effects on egg size and egg buoyancy of Baltic cod, Gadus morhua: Implications for stock structure effects on recruitment. Fis. Res 49: 21–37. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.
English translation by Christine Harris.














