Servicios Personalizados
Revista
Articulo
Indicadores
 Citado por SciELO
Citado por SciELO Accesos
Accesos
Links relacionados
 Similares en SciELO
Similares en SciELO
Compartir
Ciencia forestal en México
versión impresa ISSN 1405-3586
Rev. Cien. For. Mex vol.34 no.105 México ene./jun. 2009
Artículo científico
Identificación del agente patógeno del cancro del eucalipto en plantaciones del Sureste de México
Irma Bernal Lugo1, Carlos Juárez Palacios J.2, Rocío Santos Gally1, Luis Vázquez Silva2, Hilda Araceli Zavaleta Mancera3, Hilda Susana Azpiroz Rivero2, Conrado Parraguirre Lezama2 y María del Pilar de la Garza López de Lara2
1 Facultad de Química, Universidad Nacional Autónoma de México. Correo–e: irmofel@servidor.unam.mx.
2 Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales (CENID–COMEF), INIFAP.
3 Programa de Botánica, Colegio de Postgraduados.
Fecha de recepción: 31 de enero de 2008.
Fecha de aceptación: 13 de abril de 2009.
RESUMEN
En las plantaciones comerciales de diversas especies de eucalipto que se desarrollan en el sureste mexicano, tanto los científicos como los propietarios han informado sobre ataque del cancro en 70% de los árboles. El objetivo de este estudio fue identificar la especie de su agente causal. Se tomaron muestras de corteza, ramas, tallos y rebrotes infectados de diferentes procedencias de plantaciones experimentales, ubicadas en los estados de Chiapas y Oaxaca. Las muestras se sometieron a temperatura y humedad apropiadas para el desarrollo de esporomas. El agente patógeno se aisló y se purificó mediante cultivos in vitro iniciados del micelio desarrollado por el cancro. El aspecto, color, tamaño y características de la mayoría de las estructuras reproductoras de las colonias miceliares, fueron similares a las de Chrysoporthe cubensis. Sin embargo, se encontraron dos tipos de estructuras reproductoras diferentes, tanto en las muestras de campo como en las de laboratorio, por lo que fue necesario verificar si las dos morfías pertenecían a una sola especie de Chrysoporthe, lo cual se realizó mediante un análisis molecular. La comparación de las secuencias de nucleótidos de la región intergénica de los genes ribosomales de estas estructuras sugiere una similitud mayor de 97%, y al compararlas con los genes correspondientes reportados en el banco de genes del NCBI, indicaron que se trata de un solo agente patógeno, cuya identidad correspondió a Ch. cubensis. En esta región, el hongo presentó dismorfia, característica que puede conferir al hongo una mayor agresividad.
Palabras clave: Agente patógeno, cancro del eucalipto, Chrysoporthe cubensis, morfías, nucleótidos, secuencias ribosomales ITS.
ABSTRACT
In the Southeast of Mexico, there are marketable plantations of different species of Eucalyptus where canker has been reported. The objective of this study was to provide the morphological and molecular identification of the species of eucalyptus canker causal agent in these plantations. Samples of infected bark, branches and new shoots were obtained from different parental sources growing in Oaxaca and Chiapas. The samples were incubated under the right temperature and humidity for the development of reproductive bodies. The pathogen agent was isolated and purified from in vitro cultures of mycelium colonies developed in the canker. The aspect, color, size and morphological characteristics of the reproductive structures were similar to those of Chrysoporthe cubensis. Nevertheless two types of reproductive structures were found in the field and laboratory samples, and it was necessary to verify if both belonged one kind of morphia. To precisely define to which species belonged the morphia, it was carried out a molecular analysis of the reproductive structures. The comparison of nucleotide sequences in the intergenic region of ribosomal genes of these structures, showed a similarity over 97% and when compared to the correspondent genes reported in the gene bank NCBI, pointed out that is only one pathogenic agent whose identity is Ch. cubensis. This pathogen presents dimorphism in this region, such characteristic could make the fungus more aggressive.
Key words: Pathogenic agent, eucalyptus canker, Chrysoporthe cubensis, morfism, nucleotides, ITS ribosomal sequences.
INTRODUCCIÓN
El género Eucalyptus es originario de Australia y pertenece a la familia de las Mirtáceas, que comprenden una enorme diversidad biológica, con más de 700 especies distribuidas en regiones, esencialmente de climas mediterráneos, tropicales y subtropicales (Obregón y Restrepo, 2000).
Se estima que fue en el siglo XVIII cuando se inició la propagación de eucaliptos en diferentes latitudes del mundo, llegando a distribuirse con éxito en varios países de Europa, Asia, África, América y en algunas islas del pacifico (Obregón y Restrepo, 2000). En la actualidad, es cultivado a nivel mundial como una fuente de fibra para producir pulpa de celulosa.
El cancro del eucalipto causado por el hongo Chrysoporthe spp. es una de las enfermedades más importantes en plantaciones establecidas en las regiones tropicales y subtropicales del mundo. La infección puede dañar hasta 50% de las plantas de especies susceptibles como Eucalyptus saligna Sm. y Eucaliptus grandis Hillex Maid. Los tallos al ser infectados por el hongo y formarse un cancro se debilitan y pueden romperse, por mecanismos físicos naturales (Ferreira, 1989; Krugner y Auer, 1997).
En el pasado, el agente patogénico de esta enfermedad fue clasificado de acuerdo a los síntomas asociados al cancro y a sus características morfológicas. Así, Boerboom y Maas (1970) determinaron en Surinam que Endothia havanensis Bruner era el causante de esta enfermedad en Eucalyptus grandis y E. saligna. Más tarde se demostró que E. havanensis era una especie saprofítica y que el organismo responsable de la enfermedad era Diaporthe cubensis Bruner, un hongo muy similar a E. havanensis en su aspecto (Hodges et al., 1976). Posteriormente, Hodges et al. (1979) identificaron a la misma especie en Florida, Hawaii y Puerto Rico, por lo que el primer autor realizó un estudio taxonómico (Hodges, 1980) que lo llevó a concluir que D. cubensis y Cryphonectría cubensis (Bruner) Hodges eran una misma especie. Gibson (1981) en África, estudió esta enfermedad, mientras que Ferreira et al. (1977) detectaron el cancro de Cryphonectría en plantaciones de eucalipto en Brasil, al igual que Old y Davidson (2002) en Australia.
En estudios recientes, a través de un análisis de flogenia molecular, se encontró que los aislados del hongo, obtenidos de diversas regiones del mundo, formaban un grupo diferente de las otras especies de Cryphonectría cubensis, por lo que se describió el género Chrysoporthe para su clasificación correcta (Gryzenhout et al., 2004). Utilizando este enfoque se han determinado cuatro especies del mismo género como agentes causales de dicha infección: Ch. cubensis (Bruner) Gryzenh. & M. J. Wingf constituye el patógeno del cancro de las plantaciones comerciales de Eucaliptus spp., en Sudamérica, Sudeste de Asia, Australia y África Central (Gryzenhout et al., 2004). Esta especie, según diversos investigadores, también es capaz de afectar a Syzygium aromaticum L. o clavo (Hodges et al., 1986; Myburg et al., 2003) y Miconia spp. (Rodas et al., 2005), aunque con menor severidad; Ch. austroafricana Gryzenhout & M. J. Wingf. (Gryzenhout et al., 2004) produce el cancro de Eucaliptus spp. (Wingfeld et al., 1989) de Tibouchina spp. Aubl. (Myburg et al., 2002) y de Syzygium aromaticum (Heath et al., 2006) en Sudáfrica; Ch. doradensis Gryzenh. & M. J. es el patógeno del eucalipto en Ecuador (Gryzenhout et al., 2005) y Ch. inopina Gryzenh. & M. J. Wingf. reconocido recientemente en Cuba (Gryzenhout et al., 2006).
Debido a esta diversidad de agentes causales, los síntomas del cancro del Chrysoporthe en el mundo son diferentes. Los cancros en Sudamérica y en el Sudeste de Asia son distintos en función de las alturas de los tallos, mientras que en Sudáfrica sólo se forman en la base de los árboles (Conradie et al., 1990).
Otra particularidad de la enfermedad en Sudáfrica es el hecho de que en los cancros sólo se detectan estructuras reproductivas asexuales, lo que las distingue de los cancros de Sudamérica y del Sudeste de Asia, en las cuales son de tipo sexual (Van Hereden y Wingfeld, 2001). Estos contrastes pueden ser producto de la interacción de diversos factores incluyendo la virulencia, la resistencia del huésped, la influencia del ambiente y el tiempo de infección.
En México se iniciaron las plantaciones forestales comerciales en la década de 1950, cuando se plantaron alrededor de 6,400 ha de eucaliptos con la finalidad de contar con materia prima para fabricar tableros de fibra en el estado de San Luís Potosí. Actualmente en México existen 20,890 ha con este uso de suelo con especies introducidas y 18,640 ha con especies nativas (SEMARNAT, 2001). Los eucaliptos que han presentado mejor crecimiento en el país son: Eucalyptus urophylla ST Blake, Eucalyptus grandis Hill ex Maiden y Eucalyptus saligna Smith; la mayor parte es destinada a leña, carbón vegetal, madera de aserradero, postes para comunicaciones y construcción, suelos de parquet y pasta de celulosa (Ceccon y Martínez, 1999).
En el sureste mexicano donde se desarrollan plantaciones comerciales de diversas especies de eucalipto, se ha detectado el llamado "cáncer" o "cancro" del eucalipto y puede ocasionar pérdidas de hasta 40% en el rendimiento (m3/ha) (Venter et al., 2001). Los genotipos de estas plantaciones son principalmente Eucalyptus grandis y E. urophylla de diferentes procedencias en donde el cancro del eucalipto está presente. Por lo anterior, en las plantaciones mencionadas existe la incertidumbre del género y especie del agente causal, en virtud de que las diversas especies del hongo varían en sus mecanismos de reproducción y virulencia (Gryzenhout et al., 2004).
El desarrollo de una estrategia eficiente para el control de esta amenazante enfermedad en dichas poblaciones forestales requiere de estudios que permitan determinar con certeza la(s) especie(s) del agente causante. El estudio que se presenta a continuación tuvo como objetivos: describir los síntomas que caracterizan esta fitopatología; identificar la morfología tanto macro como microscópicamente, así como la estructura molecular de la especie que causa la enfermedad cancro del eucalipto.
MATERIALES Y MÉTODOS
Toma de muestras
Las muestras de troncos, retoños y ramas de árboles de eucalipto que portaban cancros naturales se colectaron en los estados de Chiapas y Oaxaca. En Chiapas, los sitios se localizan en el "Rancho San Antonio" del municipio de Palenque y "Aguascalientes" del municipio Salto de Agua. Ambos, ubicados a nivel del mar, con las coordenadas: 17°45" N y 91°55' O" y 17°28" N y 92°14' O", respectivamente. En Oaxaca, en el predio "La Gasolinera" localizado en el municipio de Cotzocon con coordenadas 17°20" N y 95°232' O", a una altura de 177 msnm (Figura 1).
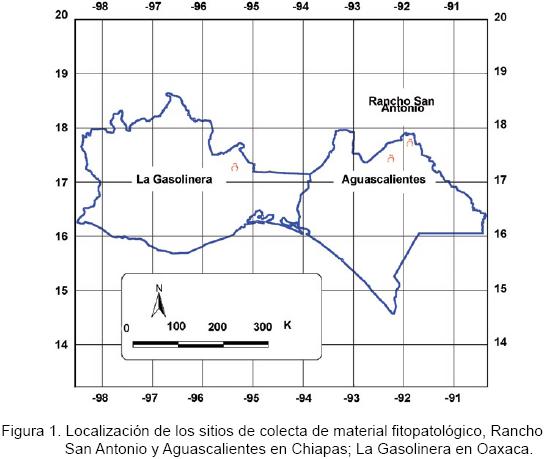
Cada sitio cuenta con las siguientes fuentes parentales o procedencias: G–386 de Cali Colombia; G–2464 de WaterVal, Sudáfrica; G–5091 localidad desconocida en Sudáfrica y G–M5246 de Waterhoutboom, Sudáfrica. Éstas pertenecen a la especie de Eucalyptus grandis, además de U– Egon y U– Pantar procedentes de Indonesia, que corresponden a la especie E. urophylla. En cada sitio y de cada fuente parental, mediante martillo y formón, se colectaron porciones de corteza de tallos con cancro. Para la recolección de varas y retoños de árboles infectados se utilizaron tijeras de podar y una lupa 4X de bolsillo.
El material procedente de los árboles se depositó inmediatamente después de la extracción, en bolsas de plástico con cierre hermético de 27 × 28 cm, que se etiquetaron con los siguientes datos: procedencia, sitio, árbol, repetición y fecha, así como otras observaciones generales de las condiciones edáficas y ambientales. Posteriormente, se acomodó en una hielera, a la cual se le agregaron cubos de hielo para evitar una posible contaminación durante su traslado al laboratorio del Campo Experimental San Martinito perteneciente al Centro de Investigación Regional Golfo Centro, INIFAP.
Manejo de muestras
Las muestras se refrigeraron a una temperatura entre 4 y 5°C hasta su utilización. De una muestra representativa de cada sitio y árbol con síntomas de infección, se tomó un trozo de corteza o rebrote de aproximadamente 1.5 × 2.0 cm; se le lavó con jabón y agua corriente y se le limpió con cuidado con una brocha de cerdas naturales para quitar el excedente de tierra e impurezas.
Estos trozos se sometieron a desinfección en hipoclorito de sodio al 2.0% por 2 min, después se enjuagaron con agua destilada por un período igual al anterior y al final se secaron con papel filtro, para eliminar el excedente de agua, y se colocaron en cajas Petri con papel filtro humedecido con agua destilada para formar una cámara húmeda. Las muestras se dejaron en reposo a una temperatura ambiente entre 19 y 23°C. Todo el proceso anterior se llevó a cabo en estrictas condiciones de asepsia.
Aislamiento y purificación del hongo
Después de ocho días de incubación en cámara húmeda, los trozos de corteza comenzaron a emitir micelio y cuerpos fructíferos del hongo, de los cuales se transfirieron cuatro pequeñas porciones a cajas Petri con malta agar al 2% (MA). Éstas fueron incubadas en estufa de germinación a temperaturas de 27 a 30°C. Durante su crecimiento, se hicieron observaciones macroscópicas. Además, cada 24 h se realizaron mediciones de tamaño, se detectaron los cambios en el color y aspecto de las colonias y se observó la formación de estructuras reproductivas. Cuando se presentó el crecimiento miceliar de las muestras sembradas, se hicieron transferencias de hifa de cada colonia del hongo en desarrollo a una nueva caja Petri con medio MA y nuevamente se incubaron a la temperatura antes mencionada. De esta manera se garantizó que las colonias micológicas fueran puras (Cibrián et al., 1999).
Preparaciones para la observación de estructuras
Las preparaciones para la observación in situ de estructuras fructíferas del hongo (picnidios y peritecios) se realizaron en forma manual (con navaja de afeitar) del tejido de corteza con cancro natural y con el microtomo de deslizamiento marca Microm HM 340E de un rango máximo de corte de 0.5–100 μ X un rango máximo de alimentación horizontal de 28 mm. Los cortes de 30–50 μ fueron colocados en portaobjetos con lactofenol para su revisión por medio de microscopio compuesto marca Olympus, modelo CX–31 con aumentos de 40X y 100X. En estas preparaciones también se detectaron ascas y ascosporas. De las colonias fúngicas purificadas, se obtuvieron muestras de micelio y cuerpos fructíferos (conidióforos y conidios) y otras características específicas del hongo.
Extracción del ADN
En un tubo de centrífuga se depositó una fracción del micelio con esporas al que se le adicionaron 10 mL de Tween 20 al 0.5 % (v/v), y se homogeneizó con politrón durante dos minutos. El homogeneizado se centrifugó a baja velocidad (5000 g) durante 20 min. El sobrenadante se eliminó. La pastilla se lavó con 10 mL de agua estéril y se centrifugó a 5000 g durante 20 min. La pastilla se resuspendió en 2.0 mL de agua estéril y se transfirió en dos alícuotas a tubos Eppendorf. Los tubos se centrifugaron por 10 min a 12000 rpm, en una microfuga a temperatura ambiente. El sobrenadante se eliminó pordecantación, se le agregaron 0.293 mLde EDTA 50 mM y 0.0075 mL de liticasa 20 mg/mL. La solución se mezcló suavemente con una micropipeta. La muestra se incubó durante 1 h a 37°C. Al término de la incubación, la muestra se centrifugó a 12000 g durante 2 minutos a temperatura ambiente y el sobrenadante se eliminó. La pastilla se congeló en nitrógeno líquido durante 3 min, se le adicionó 1.0 mL de DNAzol (in vitrogen) y se descongeló lentamente a temperatura ambiente. Una vez descongelado, se aplicaron las instrucciones descritas por el fabricante para la obtención de DNA usando el kit DNAzol marca GIBCO BRL, catálogo No. 1053.
Comparación de la secuencia ITS 1 y 2
Una de las regiones Inter génicas (ITS 1 y 2) de los genes ribosomales fueron amplificadas usando los pares de oligonucleótidos (ITS1: 5' CGGAATTCTCCG TAGGTGAACCTGCGG3', ITS2: 5TTCTATGCTTAAATTCAGGGG3') y condiciones de amplificación empleadas por White et al. (1990). Las PCRs se realizaron en tubos de reacción de 0.2 mL en un volumen final de 25 μL, conteniendo 0.2 mL de DNA polimerasa Taq platinum (Invitrogen), 200 μM de cada uno de los desoxirribonucleótidos, dATP, dGTP, dCTP y dTTP; 20 mM de tris–HCl (pH 8.4), 2.5 mM de MgCl2, 0.5 μM de cada uno de los oligonucleótidos. La reacción de amplificación incluyó un ciclo de 5 min a 95°C para activar la Taq DNA polimerasa, seguido de 30 ciclos de un minuto cada uno a 95, 54 y 72°C, seguidos de un paso de extensión final a 72°C por 5 min. El producto de PCR fue visualizado por UV en geles de agarosa al 1% y teñidos con bromuro de etidio. La banda correspondiente al ITS 1 y 2 fue purificada utilizando un Kit de purificación rápida para productos de PCR (Ultrafree–DNA Mi–llipore). La secuenciación se realizó con los oligonucleotidos utilizados para amplificar las respectivas regiones en un solo fragmento. La de los fragmentos se llevó a cabo en un secuenciador automático ABI PRISM 310 Genetic Analyzer de Perkin–Elmer Applied Biosystems. Las secuencias obtenidas del aislado se compararon con las caracterizadas en diversas partes del mundo y reportadas en el banco de genes del NCBI (National Center of Biotechnology Information), mediante el programa BLAST que proporciona esta base de datos.
RESULTADOS
Síntomas
En todas las muestras analizadas, tallos y varas de árboles de eucalipto que presentaron cancro, se observaron lesiones sobre tejidos de la corteza externa e interna (Figura 2A). Además, también se advirtieron heridas climáticas, de deterioro natural, ocasionadas por insectos o de tipo mecánico, lo que sugiere que estas lesiones permitieron la entrada del patógeno para causar la infección.

La forma y el tamaño de los cancros variaron y la mayoría invadieron tanto la corteza externa como la interna (Figura 2B). En ambos tipos de cortezas se reconocieron la presencia de exudaciones, presumiblemente toxinas o secreciones enzimáticas del hongo (Figura 2B), las cuales pudieron contribuir a la muerte de estos tejidos. La ubicación de los cancros en los tallos de los árboles varió de los 0.10 m hasta los 6 a 7 m de altura. En la mayoría de los casos, la longitud del cancro fue de 25 a 50 cm; en muy pocos casos (<1%) se detectaron ejemplares de mayor dimensión. En estas lesiones se observaron las estructuras reproductivas del patógeno (Figura 2).
Caracterización microscópica de las estructuras del patógeno desarrolladas en el cancro
Los picnidios se localizaron en la superficie sobre el cancro o ligeramente hundidos en las cortezas de las muestras puestas en cámara húmeda, de forma cilíndrica, por lo general periformes, con un cuello atenuado. Se presentan solitarios o en grupos de dos a cinco; de color café claro a café rojizo tendiendo a naranja, a los 10 días obscurecieron casi al negro excepto la punta que continuó color café rojizo y en donde se observó una masa viscosa que contenía los conidios, los cuales midieron de 27.2–298.7 μm de largo × 189.5–328.6 mm de ancho (figuras 3A, B y C).

Los peritecios aparecieron en las cortezas de las muestras incubadas en cámara húmeda en grupos o sueltos, con bases globosas y ligeramente hundidos en la corteza; se observan como pelos o cerdas muy finas, de color café brillante, después cambian a un color café oscuro y luego a uno negro cuando maduran. Los cuellos o rostrum sobresalen de la superficie de la corteza; están bifurcados en dos y hasta tres divisiones. Las medidas de estas estructuras fueron de 408.55 a 1357.67μm de largo, con un promedio de 822.50 μm y de 137.25 a 366.55 μm de ancho, con un promedio de 245.92 μm. El grosor de la pared fue de 25.39 a 56.67 μm, con un promedio de 42.24 μm (Figura 3D).
Características de las colonias miceliares
Las colonias crecidas en malta–agar provenientes de los cuerpos fructíferos desarrollados en trozos de madera infectados mostraron coloración diversa. Sin embargo, el número de colonias con un mismo color fue diferente para cada sitio (Figura 4).

En los sitios 2 y 3 (Aguascalientes, Chis. y La Gasolinera, Oax., respectivamente), la mayoría de las colonias fue de tono blanco naranja, mientras que en el sitio 1 la proporción de colonias blanco naranja y blanco cremoso fue similar. La cantidad de colonias blancas siempre fue menor que las de otras coloraciones. A diferencia de las otras fuentes parentales, la mayoría de las colonias desarrolladas en U–pantar tuvieron color blanco anaranjado.
El micelio en el medio de cultivo MA e incubado a 27°C creció al principio del ensayo con un color blanco cremoso y formó filamentos en la periferia (Figura 3E).
Al centro de la colonia, el micelio se tornó de consistencia algodonosa a los cinco días. Después, en un lapso de ocho días, cambió de blanco cremoso a naranja pálido con un anillo concéntrico en el micelio. Entre los 11 y los 16 días de desarrollo se detectó la formación de los picnidios (Figura 3F).
El micelio que cubrió el ápice de estas estructuras se modificó hacia el tono naranja, y las esporas se tornaron de color naranja amelonado, lo que sucedió a los 21 días y la colonia cambió a un color naranja café (Figura 3E). De cada una de las colonias, se tomaron muestras con estructuras reproductivas, las cuales se colocaron en porta objetos con lactofenol y se cubrieron con cubreobjetos. Las observaciones se hicieron al microscopio compuesto a 20, 40 y 100X donde se pudieron apreciar las estructuras típicas del hongo Chrysoporthe.
Identificación por microscopia de luz de las estructuras fructíferas desarrolladas en el laboratorio
Las ascas fueron de forma claviforme o elíptica con un pedicelo de 24.91–33.12 μm de largo × 5.22–6.51 μm de ancho. Por lo general se contabilizaron ocho ascosporas por asea de forma halantoide, biseriadas, hialinas, oblongas a ovoides, bicelulares con un tabique central, ligeramente constreñidas en el propio tabique y midieron de 5.79–7.95 μm de largo × 2.19–3.05 μm de ancho (Figura 5A).
Los conidióforos pueden describir como ramificados, hialinos con células básales rectangulares y de apariencia globosa con dimensiones de 2.51–3.59 × 6.11–8.21 μm de largo total y de 2.01–2.52 × 4.52–5.98 μm. En general presentaron una emisión de ramas de forma irregular de aspecto cilíndrico, además de sepias, cuya longitud total promedio fue de 2.01–2.52 × 4.52–5.98 μm (Figura 5B). Los conidios fueron unicelulares, ovales, hialinos no septados con un intervalo de 2.71–3.68 μm de largo × 1.27 de ancho y un promedio de 3.02 de largo × 1.64 μm de ancho (Figura 5B).
Identificación molecular del agente causal
La identificación molecular de la especie del agente causal del cancro del eucalipto en el sureste mexicano se realizó mediante la amplificación por PCR de la región espaciadora interna (ITS1 y 2) de los genes ribosomales (rDNA). El producto de PCR: r DNA ITS fue de 595 pb (pares de bases) para los peritecios y 541 pb para los picnidios, ambos desarrollados in vitro. Al comparar entre sí las secuencias de nucleótidos de cada producto de PCR, resultó que la longitud del fragmento de DNA amplificado fue mayor para los peritecios que para los picnidios. La secuencia de DNA 5'a 3' amplificada de los espaciadores inició en la base 61 del DNA proveniente de los peritecios, mientras que en el DNA amplificado de los picnidios lo hizo en la base 7. El final del ITS 2 alcanzó la posición 541 del DNA amplificado, proveniente de los peritecios y en la 486 de los picnidios (Cuadro 1).

Al comparar las secuencias de nucleótidos con las que tiene en el banco de genes del National Center for Biotechnology Information (NCBI), el valor más alto de identidad para los dos productos de PCR se obtuvo con la especie Ch. cubensis (Cuadro 2). Estos resultados indican que el agente causal del cancro del eucalipto en las plantaciones del sureste es Chrysoporthe cubensis. Recientemente, este hongo fue conocido como Cryphonectria cubensis, y fue transferido al nuevo género Chrysoporthe con base en el agrupamiento flogenético que resultó de la comparación de las secuencias del operon ribosomal y del gen de la β–tubulina (Gryzenhout et al., 2004).

DISCUSIÓN
Las características de los síntomas en los árboles de eucalipto, la forma y color del micelio, así como las características morfológicas de las estructuras de reproducción de los aislamientos indican que el agente causal del cancro del eucalipto en la región del sureste es el hongo Chrysoporthe cubensis. Así mismo, los tiempos que tardan las colonias miceliares para realizar el cambio de apariencia y color fueron similares a las reportadas en otros trabajos publicados por CATIE (1991). Estudios realizados por otros investigadores demuestran que las ascosporas, conidióforos y conidios de Ch. cubensis son diferentes a otras especies de Chrysoporthe. En ella, las ascosporas son septadas en el centro o un poco fuera del centro con un espaciamiento irregular. Aunque el patrón de sepias de la ascospora en otras especies de Chrysoporthe se desvían ligeramente del centro de las ascosporas, sólo en Ch. cubensis se ha informado que ocurra casi en el ápice de las esporas (Shear et al., 1917; Kobayashi, 1970). Por otro lado, el tamaño de los cuerpos fructíferos aislados de las muestras de corteza y varas extraídas de las plantaciones, así como, el de las esporas fue similar a lo encontrado por otros investigadores (Barnard et al., 1987).
En este estudio se observaron las formas anamorfa y telemorfa del hongo en muestras recabadas en el campo. Este resultado fue sorprendente ya que en la mayoría de los sitios donde el cancro es causado por Chrysoporthe spp., las especies presentan mayoritariamente sólo un tipo de reproducción. La característica dimórfica del hongo le podría conferir la posibilidad de crecer en otros huéspedes. En un estudio flogenético, Greyzenhout et al. (2006) reportan haber aislado este hongo en cancros encontrados en Clidemia serícea D. Don y Rhynchanthera mexicana DC, ambas de la familia Melastomataceae. Sin embargo, ellos no especifican la forma de reproducción que el hongo presentó y lo agruparon en el ciado que acomoda las colecciones de hongos de Sudamérica.
El hecho de haber identificado este hongo en especies diferentes del eucalipto sugiere que en México, al igual que experimentos de inoculación hechos en Brasil (Seixas et al., 2004), este hongo podría atacar diferentes especies de árboles con valor comercial como son el aguacate (Persea americanaMill.), la guayaba (Marliereae edulis Niedenzu) y la granada (Púnica granatum L). Lo anterior establece la necesidad de desarrollar estrategias integrales para el manejo y control de este hongo, ya que debido a que no es un hongo huésped especifico, puede causar enormes pérdidas económicas tanto en las plantaciones de eucaliptos, como en otras de interés comercial.
CONCLUSIÓN
Por las características morfológicas y moleculares que presentó el patógeno aislado de las muestras con cancros, se concluyó que el hongo Ch. cubensis, es el agente patógeno causante de la enfermedad cancro de los tallos del eucalipto.
AGRADECIMIENTOS
Se hace patente el agradecimiento por las facilidades proporcionadas para realizar el estudio a la empresa Forestaciones Operativas de México, S. A. de C. V. de Las Choapas Ver., así como a la empresa prestadora de servicios técnicos Yunkaax S. A. de Palenque, Chis. y a todos aquellos que de una u otra forma participaron para llevara cabo este trabajo. Para ello se contó con fondos económicos provenientes del proyecto CONACYT–CONAFOR 2004–CO4–41 y el apoyo directo de la CONAFOR a la investigación "Caracterización molecular de Chrysoporthe procedente de tres plantaciones experimentales de Eucalyptus spp".
REFERENCIAS
Bruner, S. C. 1916. A new species of Endothia. Mycologia 8: 239–242. [ Links ]
Bruner, S. C. 1917. Una enfermedad gangrenosa de los eucaliptos. Estación Experimental Agronómica: Santiago de Las Vegas, Cuba. Boletine 37: 1–38. [ Links ]
Borboom, J. H. A. and P. W. T. Maas. 1970. Canker of Eucalyptus grandis and E. saligna in Surinam caused by Endothia havanensis. Turrialba 20: 94 –99. [ Links ]
Barnard, E. L., T. Geary, J. T. English and P. Gilly. 1987. Basal Cankers and coppice failure of Eucalyptus grandis in Florida, USA. Plant Disease 71:358–361 [ Links ]
Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). 1991. Plagas y enfermedades Forestales en América Central: Guía de campo/ Centro Agronómico Tropical de Investigación y Enseñanza. (Serie Técnica: Manual Técnico/CATIE: No. 4). Turrialba, Costa Rica. 185 p. [ Links ]
Ceccon, E. y M. Martínez R. 1999. Aspectos ambientales referentes al establecimiento de plantaciones de eucalipto de gran escala en áreas tropicales: aplicación al caso de México. Interciencia 24 (6): 352–359. [ Links ]
Cibrián T, D., M. T. Méndez y B. R. Campos. 1999. Como identificar las plagas y enfermedades en las plantaciones de eucalipto y gmelina. Guía de Campo. Universidad Autónoma Chapingo. Texcoco, Edo. de México. México. 77 p. [ Links ]
Conradie, E., W. J. Swart and M. J. Wingfeld. 1990. Cryphonectria canker of Eucalyptus, an important disease in plantation forestry in South Africa. S. Afr. For. J. 152: 43–49. [ Links ]
Ferreira, F. A., M. S. Reis, A. C. Alfenas and C. S. Hodges. 1977. Avaliação da resistência de Eucalyptus spp. ao cancro causado por Diaporthe cubensis Bruner. Fitopatologia Brasileira 2: 225–241. [ Links ]
Ferreira, F. A. 1989. Patologia forestal: Principias doenças forestais no Brasil. Sociedade de Investigações Florestais. Vicosa MG, Brasil. 570 p. [ Links ]
Gibson, I. A. S. 1981. A canker diseases of Eucalyptus new to Africa. FAO for Genet. Res. Inf. 10: 23–24. [ Links ]
Gryzenhout, M., H. Myburg, N. A. van der Merwe, B. D. Wingfeld and M. J.Wingfeld. 2004. Chrysoporthe, a new genus to accommodate Cryphonectria cubensis. Studies in Mycology 50: 119 –142. [ Links ]
Gryzenhout, M., H. Myburg, B. D. Wingfeld, F. Montenegro and M. J. Wingfeld. 2005. Chrysoporthe doradensis sp. nov. pathogenic to Eucalyptus in Ecuador. Fungal Diversity 20: 39 – 57. [ Links ]
Gryzenhout, M., C. Rodas, J. Mena–Portales, P. Clegg, B. D. Wngfeld and M. J. Wingfeld. 2006. Novel hosts of the Eucalyptus canker pathogen Chrysoporthe cubensis and a new Chrysoporthe species from Colombia. Mycol Res. 110: 833 – 845. [ Links ]
Heath, R. N., M. Gryzenhout, J. Roux and M. J. Wingfeld. 2006. Discovery of the Cryphonectria canker patogen on natyve Syzygium species in South Africa. Plant Disease 60: 433 – 438. [ Links ]
Hodges, C. S., M. S. Reis, F. A. Ferreira and J. D. M. Henfing. 1976. A cancro do Eucalipto causado por Diaporthe cubensis. Fitopatologia Brasileira1: 129–162. [ Links ]
Hodges, C. S., T. F. Geary and C. E. Cordell. 1979. The occurrence of Diaporthe cubensis on Eucalyptus in Florida, Hawaii and Puerto Rico. Plant Dis. 63: 216–220. [ Links ]
Hodges, C. S. 1980. The taxonomy of Diaporthe cubensis. Mycologia 72: 542–548. [ Links ]
Hodges, C. S., A. C. Alfenas and C. E. Cordell. 1986. The conspecificity of Cryphonectria cubensis and Endothia eugeniae. Mycologia 78:343–350. [ Links ]
Kobayashi, T. 1970. Taxonomic studies of Japanese diaporthaceae with special reference to their life histories. Bull. Gov. For. Exp. St. 226:132–147. [ Links ]
Krugner, T. L. and C. G. Auer. 1997. Doenças do eucalipto. In: H. Kimati, L. Amorin, A. Bergamim Filho, L. E. A. Camargo y J. A. M. Rezende (Eds.). Manual de Fitopatología. Vol. 2: Doenças das Plantas Cultivadas. Editora Agronômica Ceres. São Paulo, Brasil. pp. 357 – 358. [ Links ]
Myburg, H., M. Gryzenhout, R. N. Heath, J. Roux, B. D. Wingfeld and M. J. Wingfeld. 2002. Cryphonectria canker on Tibuchina in South Africa. Mycological Research 106 (11): 1299 – 1306. [ Links ]
Myburg, H., M. Gryzenhout, B. D. Wingfeld and M. J. Wingfeld. 2003. Conspecificity of Endothia eugeniae and Cryphonectria cubensis: a reevaluation based on morphology and DNA sequence data. Mycoscience 104:187–196. [ Links ]
Obregón, C. y N. Restrepo. 2000. El eucalipto. Una opción de alta rentabilidad. Programa forestal Colombiano. www.Revista–MM.com. (17 de mayo de 2008). [ Links ]
Old, K. M. and E. M. Davison. 2000. Cankerdiseases of Eucalypts. In: P. J. Keane,G. A. Kile, F. D. Podger and B. N. Brown (Eds.) Diseases and pathogens of eucalypts. CSIRO Publishing. Collingwood, Victoria, Australia. pp. 241–257. [ Links ]
Rodas, C. A., M. Gryzenhoutm, H. Myburg, B. D. Wingfeld and M. J. Wingfeld. 2005. Discovery of the eucalyptus canker pathogen Chrysoporthe cubensis on native Miconia (Melastomataceae) in Colombia. Plant Pathology 54: 460–470. [ Links ]
Seixas C, D. S., R. W. Barreto, A. C. Alfenas and F. A. Ferreira. 2004. Cryphonectria cubensis on an indigenous host in Brazil: a possible origin for eucalyptus canker disease? Mycologist 18: 39–45. [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). 2001. Las Plantaciones Forestales Comerciales en México. Dirección de Plantaciones Forestales Comerciales. Documento Informativo No. 2. pp. 1–10. [ Links ]
Shear, C. L., N. E. Stevens and R. J. Tiller. 1917.Endothia parasítica and related species. United States Department of Agriculture. Bulletin 380. Washington, DC. USA. pp. 1–82. [ Links ]
Van Heerden S. W., M. J. Wingfeld, T. Coutinho, L. M. Van Zyl and J. A. Wright. 1997. Diversity of Cryphonectria cubensis isolates in Venezuela and Indonesia. Proceedings IUFRO Conference on Silviculture and Improvement of Eucalypts, Salvador, Brasil, August 24–29. EMBRAPA, Colombia. pp. 142–146. [ Links ]
Van Heerden, S. W. and M. J. Wingfeld. 2001. Genetic diversity of Cryphonectria cubensis isolates in South Africa. Mycol. Res. 105:94–99. [ Links ]
Venter, M., H. Myburg, B. D. Wingfeld, T. A. Coutinho and M. J. Wingfeld. 2001. A new species of Cryphonectria from South Africa and Australia, pathogenic on Eucalyptus. Sydowia 54: 98–119. [ Links ]
Wingfeld, M. J., W J. Swart and B. J. Abear. 1989. First record of Cryphonectria canker of Eucalyptus in South Africa. Phytophylactica 21: 311–313. [ Links ]
White, T. J., T. Bruns, S. Lee and J. Taylor. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols: a guide to methods and applications. Academic Press. San Diego, CA, USA. pp. 315–322. [ Links ]














