Servicios Personalizados
Revista
Articulo
Indicadores
 Citado por SciELO
Citado por SciELO Accesos
Accesos
Links relacionados
 Similares en SciELO
Similares en SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.27 México abr. 2009
Efecto de la presencia de fenantreno sobre la expresión de proteínas y la actividad enzimática radical de Cyperus hermaphroditus
The effect of phenanthrene on protein expression and radical enzymatic activity in Cyperus hermaphroditus
L. Angélica Guerrero–Zúñiga1, Angélica Ma. Rodríguez–Dorantes2*
1Dirección de Seguridad y Medio Ambiente, Instituto Mexicano del Petróleo Eje Central Lázaro Cárdenas 152, CP 07730, México, DF
2Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Prol. Carpio y Plan de Ayala s/n. CP 11340, México, DF Correo electrónico: anrodo2000@hotmail.com
Recibido: 10 mayo 2008
Aceptado: 29 octubre 2008
Resumen
Los hidrocarburos aromáticos policíclicos (HAP) forman parte de los contaminantes derivados del petróleo que se encuentran en el ambiente y en particular se ha encontrado que los suelos con cubierta vegetal son considerados altamente efectivos para la remoción y mineralización de éstos, ya que las raíces de las plantas presentan proteínas relacionadas con la fitorremediación, como son algunos sistemas enzimáticos asociados a la pared celular que contribuyen a la remediación de sitios contaminados a través de la acción directa o por unión, secuestro, transformación y transporte de los contaminantes orgánicos.
El objetivo de este trabajo fue analizar los cambios en la expresión de proteínas radicales solubles y unidas a la pared celular y la actividad de algunas enzimas consideradas como marcadores bioquímicos de plantas de Cyperus hermaphroditus expuestas a fenantreno: un HAP tricíclico, con la finalidad de analizar fisiológicamente estos sistemas radicales y constituir herramientas útiles para la transformación de contaminantes orgánicos. El efecto del fenantreno en la actividad de guaiacol peroxidasas, ascorbato peroxidasas, lacasas y fosfatasas ácidas radicales de C. hermaphroditus, mostró diferencias significativas entre las enzimas solubles extraídas y la concentración del contaminante; mientras que las enzimas unidas iónicamente a la pared celular, solamente mostraron diferencias significativas entre ellas y no con respecto a la concentración del contaminante. Los resultados demostraron que la magnitud de la actividad de las enzimas constitutivas y de la expresión de proteínas en su inducción o represión bajo la presencia de fenantreno en las plantas de Cyperus hermaphroditus pueden ser componentes importantes de las reacciones de plantas a la toxicidad de los contaminantes, o bien participar en la transformación parcial de éstos a productos menos tóxicos que puedan ser fácilmente absorbidos por las raíces y además ser confinados en el interior de la planta.
Palabras clave: Cyperus, fenantreno, proteínas.
Abstract
Polycyclic aromatic hydrocarbons (PAH) are part of the petroleum contaminants encountered in the environment. It has been shown that soils supporting vegetation are effective in removing and mineralizing these contaminants; because plant roots have phytoremediation–related proteins like enzymatic systems linked to the plant cell wall that contribute to the remediation of contaminated sites. Through their direct action or by union they sequester, transform and transport organic contaminants.
The aim of this work was to analyze changes in the expression of the soluble and the ionically–bound cell wall root proteins and the activity of certain enzymes considered as biochemical markers in plants of Cyperus hermaphroditus exposed to phenanthrene, a tricyclic aromatic hydrocarbon. The effect of phenanthrene on the activity of the root enzymes guaiacol peroxidases, ascorbate peroxidases, laccases and acid phosphatases showed significant differences between the enzymes of the soluble protein fraction and the contaminant concentration. However, the enzymes of the ionically–bound cell wall fraction showed significant differences only among themselves, not with respect to the concentration of contaminant. The results showed that the amount of activity of constitutive enzymes and the induction or repression of protein expression in plants of C. hermaphroditus exposed to phenanthrene can be important mechanisms of plant reactions to contaminant toxicity or in partially transforming them to less toxic products that can be easily absorbed by the roots and sequestered in the plants.
Key words: Cyperus; phenanthrene; proteins.
INTRODUCCIÓN
Los contaminantes orgánicos pueden ser absorbidos por las raíces a través de procesos pasivos y/o activos y después translocarse hacia la parte aérea de las plantas por la corriente de transpiración (Chiou et al., 2001; Li et al., 2005). El transporte pasivo se efectúa a través de una serie de procesos de partición entre el sistema planta–agua y el sistema planta–materia orgánica y dentro de los diversos componentes de las plantas, de acuerdo con las concentraciones de los contaminantes no iónicos en plantas con relación a la concentración de éstos en el agua o en la solución del suelo (Su & Zhu, 2007; Vanier et al., 2001).
Los hidrocarburos aromáticos policíclicos (HAP) se encuentran dentro de los contaminantes derivados del petróleo ubicuos persistentes, que son generados por la combustión incompleta de la pirólisis de materiales orgánicos (Jiao et al., 2007; Sheng & Gong, 2006); dada su naturaleza carcinogénica, los hace ser contaminantes blanco (ATSRD, 1999).
Ya que las raíces de las plantas generan enzimas, aminoácidos y hormonas del crecimiento que ayudan a mantener la actividad enzimática, los suelos con cubierta vegetal son considerados altamente efectivos para la remoción y mineralización de los HAP. De la misma importancia son el intrincado juego de relaciones entre las raíces de las plantas, los microorganismos, el suelo y los contaminantes, que hacen posible los diversos procesos de fitorremediación (USEPA, 2000).
La mayoría de los compuestos HAP, se adsorben a la superficie radical y se tiene solamente una pequeña transferencia de éstos o de los productos transformados hacia el interior de la planta (Fismes et al., 2002; Wang & Jones, 1994).
El fenantreno es un hidrocarburo aromático tricíclico, ampliamente distribuido en el ambiente como resultado de procesos pirólicos (Blumer, 1976). No obstante que éste no es mutagénico ni carcinogénico, se ha visto que es tóxico para los organismos acuáticos (Black et al., 1983; Blumer, 1976; Kush, 1981; Savino & Tanabe, 1989); como se trata de un hidrocarburo aromático pequeño, éste se emplea frecuentemente como un sustrato modelo para desarrollar estudios sobre el metabolismo de hidrocarburos aromáticos policíclicos carcinogénicos (Narro et al., 1992; Pelkonen & Nebert, 1982).
Es de consideración mencionar que la biodegradación de los contaminantes comienza con la participación de enzimas extracelulares, pero que se requiere la presencia de la célula completa y de sus vías metabólicas para completarse. Los HAP y otros contaminantes tóxicos se han transformado exitosamente por óxidorreductasas e hidrolasas que se han aislado de hongos, bacterias y células vegetales en ensayos realizados bajo condiciones de laboratorio.
En el caso particular de los HAP de tres y cuatro anillos, se tiene que el antraceno, el fenantreno, el pireno y el fluoranteno se han oxidado in vitro por enzimas tales como la peroxidasa de rábano picante (Guenther et al., 1998).
Las plantas, pueden responder a estrés abiótico y biótico con un cambio rápido en la expresión de genes; lo cual da lugar a la síntesis de novo de proteínas específicas (Didierjean et al., 1996; Yun et al., 1999) que son consideradas como protectoras o proteínas resistentes, que en su mayoría participan como transportadoras de xenobioticos como herbicidas y de compuestos orgánicos endógenos, hacia dentro o fuera de las células o hacia las vacuolas (Keppler et al., 1999; Wang & Dawn, 2003). Así mismo, éstas poseen un fuerte sistema enzimático de defensa para manejarse contra xenobióticos. El metabolismo de éstos en plantas, se divide en tres fases: fase I que involucra reacciones de transformación, fase II que consiste en el desarrollo de reacciones de conjugación y, finalmente, la fase III que es la fase de la compartamentalización interna y procesos de almacenamiento de los xenobióticos (Sandermann, 1992). Se ha probado la existencia de varios sistemas enzimáticos detoxificadores para muchas plantas de diferentes especies de angiospermas, gimnospermas, helechos, musgos y en macroalgas (Pflugmacher et al., 1999).
Las proteínas relacionadas con la fitorremediación (phytoremediation related proteins: PRP) contribuyen a la remediación de contaminantes ambientales a través de la acción directa o por unión, secuestro, transformación y transporte de los contaminantes orgánicos; esto distingue a las PRPs de otras proteínas que participan en el establecimiento de la estructura de las plantas, que controlan la expresión de genes o que transforman los metabolitos centrales que pueden ser productos finales de degradación de tóxicos orgánicos (Herle et al., 2002; Salekdeh et al., 2002; Sánchez et al., 2001; Wang & Dawn, 2003).
Recientemente se ha tenido el interés por conocer la diversidad genética inter e intraespecífica de la respuesta al estrés en plantas; la importancia de analizar los perfiles proteicos se ha aceptado en muchos estudios de estrés abiótico en plantas. Algunos estudios previos han proporcionado información útil sobre enzimas individuales o transportadoras, midiendo sus cambios dependientes de estrés en cantidad y actividad. Los resultados de estos estudios han formado las hipótesis sobre cadenas de respuestas al estrés que juegan un papel significativo en el control del tiempo y espacio de este tipo de respuestas en plantas (Bohnert et al., 2006).
Se sabe que algunos sistemas enzimáticos de plantas pueden degradar algunas estructuras hidrocarbonadas aromáticas y lineales (Lu et al., 1998; Tommasini et al., 1998). Estas enzimas frecuentemente son enzimas asociadas a la pared celular que proporcionan una transformación parcial de los compuestos a productos fácilmente disponibles para las raíces o los microorganismos rizosféricos (Gianfreda & Rao, 2004).
El presente estudio forma parte de la investigación básica fisiológica que se ha desarrollado para evaluar la respuesta de cyperáceas crecidas de manera natural en un suelo contaminado con hidrocarburos derivados del petróleo; investigación que ha consistido en el estudio de la respuesta del crecimiento de tres especies de cyperáceas en un suelo contaminado con hidrocarburos derivados del petróleo (Guerrero, 2000; Guerrero & Rodríguez, 2006), en la evaluación de la actividad enzimática de fenoloxidasas de Cyperus elegans de los sistemas radicales de plantas in toto y de cultivo de raíces (in vitro) expuestos a fenantreno (Guerrero, 2005; Guerrero & Rodríguez, 2005), en la detección de fenantreno en el sistema radical de Cyperus hermaphroditus empleando técnicas fotoacústicas (Cruz et al., 2004) y en este trabajo el objetivo planteado fue analizar los cambios en la expresión de proteínas radicales de plantas de Cyperus hermaphroditus expuestas a fenantreno y el efecto de este contaminante sobre la actividad de algunas enzimas consideradas como marcadores bioquímicos, con la finalidad de analizar fisiológicamente estos sistemas radicales y constituir herramientas útiles para la transformación de contaminantes orgánicos.
MATERIAL Y MÉTODOS
Obtención de las plántulas de Cyperus hermaphroditus
Las semillas empleadas provienen de una colecta de material vegetal de Cyperus hermaphroditus en el pantano Santa Alejandrina cercano a la refinería de Minatitlán en el estado de Veracruz, Ver., una zona contaminada con un total de hidrocarburos del petróleo de 81 640 mg kg–1 de suelo seco (IMP & UAM–I, 1997).
La germinación se realizó en germinadores con arena y agua destilada estéril a 36°C, en oscuridad. Posteriormente las plántulas se trasplantaron y mantuvieron para su crecimiento en cultivos hidropónicos en contenedores de vidrio ámbar de 500 mL, con 400 mL de solución mineral: 0.20M NH4H2PO4, 0.50M NH4NO3, 1.15M Ca(NO3)2, 0.26M CaCl2, 0.20M MgCl2–6H2O, 0.20M Mg(NO3)2–6H2O, 0.40M MgSO4–7H2O, 0.20M KH2PO4, 1.20M KNO3, 0.50M K2SO4, 0.040M FeCl3–6H2O, 1.2 x 10–2M H3BO3,1.2 x 10–4M CuCl2–H20,2.3 x 10–3M ZnCl2, 4.4 x 10–4M MnCl2–4H2O, 6 x 10–6M Na2MoO4–H2O, EDTA and FeSO4–7H2O: pH 6 y se mantuvieron bajo condiciones controladas en invernadero a 37/17°C y 56% de humedad relativa en promedio con fotoperiodo 12:12 por 90 días, para su exposición con fenantreno.
Exposición de los cultivos de Cyperus hermaphroditus a fenantreno
Se transfirieron plantas completas a contenedores de vidrio ámbar de 1L de capacidad que contenían 900 mL de la solución mineral, a los cuales posteriormente se les adicionó fenantreno (grado HPLC, SIGMA Chemical Co.) a las concentraciones de: 40, 80 y 120 ppm, a partir de una solución patrón de fenantreno (100 mg/10 mL etanol al 95%), exponiéndolos durante tres días. Los cultivos hidropónicos con el contaminante se mantuvieron bajo condiciones de invernadero a 37/17°C y 56% de humedad relativa en promedio, con un sistema de burbujeo continuo mediante varillas de vidrio sumergidas en cada unidad hidropónica, conectadas a una bomba de aireación para proveer de aire a la solución, prevenir la deposición de fenantreno insoluble en el fondo y favorecer la intercepción de éste por los sistemas radicales y garantizar la distribución del compuesto en el sistema.
Después de transcurrido el periodo de exposición a fenantreno, se obtuvo el peso de la biomasa total epigea (material foliar) e hipogea (material radical) para cada experimento y se separó el sistema radical para la obtención y caracterización de proteínas totales radicales y para los análisis enzimáticos.
Obtención de proteínas radicales totales: separación de proteínas solubles y unidas iónicamente a la pared celular
La extracción de las proteínas totales radicales se realizó según el método de Flocco et al. (2002) para el fraccionamiento de proteínas, tomando 1.5 g de material radical de muestras de cada experimento, homogeneizando esta biomasa en mortero en frío (4°C) con 10 mL de regulador de KPO4 50 mM pH = 6.0 frío; las muestras se centrifugaron a 3 500 rpm por 20 minutos a 4°C. Posteriormente se guardó este sobrenadante que contenía las proteínas solubles unidas débilmente a la pared celular (extracto I); mientras que el precipitado celular se lavó con el mismo regulador de fosfatos y se centrifugó nuevamente y resuspendió en regulador KPO4 50 mM + NaCl 1M pH 6.0, incubándolo a 4°C durante 24 horas, estas muestras nuevamente se centrifugaron guardando el sobrenadante que correspondió a las proteínas iónicamente unidas a la pared celular (extracto II).
Para los dos extractos radicales, se cuantificó la proteína total para cada muestra de cada uno de los experimentos, empleando el método convencional de Bradford (1976).
Actividad específica de guaiacol peroxidasas (GPX) de los extractos radicales
La determinación de la actividad de guaia–colperoxidasas de los extractos I y II, se realizó empleando el método espectro–fotométrico de la oxidación de guaiacol (Guerrero, 2005), depositando en tubos eppendorf de 1.5 mL: 100 µL de muestra (extracto radical) + 1.5 mL de regulador de fosfato de potasio 0.1M pH = 6.0 + 32 µL de guaiacol 0.2M + 32 µL de peróxido de hidrógeno 0.03M. Los tubos se incubaron 15 minutos a temperatura ambiente; se evidenció la actividad de las proteínas a través del desarrollo de la coloración café–rojiza característica de la oxidación y polimerización del guaiacol y se leyó la absorbancia a 436 nm que se transformó utilizando el coeficiente de extinción molar del guaiacol (e436 = 6.4 x 103 M–1 cm–1), para la determinación de la actividad específica de peroxidasas (nM guaiacol oxidado/min/ug proteína/g de peso fresco radical).
Actividad específica de lacasas de los extractos radicales.
La determinación de la actividad de lacasas de los extractos I y II, se realizó empleando el método espectrofotométrico de la oxidación de catecol (Guerrero, 2005), depositando en tubos eppendorf de 1.5 mL: 100 µL de muestra (extracto radical) + 1.5 mL de regulador de fosfato de potasio 20 mM pH = 6.8 + IOOuL de catecol 0.2M. Los tubos se incubaron 15 minutos a temperatura ambiente, se evidenció la actividad de las proteínas a través del desarrollo de la coloración amarilla característica de la oxidación y polimerización del catecol y se leyó la absorbancia a 450 nm que se transformó utilizando el coeficiente de extinción molar del catecol (e450 = 2.211 x 103 M–1 cm–1) para la determinación de la actividad específica de laccasas (nM catecol oxidado/min/ug proteína/g de peso fresco radical).
Actividad específica de ascorbato peroxidasas (APX) de los extractos radicales
La determinación de la actividad de las ascorbato peroxidasas de los extractos I y II, se realizó empleando el método espectrofotométrico de la oxidación de ascorbato (Nakano & Asada, 1981; Sairam et al., 2004), depositando en tubos eppendorf de 1.5 mL: 100 µL de muestra (extracto radical) + 1.5 mL de regulador de fosfato de potasio 50 mM pH = 7.0 + 500 µL de peróxido de hidrógeno 2.5 mM + 500 µL de ascorbato de sodio 1.0 mM para iniciar la reacción. Se leyó el incremento en la absorbancia a 286 nm, que se transformó utilizando el coeficiente de extinción molar del ácido ascórbico (e450 = 2.211 x 103 M–1 cm–1) durante cinco minutos, con intervalos de un minuto, para la determinación de la actividad específica de ascorbato peroxidasas (nM ascorbato oxidado/min/ug proteína/g de peso fresco radical).
Actividad específica de fosfatasas ácidas de los extractos radicales
La determinación de la actividad de fosfatasas ácidas de los extractos I y II, se realizó con base en la medición espectrofotométrica de la formación de para nitrofenol (pNP) (Triana–Córdova, 1994), que resulta de la hidrólisis del paranitrofenil fosfato (pNPP) utilizado como sustrato para la enzima; depositando en tubos de ensaye de 10 mL: 100 µL de muestra (extracto radical) + 1 mL de regulador de acetato de sodio 50 mM, pH = 4.8 + 0.5 mL de pNPP (para nitrofenil fosfato) 5 mM, en regulador de acetatos 5 mM, pH = 4.8. Los tubos se incubaron por 15 minutos a 30°C y se detuvo la reacción con 4.5 mL de NaOH 0.1N y se leyó la absorbancia de la solución a 400 nm. Los resultados obtenidos se interpolaron en una curva tipo de pNP. Para la determinación de la actividad específica de fosfatasas ácidas (nM paranitrofenol/min/ug proteína/g de peso fresco radical).
Análisis electroforético de proteínas totales radicales
Se realizó la caracterización electroforética de las proteínas totales radicales de los extractos I y II con el empleo de geles de poliacrilamida–SDS para determinar la presencia de algunas proteínas inducidas bajo la presencia de fenantreno. Los patrones de proteínas totales radicales se obtuvieron mediante la técnica de Laemmli (Ausubel et al., 1992) empleando geles discontinuos con 4% y 12% de poliacrilamida–bisacrilamida en los geles superior e inferior, respectivamente. Previo al corrimiento electroforético, las muestras de proteínas totales de los extractos se concentraron por el método de Sauvé et al. (1995), empleando fenol y éter. Como marcadores de peso molecular se emplearon las proteínas albúmina bovina (cross–linked) (66 000 + 132 000 + 198 000 y 264 000 Da) y hemoglobina (cross–linked) (16 000 + 32 000 + 48 000 y 64 000 Da) y Peroxidasa de rábano picante tipo VI (SIGMA Chemical Co.) que se disolvieron conjuntamente en 1.5 mL de regulador de muestra (Regulador Tris–HCl pH = 6.8, + glicerol + azul de bromofenol + SDS) y se sometieron a ebullición también por cinco minutos antes de su empleo.
El corrimiento se realizó utilizando regulador Tris–Glicina (Tris 0.6 g y Glicina 2.88 g) pH 8.3, a 120 volts, durante dos horas.
Al término del corrimiento los geles se fijaron con ácido tricloroacético al 10%, frío, por 30 minutos para la tinción con plata por el método de Nielsen & Brown (1984); esta técnica de tinción es mucho más sensible ya que permite la detección de menos de 1ng de proteína en un gel y se basa en la capacidad que tiene el ion plata para unirse a los restos de aminoácidos presentes en las proteínas y formar complejos plata–proteína que producen bandas coloridas.
Los corrimientos se realizaron por triplicado, y las imágenes de los geles teñidos se capturaron con una cámara digital con 3664 x 2752 pixeles de resolución; se digitalizaron cotejando con los patrones electroforéticos obtenidos y se documentaron empleando el programa SIGMA–GEL ANALYSIS Software, Ver. 1.0. para su análisis y la determinación de los pesos moleculares de las proteínas resueltas.
Se caracterizaron también las guaiacol peroxidasas de los extractos radicales I y II, mediante una tinción directa en el gel, la cual consistió en depositar el gel, después de realizado el corrimiento electroforético, en 100 mL de solución reguladora de fosfatos 0.1M pH = 6.0, adicionando 2.13 mL de guaiacol 0.2M y finalmente 2.3 mL de H2O2 0.03M. Se mezcló la solución y se dejó el gel en incubación por 40 minutos a temperatura ambiente para el desarrollo de la reacción, que se caracterizó por la presencia de una coloración café producto de la polimerización del guaiacol en las enzimas de reacción específica con este sustrato.
Se realizó también un análisis comparativo de los resultados de la expresión de proteínas como respuesta a la presencia de fenantreno, para determinar la similitud entre los experimentos realizados con C. hermaphroditus para los resultados de los polipéptidos radicales resueltos. Se utilizó el programa NTSYS–PC, versión 2.11T (Numerical Taxonomy and Multivariate Analysis System) de Rohlf (2004), para la aplicación de los índices de SMC (Simple Matching Coefficient) y DICE. Una vez obtenidos los valores de similitud entre los tratamientos, se construyó el fenograma respectivo utilizando el método de agrupamiento UPGMA (Unweighted Pair Group Method of Arithmetic Averages) para todos los casos analizados. También se estableció la veracidad y confianza de los fenogramas obtenidos a través de la obtención del coeficiente de correlación producto–momento de Pearson (Sneath & Sokal, 1973).
Análisis estadístico de los resultados
A los resultados de cuantificación de biomasa epigea e hipogea y actividad enzimática, se les aplicó un análisis de varianza (ANOVA) y prueba de Tukey–Kramer de comparación múltiple, empleando el paquete estadístico GraphPad Instat, V2.03 (Aceves, 1993) y el paquete estadístico de diseños experimentales FAUANL versión 1.4 (Olivares, 1989). Todos los experimentos se realizaron por triplicado.
RESULTADOS Y DISCUSIÓN
Evaluación de la actividad enzimática de las proteínas solubles o iónicamente unidas a la pared celular de los extractos radicales de C. hermaphorditus.
Se han desarrollado tecnologías avanzadas que permiten ahora visualizar de manera directa a los HAP; compuestos químicos que pueden adsorberse a las superficies radicales o ser absorbidos por los tejidos radicales.
Dentro de estos métodos se tienen extracciones secuenciales para separar los compuestos químicos adsorbidos en la superficie, tal como Schwab et al. (1998) sugieren que al realizar extracciones con CaCl2 de muestras radicales con HAP, se extraen los compuestos disueltos en la solución acuosa que se localiza dentro del espacio libre aparente de las raíces y que los compuestos adsorbidos a la superficie radical pueden ser recuperados posteriormente con un solvente orgánico (Binet etal., 2000).
El primer paso efectivo para la transformación vía celular de contaminantes, es comúnmente la reacción catalizada por enzimas ecto y extracelulares, que son liberadas por las células en su ambiente cercano (Gianfreda & Rao, 2004). Las enzimas extracelulares incluyen una amplia gama de óxidorreductoras e hidrolasas; ambas enzimas poseen una función degradativa y transforman las sustancias poliméricas en productos parcialmente oxidados y/o degradados, que pueden ser incorporados fácilmente por las células (Korte et al., 2000). Éstas también se localizan en el citoplasma y en organelos de las células, de tal forma que existe una distribución intracelular de enzimas que incrementa considerablemente la habilidad de detoxificación en plantas.
No obstante que en ambos extractos I y II el efecto de la presencia de fenantreno en las plantas expuestas mostró un decremento en las actividades de todas las enzimas analizadas al incrementarse la concentración del contaminante, lo que se corroboró con el análisis factorial entre enzimas y tratamientos, donde se obtuvo para cada extracto una diferencia significativa entre las enzimas analizadas (GPX; Lacasas, APX y APasa); se alcanzó un mayor crecimiento de las plantas (biomasa foliar y radical) en los experimento con la mayor concentración de fenantreno comparadas con el testigo (Fig. 1).

La extracción que se obtuvo de las proteínas totales radicales solubles y las asociadas a la pared o al sitio apoplástico radical, favorecida por la fuerza iónica del regulador de extracción, dio lugar a evidenciar que la actividad de las enzimas unidas iónicamente a la pared celular de las células radicales fue mayor que la actividad de las enzimas solubles extraídas (Fig. 2). Este comportamiento puede relacionarse con la localización y abundancia de éstas en los sitios apoplásticos (sitios intercelulares) y simplásticos (sitios intracelulares) de las raíces; la única diferencia entre ellas se dio en la magnitud de los valores obtenidos.

La mayor actividad enzimática que se asoció también con la abundancia de estas enzimas en los dos extractos obtenidos, la presentaron las fosfatasas ácidas. La respuesta de las fosfatasas ácidas de C. hermaphroditus no presentó una diferencia significativa entre la naturaleza soluble o unida a la pared celular de estas enzimas ni entre los diferentes tratamientos con fenantreno (p < 0.05) (Fig. 2).
En comparación con el resto, esto pudo estar asociado con la naturaleza de la extracción de las proteínas obtenidas, ya que se ha reportado que las fosfatasas ácidas unidas a la pared celular se activan por un incremento en la fuerza iónica de la mezcla de reacción (Noat et al., 1980).
Así mismo, se sabe que son susceptibles de su inducción bajo condiciones con metales pesados como el zinc, plomo y cadmio, tanto para enzimas unidas a membrana como solubles, lo que finalmente depende de la condición y forma estructural de la enzima (Tikhaya et al., 1999; Tikhaya & Fedorovskaya, 2000) y que las fosfatasas externas a la membrana citoplásmica pueden catalizar la liberación de ortofosfato de compuestos orgánicos que contienen fósforo, y con ello incrementan la disponibilidad de fosfato en el ambiente inmediato. Esto es importante, ya que los fosfatos orgánicos son frecuentemente uno de los componentes principales de la solución del suelo en ambientes con limitación de fósforo (Livingstone & Whitton, 1984; Shand et al., 1994; Turner & Haygarth, 2000; Turner et al., 2001).
El siguiente grupo que mostró una mayor actividad bajo la presencia de fenantreno fue el de las ascorbato peroxidasas; en estos resultados se obtuvo una diferencia significativa en la actividad de este tipo de enzimas tanto solubles como iónicamente unidas a la pared (p < 0.05) (Fig. 2), en este caso la evidencia de su presencia dada por su actividad, fue mayor en los extractos de las proteínas unidas a la pared, y su participación puede estar relacionada con aquellas condiciones que pudieron generarse bajo la acción de radicales libres, o simplemente para controlar la concentración de agentes oxidantes (Song et al., 2005), condiciones a las que se sometieron las plantas de C. hermaphroditus ante fenantreno, generando reacciones secundarias para las plantas, ya que se sabe que son enzimas que se activan bajo condiciones de estrés en las plantas y son consideradas como antioxidantes (Sairam et al., 2004), participan en las respuestas a la desecación (Menconi et al. 1995; Zhang & Kirkham, 1996; Sairam & Saxena, 2000; Sairam & Srivastava, 2001) a altas temperaturas (Upadhyaya et al., 1990; Sairam et al., 2000) bajas temperaturas y heladas (Anderson et al., 1995; Doulis et al., 1997; Scebba et al., 1999), a alta luminosidad (Danna et al., 2003; Kampfenkel et al., 1995; Mittler et al., 1999), a la infección patogénica (Park et al., 2004; Yabuta et al., 2002; Yoshimura et al., 2000) y la salinidad (Hernández et al., 1999; 2000).
Las guaiacol peroxidasas mostraron diferencias significativas en la actividad de las enzimas solubles (extracto I) entre los testigos y los tratamientos con 80 y 120 ppm de fenantreno (p < 0.05), lo que no sucedió con las enzimas iónicamente unidas (extracto II) (Fig. 2). Para estas enzimas, el efecto de la presencia de fenantreno fue mayor en las unidas débilmente a la pared; este efecto pronunciado se relaciona con el hecho de que se localizan principalmente en las paredes celulares y son importantes en procesos de detoxificación, ya que parecen ser las responsables de la formación de uniones covalentes entre contaminantes hidroxilados, metabolitos y los polímeros de las paredes celulares de plantas, a través de la polimerización oxidativa no específica de unidades fenólicas en la pared celular para producir lignina (Harvey et al. 2001; Harms et al., 2003). Más aún, las peroxidasas también se han detectado en la superficie radical de muchas especies de plantas y se han empleado en la detoxificación de contaminantes in vivo a nivel de la superficie radical (Adler et al., 1994) y están relacionadas con el metabolismo de varios contaminantes orgánicos (Dec & Bollag, 1994; Klibanov et al., 1980; Macková et al., 2001; Schnoor et al. 1995; Wevar–Oller et al., 2005).
En este caso de C. hermaphroditus con fenantreno, en comparación con el trabajo de Flocco et al. (2002) con alfalfa y fenol, la actividad de las peroxidasas solubles radicales no mostró un incremento significativo, y en su caso, las peroxidasas unidas iónicamente a la pared celular, no se vieron afectadas por la presencia del contaminante. Aquí el incremento en la concentración de fenantreno (40 a 120 ppm), indujo un efecto negativo sobre su actividad, lo que sugiere una respuesta de estrés ante el contaminante (Kortc et al., 2000; Lyte & Lite, 2001).
Finalmente, las laccasas radicales de C. hermaphroditus medidas tanto en el extracto I como en el extracto II, no presentaron una diferencia significativa en cada caso (p < 0.05) (Fig. 2). Estas enzimas pueden ser consideradas como un caso aparte, ya que la actividad de éstas se incrementó con la presencia del contaminante, en particular para el caso de las enzimas unidas iónicamente a la pared celular, no obstante que mostraron un decremento en la actividad a medida que aumentó la concentración del contaminante.
La naturaleza de estas enzimas como fenoloxidasas, sugiere que fueron susceptibles de inducir su actividad al contacto con el contaminante, de manera más evidente que las guaiacol peroxidasas; esto puede obedecer al hecho de que se sabe que las laccasas catalizan la oxidación de un amplio espectro de compuestos aromáticos (Baise et al., 2003; Duran et al., 2002) y su papel no se limita al metabolismo de compuestos fenólicos dentro de las plantas, ya que pueden ser liberadas al suelo y ejercer un papel ecológico al emplearse para transformar contaminantes fenólicos y detoxificar el microambiente del suelo que rodea a las raíces; esta detoxificación ex planta proporciona una ventaja sobre las estrategias de fitorremediación basadas en la incorporación de xenobióticos por las plantas y su acumulación y/o metabolismo (Hannik, 2001; Song, 2003; Wang et al., 2004).
Comparando con los estudios de Gramms et al. (1999) que evaluaron la exudación de enzimas por las raíces de 12 especies vegetales, donde demostraron que varios miembros de las familias Fabaceae, Gramineae y Solanceae liberaron de manera eficiente y considerable tanto oxidasas como hidrolasas en las zonas radicales del suelo, y que además dentro de estas enzimas se encontraron de manera particular: peroxidasas, laccasas, monofenol monooxigenasas, lipasas y esterasas; para C. hermaphroditus, la evaluación de la actividad de las enzimas seleccionadas, bien puede tratarse de un estudio que pudiera sugerir la participación de algunas de estas enzimas en procesos de detoxificación o aún más, de transformación del HAP probado. Ya que esto se puede relacionar con los estudios reportados por Pflugmacher et al. (1999) con los cormos de Phragmites australis, donde se investigaron las actividades de algunas enzimas que participan en procesos de detoxificación relacionados con las fases I y II, como son las guaiacol peroxidasas, las glutation peroxidasas y las glutation transferasas, entre otras. Presentándose la mayor actividad medida en las enzimas radicales de P. australis, comparada con la actividad enzimática en hojas y tallo. La razón de este comportamiento se pudo dar porque las raíces se encuentran en contacto directo con los contaminantes en el suelo o en agua (Folsom & Price, 1991), pudiendo entonces asociarse por mucho más tiempo con ellos, lo que permite su transformación y/o detoxificación por las plantas.
También cabe mencionar que en los experimentos in vitro de Chroma et al. (2002) con algunos cultivos de plantas de varias especies y morfologías, éstas fueron capaces de transformar hidrocarburos aromáticos policíclicos y que esta transformación fue atribuible a la producción de una peroxidasa constitutiva asociada a la pared celular. Se ha mencionado también que peroxidasas extracelulares de plantas pueden mostrar diferentes funciones dependiendo de las condiciones de pH y de la naturaleza de los donadores de electrones, esto fue demostrado por Harvey et al. (2002) en cultivos de Ipomea batada, que produce una amplia gama de peroxidasas que se expresan a diferentes condiciones de pH; a pH de 7 pueden oxidar compuestos en su forma de quinona, mientras que a un pH de 3, en presencia de sustratos secundarios como el NADH que sirve como un mediador redox, se da la oxidación por peroxidasas dependientes de NADH. Kraus et al. (1999) han determinado también que el contacto de las raíces con los contaminantes como los HAP, induce la actividad de peroxidasas, las cuales pueden tener una función intracelular como parte de un mecanismo de defensa y/o un efecto directo sobre la degradación de compuestos aromáticos en el medio externo.
Caracterización de proteínas inducibles: polipéptidos resueltos de los experimentos de Cyperus hermaphroditus
Los análisis electroforéticos consideraron las proteínas totales radicales extraídas, tanto solubles como las unidas iónicamente a la pared, de las plantas de C. hermaphroditus expuestas a fenantreno, de las que se muestran los patrones electroforéticos (tablas 1 y 2) y electroferogramas representativos (Figs. 3 y 4).
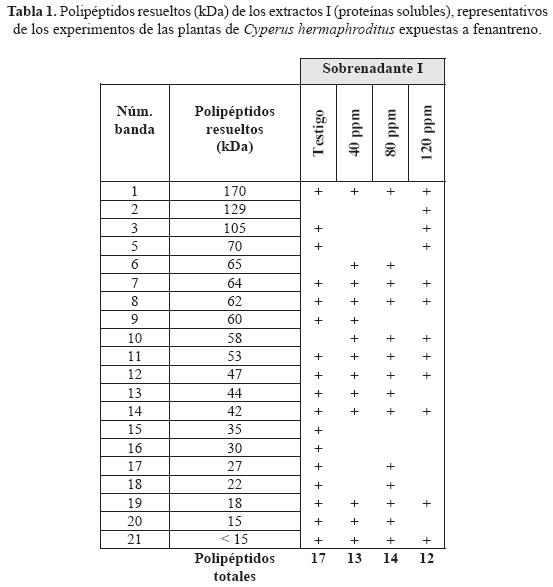



La presencia de fenantreno no ejerció tampoco un efecto notorio sobre la expresión de las proteínas; en cuanto al número de proteínas totales solubles radicales resueltas en la electroforesis, que no fue mayor al patrón obtenido de las proteínas radicales de plantas no expuestas a fenantreno, y solamente un 17% de ellos fueron inducidos de manera única con el fenantreno.
En cuanto a las proteínas totales radicales unidas iónicamente a la pared, el número de polipéptidos totales resueltos comparados con las proteínas solubles fue menor; además de que sólo el 18% de sus proteínas expresadas fueron inducidas bajo la presencia del contaminante.
La comparación de los patrones electroforéticos obtenidos entre experimentos, mostró que se comparten entre ellos algunas proteínas: los polipéptidos resueltos comunes entre las proteínas solubles y las unidas iónicamente a la pared, fueron cuatro: de 65, 44, 18 kDa y dos polipéptidos de < 15 kDa, de éstos sobresalió, por su distribución común, el de 18 kDa ya que se presentó en todos los experimentos realizados y puede ser considerado como constitutivo de la especie.
Los polipéptidos específicos, que corresponden a los polipéptidos de las proteínas solubles extraídas, exclusivos en los experimentos de testigo y fenantreno 40, 80 y 120 ppm fueron los de 170, 64, 62, 53, 47 y 42 kDa. Los polipéptidos de las proteínas iónicamente unidas a la pared de los experimentos de testigo y fenantreno 40, 80 y 120 ppm, fueron los de 180, 59 y 55 kDa; aunque quizá también puedan considerarse los de 88 y 48 kDa.
Para cada experimento, éstos pudieran tratarse de proteínas constitutivas y, de manera particular, los de 129 y 58 kDa para las proteínas solubles y el de 63 kDa de las proteínas totales iónicamente unidas a la pared celular, ser considerados como polipéptidos inducidos bajo la presencia del contaminante. La frecuencia del resto de los polipéptidos se mantuvo repartida entre todos los patrones electroforéticos obtenidos sin mostrar una tendencia particular; quizá con una importancia relativa dependiendo de las condiciones y con ello de su grado de expresión por la planta bajo las condiciones del contaminante.
Cabe mencionar también que en general, los polipéptidos resueltos correspondieron a proteínas con un alto contenido de lisina y ácido aspártico entre los aminoácidos que las conforman, por la evidencia colorida del gel con la tinción con plata (Nielsen & Brown, 1984).
La comparación entre los polipéptidos resueltos de las peroxidasas de rábano picante empleadas como marcador de peso molecular en la tinción con plata, mostró que algunos de éstos fueron los mismos que se presentaron en los extractos radicales tanto de las proteínas solubles (170, 58 y 22 kDa) como las proteínas extraídas unidas iónicamente a la pared (59, 55 y 24 kDa), los de las peroxidasas de rábano picante de 38 y 11 kDa resultaron un caso único, ya que no se presentaron en ninguno de los resultados radicales.
En cuanto a la caracterización de las guaiacol peroxidasas por la tinción específica de éstas en el gel, se obtuvo como resultado la presencia de un polipéptido común en todos los experimentos de ambos extractos radicales, que correspondió también a un polipéptido característico de las peroxidasas de rábano picante, cuyo peso molecular fue de 65 kDa (Fig. 5). Cabe mencionar que no se mostró ningún patrón isoenzimático para este tipo de peroxidasas en las muestras de los extractos de proteínas totales radicales analizados; aunque se reporta que el nivel de los patrones isoenzimáticos de peroxidasas pueden alterarse por condiciones de estrés ambiental (Flocco et al., 2002); estas enzimas pueden considerarse constitutivas e inducibles, las cuales se expresan como proteínas solubles tanto extracelulares como unidas a membrana en algunos tejidos vegetales, donde se presenta la oxidación de sustratos aromáticos y se emplea peróxido de hidrógeno como un cosustrato (González et al., 2006; Pearse et al., 2005). La peroxidasa de rábano picante (HRP: horseradish peroxidase) es una peroxidasa que puede ser excretada también por raíces transformadas de plantas de rábano picante y pueden catalizar la oxidación de compuestos tales como fenoles, bifenoles, anilinas y benzidinas, sobre una amplia gama de pH y temperaturas (Duran & Esposito, 2000) y pueden ser consideradas por ello dentro del gran número de enzimas extracelulares con potencial para la biorremediación (Ruggaber et al., 2006).

Comparación de los resultados bioquímicos y moleculares de la respuesta de Cyperus hermaphroditus a fenantreno, empleando análisis numérico
Se obtuvo información relevante del análisis de la comparación entre los tratamientos sin fenantreno y con 40, 80 y 120 ppm del contaminante, donde se compararon el número de polipéptidos totales resueltos de las proteínas totales radicales extraídas solubles y las iónicamente unidas a la pared celular.
Se presenta el fenograma de la comparación de los polipéptidos totales resueltos de las proteínas totales radicales extraídas (extractos I y II) de los diferentes tratamientos con y sin fenantreno (Fig. 6), derivado de la aplicación del coeficiente de Dice, con un valor de correlación de 0.98, que numéricamente resultó confiable (Kohl–mann, 1994; Rodríguez 1998; Rodríguez & Castañeda, 1998) en el establecimiento de los grupos asociados, cuya cercanía se relacionó con la respuesta de inducción de proteínas bajo la presencia de fenantreno como se describe a continuación.
El análisis numérico realizado con los polipéptidos presentes en todos los experimentos relacionados con la expresión de las proteínas inducidas por la presencia de fenantreno, mostró la asociación entre dos grupos principales: los patrones de las proteínas totales radicales solubles (extracto I) y las iónicamente unidas a la pared (extracto II) de manera independiente. Dentro de cada uno de ellos, la similitud entre los tratamientos de 40 y 80 ppm con fenantreno y testigo por separado e independientes a éstos el tratamiento con 120 ppm de las proteínas de ambos extractos.
La mayor identidad o similitud se obtuvo entre los experimentos con 40 y 80 ppm de fenantreno, en cuanto al número y tipo de polipéptidos comunes inducidos por la presencia del contaminante. Las agrupaciones derivadas del análisis numérico, permitieron analizar con detalle que la expresión de las proteínas analizadas por electroforesis, mostraron que la respuesta fue similar entre el testigo y las concentraciones de 40 y 80 ppm de fenantreno, lo que sugiere que al aumentar la concentración de fenantreno en el ensayo a 120 ppm, la respuesta particular en cuanto a la naturaleza de las proteínas inducidas es de considerar una respuesta de estrés ante el contaminante.
CONCLUSIONES
Del análisis sobre el efecto de fenantreno en la actividad de guaiacol peroxidasas, ascorbato peroxidasas, laccasas y fosfatasas ácidas radicales de Cyperus hermaphroditus se mostraron diferencias significativas entre las enzimas solubles extraídas analizadas y la concentración del contaminante, lo que para el caso de las unidas iónicamente a la pared celular, solamente se obtuvieron diferencias significativas entre las enzimas analizadas. La variación en la actividad de las enzimas radicales de ambos extractos, mostró que la presencia de fenantreno alteró la naturaleza de la respuesta, lo que puede asociarse a una adaptación bioquímica de esta especie ante el contaminante.
Los resultados demostraron que los niveles de la actividad de las enzimas constitutivas y de la expresión de proteínas en su inducción o represión bajo la presencia de fenantreno en las plantas de Cyperus hermaphroditus pueden ser componentes importantes de las reacciones de plantas a la toxicidad de los contaminantes, ya que estas enzimas pueden considerarse como biomarcadores no específicos de contaminación ambiental a través de los cambios en su actividad como respuesta a condiciones de estrés al ser útiles para proporcionar una detección temprana de las alteraciones primarias en plantas, y la presencia de nuevas proteínas puede ser considerada como respuesta a una amplia gama de análisis de estrés ambiental, lo que pudiera derivar en la implicación de enzimas transformadoras de contaminantes orgánicos, liberadas por las raíces de las plantas al ambiente cercano del suelo. Estas enzimas, al estar asociadas comúnmente a la pared celular, pueden realizar una transformación parcial de los compuestos en productos menos tóxicos que puedan ser fácilmente absorbidos por las raíces y ser confinados en el interior de la planta.
AGRADECIMIENTOS
El segundo autor agradece a la Dirección de Posgrado e Investigación del IPN, el apoyo financiero otorgado al Proyecto SEPI: 2006749, para la realización de este trabajo.
LITERATURA CITADA
Aceves, J., 1993. GraphPad Software. V.2.03. [ Links ]
Agency for Toxic Substances and Disease Registry (ATSDR), 1999. Toxicological profile for polycyclic aromatic hydrocarbons (PAHs) (uptdate). ATSDR. Atlanta, G. A. 518 pp. [ Links ]
Anderson, M.D., T.K. Prasad & C.R. Stewart, 1995. "Changes in isozyme profiles of catalase, peroxidase and glutathione reductase during acclimation to chilling in mesocotyls of maize seedlings". Plant Physiol., 109: 1247–1257. [ Links ]
Ausubel, T.M., R. Brent, R.E. Kingston, D.D. Moore, J.G. Seidman, J.A. Smith & K. Struhl, 1992. Short Protocols in Molecular Biology (A Compendium of Methods from Current Protocols in Molecular Biology). Section II: electrophoretic separation of proteins. Second Edition. John Willey & Sons. [ Links ]
Baise, H.P., R. Vepachedu, S. Gilroy, R.M. Callaway & J.M. Vivanco, 2003. Allelopathy and exotics plant invasion: from molecules and genes to species interactions". Science, 301: 1377–1380. [ Links ]
Binet, P., J.M. Portal & C. Leyval. 2000. "Fate of polycyclic aromatic hydrocarbons (PAH) in the rhizosphere and mycorrhizosphere of ryegrass". Plant Soil, 227:207–213. [ Links ]
Black, J.A., W.J. Birge, A.G. Westerman & P.C. Francis, 1983. "Comparative aquatic toxicology of aromatic hydrocarbons". Fundam. Appl. Toxicol., 3: 353–358. [ Links ]
Blumer, M., 1976. "Polycyclic aromatic hydrocarbon in nature". Sci. Am., 234: 34–44. [ Links ]
Bohnert, H.J., Q. Gong, P. Li & Sh. Ma., 2006. "Unravelling abiotic stress tolerance mechanismsgetting genomics going". Curr.Opin.Plant Biol. 9: 180–188. [ Links ]
Bradford, M., 1976. "Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding". Anal.Biochem., 72: 248–254. [ Links ]
Chiou, C.T., G. Sheng & M. Manes, 2001. " A partition–limited model for the plant uptake of organic contaminants from soil and water". Environ. Sci. Technol. 39: 4864–4870. [ Links ]
Chroma, L., M. Mackova, P. Kucerova, C. Der Wiesche, J. Burkhard & T. Macek., 2002. "Enzymes in plant metabolism of PCBs and PS". Acta Biotechnol. 22: 35–41. [ Links ]
Cruz, O.A., V.S. Tomás, , Z.A. Guerrero, & D.A. Rodríguez, 2004. "Detection of an aromatic compound at the roots of Cyperus hermaphroditus by photoacoustic techniques". Int. J. Thermophys., 25: 603–610. [ Links ]
Danna, C.H., C.G. Bartoli & F. Sacco, 2003. "Thylacoid–bound ascorbate peroxidase mutant exhibits in paired electron and photo synthetic activity". Plant Physiol., 132: 2116–2125. [ Links ]
Dec, J. & J.M. Bollag, 1994. "Use of plant material for the decontamination of water polluted with phenols". Biotechnol. Bioeng., 44: 1132–1139. [ Links ]
Didierjean, L., P. Frendo, W. Nasser, G. Genot, J. Marivet & G. Burkard, 1996. "Heavy–metal–responsive genes in maize: identification and comparison of their expression upon various forms of abiotic stress". Planta, 199: 1–8. [ Links ]
Doulis, A., N. Debian, A.H. Kingston–Smith & C.H. Foyer, 1997. "Characterization of chilling sensitivity in maize. I. Differential localization of antioxidants in maize leaves". Plant Physiol., 114: 1031–1037. [ Links ]
Duran, N. & E. Esposito, 2000. "Potential applications of oxidative enzymes and phenoloxidase–like compounds in was tewater and soil treatment: a review". Appl. Catal. B., 28: 83–99. [ Links ]
Duran, N., M.A. Rosa, A.D'Annibale & L. Gianfreda, 2002. "Applications of laccases and tyrosinases (phenoloidases) immobilized on different supports: a review". Enzyme Microbiol. Technol., 31: 907–931. [ Links ]
Fismes, J., C. Perrin–Ganier, P. Empereur–Bissonnet & J.L. Morel, 2002. "Soilto–root transfer and translocation of polycyclic aromatic hydrocarbons by vegetables grown on industrial contaminated soils". J. Environ.Qual., 31: 1649–1656. [ Links ]
Flocco, C.G., A. Lobalbo, M.P. Carranza & A.M. Giuletti, 2002. "Removal of phenol by alfalfa (Medicago sativa L.) grown in hydroponics and its effect on some physiological parameters". Acta Biotechnol., 22: 43–54. [ Links ]
Folsom, B.L. & R.A. Rice, 1991. "A plant bioassay for assessing plant uptake of contaminants from freshwater soils or dredged materials". Plant Toxicity Assess., 2: 172–177. [ Links ]
Gianfreda, L. & M.A. Rao, 2004. "Potential of extracellular enzymes in remediation of polluted soils: a review". Enzyme Microb. Technol., 35: 339–354. [ Links ]
González, P.S., C.E. Capuzucca, H.A. Tigier, S.R. Milrad & E. Agostini, 2006. "Phytoremediation of phenol from wastewater, by peroxidases of tomato hairy root cultures". Enzyme Microbiol. Technol., 39: 647–653. [ Links ]
Gramms, G., K.D. Voigt & B. Kirsche, 1999. "Oxidoreductase enzymes liberated by plant roots and their effects on soil humic material". Chemosphere, 38: 1481–1494. [ Links ]
Guenther, T., U. Sack, M. Hofrichter & M. Laetz, 1998. "Oxidation of PAH and PAH–derivatives by fungal and plant oxidoreductases". J. Basic Microbiol., 38: 113–122. [ Links ]
Guerrero, Z.L.A., 2000. Evaluación del efecto de un suelo contaminado por hidrocarburos sobre el crecimiento y metabolismo de tres especies de cyperáceas. Tesis de Maestría, Escuela Nacional de Ciencias Biológicas, IPN, México, DF. [ Links ]
Guerrero, Z.L.A., 2005. Estabilización y transformación de fenantreno en el sistema radical de Cyperus hermaphroditus. Tesis de Doctorado, Escuela Nacional de Ciencias Biológicas, IPN, México, DF. [ Links ]
Guerrero, Z.L.A. & D.A. Rodríguez, 2005. "Comparación de la capacidad de remoción de fenantreno y la actividad enzimática radical superficial de cultivos radicales (In toto e In vitro) de Cyperus elegans". Polibotánica, 20: 31–45. [ Links ]
Guerrero, Z. A. & D. A. Rodríguez, 2006. "Respuesta del crecimiento de tres especies de cyperáceas en un suelo contaminado con hidrocarburos del petróleo". An. esc. Nac. cienc. biol. Méx. (en prensa). [ Links ]
Hannik, N., S. J. Rosser, C.E. French, A. Basran, J.A.H. Murray, S. Nicklin & M.C. Bruce, 2001. "Phytodetoxification of TNT by transgenic plants expressing a bacterial nitroreductase". Nat. Biotechnol., 19: 1168–1172. [ Links ]
Harms, H., M. Bokern, M. Kolb & C. Bock, 2003. Phytoremediation transformation and control of contaminants. Willey/Interscience, Hoboken, New Jersey. [ Links ]
Harvey, P.J., M. Xiang & J. M. Palmer, 2001. "Extra cellular enzymes in the rhizosphere". En: Proceedings of the Inter–Cost Workshop on Soil–Microbe–Root Interactions: maximizing phytoremediation/bioremediation. Grainau, Germany. [ Links ]
Harvey, P.J., B.F. Campanella, P.M.L. Castro, H. Harms, E. Lichtfouse, A.R. Schaeffener, S. Smrcek & D. Werck–Reichhart, 2002. "Phytoremediation of polyaromatic hydrocarbons, anilines and phenols". Environ. Sci. Pollut. Res. Int., 9: 29–47. [ Links ]
Hernández, J.A., A. Campillo, A. Jiménez, J.J.J. Alarcón & F. Sevilla, 1999. "Response of antioxidant systems and leaf water relations to NaCl stress in pea". New Phytol., 141: 241–255. [ Links ]
Hernández, J.A., A. Jiménez, P. Mullineaux & F. Sevilla, 2000. "Tolerance of pea (Pisum sativum L.) to long salt stress associated with induction of antioxidant defenses". Plant Cell Environ., 23: 853–862. [ Links ]
Herle, T., Z. Michel & P. Christophe, 2002. "Combining proteomic and genetic studies in plants". J. Chromatogr. B., 782: 137–149. [ Links ]
I.M.P. & UAM–I,1997. Biorremediación de suelos contaminados con hidrocarburos en el Pantano Santa Alejandrina, Minatitllán, Ver. Reporte Técnico, México. [ Links ]
Jiao, X.C., F.L. Xu, R. Dawson, S.H. Chen & S. Tao, 2007. "Adsorption and absorption of polycyclic aromatic hydrocarbons to rice roots". Environ. Pollut., 148: 230–235. [ Links ]
Kampfenkel, K., M.V. Montagu & D. Inze, 1995. "Extraction and determination of ascorbate and dehydroascorbate from plant tissue". Anal. Biochem., 225: 165–167. [ Links ]
Keppler, D., Y. Cui, J. Konig, I. Leier & A. Nies, 1999. "Export pumps for anionic conjugates encoded by MRP genes". Adv. Enzyme Regul., 39: 237–246. [ Links ]
Klibanov, A.M., B.V. Alberti, E.D. Morris & L.M. Felshin, 1980. "Enzymatic removal of toxic phenols and anilines from wastewaters". J. Appl. Biochem., 2: 414–421. [ Links ]
Kohlmann, B., 1994. "Algunos aspectos de la taxonomía numérica y sus usos en México". En: Llorente, J. & Luna, I. (eds.) Taxonomía Biológica, F.C.E. México, DF. [ Links ]
Korte, F., G. Kvesitadze, D. Ugrekhelidze, M. Gordeziani, G. Khatisashvili, O. Buadze & F. Coulston, 2000. "Organic toxicants in plants (Review)". Ecotoxicol. Environ, Saf., 47: 1–26. [ Links ]
Kraus. J.J., J.Z. Munir, J.P. Mc Eldoon, D.S. Clark & J.S. Dordick, 1999. "Oxidation of polycyclic aromatic hydrocarbons catalyzed by soybean peroxidase". Appl. Biochem. Biotech., 80: 221–230. [ Links ]
Kush, K.O., 1981. "Comparison of the effects of aromatic hydrocarbons on a laboratory alga and natural phytoplankton". Bot. Mar., 24: 611–613. [ Links ]
Li, H., G. Sheng, C.T. Chiou & O. Ku, 2005. "Relation of organic contaminant equilibrium sorption and kinetic uptake in plants". Environ. Sci. Technol., 39: 4864–4870. [ Links ]
Livingstone, D. & B.A. Whitton, 1984. "Water chemistry and phosphatase activity of the blue–green alga Rivularia, in upper teesdale streams". J. Ecol. 72: 405–421. [ Links ]
Lu, Y.P., Z.S. Li, Y.M. Drozdowicz, S. Hortensteiner & E.P.A. Martinoia, 1998. "AtMRP2, an Arabidopsis ATP binding cassette transporter able to transport glutathione S–conjugates and chlorophyll catabolites: functional comparisons with AtMRP1". Plant Cell., 10: 267–282. [ Links ]
Lyte, J.S. & T.F. Lyte, 2001. "Use of plants for toxicity assessment of estuarine ecosystems". Environ. Toxicol. Chem., 20: 63–68. [ Links ]
Macková, M., L. Chroma, P. Kucerová, J. Burkhard, K. Demnerová & T. Macek, 2001. "Some aspects of PCB metabolism by horseradish cell". Inter. J. Phytorem., 3: 401–414. [ Links ]
Menconi, M., C.L.M. Sgherri, C. Pinzino & F. Navari–Izzo, 1995. "Activated oxygen production and detoxification in wheat plants subjected to a water deficit programme". J. Exp. Bot., 46: 1123–1130. [ Links ]
Mittler R. E. Lam, V. Shutaev & M. Cohen, 1999. "Signals controlling the expression of cytosilic ascorbate peroxidase during pathogen–induced programmed dell death in tobacco". Plant Mol. Biol., 39: 1025–1035. [ Links ]
Nakano, Y. & K. Asada, 1981. "Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplasts". Plant Cell Physiol., 22: 867–880. [ Links ]
Narro, M.L., C.E. Cerniglia, C. Van Baalen & D.T. Gibson, 1992. "Metabolism of phenanthrene by the marine cyanobacterium Agmenellum quadruplicatum PR–6". Appl. Environ. Microbiol., 58: 1351–1359. [ Links ]
Nielsen, B.L. & L.R. Brown, 1984. "The basis for colored silver–protein complex formation in stained polyacrylamide gels". Anal. Biochem., 141: 311–315. [ Links ]
Noat, G., M. Crasiner & J. Ricard, 1980. "Ionic control of acid phosphatase activity in plant cell wall". Plant Cell Environ., 3: 225–229. [ Links ]
Olivares, S.E., 1989. Paquete de diseños experimentales FAUNL. Versión 1.4. Facultad de Agronomía UANL. Marín, N.L. México. [ Links ]
Park, S.Y., S.H. Ryu & L.C. Jang, 2004. "Molecular cloning of a cytosolic ascorbate peroxidase cDNA from cell cultures of sweet potato and its expression in response to stress". Mol. Gen. Genomics, 271: 339–346. [ Links ]
Pearse, I.S., K.D. Heath & J. M. Cheeseman, 2005. "Biochemical and ecological characterization of two peroxidase isoenzymes from the mangrove, Rhizophora mangle". Plant Cell Environ., 28: 612–622. [ Links ]
Pelkonen, O. & D.W. Nebert, 1982. "Metabolism of polycyclic hydrocarbon: etiologic role in carcinogenesis". Pharmacol. Rev., 34: 189–222. [ Links ]
Pflugmacher, S., K. Geissler & C. Steinberg, 1999. "Activity of Phase I and Phase II detoxification enzymes in different cormus parts of Phragmites australis". Ecotox. Environ. Safe., 42: 62–66. [ Links ]
Rodríguez D.A., 1998. Estudio de la variación molecular de algunos representantes de las familias: Caricaceae, Fouquieriaceae y Passifloraceae. Tesis de Maestría, Escuela Nacional de Ciencias Biológicas, IPN, México, DF. [ Links ]
Rodríguez D.A. & M.T.G. Castañeda, 1998. "Caracterización espectrofotométrica y electroforética de los componentes polipeptídicos de ficobilisomas de ocho cepas de cianobacterias". An. esc. Nac. cienc. biol. Méx., 44: 117–125. [ Links ]
Rohlf, J., 2004. NTSYS–PC Version 2.11T. Numerical Taxonomy and Multivariate Analysis System. Applied Bioestastistics, Inc. [ Links ]
Ruggaber, T.P., M. Asce, J.W. Talley & M. Asce, 2006. "Enhancing biore–mediation with enzymatic processes: a review. Pract. Periodical of Haz". Toxic and Radioactive Waste Mgmt., 10: 73–85. [ Links ]
Sairam, R.K. & D.C. Saxena, 2000. "Oxidative stress and antioxidants in wheat genotypes: possible mechanism of water stress tolerance". J. Agron. Crop Sci., 184: 55–61. [ Links ]
Sairam, R.K. & G.C. Srivastava, 2001. "Water stress tolerance of wheat (Triticum aestivum L.): variations in hydrogen peroxide accumulation and antioxidant activity in tolerant and susceptible genotypes". J. Agron. Crop Sci., 186: 63–70. [ Links ]
Sairam, R.K., G.C. Srivastava & D.C. Saxena, 2000. "Increased antioxidant activity under elevate temperature: a mechanism of heat stress tolerance in wheat genotypes". Biol. Plant., 43: 245–251. [ Links ]
Sairam, R.K., D.V. Singh & G.C. Srivastava, 2004. "Changes in activities of antioxidant enzymes in sunflower leaves of different ages". Biol. Plant., 47: 61–66. [ Links ]
Salekdeh, G.H., J. Slopongco, L.J. Wade & B. Ghareyazie, 2002. "Proteomic analysis of rice leaves during drought stress and recovery". Proteomics., 2: 1131–1145. [ Links ]
Sánchez, F.R., T.G. Davies, J.O. Coleman & P.A. Rea, 2001. "The Arabidopsis thaliana ABC protein superfamily: a complete inventory". J. Biol. Chem., 276: 31–44. [ Links ]
Sandermann, H., 1992. "Plant metabolism of xenobiotics". Trends Biochem. Sci., 17: 82–84. [ Links ]
Sauvé, D.M., D.T. Ho & M. Roberge, 1995. "Concentration of dilute protein for gel electrophoresis". Anal. Biochem., 226: 382–383. [ Links ]
Savino, J.F. & L.L. Tanabe, 1989. "Sublethal effects of phenanthrene, nicotine, and pinane on Daphnia pulex". Bull. Environ. Contam. Toxicol., 42: 778–784. [ Links ]
Scebba, F., L. Sebastián & C. Vitagliano, 1999. "Protective enzymes against activated oxygen species in wheat (Triticum aestivum L. ) seedlings. Response to cold acclimation". J. Plant Physiol., 155: 762–768. [ Links ]
Schnoor, J.L., L.A. Licht, S.C. McCutcheon, N.L. Wolfe & L.H. Carreira, 1995. "Phytoremediation of organic and nutrient contaminants". Environ. Sci. and Tech., 29: 319–323. [ Links ]
Schwab, A.P., A.A. Al–Assi & M. K. Banks, 1998. "Adsorption of naphtalene onto plant roots". J. Environ. Qual., 27: 220–224. [ Links ]
Shand, C.A., A.E.S. Macklon, A.C. Edwards & S. Smith, 1994. "Inorganic and organic P in soil solutions from three upland soils. I. Effect of soil solution extraction conditions, soil type and season". Plant Soil., 159: 255–264. [ Links ]
Sheng, X.F. & J.X. Gong, 2006. "Increased degradation of phenanthrene in soil by Pseudomonas sp. GF3 in the presence of wheat". Soil Biol. Biochem., 38: 2587–2592. [ Links ]
Sneath P. H. A. & R. R. Sokal, 1973. Numerical Taxonomy: the principles and practice of numerical classification. Freeman, San Francisco. [ Links ]
Song, X.Sh., W.H. Hu, W.H. Mao, J.O. Ogweno, Y.H. Zhou & J.Q. Yu, 2005. "Response of ascorbate peroxidase isoenzymes and ascorbate regeneration system to abiotic stresses in Cucumis sativus L." Plant Physiol. and Bioch., 43: 1082–1088. [ Links ]
Song, W.Y., E.J. Sohn, E. Martinoia, Y.I. Lee, Y.Y. Yang, M. Jasinski, C. Forestier, I. Hwang & Y. Lee, 2003. "Engineering tolerance and accumulation of lead and cadmium in transgenic plants". Nat. Biotechnol., 21: 914–919. [ Links ]
Su, Y.H. & Y.G., Zhu, 2007. "Transport mechanisms for the uptake of organic compounds by rice (Oryza sativa) roots". Environ. Pollut., 148: 94–100. [ Links ]
Tikhaya, N.I., T.N. Stekhanova & M.D. Fedorovskaya, 1999. "Variability of acid phosphatases specific for apoplasts of barley root cells?". Fiziologiya rastenii., 46: 726–735. [ Links ]
Tikhaya, N.I. & M.D. Fedorovskaya, 2000. "Biochemical adaptation of barley root cells to toxic substances. II. Effect of heavy metals on phosphohydrolase activity". Biology Bulletin., 27: 579–584. [ Links ]
Tommasini, R.E. Vogt, M. Fromenteau, S. Hortensteiner, P. Matile & N, Amrhein, 1998. "An ABC–transporter of Arabidopsis thaliana has both glutathione–conjugate and chlorophyll catabolites transport activity". Plant J., 137: 73–80. [ Links ]
Triana–Córdova, S. del C., 1994. Efecto de la ceniza en suelo sobre la actividad de fosfatasa ácida en raíces de Acacia cochliacantha, Brachiaria brizantha, Mimosa pigra y Senna uniflora B. Sc. Tesis de Licenciatura, Escuela Nacional de Ciencias Biológicas, IPN, México, DF. [ Links ]
Turner, B.L. & P.M. Haygarth, 2000. "Phosphorous forms and concentrations in leachate under four grassland soil types". Soil Sci. Soc. Am. J., 64: 1090–1097. [ Links ]
Turner, B.L., R. Baxter, N.T. Ellwood & B.A. Whitton, 2001. "Characterization of the phosphate activities of mosses in relation to their environment". Plant Cell Environ., 24: 1165–1176. [ Links ]
Upadhyaya, A., T.D. Davis, M.H. Larsen, R.H. Waker & N. Sankhla, 1990. "Uniconazole–induced thermotolerance in soybean seedling root tissues". Physiol. Plant., 79: 78–84. [ Links ]
U.S. Environmental Protection agency (USEPA), 2000. "Introduction to phy to remediation". Publication No. 600/R–99/107. Cincinnati. [ Links ]
Vanier, C., D. Planas & M. Silvestre, 2001. "Equilibrium partition theory applied to PCBs in macrophytes". Environ. Sci. Technol., 35: 4830–4833. [ Links ]
Wang, M.I. & K.C. Jones, 1994. "Uptake of chlorobenzenes by carrots from spiked and sewage sludge amended soil". Environ. Sci. Technol., 28: 1260–1267. [ Links ]
Wang, D.F. & S.L. Dawn, 2003. "Heat sensitivity in a bentgrass variant: failure to accumulate a chloroplast heat shock protein isoform implicated in heat tolerance". Plant Physiol., 133: 319–327. [ Links ]
Wang, G.D., Q.J. Li , B. Luo & X.Y. Chen, 2004. "Ex planta phytoremediation of trichlorophenol and phenolic allelo–chemicals via an engineered secretory laccase". Nature Biotechnol., 22: 893–897. [ Links ]
Wevar–Oller, A.L., E. Agostini, M.A. Talano, C. Capozucca, S.R. Milrad, H.A. Tigier & M.I. Medina, 2005. "Overexpression of a basic preoxidase in transgenic tomato (Lycopersicon esculentum Mill. C.v. Pera) hairy root increases phytoremediation of phenol". Plant Sci., 169: 1102–1111. [ Links ]
Yabuta, Y., T. Motoki & K. Yoshimura, 2002. "Thylacoid membrane–bound ascorbate preoxidase is a limiting factor of antioxidative systems under photooxidative stress". Plant J., 32: 915–925. [ Links ]
Yoshimura, Y., Y. Yabuta, T. Ishikawa & S. Shigeoka, 2000. "Expression of spinach ascorbate peroxidase isoenzymes in response to oxidative stresses". Plant Physiol., 123: 223–233. [ Links ]
Yun, H.K., S.H. Yu & D. Choi, 1999. "Cloning of a pathogenesis–related protein–1gene from Nicotiana glutinosa L. and its salicylic acid–independent induction by copper and p–aminobutyric acid". J. Plant Physiol., 154: 327–33. [ Links ]
Zhang, J. & M.B. Kirkham, 1996. "Antioxidant responses to drought in sunflower and sorghum seedlings". New Phytol., 132: 361–373. [ Links ]
* Becaria de la Comisión de Operaciones y Fomento de Actividades Académicas (COFAA–IPN).














