Servicios Personalizados
Revista
Articulo
Indicadores
 Citado por SciELO
Citado por SciELO Accesos
Accesos
Links relacionados
 Similares en SciELO
Similares en SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.2 no.5 Texcoco sep./oct. 2011
Artículos
Variación en la tolerancia a desinfectantes de genotipos élite de Coffea spp. cultivados in vitro*
Variation in tolerance to disinfectants of elite genotypes of Coffea spp. cultivated in vitro
Pablo López-Gómez1§, Leobardo Iracheta-Donjuan1, Marbella Castellanos-Juárez1, Ismael Méndez-López1, Juan Francisco Aguirre-Medina1, Adriana Gutiérrez-Díez2, Ma. del Carmen Ojeda-Zacarías2 y Bernardito Ribai Pérez-Pérez1
1 Campo Experimental Rosario Izapa. INIFAP. Carretera Tapachula-Cacahoatan, km 18. Tuxtla Chico, Chiapas. C. P. 30870. Tel. 01 919 6738137. (iracheta.leobardo@inifap.gob.mx), (castellanos.marbella@inifap.gob.mx), (mendez.ismael@inifap.gob.mx), (aguirre.medina@inifao.gob.mx), (perez.bernardito@gmail.com). §Autor para correspondencia: lopez.pablo@inifap.gob.mx.
2 Facultad de Agronomía. Universidad Autónoma de Nuevo León. Carretera Zuazua-Marín, km 17.5. Marín, N. L. C. P. 66700. Tel. 01 811 3404399. (adirna.gutierrezdz@uanl.edu.mx), (maria.ojedazc@uanl.edu.mx).
* Recibido: marzo de 2011
Aceptado: octubre de 2011
Resumen
La embriogénesis somática puede ser afectada por la oxidación de los explantes al aplicar un método común de desinfección. En el Campo Experimental Rosario Izapa en 2006, se determinó la tolerancia a desinfectantes de explantes foliares de genotipos de café, mediante la dosis letal media (DL50) y con base en la tolerancia, se definió el desinfectante óptimo para el establecimiento aséptico. La DL50 de hipoclorito de sodio (NaClO), de hipoclorito de calcio (Ca[ClO]2) y la combinación de ambos, en explantes foliares de genotipos de Coffea canephora P. (INIFAP 95-8, 95-9, 97-10, 97-12, 97-15, 97-18, 97-19, 97-20, 00-24 y 00-28) y genotipos de C. arabica L. (INIFAP 2000-1018, 2000-1128 y 2000-692), se determinó mediante la aplicación de ocho concentraciones de NaClO (0.1, 0.5, 1, 1.5, 2, 2.5, 3, 3.5%), ocho concentraciones de Ca(ClO)2 (3, 4, 5, 6, 7, 8, 9 y 10%) y la combinación. Con base en la tolerancia se aplicaron tratamientos de desinfección: 1, 3 y 6% de NaClO, 3.5, 7 y 10.5% de Ca(ClO)2 y la combinación testigo de 3 y 7% de NaClO y Ca(ClO)2, respectivamente. Existió variabilidad en la tolerancia, puesto que la DL50 varió dependiendo del genotipo y el agente desinfectante. La mayoría de los genotipos fueron menos tolerantes al NaClO (DL50 de 2 a 4%); no obstante, el NaClO controló la contaminación y oxidación en dosis bajas (1 y 3%). El NaClO y el Ca(ClO)2 en bajas concentraciones de hasta 2 y 3.5% respectivamente, son una opción para la desinfección de explantes de café que pueden garantizar un estado fisiológico adecuado para dar inicio a la embriogénesis.
Palabras clave: Coffea arabica L., Coffea canephora P., embriogénesis.
Abstract
The somatic embryogenesis can be affected by explants' oxidation when a common method of disinfection is. In the Experimental Field Rosario Izapa in 2006, the tolerance to disinfectants of leaf explants of coffee genotypes was determined by the median lethal dose (LD50) and based on its tolerance the optimal disinfectant for aseptic establishment was defined. The LD50 of sodium hypochlorite (NaClO), calcium hypochlorite (Ca[ClO]2) and the combination of both in leaf explants of Coffea canephora P. genotypes (INIFAP 95-8, 95-9, 97-10, 97-12, 97-15, 97-18, 97-19, 97-20, 00-24 and 00-28) and genotypes of C. arabica L. (INIFAP 2000-1018, 2000-1128 and 2000-692), was determined by applying eight concentrations of NaClO (0.1, 0.5, 1, 1.5, 2, 2.5, 3, 3.5%), eight concentrations of Ca(ClO )2 (3, 4, 5, 6, 7, 8, 9 and 10%) and the combination. Based on the tolerance, disinfection treatments were applied: 1, 3 and 6% of NaClO, 3.5, 7 and 10.5% of Ca (ClO)2 and control's combination of 3 and 7% NaClO and Ca(ClO)2, respectively. There was variability in the tolerance, since LD50 varied depending on genotype and disinfecting agent. Most genotypes were less tolerant to NaClO (LD50 from 2 to 4%); however, NaClO controlled pollution and oxidation at low doses (1 and 3%). NaCl and Ca(ClO)2 at low concentrations up to 2 and 3.5% respectively, these are an option for coffee explants disinfection that can ensure proper physiological state to initiate the embryogenesis.
Key words: Coffea arabica L., Coffea canephora P., embryogenesis.
INTRODUCCIÓN
El café (Coffea spp.) genera empleos para más de tres millones de mexicanos durante el cultivo, la cosecha, el beneficio y la comercialización (Escamilla et al., 2005). Sin embargo, las plantaciones establecidas son de edad avanzada, poco rendidoras, susceptibles a plagas y enfermedades y la renovación de las mismas, con los recursos genéticos mejorados mediante los métodos tradicionales de siembra por semilla, requieren de mucho tiempo para incorporar los nuevos recursos a los campos de los productores. Una alternativa para disponer de mayor número de plantas con características agronómicas deseables, a bajo costo, libres de plagas y enfermedades y en menor tiempo y costo, son las técnicas de cultivos de tejidos (Echeverría, 2000).
Las dos especies de cafeto más cultivadas, Coffea arabica L. y C. canephora P., poseen diferentes esquemas de propagación y mejoramiento genético. El C. arabica L. es autógama y da lugar a variedades comerciales propagadas por semilla, mientras que C. canephora P., es alógama y su propagación por la vía sexual genera individuos diferentes a los progenitores (Etienne et al., 1999). En ambos casos, la embriogénesis somática es un método fiable de multiplicación vegetativa. Sin embargo, los antecedentes registrados por Staritsky (1970), a partir de entrenudos de C. canephora P., o bien, los estudios de Afreen et al. (2002), en Coffea spp., consignan la respuesta diferencial de los genotipos para tolerar los desinfectantes durante el establecimiento aséptico, debido a problemas de oxidación que limitan la respuesta morfogénica.
En la fase inicial del proceso, es fundamental definir el agente desinfectante y su concentración para cada genotipo, mediante el cual se logren generar explantes sanos para inducir la embriogénesis; puesto que el éxito de la embriogénesis somática y el tipo de callo que se va a generar, dependerá del estado fisiológico del explante y de la interacción con los agentes desinfectantes, los cuales podrían generar cambios epigenéticos que afectan la inducción de la morfogénesis (Scott, 1995).
Con estos antecedentes se desarrolló la presente investigación, con el objetivo de indagar la respuesta de los explantes foliares de 13 genotipos élite de café a dos desinfectantes, mediante la determinación de la DL50 y con base en la tolerancia definir para cada genotipo, el agente desinfectante y la concentración óptima del mismo.
MATERIALES Y MÉTODOS
La presente investigación se realizó durante 2006 en el Laboratorio de Biotecnología de Cultivos Tropicales del Campo Experimental Rosario Izapa, del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), en Tuxtla Chico, Chiapas, México.
Material biológico
Se usaron hojas jóvenes de cinco meses de edad de diez genotipos élite de C. canephora P., variedad Robusta (INIFAP 95-8, 95-9, 97-10, 97-12, 97-15, 97-18, 97-19, 97-20, 00-24 e INIFAP 00-28), y tres líneas avanzadas F7 de C. arabica L. (INIFAP 2000-692, 2000-1018 e INIFAP 2000-1128). Los genotipos de C. arabica L., se caracterizan por tener alto rendimiento y resistencia a la roya del café (Hemileia vastatrix Berk & Br.), mientras que los genotipos de C. canephora P. presentan alto rendimiento y calidad industrial. Todos ellos provenientes del programa de mejoramiento genético del INIFAP en Rosario Izapa, Chiapas, México.
Medio de cultivo y condiciones de incubación
El medio de cultivo usado en los experimentos consistió en las sales inorgánicas de Yasuda et al. (1985), con vitaminas de Gamborg (2002), 30 g L-1 de sacarosa; 1.125 mg L-1 de Bencilaminopurina (BAP), 5 g L-1 de phytagel Sigma®, y pH ajustado a 5.8 con KOH o HCl 1 N. El medio de cultivo se esterilizó en autoclave a 121 oC y 1.1 kg cm-2 de presión durante 20 min.
Las cajas Petri con los materiales sembrados y herméticamente sellados con parafilm, se incubaron en condiciones de oscuridad total a 26 oC ±1 y 50% de humedad relativa.
Predesinfección de hojas
Las plantas madres fueron asperjadas con solución fungicida [1 g L-1 de Amistar® (Azoxystrobin al 50%)], tres días antes del establecimiento in vitro. Las hojas recolectadas del campo se lavaron con detergente comercial y se enjuagaron con agua corriente. Posteriormente se colocaron en solución antioxidante-fungicida esterilizada (30 g L-1 de sacarosa, 100 mg L-1 de ácido ascórbico, 150 mg L-1 de ácido cítrico y 1 g L-1 de Amistar®). Las hojas en estas condiciones fueron sometidas a vacío parcial, mediante una bomba de vacío (Welch Duo Seal® 1 400) por 3 min, con el fin de evitar que las burbujas de aire atrapadas en los estomas y los tricomas de los tejidos impidan el contacto con la solución. Las hojas permanecieron en la solución antioxidante-fungicida por 10 min y posteriormente fueron desinfectadas de acuerdo a cada experimento.
Determinación de la DL50
Se llevó a cabo la determinación de la DL50 de desinfectantes en los explantes de hojas jóvenes de los 13 genotipos, mediante la aplicación de ocho concentraciones de hipoclorito de sodio (0.1, 0.5, 1, 1.5, 2, 2.5, 3 y 3.5%), ocho de hipoclorito de calcio (3, 4, 5, 6, 7, 8, 9 y 10%) y la combinación de ambas concentraciones (0.1-3, 0.5-4, 1-5, 1.5-6, 2-7, 2.5-8, 3-9, 3.5-10%); en estas últimas se incluyó la combinación testigo de 2 y 7% de hipoclorito de sodio y de calcio, respectivamente.
Las hojas se introdujeron en las soluciones durante 15 min y después de este tiempo se enjuagaron tres veces con agua destilada esterilizada. De las hojas desinfectadas, se extrajeron explantes de 1 cm2 a partir de la lámina central sin tomar la nervadura central y se colocaron en condiciones asépticas, en cajas de Petri de 100*12 mm con 20 ml del medio de cultivo.
Se evaluó el porcentaje de oxidación para cada genotipo al sexto día del establecimiento in vitro, para determinar el daño causado por el desinfectante. Para verificar el grado de tolerancia de cada uno de los genotipos, se determinó la DL50 con base al dato de oxidación y de acuerdo al siguiente criterio: 0% para explantes completamente verdes; 25% para una cuarta parte del explante oxidado, 50% a la mitad del explante oxidado; 75% para las tres cuartas partes oxidadas y 100% a todo el explante oxidado. Se tuvieron diez repeticiones por tratamiento y los datos se analizaron estadísticamente, por cada genotipo y tipo de desinfectante, con regresiones lineales o de tipo polinomial de segundo y tercer orden, con el apoyo del programa SAS versión 6.12 (SAS Institute, 1997).
Determinación de la concentración óptima de desinfectantes
Se establecieron explantes provenientes de hojas jóvenes de cada genotipo y de acuerdo a su tolerancia observada en el experimento anterior, se evaluaron tres concentraciones de hipoclorito de sodio (1, 3 y 6%), tres de hipoclorito de calcio (3.5, 7 y 10.5%) y la combinación de 3% de NaClO y 7% de Ca(ClO)2. Las hojas se mantuvieron durante 15 min en las diferentes concentraciones y agentes desinfectantes, posteriormente fueron lavadas tres veces con agua destilada esterilizada; en el caso de la combinación de desinfectantes, las hojas primeramente fueron sometidas a la solución de NaClO por 15 min y posteriormente en la solución de Ca(ClO)2 por otros 15 min y al final se lavaron tres veces con agua destilada esterilizada.
De las hojas desinfectadas se extrajeron explantes de 1 cm2, a partir de la lámina central sin tomar la nervadura central y se colocaron en cajas petri de 100*12 mm con 20 ml con el medio de cultivo esterilizado.
Las variables de respuesta fueron el porcentaje de oxidación de acuerdo al grado de tejido dañado y con el mismo criterio del experimento anterior; así como el porcentaje de contaminación de acuerdo a presencia o ausencia de contaminación por hongos, bacterias o por ambos microorganismos. Ambas variables se evaluaron cinco días después del establecimiento in vitro y se contó con seis repeticiones por cada tratamiento.
Los datos colectados se transformaron con la raíz cuadrada de X+1 y se analizaron con un diseño completamente al azar de acuerdo a la variable analizada. El análisis de varianza igual que en el caso anterior se hizo con la ayuda del paquete estadístico SAS versión 6.12 (SAS Institute, 1997) y para la comparación de medias se utilizó la prueba de LSD con un nivel de 5% de significancia estadística.
RESULTADOS Y DISCUSIÓN
Tolerancia de explantes (DL50)
Con los resultados obtenidos para la determinación de la DL50 de NaClO, fue posible identificar tres grupos de genotipos por su grado de tolerancia a este desinfectante, un grupo sensible constituido por los genotipos INIFAP 97-15, 97-18, 97-19 y 2000-1018, cuyas DL50 no alcanzaron 2% de NaClO. El segundo grupo fue moderadamente sensible, donde los genotipos INIFAP 95-8, 97-12, 00-24, 2000-1128 y 00-28, no alcanzaron la DL50 de 4% de NaClO. Por otro lado, los genotipos INIFAP 95-9, 97-10, 97-20 y 2000-692 constituyeron el tercer grupo que fue el tolerante con DL50 entre 4.0 y 9.6% de NaClO (Cuadro 1).
La mayoría de los genotipos al ser sometidos al NaClO presentaron DL50 más bajas con respecto al Ca(ClO)2, a excepción del genotipo INIFAP 97-20 que presentó mayor tolerancia (con DL50 de 9.6% de NaClO). Vargas y García (1997), mencionan que el NaClO puede llegar a ser fitotóxico en altas concentraciones e incluso recomiendan el uso de este desinfectante en cultivos de tejidos vegetales a concentraciones de 0.01 a 3%, lo cual indica una variabilidad de respuesta dependiendo del tejido.
La mayor susceptibilidad de los explantes al hipoclorito de sodio está asociada al catión Na+; el cual corresponde a un ion no esencial en la mayor parte de los tejidos vegetales y que es altamente tóxico en una gran variedad de plantas (Hasegawa et al., 2000; Mäser et al., 2001; Yokoi et al., 2002).
La mayor tolerancia al NaClO por parte del genotipo INIFAP 97-20, podría estar asociada a la capacidad de este genotipo para ajustarse osmóticamente a concentraciones elevadas de dicho desinfectante.
En el caso de los explantes de hoja sometidos a desinfección con Ca(ClO)2, se observó que los genotipos formaron dos grupos, los genotipos INIFAP 97-15, 97-18 y 00-28 fueron más sensibles, ya que no alcanzaron la DL50 de 5%; mientras que el resto de los genotipos presentaron mayor tolerancia con una DL50 de 9 a 12% e incluso mayores en el genotipo INIFAP 97-10 (Cuadro 1).
A pesar de que el hipoclorito de calcio fue menos agresivo con los tejidos foliares no siempre fue el mejor para controlar la contaminación. El menor daño a los tejidos se atribuyó a que este desinfectante es menos ftotóxico (Vargas y García, 1997); además que el calcio (Ca2+) es esencial en muchos procesos del metabolismo vegetal, ya sea como elemento estructural de la lámina media de la pared celular, constituyente o activador enzimático vía calmodulina o como segundo mensajero asociado con fitohormonas (Bressan et al., 1998; Murata et al., 2000). Esto explica valores altos en la DL50 de hipoclorito de calcio para todos los genotipos, comparado con el hipoclorito de sodio.
Adicionalmente el hipoclorito de calcio podría estar aportando calcio soluble a los tejidos y ayudar a neutralizar los ácidos orgánicos y la producción de fenoles o polifenoles en los tejidos, ya que estas sustancias contribuyen a la oxidación de los explantes al ser sometidos a los métodos de desinfección (Sánchez-Cuevas y Salaverría, 2004). Sin embargo, aún es necesario evaluar la efectividad en la contaminación de los tejidos a largo plazo.
Cuando se aplicó la combinación NaClO y Ca(ClO)2, la mayoría de los genotipos mostraron una DL50 más baja que al aplicar los desinfectantes de forma individual, lo que demostró una menor tolerancia a dicha combinación. Sin embargo, al calcular la DL50 de cada uno de los agentes desinfectantes en cada combinación, fue posible identificar dos grupos en cada uno de estos (Cuadro 1); de tal forma que en dicha combinación de desinfectantes, para NaClO el primer grupo, conformado por los genotipos INIFAP 00-24, 00-28, 97-15, 2000-692, 2000-1128 y 2000-1018, presentaron DL50 por abajo de 2% de NaClO; por su parte el segundo grupo comprendió a los genotipos INIFAP 95-8, 95-9, 97-10, 97-20, 97-18, 97-19 y 97-12 con DL50 de 2 a 4% de NaClO.
En el caso del Ca(ClO)2, de igual forma se identificaron dos grupos de acuerdo al nivel de tolerancia a los agentes desinfectantes. En el primer grupo los genotipos INIFAP 00-28, 97-15, 2000-692, 2000-1128 y 2000-1018 presentaron DL50 inferiores a 6% de Ca(ClO)2, mientras que en el segundo grupo los genotipos INIFAP 00-24, 95-8, 95-9, 97-10, 97-12, 97-18, 97-19 y 97-20 mostraron DL50 de 6 a 11.5% de Ca(ClO)2.
En general, los genotipos presentaron variabilidad de respuesta para la DL50 de desinfectante. Los genotipos INIFAP 97-15 y 97-18 fueron los más susceptibles al NaClO y Ca(ClO)2. Por otra parte, los genotipos INIFAP 95-9, 97-10, 97-20 y 2000-692 fueron los que presentaron una mayor tolerancia al NaClO; sin embargo la mayoría de los genotipos fueron menos afectados por el Ca(ClO)2.
Los resultados anteriores señalan la necesidad de aplicar un método de desinfección específico, para cada genotipo durante el establecimiento aséptico.
Concentración óptima para la desinfección
Los explantes foliares presentaron diferencias significativas en el porcentaje de contaminación en la mayoría de los genotipos, excepto en INIFAP 97-19, 95-9 y 2000-1018, lo cual fue debido a los diferentes agentes desinfectantes y a las dosis probadas en cada uno de ellos (Cuadros 2 y 3).
Los genotipos INIFAP 97-19 y 95-9 fueron los que presentaron porcentajes de contaminación más altos (66 a 100%), sin importar el tipo y concentración del agente desinfectante, esta contaminación se observó en los bordes del tejido, lo cual indica la presencia de contaminación endógena. Por el contrario, los genotipos con la gama de valores más baja para el porcentaje de contaminación (0 a 50%), fueron INIFAP 2000-1018 y 00-24; en el resto de los genotipos los porcentajes de contaminación fueron de 0 a 100% dependiendo del genotipo (Cuadro 2 y 3).
La aplicación de los diferentes tratamientos de desinfección en los explantes propiciaron altos porcentajes de asepsia en doce de los genotipos establecidos, aunque estos no siempre fueron buenos para evitar la oxidación de los explantes (Cuadros 2 y 3); por tanto, la elección del mejor método de desinfección se llevó a cabo considerando la concentración que presentó bajos niveles de oxidación y contaminación (Cuadro 4); fue preferible incluso sacrificar el porcentaje de contaminación a favor de aquellos tratamientos con el menor índice de oxidación; ya que la respuesta morfogénica de los explantes depende en mayor medida del grado de oxidación del explante; es decir, de nada serviría tener explantes asépticos cuando el tejido está oxidado y sin capacidad de respuesta. Al respecto Abdelnour y Escalant (1994), mencionan que la concentración óptima del desinfectante es aquella con la que se logra la desinfección del explante, causándole el menor daño posible.
El tratamiento de desinfección testigo (3% de NaClO + 7% de Ca(ClO)2), no figuró dentro de los tratamientos con los menores porcentajes de contaminación, y sobre todo de oxidación, en ninguno de los genotipos evaluados. Ello debido a la acción sinérgica de los agentes desinfectantes sobre la oxidación de los explantes.
Se logró identificar cuatro grupos de tratamientos de desinfección que resultaron ser más apropiados para el establecimiento aséptico de los explantes y control de la oxidación. De esta manera, el 1 y 3% de NaClO fueron los mejores tratamientos para 10 de 13 genotipos evaluados; mientras que 3.5 y 7% Ca(ClO)2 sólo fueron para tres genotipos (Cuadro 5).
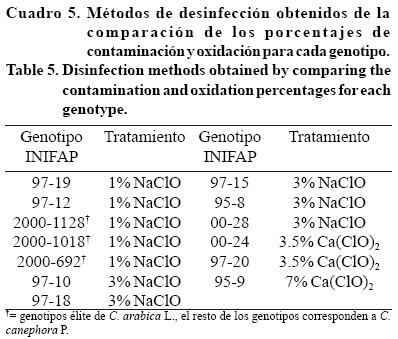
Los procedimientos de desinfección con hipoclorito de sodio han sido descritos por varios autores y concuerdan de manera significativa con los resultados obtenidos en algunos genotipos aquí probados, así la desinfección de explantes foliares provenientes de café aplicando una solución al 3% de hipoclorito de sodio durante 15 min y en otros genotipos del genero Coffea spp., ha dado buenos resultados en estudios sobre embriogénesis somática (González et al., 2001; Cevallos et al., 2002).
Al respecto, De Rezende et al. (2003), han sugerido la aplicación de alcohol al 70% por 1 min, e hipoclorito de sodio al 1% por 15 min en C. arabica L. cv. Obata. Ayub y Nisi (2003), aplicaron un método de desinfección en explantes de hojas jóvenes de C. arabica cultivar IAPAR 59, híbrido de Sarchimor, que consistió en la inmersión de las hojas en alcohol al 70% por 40 s seguida de una inmersión en solución de NaClO al 2% y Tween 80 al 1% por 15 min. Por su parte, Fernandez-Da Silva et al. (2005), sugieren la aplicación de NaClO al 1.575% por 30 min para C. arabica cv. Catimor.
Las concentraciones de los desinfectantes antes citados resultaron ser parecidas a la obtenida en este trabajo de investigación, en cuanto a las concentraciones de hipoclorito de sodio; no obstante, resalta la variabilidad de respuesta entre cultivares. Por otro lado, en el caso del Ca(ClO)2, no se han reportado métodos de desinfección parecidos en alguna especie; sin embargo, las concentraciones encontradas son congruentes con las sugeridas por Vargas y García (1997), para este agente desinfectante en la asepsia de distintas especies de tejidos vegetales (6 a 12% de hipoclorito de calcio).
Como se puede apreciar en el Cuadro 5, la dosis óptima que se eligió para diez de los genotipos (INIFAP 97-19, 97-12, 2000-1128, 2000-1018, 2000-692, 97-10, 95-8, 00-24, 97-20, 95-9), estuvo por debajo del valor de la DL50 de NaClO o Ca(ClO)2 reportada en este trabajo (Cuadro 1). Sin embargo, en el caso de los genotipos INIFAP 00-28, 97-15 y 97-18, las dosis que tuvieron mejor control de la contaminación y la oxidación estuvieron por encima del valor de la DL50, esto se puede atribuir por una parte que la evaluación en este experimento se llevó a cabo al quinto día del establecimiento, mientras que en el experimento de DL50 la evaluación se llevó a cabo al sexto día, pudiéndose manifestar cambios en la oxidación de un día para otro en estos genotipos.
Otra causa de la menor sensibilidad a los agentes desinfectantes de estos tres genotipos en el experimento de establecimiento aséptico, podría estar asociada al estatus hídrico de las hojas al momento de la colecta en campo, lo anterior debido que durante la colecta de las hojas para el experimento de DL50 los niveles de precipitación en campo fueron nulos, en cambio cuando se efectuó el experimento de establecimiento aséptico la precipitación mensual fue de 50 mm (Com. Pers. Alonso, M. Registro Climatológico del Campo Experimental Rosario Izapa, 2005-2006).
Por tanto, un menor contenido de agua en los tejidos foliares pudieron haber propiciado DL50 bajas en estos tres genotipos. En este sentido el déficit hídrico en los suelos afectó el crecimiento del cultivo, lo cual creó un desequilibrio, que interfiere generalmente con la nutrición mineral y el metabolismo celular (Leidi y Pardo, 2002).
Al respecto, Gálvez-López (2007) en comunicación personal indica que, en estudios de relaciones hídricas con las mismas dosis y tipos de agentes desinfectantes utilizadas en este trabajo, los explantes foliares del genotipo INIFAP 97-15 carecieron de la capacidad de ajuste osmótico, mientras que en el genotipo INIFAP 97-18 el ajuste osmótico fue bajo, lo cual podría indicar el efecto adverso que puede provocar la disponibilidad de agua en la calidad del explante y capacidad para resistir a los agentes desinfectantes. De igual forma señala que el genotipo INIFAP 97-10 carece de ajuste osmótico, pero que es uno de los más tolerantes a la oxidación. Lo anterior implica que este último genotipo presenta un mecanismo de tolerancia a los desinfectantes diferente al resto de los genotipos.
CONCLUSIONES
Existe variabilidad en la tolerancia a los desinfectantes, puesto que la DL50 varió dependiendo del genotipo y el agente desinfectante evaluado. No obstante, la mayor parte de los genotipos fueron menos tolerantes a concentraciones elevadas de hipoclorito de sodio (DL50≤ 4.1%), las concentraciones bajas de este desinfectante (1 a 3%) resultaron ser más efectivas para controlar la contaminación y mantener índices de oxidación aceptables.
Por otro lado, la tolerancia de los explantes varió dependiendo de la época de colecta y del estado hídrico de la planta madre. El empleo del hipoclorito de sodio se puede aplicar en bajas concentraciones hasta 1% para controlar la oxidación y contaminación en diez genotipos de café, mientras que el hipoclorito de calcio resultó efectivo en sólo tres de los genotipos evaluados.
AGRADECIMIENTOS
Los autores agradecen a los Fondos Sectoriales SAGARPA-CONACYT-COFUPRO-2004-C01-116 y a la empresa S. A. de C. V., por el financiamiento otorgado para este trabajo de investigación.
LITERATURA CITADA
Abdelnour, A. y Escalant, J. V. 1994. Conceptos básicos de cultivo de tejidos vegetales. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Turrialba, Costa Rica. 38 p. [ Links ]
Afreen, F.; Zobayed, S. M. A. and Kozai, T. 2002. Photoautotrophic culture of Coffea arabusta somatic embryos: photosynthetic ability and growth of different stage embryos. Ann. Bot. 90:11-19. [ Links ]
Ayub, R. A. y Nisio, G. A. 2003. Embriogenese somatica em genótipos de café (Coffea arabica) é citocinina dependente. UEPG Ci Exatas Terra, Ponta Grossa. 9:25-30. [ Links ]
Bressan, R. A.; Hasegawa, P. M. and Pardo, J. M. 1998. Plants use calcium to resolve salt stress. Trends in Plant Sci. 3:411-412. [ Links ]
Cevallos, M.; Sánchez, I. S. y Montes, S. 2002. Caracterización histológica de la embriogénesis en Coffea canephora P. var. Robusta. Revista Protección Vegetal. 17:14-19. [ Links ]
De Rezende, M. A. L.; Pasqual, M.; Pereira, A. R.; Costa, D. J.; Bortolotti, D. A. and Ferreira, D. L. 2003. Embriogënese somatica indireta em explantes foliares de Coffea arabica L. cv. Obata. Ciënce Agrotec Lavras. 27:107-116. [ Links ]
Echeverría, R. G. 2000. Opciones para reducir la pobreza rural en América Latina y el Caribe. Revista de la CEPAL. 70:147-160. [ Links ]
Escamilla, P. E.; Ruiz, R. O.; Díaz, P. G.; Landeros, S. C.; Platas, R. D. E.; Zamarripa, C. A. y González H. V. A. 2005. El agroecosistema café orgánico en México. Manejo Integrado de Plagas y Agroecología. 76:5-16. [ Links ]
Etienne, H.; Barry-Etienne, D.; Vasquéz, N. y Berthouly, M. 1999. Aportes de la biotecnología al mejoramiento genético del café. In: desafíos de la caficultura en Centroamérica. Bertrand, B. y Rapidel, B. (eds.). IICA. San José, Costa Rica. 457-495 pp. [ Links ]
Fernandez-Da Silva, R.; Hermoso-Gallardo, L. and Menéndez-Yuffá, A. 2005. Primary and secondary somatic embryogenesis in leaf sections and cell suspensions of Coffea arabica cv. Catimor. Interciencia. 30:694-698. [ Links ]
Gamborg, O. L. 2002. Plant tissue culture. The technology. Part 1. Exegetics Ltd. Edington. 547 p. [ Links ]
González, M. E.; Santana, N. y López, C. 2001. Efecto de la composición del medio de cultivo y el genotipo de la inducción de la embriogésis somática en clones de Coffea canephora P. Var Robusta. Cultivos Tropicales. 22:17-21. [ Links ]
Hasegawa, P. M.; Bressan, R.; Zhu, J. K. y Kohnert, J. 2000. Plant cellular and molecular responses to high salinity. Annual Review of Plant Physiology and Plant Mol. Biol. 51:463-499. [ Links ]
Leidi, E. O. y Pardo, J. M. 2002. Tolerancia de los cultivos al estrés salino: qué hay de nuevo. Universidad Nacional de Rosario. Revista de Investigaciones de la Facultad de Ciencias Agrarias. 2:319-325. [ Links ]
Mäser, P.; Thomine, S.; Schroeder, I. J.; Ward, J. M.; Hirsch, K.; Sze, H.; Talke, I. N.; Amtmann, A.; Maathuis, F. J.; Sanders, D.; Harper, J. F.; Tchieu, J.; Gribskov, M.; Persans, M. W.; Salt, D. E.; Kim, S. A. and Guerinot, M. L. 2001. Phylogenetic relationships within cation transporter families of Arabidopsis. Plant Physiol. 126:1646-67. [ Links ]
Murata, Y. ; Katsura, S.; Obi, I. and Kakutani, T. 2000. Alterations in Ca2+ binding on plasma membrane after adaptation to salt stress of tobacco cells in suspension. Plant Cell Physiol. 41:1286-1292. [ Links ]
Sánchez-Cuevas, M. C. y Salaverría, J. L. 2004. Control de la oxidación y la contaminación en el cultivo in vitro de fresa (Fragaria*ananassa Duch.). UDO Agrícola. 4:21-26. [ Links ]
Scott, A. M. 1995. Strategies for dealing with limitations of somatic embryogenesis in hardwood trees. Plant Tissue Culture and Biotechnology. 1:112-121. [ Links ]
Statistical Analysis System (SAS Institute). 1997. Cary, NC, USA. 917 p. [ Links ]
Staritsky, G. 1970. Embryo formation in callus tissues of coffee. Acta Botánica Neerlandica. 19:509-514. [ Links ]
Vargas, T. y García, E. 1997. Propagación in vitro de "Cala Blanca" Spathiphyllum sp. Agronomía Tropical. 47:171-183.
Yasuda, T.; Fuji, Y. and Yamaguchi, T. 1985. Embryogenic callus induction from Coffea arabica leaf explants by benzyladenine. Plant Cell Physiol. 26:595-597.
Yokoi, S.; Quintero, F. J.; Cubero, B. L.; Ruiz, M. T.; Bressan, R.; Hasegawa, P. M. and Pardo, J. M. 2002. Differential expression and function of Arabidopsis thaliana Nhx Na+/H+ antiporters in the salt stress response. Plant J. 30:529-539.














