Introducción
Un acceso vascular (AV) funcionante es esencial para el paciente en hemodiálisis (HD). Las directrices de la Iniciativa Nacional de Calidad de los Resultados de la Enfermedad Renal de la Fundación Nacional del Riñón (NKF KDOQI), las guías europeas y la Guía española de acceso vascular para hemodiálisis recomiendan que la creación de un acceso permanente para HD se realice mediante la fístula arteriovenosa (FAV) nativa, la cual es el AV más efectivo1-3.
El problema principal de la FAV es mantenerla permeable a lo largo del tiempo para que proporcione una HD eficaz, siendo sus principales inconvenientes el fallo primario y la trombosis aguda2-7. Es por ello que tanto las FAV nativas como las protésicas pueden requerir múltiples intervenciones para alcanzar y mantener su uso a lo largo del tiempo8.
Existen diversas técnicas para la creación de una FAV y para el mantenimiento de su funcionalidad: cirugía abierta (FAV nativa y FAV protésica), procedimientos endovasculares para la creación de fístulas, procedimientos endovasculares para la reparación de complicaciones de las FAV (angioplastias simples, stenting, etc.) y procedimientos híbridos1.
La tendencia de «crear primero una FAV, usar un catéter venoso central como último recurso y preferir vasos distales en la medida de lo posible» ha sido reemplazada por «adoptar un enfoque individualizado para cada paciente». No obstante, se busca, en medida de lo posible, reservar los vasos proximales para futuros accesos2. Entre las fístulas distales, la fístula radiocefálica es la preferida, pero en muchos pacientes la permeabilidad primaria de este acceso es baja9,10.
En los últimos años se han desarrollado una serie de dispositivos percutáneos que permiten una anastomosis arteriovenosa por medio de un abordaje endovascular, con el objetivo de establecer una nueva vía de terapia de reemplazo renal9.
Desde 2018, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado dos dispositivos para la creación de FAV percutáneas: el sistema Ellipsys (Avenu Medical Inc., ahora Medtronic) y el WavelinQ (anteriormente Everlinq, Becton, Dickinson and Company, Franklin Lakes, NJ)8
Cuando los exámenes clínicos y ecográficos indican que la posibilidad de crear una FAV en la muñeca es desfavorable, la opción de una FAV percutánea puede preservar las ventajas de una FAV en la arteria radial, con un menor riesgo de isquemia distal inducida y un menor riesgo de insuficiencia cardiaca, típicamente asociado al hiperaflujo de FAV más proximales7,10. Los resultados iniciales y los estudios a largo plazo de estos dispositivos sugieren que brindan beneficios significativos y resultados favorables en pacientes con anatomía adecuada7.
Valoración preoperatoria
La valoración preoperatoria es fundamental para definir qué pacientes son candidatos a una FAV en general y a una FAV percutánea en este caso. Se compone de una valoración clínica y ecográfica completa de las arterias y venas de ambos brazos. En la valoración arterial debe comprobarse la presencia de un arco palmar intacto, con el fin de prevenir la isquemia de la mano. Los grupos con más experiencia recomiendan la prueba de Allen modificada o la prueba de Barbeau7.
En lo que respecta a la valoración venosa, resulta fundamental tener en cuenta la anatomía normal del brazo y antebrazo. La vena perforante comunica el sistema venoso superficial y profundo y, en la mayoría de los casos, se ubica en la zona distal del codo. La presencia y características de esta vena son importantes para la creación de una FAV percutánea, ya que es la que permite que la sangre venosa arterializada del sistema venoso profundo llegue al sistema venoso superficial y la FAV pueda utilizarse11.
Es importante señalar que este tipo de FAV no deben realizarse en pacientes con alteraciones graves del flujo arterial o venoso, como isquemia arterial crónica severa o trombosis del sistema venoso superficial1.
Es por ello que el mapeo ecográfico juega un papel esencial en la identificación de los pacientes adecuados para el procedimiento7.
Las directrices de uso para ambos dispositivos son:
El dispositivo WavelinQ requiere que la distancia entre la arteria radial o cubital proximal y la vena adyacente sea inferior a 1 mm7. Por otro lado, el dispositivo Ellipsys requiere una distancia de 1.5 mm entre la vena perforante y la arteria radial proximal7. En ambos casos es imperativo que la vena perforante presente un trayecto recto para posibilitar la anastomosis12. Si no existen venas aptas en el brazo o la distancia entre los vasos es mayor de la estipulada, no será posible realizar la FAV.
Un estudio de Popli et al.13 reporta que la idoneidad anatómica es crucial para el uso efectivo de estos dispositivos, registrando una tasa de idoneidad de extremidades del 93% para WavelinQ y del 52% para Ellipsys.
Procedimiento quirúrgico
Una vez decidido el brazo donde realizar el acceso, la cirugía sigue los estándares iniciales de una FAV quirúrgica. La profilaxis antibiótica se alinea con los protocolos hospitalarios de cada centro7. En cuanto a la anestesia, es posible realizar un bloqueo regional axilar o supraclavicular para favorecer la dilatación venosa7, aunque la anestesia local junto con sedación también es una opción viable11.
Durante el procedimiento, se administra heparina sódica en una dosis entre 2,000-5,000 unidades internacionales (UI) o 50 UI/kg. En situaciones selectas, donde se presenta vasoespasmo, se puede emplear una solución diluida de nitroglicerina, verapamilo y heparina sódica7.
Al concluir el procedimiento, se debe examinar la morfología de la FAV y medir el flujo en la arteria cubital y radial proximal cercanas a la anastomosis, para evaluar posibles complicaciones que requieran una angioplastia en el mismo procedimiento7.
A continuación, describiremos las características diferenciales de cada uno de los sistemas de creación de FAV percutánea.
Sistema Ellipsys
El dispositivo Ellipsys genera una FAV siguiendo una técnica similar a la desarrollada por Gracz, Konner y Jennings14.
La inserción del dispositivo se realiza bajo guía ecográfica, utilizando un único cable guía posicionado en una vena superficial. La guía se desplaza a través de la vena perforante, perfora la pared venosa y accede a la arteria radial proximal7.
Una vez posicionado, el dispositivo avanza sobre la guía, capturando tanto las paredes arteriales como venosas. Cuando se encuentra cerrado y activado, se forma una anastomosis segura mediante presión y energía térmica pulsada. El propio aparato controla el proceso y su finalización. Para completar el procedimiento, se realiza una angioplastia con balón en la anastomosis7 (Figs. 1 y 2).

Figura 1 Proceso de sellado con energía térmica del dispositivo Ellipsys Medtronic15. Imagen cortesía de Medtronic.

Figura 2 Angioplastia con balón para finalizar el procedimiento de creación de fístula arteriovenosa endovascular con dispositivo Ellipsys Medtronic15. Imagen cortesía de Medtronic.
Se requieren los siguientes materiales para realizar el procedimiento: un catéter Ellipsys (Medtronic, 710 Medtronic Parkway Minneapolis), el Generador (Medtronic, 710 Medtronic Parkway Minneapolis), un kit de micropunción de 6 Fr (Medtronic, 710 Medtronic Parkway Minneapolis), una guía de 0.014 pulgadas, un balón de 5 x 20 mm y un manómetro de presión16 (Fig. 3).
El grupo de Mallios et al.14 informa sobre una ligera variante de la técnica que involucra la punción ecoguiada mediante el uso de un kit de micropunción de la vena cefálica media. La punción se realiza con una aguja sin guía, avanzando por el centro de la vena hasta que la pared venosa contacte con la arterial, con el propósito de mejorar la visualización de la punta de la aguja. Posteriormente se procede a la perforación de ambas paredes, venosa y arterial, y se introduce la guía, observando la punta de la aguja en la zona central de la arteria. Esta modificación se recomienda con el fin de prevenir el potencial vasoespasmo que podría resultar de la presencia de la guía en la vena. Se introduce una guía de calibre 0.021 junto con un introductor de 6 French (Fr). La anastomosis se lleva a cabo siguiendo las indicaciones del dispositivo y finaliza con una angioplastia con balón simple de dimensiones 6 x 20 mm, ajustando el tamaño de este en relación con el tamaño de la arteria. En caso de que, al concluir el procedimiento, el flujo sanguíneo de la FAV medido en la arteria humeral sea inferior a 200 ml/min, proceden a realizar una angioplastia arterial y venosa yuxta-anastomótica mediante la aplicación de una técnica conocida como kissing balloon14.
Sistema WavelinQ
Inicialmente era comercializado como un dispositivo 6 Fr bajo el nombre de EverlinQ17. En la actualidad este sistema utiliza dos catéteres de calibre 4 Fr, los cuales están alineados entre sí mediante imanes y se colocan en la arteria y la vena objetivo7. La inserción de los catéteres se realiza mediante punción ecoguiada, mediante un kit de micropunción. La FDA aprueba la inserción del catéter arterial a nivel braquial, mientras que la inserción radial y cubital están aprobadas únicamente en Europa. El catéter venoso, que incorpora un electrodo de radiofrecuencia, está autorizado para su inserción en las venas braquial, radial o cubital7.
Tras la punción, una guía de calibre 0.014 se dirige en dirección distal hacia la vena y la arteria cubital, o hacia la vena y la arteria radial. El catéter venoso dispone de un electrodo que se coloca frente a un respaldo de cerámica en el catéter arterial y emplea energía de radiofrecuencia durante un lapso de 0.7 segundos para la creación del acceso9,11. Algunos grupos9,17 prefieren la anastomosis cubito-cubital debido a la proximidad de la vena cubital con la vena perforante.
Es importante señalar que, antes de llevar a cabo la anastomosis, los catéteres deben alinear las marcas de los imanes con una vista ortogonal mediante fluoroscopia. Cada catéter dispone de indicadores de rotación que garantizan la posición de los imanes18. Una vez finalizada la anastomosis, se verifica el flujo de la FAV mediante una fluoroscopia con contraste11 (Figs. 4 y 5).
Figura 4 Dispositivo WavelinQ posicionado previo al uso de radiofrecuencia (WavelinQ EndoAVF System Specification19). Imagen cortesía de WavelinQ (BD-41679).
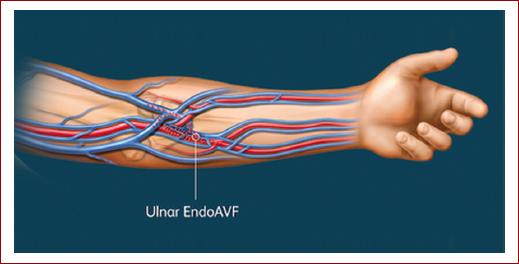
Figura 5 Fístula cubito-cubital endovascular creada por dispositivo WavelinQ (WavelinQ EndoAVF System Specification19). Imagen cortesía de WavelinQ (BD-41679).
El flujo sanguíneo proveniente de la FAV ingresa en el sistema venoso profundo y se distribuye a través de los sistemas profundos y superficiales del antebrazo y los brazos, mediante las ramas venosas perforantes y comunicantes9. La embolización con coils de la vena braquial proximal dominante estimula el flujo superficial de la FAV percutánea a través de las venas superficiales. Este último procedimiento no es obligatorio, aunque se reporta una frecuencia del 66.7% en su realización7,11,17 (Fig. 6).

Figura 6 Kit del dispositivo de fístula arteriovenosa endovascular (WavelinQ EndoAVF System Specification19). Imagen cortesía de WavelinQ (BD-41679).
En la tabla 1 se detallan las principales características y diferencias de los dispositivos destinados a la creación de FAV percutánea.
Tabla 1 Principales características de los dispositivos de creación de fístulas arteriovenosas percutáneas
| Tipo de dispositivo | Ellipsys | WavelinQ |
|---|---|---|
| Catéter | 1 catéter: acceso venoso | 2 catéteres: acceso arterial 4 Fr por arteria humeral (EE.UU.), acceso radial, cubital y humeral (Europa) y acceso venoso |
| Tipo de anastomosis | Anastomosis: radial proximal a vena perforante | Anastomosis: cubital o radial proximal a vena adyacente |
| Medio de imagen para realizar el procedimiento | Realizado con ecografía | Punción con ecografía y procedimiento con fluoroscopia |
| Embolización con coils | No se realiza embolización | Embolización con coils de vena braquial proximal (opcional)17 |
| Medio para realizar la anastomosis | Fusión térmica y angioplastia | Radiofrecuencia |
| Tiempo medio por procedimiento | 15-30 minutos14 | 84 ± 62 minutos17 |
| Éxito técnico | (99%)14 | Éxito técnico 96.7%17 |
Valoración postoperatoria
En el proceso de seguimiento postoperatorio de ambos dispositivos se realiza de nuevo una exploración clínica y ecográfica14. Clínicamente, el aspecto del brazo no difiere del de una FAV nativa.
Se recomienda medir el flujo en la arteria humeral mediante ecografía Doppler al finalizar el procedimiento y una semana después de este7. Si la velocidad del flujo se sitúa entre 250 y 400 ml/min al finalizar el procedimiento, deben ser evaluados en consulta durante la primera semana posterior a la intervención. En los casos en los que la velocidad de flujo permanece entre 250 y 400 ml/min, se opta por realizar una angioplastia con balón simple. Si las velocidades de flujo son superiores, se recomienda realizar un seguimiento adicional a las cuatro semanas y comenzar las canulaciones si el diámetro y el flujo son apropiados7.
El flujo de la FAV no muestra alteraciones significativas en aquellos pacientes con drenaje a través de una única vena (cefálica o basílica) ni cuando dicho drenaje se dirige a ambas venas (cefálica y basílica); se acompaña de un ligero drenaje hacia el sistema venoso profundo, sin aparentes complicaciones derivadas de ello20.
Canulación
Se sugiere el uso de un torniquete y una punción ecoguiada, ya que la ausencia de cicatriz puede dificultar la localización de la anastomosis de la FAV. Otra variable importante para considerar es que el flujo venoso de salida puede ser múltiple (cefálico, basílico, humeral), lo que puede complicar la canulación en una zona distendida y pulsátil. La canulación inicial se realiza con una única aguja de 17 G, con un ángulo de 25-35°. Conforme la maduración de la FAV avanza, se progresa hacia la canulación con dos agujas de un calibre mayor11.
Resultados generales, permeabilidad y uso
El metaanálisis más reciente de Bontinis et al. reporta una permeabilidad primaria del 51.85 y el 47.97% para WavelinQ y Ellipsys, respectivamente. La permeabilidad secundaria fue del 81.36 y 92.12%, respectivamente21.
Por otro lado, el equipo de Mallios reporta que el sistema Ellipsys tiene una permeabilidad primaria al año del 54%, permeabilidad asistida al año del 85% y secundaria al año del 96%14. Los resultados reportados por los grupos de Inston y Belarnd por el sistema WavelinQ muestran una permeabilidad primaria al año del 65 al 74%, una permeabilidad asistida del 80.7% y una permeabilidad secundaria del 87.8%9,17.
Los resultados en la literatura son múltiples y diversos según la experiencia que se adquiera con los dispositivos. La revisión de Shimamura et al.22 expone los múltiples sesgos posibles encontrados en los distintos grupos de trabajo, pero deja claro que las fístulas endovasculares son costo-efectivas.
El equipo de Shahverdyan, en Hamburgo, ha tenido experiencia con los dos dispositivos y coinciden que tienen un porcentaje de éxito técnico cercano al 100%, aunque el dispositivo Ellipsys requiere menor tiempo de intervención23.
El flujo medio obtenido en un tiempo medio de un año de seguimiento fue de 923 ± 230 ml/min y 1,337 ± 6,655 ml/min en los dispositivos Ellipsys y WavelinQ respectivamente14,17.
En cuanto al uso de la fístula endovascular, comprendido como una HD exitosa, el estudio NEAT refiere que el dispositivo WavelinQ logró esta en el 87% de los pacientes24. Por su parte, el equipo de Hull et al. reporta que con el dispositivo Ellipsys se logró una HD exitosa en un 87% de los pacientes25.
Complicaciones
Las complicaciones de las FAV endovasculares son poco comunes. En caso de que surjan, su naturaleza es similar a la de las FAV quirúrgicas: hematomas, pseudoaneurismas, disección arterial, trombosis temprana y lesiones neurológicas, como daño al nervio mediano7,11. También existe el riesgo de migración de los coils, en aquellos casos donde se realiza embolización de la vena braquial.
Existe un bajo riesgo de hipoperfusión distal, degeneración aneurismática o hipertensión venosa26. En los distintos estudios, se han encontrado complicaciones en un 2.48% para Ellipsys 19 y en un 5.8% para WavelinQ17.
Conclusiones
Las FAV percutáneas se presentan como una opción mínimamente invasiva y segura para la creación de accesos vasculares destinados a HD. En el mercado existen dos dispositivos aprobados para su implementación, con prometedores resultados en términos de permeabilidad y durabilidad. No obstante, es relevante señalar que este tipo de FAV pueden requerir intervenciones posteriores para mejorar y mantener su permeabilidad. No se han llevado a cabo estudios comparativos que establezcan la superioridad de un dispositivo sobre otro.











 nueva página del texto (beta)
nueva página del texto (beta)



