Introducción
Las enfermedades cardiovasculares (ECV), entre las que se encuentra la enfermedad arterial periférica (EAP), son una de las principales causas de muerte y discapacidad en el mundo1. Debido a que la mayoría de estas enfermedades tienen una manifestación clínica en estadios avanzados, resulta importante implementar estrategias de prevención para incidir sobre los factores de riesgo; entre ellos la diabetes mellitus (DM), hipertensión arterial periférica, obesidad, síndrome metabólico, tabaquismo y dislipidemia asociada a aterosclerosis.
Entre las opciones terapéuticas para el control o modificación de la ateroesclerosis y de la EAP se encuentran los tratamientos hipolipemiantes, como las estatinas2. Recientemente ha surgido una nueva propuesta con sustento genómico mediante la inhibición de un metabolito que de manera fisiológica modifica la regulación del colesterol vinculado a lipoproteínas de baja densidad (c-LDL), los medicamentos inhibidores del gen de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9), como el evolocumab3.
El c-LDL circulante tiene un potente efecto aterogénico, y el organismo dispone de un sistema de destrucción de c-LDL en el hígado que no siempre es eficiente, especialmente cuando se asocia a mutaciones genéticas de proteínas4. Se han desarrollado medicamentos que interfieren con la actividad de la PCSK9, tales son aquellos que inhiben de manera directa la proteína mediante anticuerpos monoclonales, las sustancias activas son alirocumab, bococizumab y evolocumab. El bococizumab tiene mayor capacidad de generar anticuerpos contra sí mismo y perder efectividad, razón por la cual fuera descontinuado del mercado; mientras que el alirocumab y el evolocumab son anticuerpos 100% humanos5,6. Los iPCSK9 disminuyen el c-LDL, la apolipoproteína (apo) B y los triglicéridos (TG) e incrementan el colesterol vinculado a lipoproteínas de alta densidad (c-HDL) y la apoA1; existe evidencia de que por cada incremento de 5 mg/dl de c-HDL disminuye en un 6% el riesgo de hospitalización por ECV; además, los pacientes tratados disminuyeron las concentraciones de c-LDL por debajo de valores que no se habían alcanzado con las estatinas y permiten alcanzar los objetivos terapéuticos en los pacientes con hipercolesterolemia. Con los tres fármacos se ha evidenciado la reducción hasta en un 80% de los valores basales de c-LDL, en pacientes con diversas características y comorbilidades, en tratamiento solo o combinados con diferentes estatinas o ezetimiba; también se observó una reducción del colesterol total de lipoproteína y un aumento del c-HDL7-9. En el núcleo del hepatocito se producen receptores de LDL (LDLr) y la proteína PCSK9; los LDLr son liberados a la superficie celular para capturar el c-LDL circulante e internalizan mediante endocitosis al hepatocito donde posteriormente los lisosomas lo destruyen y vuelve a liberarse el LDLr, que se recicla para hacer la misma acción por hasta un centenar de ciclos; por otro lado, la proteína PCSK9 también se secreta al exterior celular y se une al LDLr, este complejo sufre el mismo proceso de endocitosis, pero se degrada en su totalidad dentro de los lisosomas; en cierto modo, la proteína PCSK9 es un mediador de la degradación de los LDLr10-12.
La hipercolesterolemia es el factor de riesgo más importante en las ECV ateroescleróticas, el tratamiento como dieta, ejercicio y los fármacos hipolipemiantes como las estatinas o ezetimiba no siempre resultan eficaces13.
Por lo que los fármacos del tipo anticuerpos monoclonales que inhiben a la proteína PCSK9, como el evolocumab, han tomado especial relevancia dados los resultados exitosos en el control terapéutico de pacientes con dislipidemia de difícil control, aunado a los efectos en la reducción del riesgo de mortalidad por ECV14.
Material y métodos
El objetivo principal del estudio fue evaluar el efecto del tratamiento combinado de evolocumab y estatinas sobre la estenosis arterial en pacientes con EAP. El estudio se realizó en el Hospital Central Militar, en la consulta externa del Servicio de Angiología y Cirugía vascular, así como en el laboratorio vascular no invasivo durante el periodo comprendido de julio de 2021 a julio de 2022, con un total de 303 pacientes, realizando investigación descriptiva, observacional, comparativa, tipo cohorte, longitudinal y prospectiva. La población se separó en dos grupos de estudio de acuerdo con el tratamiento: de estatinas (grupo 1) un total de 267 pacientes, y estatinas más evolocumab (grupo 2) con un total de 36 pacientes, previamente asignado y en seguimiento por el servicio de cardiología, se evaluó el efecto del tratamiento combinado de estatinas y evolocumab, observando el porcentaje de estenosis arterial por ultrasonido Doppler arterial realizando las pruebas de Kruskal-Wallis y de U de Mann-Whitney. Para todas las estimaciones, se consideró una diferencia estadísticamente significativa cuando los valores p eran < 0.05.
El estudio fue sometido a revisión por el Comité de Ética e Investigación del Hospital Central Militar y fue aprobado con el número 037/2021.
Resultados
En el estudio se incluyó un total de 303 pacientes que cumplieron todos los criterios. En relación con la edad, esta varió de 22 años (paciente con hipercolesterolemia familiar y claudicación de extremidades inferiores) a 97 años (paciente con enfermedad vascular cerebral y dolor isquémico), con una media de 64.15 ± 14.38 años. Dentro de las principales comorbilidades, se encontró: EAP en la totalidad de pacientes (303, 100%), síndrome isquémico o infarto agudo de miocardio (IAM) en 139 (46%), enfermedad vascular cerebral en 134 (44%), tabaquismo en 135 (45%), hipertensión arterial (HAS) en 198 (65%), dislipidemia en 41 (14%) y DM en 238 (79%). Posteriormente se separó a los pacientes en dos grupos de acuerdo con el tratamiento de iPCSK9, teniendo que 36 (12%) pacientes contaron con este. Se realizó una comparación de los promedios de los resultados obtenidos de c-LDL al inicio del tratamiento (T0) en pacientes con estatinas y pacientes con estatinas + iPCSK9, encontrándose diferencias estadísticamente significativas (p < 0.0001).
Se realizó una comparación del porcentaje de estenosis obtenido en las mediciones realizadas con ultrasonido Doppler arterial al inicio del tratamiento (T0) en pacientes con estatinas y pacientes con estatinas + iPCSK9, encontrándose diferencias estadísticamente significativas en femoral común derecha, femoral común izquierda, tibial posterior izquierda, tibial anterior derecha, tibial anterior izquierda, peronea derecha y peronea izquierda (p < 0.05) (Tablas 1 y 2, Figs. 1 y 2). Se compararon los promedios de los resultados obtenidos de los niveles de c-LDL al término del tratamiento en pacientes con estatinas y pacientes con estatinas + iPCSK9, encontrándose diferencias estadísticamente significativas. Se describieron los promedios de los niveles de c-LDL mg/dl al inicio (T0) y término (T1) del tratamiento en pacientes con estatinas y pacientes con estatinas + iPCSK9.
Tabla 1 Comparación del porcentaje de estenosis obtenido en las mediciones realizadas con ultrasonido Doppler al inicio del tratamiento (T0) en ambos grupos
| Variable | Grupo estatinas | Grupo estatinas + inhibidor PCSK9 | Valor p |
|---|---|---|---|
| (n = 231) media ± DE | (n = 72) media ± DE | ||
| Femoral común derecha | 12.91 ± 6.92 | 18.10 ± 8.72 | 0.030* |
| Femoral común izquierda | 13.52 ± 6.47 | 18.28 ± 8.94 | 0.012* |
| Femoral superficial derecha | 22.97 ± 6.44 | 27.26 ± 8.39 | 0.863 |
| Femoral superficial izquierda | 23.81 ± 6.87 | 28.47 ± 8.93 | 0.703 |
| Poplítea derecha | 29.87 ± 10.38 | 38.68 ± 10.38 | 0.506 |
| Poplítea izquierda | 30.60 ± 9.35 | 37.43 ± 11.64 | 0.214 |
| Tibial posterior derecha | 35.63 ± 8.49 | 43.89 ± 12.06 | 0.774 |
| Tibial posterior izquierda | 35.69 ± 8.70 | 45.28 ± 13.12 | 0.038* |
| Tibial anterior derecha | 40.64 ± 10.50 | 50.82 ± 13.58 | 0.006* |
| Tibial anterior izquierda | 40.53 ± 10.88 | 51.53 ± 14.74 | 0.001* |
| Peronea derecha | 34.26 ± 15.04 | 49.25 ± 18.51 | < 0.0001* |
| Peronea izquierda | 34.84 ± 14.85 | 50.06 ± 19.87 | < 0.0001* |
*Estadísticamente significativo. DE: desviación estándar; PCSK9: proproteína convertasa subtilisina/kexina tipo 9.
Tabla 2 Comparación del porcentaje de estenosis obtenido en las mediciones realizadas con ultrasonido Doppler al término del tratamiento (T1) en ambos grupos
| Variable | Grupo estatinas | Grupo estatinas + inhibidor PCSK9 | Valor p |
|---|---|---|---|
| (n = 231) media ± DE | (n = 72) media ± DE | ||
| Femoral común derecha | 11.35 ± 5.80 | 13.15 ± 6.48 | 0.030* |
| Femoral común izquierda | 11.90 ± 5.65 | 14.11 ± 7.35 | 0.012* |
| Femoral superficial derecha | 21.27 ± 6.02 | 21.40 ± 7.10 | 0.863 |
| Femoral superficial izquierda | 22.07 ± 6.27 | 22.43 ± 7.43 | 0.703 |
| Poplítea derecha | 27.07 ± 6.27 | 28.42 ± 8.69 | 0.506 |
| Poplítea izquierda | 28.49 ± 8.76 | 30.08 ± 9.40 | 0.214 |
| Tibial posterior derecha | 33.73 ± 7.83 | 35.29 ± 10.15 | 0.774 |
| Tibial posterior izquierda | 33.66 ± 7.73 | 37.38 ± 10.87 | 0.038* |
| Tibial anterior derecha | 38.46 ± 9.42 | 42.26 ± 11.13 | 0.006* |
| Tibial anterior izquierda | 38.37 ± 9.84 | 43.49 ± 11.70 | 0.001* |
| Peronea derecha | 32.08 ± 13.49 | 41.15 ± 15.11 | < 0.0001* |
| Peronea izquierda | 32.58 ± 13.44 | 42.13 ± 16.34 | < 0.0001* |
*Estadísticamente significativo. DE: desviación estándar; PCSK9: proproteína convertasa subtilisina/kexina tipo 9.

Figura 1 Comparación del porcentaje de estenosis obtenido en las mediciones realizadas con ultrasonido Doppler al inicio del tratamiento (T0) en ambos grupos. FCD: femoral común derecha; FCI: femoral común izquierda; FSD: femoral superficial derecha; FSI: femoral superficial izquierda; PD: poplítea derecha; PerD: peronea derecha; Perl: peronea izquierda; PI: poplítea izquierda; TAD: tibial anterior derecha; TAI: tibial anterior izquierda; TPD: tibial posterior derecha; TPI: tibial posterior izquierda.
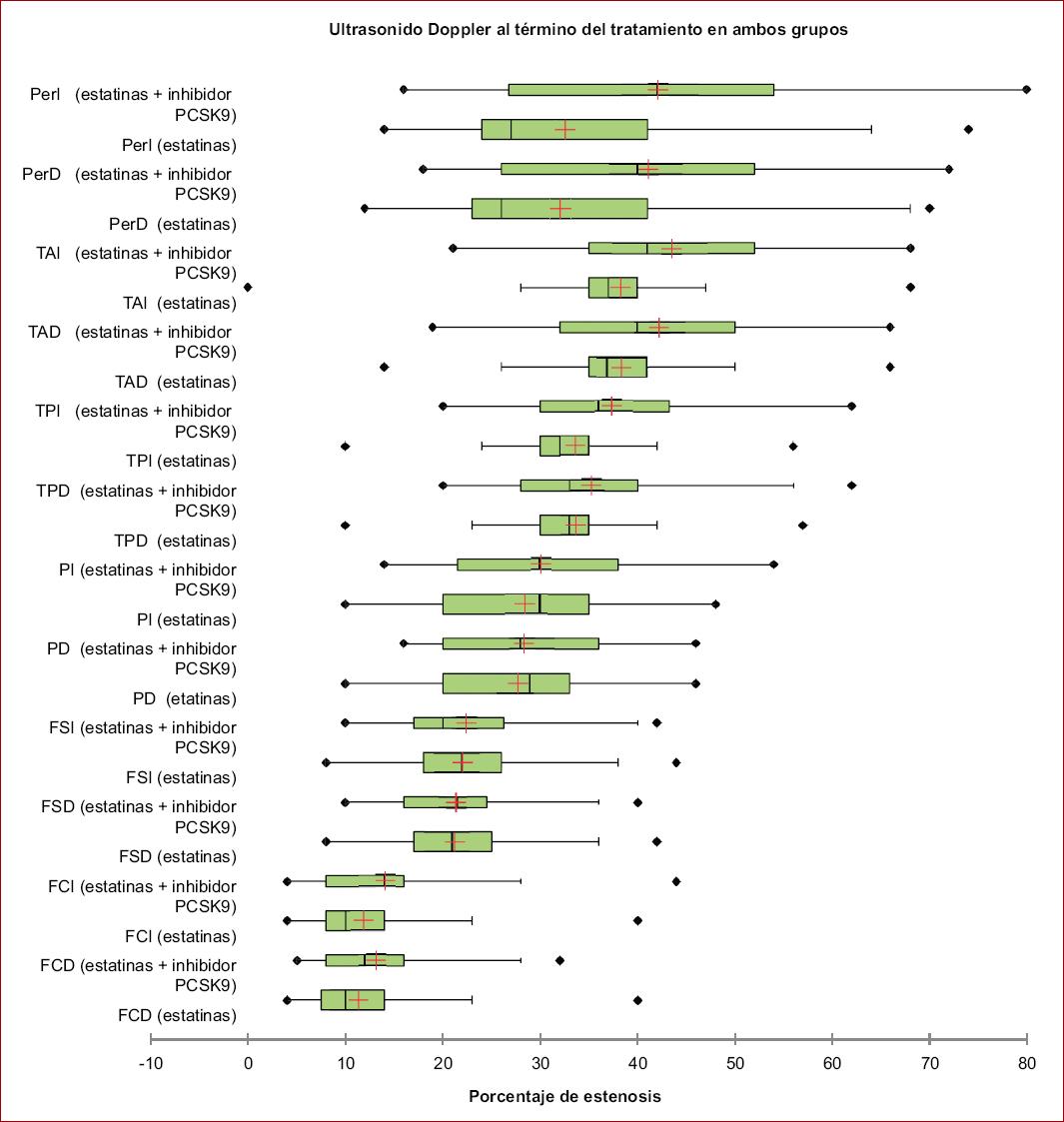
Figura 2 Comparación del porcentaje de estenosis obtenido en las mediciones realizadas con ultrasonido Doppler al término del tratamiento (T1) en ambos grupos. FCD: femoral común derecha; FCI: femoral común izquierda; FSD: femoral superficial derecha; FSI: femoral superficial izquierda; PD: poplítea derecha; PerD: peronea derecha; Perl: peronea izquierda; PI: poplítea izquierda; TAD: tibial anterior derecha; TAI: tibial anterior izquierda; TPD: tibial posterior derecha; TPI: tibial posterior izquierda.
Por último, se obtuvieron los porcentajes de claudicación presentada al inicio (T0) y al término del tratamiento (T1) en pacientes con estatinas y pacientes con estatinas + iPCSK9 (Figs. 3 y 4).

Figura 3 Comparación del porcentaje de claudicación menor a 200 metros en pacientes al inicio (T0) y término (T1) del tratamiento con estatinas.

Figura 4 Comparación del porcentaje de claudicación menor a 200 metros en pacientes al inicio (T0) y término (T1) del tratamiento con estatinas + inhibidor de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9).
En el estudio se realizó una comparación del porcentaje de estenosis arterial, obtenido en las mediciones realizadas con ultrasonido Doppler al inicio y término del tratamiento (T0) en pacientes con estatinas y pacientes con estatinas + iPCSK9, encontrándose diferencias estadísticamente significativas, presentándose un menor porcentaje de estenosis arterial en las mediciones en los pacientes del grupo de estatinas; sin embargo la disminución en porcentaje fue mayor en el grupo de estatinas + iPCSK9, este resultado en parte puede deberse a la duración del tratamiento.
Con respecto a la claudicación al inicio (T0) y al término del tratamiento (T1), no hubo disminución del porcentaje de claudicación al inicio y término del tratamiento en el grupo de estatinas. En el grupo de estatinas + iPCSK9 se identificó disminución con significancia estadística del 50% de la claudicación al inicio y término de este.
Discusión
Dentro de las principales comorbilidades, identificamos que estuvo presente la EAP en la totalidad de los 303 pacientes (100%), el síndrome isquémico o IAM en 139 (46%), la enfermedad vascular cerebral en 134 (44%), el tabaquismo en 135 (45%), HAS en 198 (65%), dislipidemia en 41 (14%) y DM en 238 (79%). Las principales comorbilidades de la población con EAP fueron DM, HAS y tabaquismo, correspondiendo con lo reportado en la literatura15. Como parte de nuestro análisis, se realizó una comparación del porcentaje de estenosis arterial obtenido en las mediciones realizadas con ultrasonido Doppler arterial al inicio y término del tratamiento (T0) en pacientes con estatinas y pacientes con estatinas + iPCSK9, encontrándose diferencias estadísticamente significativas, presentándose un menor porcentaje de estenosis arterial en las mediciones en los pacientes del grupo de estatinas + iPCSK9. La EAP se presentó principalmente en mayores de 60 años y en pacientes que presentan sobrepeso (índice de masa corporal > 28).
Con respecto a las mediciones realizadas con ultrasonido Doppler al inicio y término del tratamiento, se reportó un menor porcentaje en las mediciones en los pacientes del grupo de estatinas, sin embargo, la disminución en porcentaje es mayor en el grupo de estatinas + iPCSK9.
No hubo disminución del porcentaje de claudicación al inicio y término del tratamiento en el grupo de estatinas, pero en el grupo de estatinas + iPCSK9 hubo una disminución significativa del 50% de la claudicación al inicio y al término de este. Hubo disminución de los valores (mg/dl) de c-LDL en los pacientes de ambos grupos, sin embargo, la disminución de los valores (mg/dl) de c-LDL fue mayor en los pacientes del grupo de estatinas + iPCSK9 que en los pacientes del grupo de estatinas.
El tratamiento con estatinas más el uso de iPCSK9 ha demostrado ser efectivo en la reducción del colesterol. La finalización de dos importantes ensayos clínicos sobre iPCSK9, FOURIER y ODYSSEY, ha marcado el inicio de una nueva era de fármacos hipolipemiantes, los iPCSK9 aumentan el número de LDLr, lo que conduce a una profunda reducción de las partículas LDL circulantes16. Al impedir la destrucción de los LDLr, los iPCSK9, como complemento del tratamiento con estatinas, pueden reducir los episodios cardiovasculares y la mortalidad por todas las causas en pacientes con ECV. Basándose en la evidencia de los ensayos clínicos, las directrices de 2019 de la Sociedad Europea de Cardiología (ESC)/Sociedad Europea de Aterosclerosis (EAS) para el manejo de las dislipidemias incluyen ahora el uso de iPCSK9 en pacientes con ECV ateroesclerótica de muy alto riesgo que no están alcanzando los objetivos de tratamiento con una dosis máxima tolerada de una estatina. Sin embargo, la relación costo-efectividad del tratamiento con iPCSK9 se limita a la prevención secundaria en pacientes de alto riesgo17.
En un metaanálisis reciente de ensayos clínicos aleatorizados que evaluaron terapias contra PCSK9, en pacientes con diagnóstico clínico de hipercolesterolemia familiar heterocigota y se restringieron los análisis a aquellos pacientes en los que se disponía de datos genotípicos, se encontraron los siguientes resultados: entre los casos de hipercolesterolemia familiar heterocigota monogénica (HeFH) (N = 1,347), la reducción del c-LDL desde el valor basal fue del 50.4% para alirocumab y evolocumab en comparación con el control. Entre los pacientes con HeFH, el efecto reductor del c-LDL de los fármacos dirigidos a la PCSK9 no mostró heterogeneidad estadística entre las diferentes clases de fármacos ni entre las variantes genéticas. Barrios et al. presentaron el primer registro que analiza el perfil clínico de los pacientes tratados en España con evolocumab y la efectividad sobre el perfil lipídico y su seguridad en el «mundo real». Tuvieron un perfil lipídico basal: colesterol total 219.4 ± 52.2 mg/dl, c-LDL 144.0 ± 49.0 mg/dl, c-HDL 47.7 ± 13.0 mg/dl y TG 151.0 ± 76.2 mg/dl18.
En nuestro estudio también se encontró disminución del colesterol, habiéndose identificado un promedio de 150.44 mg/dl al inicio del tratamiento vs. 104.56 mg/dl al término del tratamiento en el grupo de estatinas + iPCSK9. Y de 133.33 mg/dl de colesterol al inicio del tratamiento vs. 96.61 mg/dl al término del tratamiento en el grupo de estatinas.
Estos resultados son consistentes con estudios previos que han demostrado la eficacia de la combinación de estatinas e iPCSK9 en la reducción del colesterol19. Otros estudios donde se evaluaron iPCSK9 y estatinas observaron la reducción significativa del colesterol total (30.9% a las 2 semanas y 39.3% a las 12 semanas; p < 0.001), c-LDL (44.4 y 57.6%, respectivamente; p < 0.001) y TG (14.8 y 5.2%; p < 0.001), sin modificar significativamente el c-HDL (6.7 y 2.0%; p = 0.14). Se evaluó la eficacia del iPCSK9 alirocumab en combinación con estatinas en la reducción del colesterol en pacientes con hipercolesterolemia. Los resultados del estudio mostraron que la combinación de alirocumab y estatinas redujo significativamente los niveles de c-LDL en comparación con el tratamiento con estatinas sola20.
El tratamiento con estatinas reduce significativamente los niveles de LDL, así como la incidencia de eventos cardiovasculares en pacientes con alto riesgo cardiovascular, además del tratamiento con estatinas, el uso de iPCSK9 también ha demostrado ser efectivo en la reducción del colesterol, por lo que el uso combinado de estatinas con iPCSK9 ha sido objeto de interés reciente en la literatura médica21.
En el presente estudio se observó una disminución significativa de estenosis arterial mediante ultrasonido Doppler arterial y la claudicación en extremidades inferiores, por lo que conocer la modificación de la placa ateroesclerótica en pacientes con EAP tratados con esquema combinado de estatinas y evolocumab podría ayudar a complementar las medidas de prevención secundaria y ser una terapia profiláctica coadyuvante para las complicaciones microvasculares y macrovasculares de los pacientes con EAP, así como ECV.
Conclusiones
En la práctica clínica en el Hospital Central Militar, el evolocumab se asoció con reducciones de los niveles séricos del c-LDL del 39% tras 12 semanas de tratamiento, con una tasa de suspensión del tratamiento por efectos adversos muy baja y con un elevado cumplimiento terapéutico. Estos resultados son consistentes con los obtenidos en los ensayos clínicos aleatorizados. Por lo que la reducción del c-LDL a objetivos bajos debería ser un enfoque central de la terapia preventiva en pacientes con EAP, ya que se observó una asociación en la disminución de los porcentajes de estenosis arterial mediante ultrasonido Doppler arterial, con mejoría clínica significativa en pacientes claudicantes.











 nueva página del texto (beta)
nueva página del texto (beta)


