Introducción
La tromboembolia venosa (TEV), la cual incluye la trombosis venosa profunda (TVP) y la embolia pulmonar (EP), es la tercera alteración cardiovascular más común, afectando a un 5% de la población a lo largo de su vida1. La tromboembolia pulmonar (TEP) es una enfermedad aguda y potencialmente mortal en la que el material embólico, por lo general un trombo procedente de una de las venas profundas de los miembros inferiores, bloquea una o más arterias pulmonares, causando un flujo sanguíneo deteriorado y un aumento de la presión para el ventrículo cardiaco derecho (VD). La TEP es difícil de diagnosticar porque los síntomas no son específicos y la presentación clínica de los pacientes con sospecha de TEP varía ampliamente desde pacientes asintomáticos hasta aquellos en shock cardiogénico, cuya manifestación clínica más frecuente es la disnea seguida del dolor torácico, y hemoptisis, entre otras1,2. El diagnóstico y el tratamiento del cuadro clínico oportuno representan el pilar para la sobrevivencia de los pacientes. Los pacientes deben ser monitoreados por las complicaciones tempranas y tardías de la TEP (trombosis recurrente, hipertensión pulmonar tromboembólica crónica [HPTEC] y muerte), así como por las complicaciones por la terapia anticoagulante y otras terapias definitivas2.
Metodología
Para la realización de la presente revisión bibliográfica se han utilizado diferentes fuentes bibliográficas primarias y secundarias obtenidas de motores de búsqueda como PubMed, Trip, Scopus y Google Scholar, con las siguientes palabras clave y términos MeSH: “pulmonary embolism”, “venous thromboembolism”, “D-Dimer”, “risk factors”, “pulmonary embolism - diagnostic” y “treatment - pulmonary embolism”, “anticoagulant terapy”; adicionalmente se formularon preguntas PICO en la búsqueda de los estudios relacionados con terapéutica utilizando el motor de búsqueda Trip. Como filtros adicionales se utilizaron en el tipo de artículo: “meta-analysis”, “randomized controlled trial”, “clinical trial”, “review” y “systematic review”, y se filtró por los trabajos publicados en los últimos cinco años. La búsqueda arrojó 2,291 resultados y se los discriminó de acuerdo con la pertinencia y relevancia del título de los artículos. Luego de este proceso se descartaron 2,233 trabajos y 58 artículos continuaron en el proceso de análisis. Los investigadores a continuación evaluaron el resumen. Finalmente se descartaron 33 trabajos y 25 fueron seleccionados para la realización de este artículo de revisión. El análisis final se realizó en formato de conclusión de acuerdo con los subtemas: epidemiología y factores de riesgo, diagnóstico y tratamiento de TEP.
Definición
La TEP es una forma de TEV que es común y, a veces, mortal. Se debe a la obstrucción de la arteria pulmonar o una de sus ramas por material (trombo, tumor, aire o grasa) que se originó en otra parte del cuerpo3. Se puede clasificar de la siguiente manera:
-
- El patrón temporal de presentación:
- Ubicación anatómica (en silla de montar, lobar, segmentaria, subsegmentaria):
La TEP en silla de montar (3-6%) se ubica en la bifurcación de la arteria pulmonar principal y, generalmente, se alarga hacia las arterias pulmonares principales derecha e izquierda; tradicionalmente, se pensaba que estaba asociada con inestabilidad hemodinámica y muerte4.
La mayoría de los émbolos pulmonares se desplazan distalmente a la bifurcación de la arteria pulmonar principal para ubicarse en las ramas lobulares, segmentarias o subsegmentarias principales, y pueden ser de carácter bilateral o unilateral3,4.
-
- Presencia o ausencia de estabilidad hemodinámica. Definiciones de la American Heart Association (AHA) y el American College of Chest Physicians (ACCP):
TEP hemodinámicamente inestable. Resulta en hipotensión. La hipotensión se define como una presión arterial sistólica < 90 mmHg o una caída de la presión arterial sistólica ≥ 40 mmHg desde el inicio durante un periodo > 15 minutos o hipotensión que requiere vasopresores o soporte inotrópico y no se explica por otras causas como sepsis, arritmia, infarto agudo de miocardio o hipovolemia3,4 (Tabla 1).
TEP hemodinámicamente estable. Es una TEP que no cumple con la definición de TEP hemodinámicamente inestable. Pacientes que presentan una TEP pequeña, levemente sintomática o asintomática a aquellos que tienen hipotensión leve que se estabiliza mediante fluidoterapia, o presentan disfunción del VD4.
Tabla 1 Definición de inestabilidad hemodinámica, que delimita la embolia pulmonar aguda de alto riesgo
| Paro cardiaco | Shock obstructivo | Hipotensión persistente |
|---|---|---|
| Necesidad de resucitación cardiopulmonar | PA sistólica < 90 mmHg o que requiere vasopresores para alcanzar PA sistólica > 90 mmHg a pesar de un estado adecuado de llenado | PA sistólica < 90 mmHg o caída de PA sistólica > 40 mmHg, con una duración superior a 15 min y no causada por arritmia, hipopotasemia o sepsis de nueva aparición |
| Hipoperfusión de órgano blanco (alteración del estado mental; frío, piel fría y húmeda; oliguria/anuria; aumento de lactato sérico) |
PA: presión arterial.
Fisiopatología e historia natural
La TEP aguda frecuentemente se debe a un desprendimiento de un trombo localizado en las extremidades inferiores, también puede resultar de material no trombótico (grasa, tumor, aire). Este interfiere con la circulación pulmonar normal y con el intercambio de gases3,4. Debido a la obstrucción de la arteria pulmonar o sus ramas se produce una insuficiencia ventricular derecha por aumento de presión aguda, lo que lleva a ser la principal causa de muerte de la TEP aguda. La obstrucción da lugar a un aumento de la presión de la arteria pulmonar si se ocluye más del 30-50% del área transversal del lecho arterial pulmonar, además ocurre un aumento de la resistencia vascular pulmonar (RVP) por la liberación de tromboxano A2 y serotonina4,5 (Fig. 1).
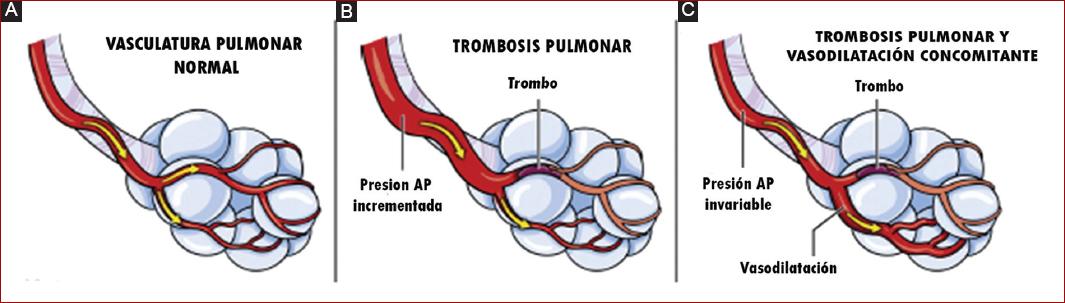
Figura 1 Ilustración que muestra cómo la vasodilatación concomitante puede mitigar los efectos hemodinámicos de la trombosis pulmonar. A: vasculatura pulmonar normal. B: trombosis pulmonar, que aumenta la resistencia vascular pulmonar y conduce a un aumento de la presión de la AP. C: la vasodilatación pulmonar concomitante puede «anular» potencialmente los aumentos de la resistencia vascular pulmonar y la presión de la presión pulmonar causados por la trombosis pulmonar(tomado de Homan 2021). AP: arteria pulmonar.
El aumento brusco de la RVP da lugar a la dilatación del VD, lo que altera las propiedades contráctiles del miocardio del VD por el mecanismo de Frank Starling (cuanto mayor es la precarga ventricular, mayor es el volumen sistólico)5,6. El aumento de la presión y el volumen del VD lleva a un aumento de la tensión parietal y al estiramiento de los miocitos4,5. El tiempo de contracción del VD se alarga y la activación neurohumoral conduce a estimulación inotrópica y cronotrópica. Junto con la vasoconstricción sistémica, estos mecanismos aumentan la presión arterial pulmonar (PAP), mejorando el flujo vascular pulmonar obstruido y estabilizando temporalmente la presión arterial sistémica. Pero, el grado de adaptación inmediata es limitado, ya que un VD de paredes delgadas no preacondicionado no puede generar una PAP media > 40 mmHg5,6.
La prolongación del tiempo de contracción del VD en la diástole temprana en el ventrículo izquierdo (VI) conduce a una desincronización de los ventrículos que puede verse exacerbada por el desarrollo de un bloqueo de rama derecha. Como resultado, se impide el llenado del VI en la diástole temprana, lo que lleva a una reducción del gasto cardiaco (GC) y contribuir a la hipotensión sistémica y la inestabilidad hemodinámica6,7. Se han encontrado infiltrados de células inflamatorias en el miocardio del VD en pacientes fallecidos dentro de las 48 h posteriores a la TEP aguda, lo cual puede explicarse por los altos niveles de adrenalina liberados como resultado de la «miocarditis» inducida por TEP7. En virtud de esto, la insuficiencia aguda del VD, definida como un síndrome rápido, caracterizado por congestión vascular sistémica debido a una reducción del gasto del VD, representa un factor crítico de la gravedad clínica y evolución a la mortalidad por TEP7. En la figura 2 se observan los factores que contribuyen al colapso hemodinámico en pacientes con TEP.
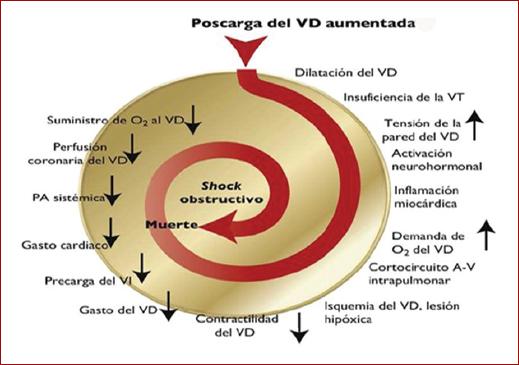
Figura 2 Factores que contribuyen al colapso hemodinámico y la muerte en tromboembolia pulmonar (tomado de Konstantinides et al., 201912). A-V: auriculoventricular; O2: oxígeno; PA: presión arterial; VD: ventrículo derecho; VI: ventrículo izquierdo; VT: válvula tricúspide.
Epidemiología
No se conoce la prevalencia exacta de la TEP. La mayoría se origina debido a una TVP de las extremidades inferiores, y aproximadamente el 50% de las TVP puede provocar una TEP silenciosa. En EE.UU., la incidencia estimada es de 100 a 200 casos por cada 100,000 personas, similar a la incidencia en partes de Europa. Cuando no se trata, puede tener una mortalidad de hasta el 25%, pero disminuye al 3% con tratamiento7. A pesar del tratamiento de la TEP, la mortalidad a los tres meses oscila entre el 15 y el 30%7,8. Esta mortalidad se atribuye a comorbilidades del paciente (malignidad subyacente, insuficiencia cardiaca, EPOC y edad avanzada). La incidencia varía de acuerdo con el sexo y la raza, siendo más habitual en hombres que en mujeres (56 vs. 48 por cada 100,000 personas) y la tasa de recurrencia también es mayor en los hombres7,8. Los hombres de raza negra tienen una mayor probabilidad de desarrollar TEV que los hombres blancos. Actualmente, se estima que la TEP es la causa de 100,000 muertes al año en EE.UU. y la TEV es la tercera causa más común de muerte cardiovascular en este país8,9.
Factores de riesgo
Existen múltiples factores de riesgo que pueden aumentar la probabilidad de desarrollar TEV (Tabla 2). Los factores de riesgo se dividen en dos categorías principales: heredados y adquiridos. Los factores de riesgo adquiridos se pueden subdividir en provocadores o no provocadores8. La naturaleza de los factores de riesgo provocadores es que, mientras están presentes, aumentan el riesgo de TEP durante un periodo finito, después del cual el riesgo vuelve a la línea de base. Por el contrario, con factores de riesgo no provocadores, el riesgo de TEV permanece elevado con el tiempo. La distinción entre factores provocadores y no provocadores es importante, ya que esto puede informar la estrategia de manejo a largo plazo8,9.
Tabla 2 Factores de riesgo predisponentes para el desarrollo de tromboembolia venosa (TEV)
| Factores de riesgo fuertes (OR > 10) |
|---|
| Fractura de miembro inferior |
| Hospitalización por IC o fibrilación/aleteo auricular (dentro de los 3 meses anteriores) |
| Reemplazo de cadera o rodilla |
| Trauma mayor |
| Infarto de miocardio (en los 3 meses anteriores) |
| TEV anterior |
| Lesión de la médula espinal |
| Factores de riesgo moderados (OR 2-9) |
| Cirugía artroscópica de rodilla |
| Enfermedades autoinmunes |
| Transfusión de sangre |
| Líneas venosas centrales |
| Catéteres y cables intravenosos |
| Quimioterapia |
| IC congestiva o insuficiencia respiratoria |
| Agentes estimulantes de la eritropoyesis |
| Terapia de reemplazo hormonal (depende de la formulación) |
| Fertilización in vitro |
| Terapia anticonceptiva oral |
| Periodo posparto |
| Infección (específicamente neumonía, tracto urinario, infección y VIH) |
| Enfermedad inflamatoria intestinal |
| Cáncer (mayor riesgo en la enfermedad metastásica) |
| Accidente cerebrovascular paralítico |
| Trombosis venosa superficial Trombofilia |
| Factores de riesgo débiles (OR < 2) |
| Reposo en cama > 3 días |
| Diabetes mellitus |
| Hipertensión arterial |
| Inmovilidad por estar sentado (p. ej., viajes prolongados en automóvil o avión) |
| Edad creciente |
| Cirugía laparoscópica (p. ej., colecistectomía) |
| Obesidad |
| Embarazo |
| Venas varicosas |
IC: insuficiencia cardiaca; OR: odds ratio, VIH: virus de la inmunodeficiencia humana.
Tomado de Konstantinides et al., 201912
Factores de riesgo heredados
Varios factores de riesgo genéticos incrementan el riesgo de TEV, frecuentemente alteraciones en la producción o actividad de factores de coagulación. Estos incluyen: factor V de Leiden, mutación del gen de la protrombina, deficiencia de antitrombina, deficiencia de proteína C, deficiencia de proteína S e hiperhomocisteinemia, entre otros, pero aun así solo explican una pequeña proporción de los casos de TEP9,10.
Factores de riesgo adquiridos
Se incluyen factores de estilo de vida, comorbilidades y procedimientos médicos. Algunos de estos provocan TEV de manera aguda (factores provocadores), mientras que otros incrementan el riesgo de por vida de un individuo de desarrollar TEV (factores no provocadores)10,11. Comúnmente, factores provocadores incluyen: cirugía, cáncer activo, inmovilización, embarazo, terapia de sustitución hormonal y catéteres vasculares permanentes. Por otro lado, los factores no provocadores incluyen: edad avanzada, insuficiencia venosa, obesidad, condiciones reumatológicas, síndrome antifosfolipídico, enfermedad cardiovascular, consumo de cigarrillo y TEV previa. Además, la combinación de factores de riesgo no provocadores y provocadores resulta de un incremento sustancial de desarrollar TEV en comparación a un factor en solitario11.
Manifestaciones clínicas
El espectro de presentación de TEP es variado, desde casos asintomáticos o levemente sintomáticos hasta casos en los que se presentan con inestabilidad hemodinámica con shock cardiogénico12. Cuando se presentan síntomas, estos son inespecíficos; en la mayoría de los casos, se sospecha de TEP en pacientes que presentan disnea, dolor torácico, presíncope/síncope o hemoptisis. La disnea puede ser aguda y grave en TEP masiva, mientras que en la TEP submasiva o periférica suele ser leve y transitoria (Tabla 3)12,13.
Tabla 3 Síntomas y signos de tromboembolia pulmonar
| Síntomas | % | Signos clínicos | % |
|---|---|---|---|
| Disnea | 80 | Taquipnea | 62 |
| Disnea de reposo | 60 | Taquicardia | 45 |
| Disnea de esfuerzo | 23 | Diaforesis | 9 |
| Ortopnea | 36 | Fiebre | 6 |
| Dolor pleurítico | 45 | Incremento del 2.º tono cardiaco | 15 |
| Dolor torácico no pleurítico | 27 | Ingurgitación yugular | 13 |
| Tos | 31 | Cianosis | 6 |
| Hemoptisis | 12 | Crepitantes | 14 |
| Síncope | 12 | Sibilancias | 18 |
| Mareo | 12 | Roncus | 5 |
| Dolor o edema en pantorrilla | 39 | Disminución del murmullo vesicular | 21 |
| Dolor o edema en muslo | 22 | Signos de TVP | 31 |
TVP: trombosis venosa profunda.
Tomado de García, 2012.
La inestabilidad hemodinámica, aunque rara, es importante, ya que indica TEP masiva con reserva hemodinámica reducida. El síncope se asocia con una prevalencia alta de esta y disfunción del VD11. En pacientes con patologías preexistentes como insuficiencia cardiaca o enfermedad pulmonar, el empeoramiento de la disnea puede ser el único síntoma de una TEP13. Además, el dolor torácico es un síntoma frecuente causado por irritación pleural por émbolos distales que causan infarto pulmonar. En TEP central, el dolor torácico es más característico de angina y refleja probablemente un proceso isquémico del VD13,14.
Además, la hipoxemia es frecuente, aunque hasta un 40% de pacientes tiene una saturación arterial de oxígeno normal; también suele haber hipocapnia. La radiografía de tórax frecuentemente es anormal, y aunque los hallazgos suelen ser inespecíficos en TEP, su utilidad radica para excluir otras causas de disnea o dolor torácico13,14.
Finalmente, los cambios electrocardiográficos serán indicativos de sobrecarga del VD: inversión de las ondas T en las derivaciones V1-V4, un patrón QR en V1, un patrón S1Q3T3 y bloqueo completo o incompleto de rama derecha se encuentran normalmente en los casos más graves de TEP. En casos leves la única alteración suele ser la taquicardia sinusal. Por último, las arritmias auriculares (fibrilación auricular) suelen estar asociadas con TEP aguda14 (Fig. 3).

Figura 3 Electrocardiograma de 12 derivaciones obtenido de un paciente con signos de hipertensión pulmonar que incluyen frecuencia cardiaca superior a 100, un patrón S1, Q3, T3 en las derivaciones I y III y las derivaciones precordiales V1-V4 muestran inversión de la onda T (tomado de Kline, 2017 11).
Diagnóstico
Ante la sospecha de un paciente con TEP se lleva a cabo una estrategia diagnóstica basada en la combinación de escalas de probabilidad clínica, exámenes paraclínicos (dímero D) y exámenes de imagen (angiografía pulmonar por tomografía computarizada [TC], V/Q planar o tomografía por emisión de fotón único [SPECT], ecocardiograma transtorácico, ultrasonido de compresión [USC]), cada una se describe a continuación.
Escalas de probabilidad clínica pretest
La combinación de síntomas y signos clínicos con la presencia de factores de riesgo predisponentes para TEV permite clasificar a los pacientes con sospecha de TEP en varias categorías de probabilidad clínica. Esta valoración se realiza mediante juicio clínico empírico o aplicando reglas de predicción14,15. Este incluye pruebas como radiografía de tórax y el electrocardiograma para el diagnóstico diferencial, pero debido a que no existe una estandarización del juicio clínico, se han desarrollado varias escalas de predicción clínica, de ellas las que más se utilizan son la de Ginebra y el score de Wells (Tabla 4)15. Independientemente de la escala que se utilice, la proporción de pacientes con TEP confirmada es de alrededor del 10% en categoría de probabilidad baja, un 30% en la categoría de probabilidad intermedia y un 65% en la categoría de probabilidad alta15.
Tabla 4 Escala de probabilidad clínica de Wells y de Ginebra
| Escala de Wells | Puntos | Escala de Ginebra | Puntos |
|---|---|---|---|
| TEP como primera posibilidad diagnóstica | 3 | Cirugía reciente | 3 |
| Signos de TVP | 3 | TEP o TVP previas | 2 |
| TEP o TVP previas | 1.5 | PaO2 (mmHg) < 48.7 48.7-59.9 60-71.2 71.3-82.4 |
4 3 2 1 |
| Frecuencia cardiaca > 100 lpm | 1.5 | ||
| Cirugía o inmovilización en las 4 semanas previas | 1.5 | PaCO2 (mmHg) < 36 36-38.9 |
2 1 |
| Cáncer tratado en los 6 meses previos o en tratamiento paliativo | 1 | Edad (años): 60-79 ≥ 80 | 1 2 |
| Hemoptisis | 1 | Frecuencia cardiaca > 100 lpm | 1 |
| Probabilidad clínica | Puntos | Atelectasias | 1 |
| Baja | 0-1 | Elevación del hemidiafragma | 1 |
| Intermedia | 2-6 | Probabilidad clínica | Puntos |
| Alta | ≥ 7 | Baja | 0-4 |
| Improbable | ≤ 4 | Intermedia | 5-8 |
| Probable | > 4 | Alta | ≥ 9 |
PaO2: presión arterial de oxígeno; PaCO2: presión parcial de dióxido de carbono en la sangre arterial; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
Dímero D
Es un producto de degradación de la fibrina, investigado en el diagnóstico de TEV. Los niveles de este aumentan en presencia de un coágulo agudo, pero también lo hace en una variedad de afecciones, como cáncer, inflamación, infección, insuficiencia renal crónica, embarazo, TEV previa y edad avanzada15.
Un nivel normal de dímero D hace que la TEP aguda sea poco probable. Dado que este se utiliza como prueba de exclusión, la sensibilidad de la prueba utilizada en un paciente es un tema crucial. Los ensayos ELISA (ensayo por inmunoabsorción ligado a enzimas) cuantitativos tienen la mayor sensibilidad (> 95%) y una especificidad del 40%. En el servicio de urgencias, un dímero D de ELISA negativo puede excluir TEP sin más pruebas en combinación con una probabilidad clínica poco probable16. Por lo tanto, la probabilidad clínica y el dímero D se utilizan en la mayoría de las estrategias diagnósticas como primer filtro, para evitar las imágenes torácicas. Por otro lado, la especificidad del dímero D para TEV es pobre. Por lo tanto, el dímero D no es útil para confirmar TEP16.
Angiografía pulmonar por tomografía computarizada
La angiografía pulmonar por tomografía computarizada (APTC) se ha convertido en el método de elección cuando se necesitan imágenes por sospecha de TEP. Permite la visualización directa de las arterias pulmonares hasta al menos el nivel segmentario tras la inyección intravenosa de medio de contraste yodado (Fig. 4)16,17. Muchos estudios prospectivos recientes proporcionan evidencia de que es seguro descartar la embolia pulmonar (EP) después de una APTC negativa. Aun es controvertido si los pacientes con una APTC negativa y una alta probabilidad clínica deben ser investigados más a fondo mediante USC venoso y/o gammagrafía de ventilación-perfusión o angiografía pulmonar17,18.
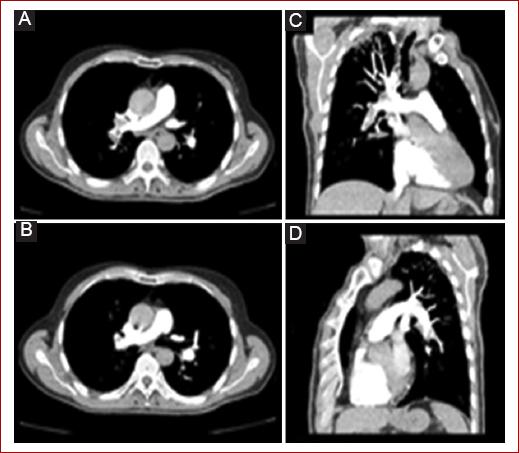
Figura 4 Tromboembolia pulmonar a nivel de arterias lobares derechas (A y B en vistas axial y coronal) e izquierdas (C y D en vistas axial y coronal) (tomado de Kruger et al., 2019 13).
Gammagrafía pulmonar de ventilación-perfusión (exploración V/Q)
Técnica no invasiva que permite un diagnóstico indirecto de TEP. Los resultados de la exploración V/Q se clasifican en tres categorías: normal, alta probabilidad y no diagnóstico. El alto valor predictivo negativo de una exploración V/Q normal ha sido confirmado por varios estudios y se reconoce como un criterio válido para excluir TEP18.
La exploración V/Q ha sido reemplazada por la APTC y sigue utilizándose en pacientes con una contraindicación para la APTC, con mayor frecuencia en pacientes con insuficiencia renal. También es importante señalar que la exploración V/Q es la prueba diagnóstica inicial de elección para descartar HPTEC en un paciente con síntomas persistentes y una ecografía cardiaca sospechosa después de una TEP inicial18.
Ultrasonografía de compresión
La ecografía de compresión de las venas de las extremidades inferiores es la principal herramienta diagnóstica de la TVP. Puede usarse en pacientes con sospecha de TEP. De hecho, la presencia de una TVP proximal es altamente predictiva de TEP, lo que permite descartar el diagnóstico de TEP sin imágenes torácicas adicionales (sensibilidad 41% y especificidad 96%)18.
Puede usarse en pacientes en los que la APTC está contraindicada o no es deseable, como en pacientes con insuficiencia renal, alergia a los medios de contraste yodados o mujeres embarazadas. Sin embargo, incluso si un USC positivo permite confirmar el diagnóstico de TEP y, por lo tanto, la necesidad de anticoagulación, la estratificación del riesgo de TEP con puntuaciones clínicas, ultrasonido (US) y/o biomarcadores sigue siendo necesaria18.
Otras pruebas de imagen para tromboembolia pulmonar
ANGIOGRAFÍA POR RESONANCIA MAGNÉTICA
A pesar de que el uso de la angiografía por resonancia magnética (ARM) podría superar algunos de los inconvenientes de la APTC, especialmente la exposición a la radiación y a los medios de contraste yodados, los datos sobre resultados no concluyentes y la falta de sensibilidad disminuyen el uso de la ARM como prueba para descartar TEP en la práctica clínica diaria. Además, la ARM no está tan ampliamente disponible como la APTC y los tiempos de adquisición son mucho más largos18,19.
TOMOGRAFÍA POR EMISIÓN DE FOTÓN ÚNICO DE VENTILACIÓN/PERFUSIÓN
La tomografía por emisión de fotón único de ventilación/perfusión (SPECT V/Q) proporciona imágenes tomográficas tridimensionales en lugar de imágenes planas. Estas permiten una mejor resolución de contraste y limitan la superposición de pequeños defectos de perfusión por parte del tejido normal. Estas ventajas deberían hacer que la SPECT V/Q sea superior a la V/Q planar para el diagnóstico de TEP16. Esta es tan precisa como la APTC y ambas modalidades son más precisas que la V/Q plana19.
VENOGRAFÍA POR TOMOGRAFÍA COMPUTARIZADA
Mediante una angio-TC se pueden visualizar las venas profundas de las piernas durante la toma de imágenes. Sin embargo, esta técnica no se ha validado lo suficiente y el valor adicional de la imagen venosa es escaso. Además, su uso se asocia con un aumento de la dosis de radiación19.
Con base en los procedimientos diagnósticos mencionados, se presenta en la figura 5 un algoritmo diagnóstico.

Figura 5 Algoritmo diagnóstico de tromboembolia pulmonar (TEP) (tomado de Righini et al., 2018 17). ATAC: angiotomografía axial computarizada; HBPM: heparina de bajo peso molecular; PERC: criterios para descartar embolia pulmonar (se toman en cuenta las siglas en inglés para Pulmonary Embolism Rule Out Criteria); SPECT: tomografía por emisión de fotón único; US EI: ultrasonido de extremidades inferiores; V/Q: ventilación/perfusión.
Manejo
El manejo en la fase aguda consiste en varias medidas dentro de las que se incluyen la asistencia hemodinámica y respiratoria, la anticoagulación inicial, el tratamiento de reperfusión y el uso de filtros de vena cava20.
Asistencia hemodinámica y respiratoria
La administración de oxígeno/ventilación, dada la hipoxemia debida al desajuste ventilación/perfusión, está indicada para pacientes con TEP y saturación de oxígeno del 90%; en caso de no existir una respuesta adecuada se puede explicar por la presencia de un foramen oval permeable con cortocircuito derecha-izquierda20,21. Se debe considerar la administración de oxígeno a alto flujo y/o ventilación mecánica en casos de inestabilidad hemodinámica severa; en el caso de usar esta última se debe tener cuidado para limitar efectos hemodinámicos adversos, el uso temporal de asistencia cardiopulmonar mecánica, fundamentalmente oxigenación por membrana extracorpórea (ECMO), puede ser útil para pacientes con TEP de riesgo alto y colapso circulatorio o parada cardiaca. El uso de ECMO se asocia con una alta incidencia de complicaciones y los resultados dependen tanto de la experiencia del centro como de la selección de los pacientes. Se debe considerar el aumento de riesgo hemorrágico relacionado con la necesidad de acceso vascular, particularmente en pacientes sometidos a trombólisis20,21.
Además, debido a que la TEP conlleva una insuficiencia ventricular derecha aguda y un bajo GC sistémico, siendo esta la causa principal de muerte de los pacientes con TEP, es necesario tratarla. Si la presión venosa central es baja, se podrá dar una carga de fluidos moderada (> 500 ml) durante 20 min, no se recomienda una expansión de volumen agresiva, ya que esta puede conllevar una mayor disfunción ventricular derecha y un menor GC sistémico19,20.
Con frecuencia se necesita usar vasopresores simultáneamente con el tratamiento de reperfusión o mientras se espera para llevarse a cabo, su uso se limita a pacientes en shock, se puede utilizar norepinefrina (0.2-1.0 ug/kg/min), que puede mejorar los parámetros hemodinámicos sin causar cambios en la resistencia vascular pulmonar, o dobutamina (2-20 ug/kg/min)19. Por último, en la parada cardiaca causada presumiblemente por TEP aguda se deben seguir las guías sobre soporte vital avanzado20.
Tratamiento anticoagulante
Ante un paciente con probabilidad media/alta de TEP se debe iniciar anticoagulación mientras se espera el resultado de las pruebas diagnósticas. Habitualmente, esto se realiza mediante el uso de heparina de bajo peso molecular (HBPM), fondaparinux o heparina no fraccionada (HNF), siendo los dos primeros preferibles debido a que conllevan un menor riesgo de hemorragia y trombocitopenia inducida por heparina, además de no requerir monitorización con niveles de concentración de anti-Xa21.
Actualmente, el uso de HNF se restringe a los pacientes con inestabilidad hemodinámica y está recomendada en pacientes con disfunción renal (depuración de creatinina [CrCl] < 30 ml/min) u obesidad grave y se ajusta por el tiempo de tromboplastina parcial activado. Además, si se prescribe HBPM a pacientes con CrCl de 15-30 ml/min se requiere un esquema de ajuste de dosis. La anticoagulación con HNF o HBPM debe continuarse durante al menos cinco días21. Como alternativa al tratamiento con heparina, se aprobaron dos nuevos anticoagulantes orales, los agentes anti-Xa rivaroxabán y apixabán, como régimen de anticoagulación en pacientes hemodinámicamente estables. Ambos mostraron eficacia (prevención de TEV sintomática o en disminución de la mortalidad por TEP) que no fue inferior a la de HBPM y se asocian con menos hemorragias graves. El tratamiento inicial con fármacos anti-Xa acorta la estancia hospitalaria sin aumentar las complicaciones21,22. Además, es importante controlar el riesgo de sangrado en pacientes que se someten a la terapia mencionada, para lo cual existen varios scores cuya utilidad ha sido determinada como son RIETE (Registro informatizado de la enfermedad tromboembólica en España; Computerized Registry of patients with Venous Thromboembolism), VTE-BLEED (Venous Thrombo-Embolism Bleed) o el PE-SARD, por último, un novedoso sistema de puntuación desarrollado por investigadores en Francia, la puntuación de riesgo de hemorragia por embolia pulmonar, anemia y disfunción renal (PE-SARD, por sus siglas en inglés), puede estimar el riesgo de hemorragia grave temprana en pacientes con EP aguda, según los resultados de un estudio reciente. En un estudio publicado en la revista Chest se comparó el nuevo sistema de puntuación de riesgo con VTE-BLEED, RIETE y BACS (Bleeding, Age, Cancer and Syncope), en donde se determinó que el PE-SARD exhibe un mejor rendimiento en comparación con los sistemas de puntuación existentes en el contexto de la TEP22,23.
TRATAMIENTO DE REPERFUSIÓN
Trombólisis sistémica
El tratamiento trombolítico en comparación con el uso de HNF actúa más rápidamente en la obstrucción pulmonar y disminuye así la PAP y la resistencia vascular; que se refleja con una reducción de la dilatación del VD en el ecocardiograma. Su mayor beneficio se observa cuando su uso se inicia en las primeras 48 horas desde la aparición de los síntomas (Tabla 5)21,22. Un ensayo aleatorizado (PEITHO) comparó la terapia trombolítica sistémica (tenecteplasa) más heparina con placebo más heparina en 1,005 pacientes con TEP aguda de riesgo intermedio-alto. La trombólisis resultó en una reducción en el criterio principal de valoración combinado de muerte o descompensación hemodinámica a los siete días en comparación con la heparina sola22,23.
Tabla 5 Fármacos trombolíticos utilizados en tromboembolia pulmonar (TEP)
| Molécula | Régimen | Contraindicaciones |
|---|---|---|
| rtPA | 100 mg durante 2 horas | Absolutas: Historia de ictus hemorrágico Ictus isquémico 6 meses anteriores Neoplasma en SNC Trauma importante, cirugía o trauma craneal 3 semanas antes Diátesis hemorrágica Hemorragia activa Relativas: AIT en los 6 meses anteriores Anticoagulación oral Embarazo Zonas de punción no comprimibles Reanimación traumática Hipertensión refractaria Enfermedad hepática avanzada Endocarditis infecciosa Úlcera péptica activa |
| 0.6 mg/kg durante 15 min (dosis máxima 50 mg) | ||
| Estreptocinasa | 250,000 UI como dosis de carga durante 30 min, seguido de 100,000 UI/h durante 12-24 horas. | |
| Régimen acelerado: 1.5 millones de UI durante 2 h | ||
| Urocinasa | 4,400 UI/kg como dosis de carga durante 10 min, seguido de 4,400 UI/kg/h durante 12-24 h | |
| Régimen acelerado: 3 millones de UI durante 2 h |
AIT: accidente isquémico transitorio; rtPA: alteplasa; SNC: sistema nervioso central.
Tomado de Konstantinides et al., 201912 .
Trombólisis dirigida por catéter
La reperfusión mecánica se basa en la introducción de catéter dirigido hacia las arterias pulmonares por vía femoral, hay varios tipos de catéteres para la fragmentación mecánica o aspiración de trombos22,23. Un metaanálisis de 28 con un total de 2,135 pacientes, el 53% de los cuales tenía TEP de riesgo intermedio, informó una mejora significativa en la hemodinámica cardiopulmonar con trombólisis dirigida por catéter asistida por ultrasonido (TCAUS). El único ensayo de trombólisis dirigida por catéter (TDC) que asignó al azar a los pacientes a TDC más anticoagulación o anticoagulación sola fue el ensayo ULTIMA22,23. A las 24 horas, en comparación con la anticoagulación convencional, la TCAUS dio como resultado una relación VD/VI mejorada estadísticamente significativa (diferencia de medias 0.3 frente a 0.03), lo que respalda un beneficio hemodinámico. A los 90 días no hubo diferencia en la mortalidad y no hubo eventos hemorrágicos mayores o hemorragia intracraneal (HIC) en ninguno de los grupos22,23. Además, en el ensayo SEATTLE II la TDC con TCAUS dio como resultado una reducción en la relación VD/VI media a 48 horas posteriores a la trombólisis, en comparación con el valor inicial. Por último, el ensayo OPTALYSE se diseñó posteriormente para optimizar las dosis y la duración de las infusiones de TCAUS-tPA (activador del plasminógeno tisular) donde todos los regímenes mejoraron significativamente la relación VD/VI (en aproximadamente un 24%) en comparación con el valor inicial22,23.
Embolectomía quirúrgica
Normalmente, se realiza con bypass cardiopulmonar, sin pinzamiento aórtico ni parada cardiaca, posteriormente se realiza la incisión de las dos arterias pulmonares más importantes y la retirada de trombos/émbolos. Se ha determinado que esta técnica en comparación con la trombólisis sistémica ha resultado más eficaz en casos de TEP grave debido a que la trombólisis se ha asociado a un riesgo mayor de ictus, reintervención a los 30 días y una tasa más elevada de TEP posterior22.
Filtros de vena cava
Los filtros de vena cava se utilizan con éxito para la prevención de la recurrencia de TEP solo si la anticoagulación está absolutamente contraindicada o en casos de recurrencia, a pesar de un tratamiento médico prescrito adecuadamente. Sin embargo, la colocación de un filtro en la vena cava inferior puede aumentar el riesgo de TVP de la pierna a largo plazo22. Siempre que se utilicen filtros en un paciente con factores de riesgo transitorios de TEP se debe colocar un dispositivo recuperable21,22.
Estrategia de tratamiento ajustada al riesgo en la fase aguda
Una herramienta para estratificar el riesgo es el Pulmonary Embolism Severity Index (PESI), el cual ha mostrado ser mayor que otras estrategias como el score Geneva22. El PESI es un sistema de clasificación de riesgo de muerte y resultados adversos secundarios a la presencia de TEP aguda confirmada, por medio del uso de parámetros clínicos, en la cual se establece una puntuación de la que se deriva un riesgo determinado, el cual a su vez se correlaciona con un desenlace a 30 días y orienta sobre quiénes, debido a su bajo riesgo, pueden recibir un manejo ambulatorio.
Tromboembolia pulmonar de alto riesgo
En virtud de la alta mortalidad temprana y el riesgo de complicaciones de TEP de alto riesgo, las guías existentes recomiendan que los pacientes que presentan hipotensión arterial persistente o shock necesitan tratamiento farmacológico primario inmediato o recanalización mecánica de las arterias pulmonares ocluidas. Por ende, los pacientes hemodinámicamente inestables con sospecha de TEP de alto riesgo deben recibir inmediatamente un bolo de HNF ajustado al peso, mientras se esperan los resultados de las pruebas diagnósticas adicionales; si se confirma la TEP, debe administrarse trombólisis sin demora. Si la trombólisis está contraindicada o ha fallado, la embolectomía quirúrgica o las intervenciones mediante catéter son alternativas valiosas23.
Tromboembolia pulmonar de riesgo intermedio
En los pacientes con TEP aguda sin deterioro hemodinámico la anticoagulación parenteral u oral es el tratamiento adecuado, además se debe indicar la hospitalización a pacientes normotensos con uno o más indicadores de aumento del riesgo relacionado con TEP o con comorbilidades. Monitorizar durante las primeras horas/días a los pacientes con signos de disfunción del VD sea en la ecocardiografía o angio-TC junto con una prueba de troponinas positiva debido al riesgo inmediato de descompensación hemodinámica que existe. No se recomienda el tratamiento de reperfusión primario sistemático, debido al riesgo de complicaciones hemorrágicas potencialmente mortales. El tratamiento trombolítico de rescate o la embolectomía quirúrgica o tratamiento percutáneo debe reservarse a pacientes que presentan signos de inestabilidad hemodinámica. Resulta coherente entonces manejar a los pacientes con TEP de riesgo intermedio con tratamiento anticoagulante con HBPM durante los primeros dos o tres días y realizar el cambio a anticoagulación oral siempre y cuando se encuentren estables23,24.
Tromboembolia pulmonar de bajo riesgo
En pacientes con TEP confirmada y una puntuación PESI baja (≤ 85 puntos), una puntuación PESI de 0 se puede considerar la hospitalización para el alta temprana y el tratamiento domiciliario, en vista del riesgo muy bajo de un resultado adverso temprano24.
Se puede considerar el alta temprana de un paciente con TEP aguda y continuación del tratamiento anticoagulante de manera ambulatoria siempre que se cumplan los siguientes tres criterios: a) riesgo de muerte precoz o complicaciones graves relacionadas con TEP bajo; b) ausencia de comorbilidad agravante, y c) el paciente puede recibir atención ambulatoria adecuada y tratamiento anticoagulante tomando en consideración la adherencia del paciente al tratamiento24,25.
Es importante mencionar que a pesar de que existen los manejos mencionados dependiendo el riesgo de la TEP, para la TEP de riesgo alto e intermedio no se ha esclarecido del todo cuál de todas las terapias resulta la más indicada24. En el 2012 se estableció el concepto PERT (Pulmonary Embolism Response Teams), el cual es un equipo multidisciplinario de expertos en el cuidado de la EP, con un proceso de activación único centralizado, que puede proporcionar una evaluación rápida y una estratificación del riesgo del paciente con EP, formular un enfoque de tratamiento individualizado y facilitar la implementación de la estrategia terapéutica recomendada24. Además, datos retrospectivos y prospectivos recientes han demostrado que la implementación de un PERT en una institución se asocia con una mayor utilización de terapias avanzadas de TEP, así como con mejores resultados. Es de destacar que esto se logra incluso cuando el PERT no participa activamente en todos los casos informados, lo que sugiere que existen beneficios de simplemente tener un PERT en funcionamiento en una institución, probablemente relacionado con una mayor conciencia y educación sobre la educación física después de la implementación del PERT24.
Tratamiento crónico y profilaxis secundaria extendida
La anticoagulación posterior a un episodio de TEP provocado por factores de riesgo transitorios puede suspenderse a los tres meses, con un riesgo aceptablemente bajo de recurrencia posterior23,24. El TEP no provocado conlleva un mayor riesgo de por vida de episodios recurrentes de TEV, que en la mayoría de los casos también se presentan como TEP. La tasa de recurrencia a largo plazo puede ser > 30% después de 8 a 10 años24,25.
Prolongar la anticoagulación de 6 a 18 meses no tiene ningún efecto sobre la prevalencia acumulada de TEV, reduce el riesgo de tromboembolia recurrente en aproximadamente un 80%, pero se asocia con un riesgo considerable de hemorragia mayor; la guía europea recomienda la continuación de terapia anticoagulante más allá de los tres meses en pacientes con TEV recurrente sin factores de riesgo reversibles, y se debe considerar en pacientes con un primer episodio de TEP sin factores de riesgo identificables o asociado a un factor de riesgo persistente23,24. Por lo tanto, la duración de la profilaxis secundaria debe determinarse individualmente y reevaluarse continuamente con la ayuda de puntajes específicamente desarrollados que predicen el riesgo de hemorragia en sobrevivientes de TEV con terapia anticoagulante estable, por ejemplo, la escala HERDOO-2 score, utilizada para determinar cuándo descontinuar la anticoagulación en mujeres con TEV no provocada previa (0-1: descontinuar anticoagulación, ≥ 2 y en hombres continuar)24,26. Si bien los pacientes con trombofilia de alto riesgo o cáncer activo son candidatos probables para la anticoagulación oral a largo plazo, otros pacientes (p. ej., obesidad, sedentarismo, terapia hormonal) podrían beneficiarse de intentar interrumpir la profilaxis secundaria26,27.
El aumento de los niveles de dímero D después de un mes de la interrupción de la profilaxis secundaria puede indicar un riesgo elevado de recurrencia y representa un argumento a favor de reanudar el tratamiento anticoagulante; por otro lado, es cuestionable si los anticoagulantes pueden suspenderse en pacientes con una prueba de dímero D negativa, ya que este escenario no parece excluir con seguridad la recurrencia25.
Por lo tanto, antes de decidir sobre la interrupción de la profilaxis secundaria, realizar una anamnesis enfocada y, posiblemente, un control electrocardiográfico de 24 horas. Los anticoagulantes orales directos (ACOD) pueden facilitar un tratamiento prolongado o incluso indefinido24,25.
Conclusiones
La TEP representa una patología con una importante tasa de morbilidad y mortalidad tanto a corto como a largo plazo que requiere un diagnóstico y tratamiento oportunos. Con la creciente disponibilidad de imágenes médicas rápidas y precisas que pueden detectar embolias pulmonares asintomáticas, la incidencia de EP parece estar aumentando. Los ACOD han ampliado las opciones de tratamiento disponibles y ahora se recomiendan como tratamiento anticoagulante de primera línea para la mayoría de los pacientes. Por lo general, la terapia trombolítica solo se administra a pacientes seleccionados en los que se ha confirmado el diagnóstico de TEP aguda, aunque existen excepciones (p. ej., durante la reanimación cardiopulmonar). Para los pacientes en los que se está considerando la terapia trombolítica, apoyamos un enfoque multidisciplinario (p. ej., equipo de respuesta a la TEP). El abordaje debe integrar varios factores clínicos que estratifiquen el riesgo de muerte por TEP aguda (riesgo bajo, intermedio, alto) y el riesgo de sangrado por el agente a usar.











 nueva página del texto (beta)
nueva página del texto (beta)


