Introducción
Con la creciente prevalencia de enfermedades cardiovasculares, el uso de injertos vasculares ha aumentado sustancialmente durante la última década1. Sin embargo, estos injertos no están exentos de complicaciones, ya que se acompañan de un riesgo de infección del 0.5 al 6%. A pesar de que se desconocen las estadísticas en México y en Latinoamérica2, se sabe que la morbilidad asociada con la infección del injerto protésico es alta. En el caso de las prótesis vasculares periféricas, se ha reportado una morbilidad de hasta el 41%, que en su mayoría resulta en amputación, con una mortalidad atribuible del 17%. En los injertos vasculares aórticos se observó una tasa de mortalidad del 24 al 75%, con una tasa de supervivencia a los 5 años < 50%3.
La infección del injerto vascular (IIV) representa una carga económica significativa4. En los EE.UU. se calcula que la incidencia anual de las infecciones de heridas quirúrgicas es del 2 al 5%; el sobrecosto de estas oscila entre 10,000 y 90,000 dólares por paciente, provoca una estancia hospitalaria adicional de 7 a 10 días promedio y tiene de 2 a 11 veces más riesgo de morbilidad. Desafortunadamente en México, las infecciones de sitio quirúrgico (ISQ) son causa frecuente de estancias prolongadas e incremento en morbilidad y mortalidad y la información epidemiológica en este rubro es escasa y fluctuante. Se ha identificado que en México la incidencia de ISQ varía entre el 9 y el 46%, dependiendo del tipo de institución de salud, nivel socioeconómico y escolaridad del paciente5. Debido a las consecuencias de la infección en la cirugía vascular y la creciente resistencia de los microorganismos causantes, la estrategia para enfrentar las complicaciones infecciosas debe enfocarse en la prevención primaria de estas, con la finalidad de no depender del tratamiento con antibióticos sistémicos una vez manifiesta la infección6.
El diagnóstico de IIV generalmente se relaciona con hallazgos clínicos, estudios de imagen y exámenes microbiológicos7. De acuerdo con los hallazgos clínicos en infección de heridas, encontramos diversas herramientas para su clasificación8. La clasificación de Szilagyi y la clasificación de Samson consideran específicamente el compromiso del injerto vascular, mientras que la extensión de la afectación por tipo y sitio del injerto se puede describir mediante la clasificación de Bunt (Tabla 1)7-9. Además, la IIV también se puede dividir en inicio temprano (< 4 meses) o tardío (> 4 meses)9.
Tabla 1 Clasificaciones de infecciones de heridas e injertos vasculares con respecto a la infección de heridas (Szilagyi, Samson) y al grado de afectación del injerto (Bunt)
| Clasificación de Szilagyi |
| Grado I: celulitis que afecta a la herida |
| Grado II: infección que afecta al tejido subcutáneo |
| Grado III: infección que afecta a la prótesis vascular |
| Clasificación de Samson |
| Grupo 1: no más profundo que la dermis |
| Grupo 2: tejido subcutáneo, sin contacto directo con el injerto |
| Grupo 3: cuerpo del injerto, pero no anastomosis |
| Grupo 4: anastomosis expuesta, sin sangrado, sin bacteriemia |
| Grupo 5: anastomosis comprometida, hemorragia, bacteriemia |
| Grado de afectación del injerto (clasificación de Bunt modificada) |
| Infección del injerto periférico |
| Infección del injerto P0: infección de un injerto cavitario (p. ej., arco aórtico, interposición aórtica abdominal y torácica, infecciones del injerto aortoilíaco, aortofemoral, iliofemoral) |
| Infección del injerto P1: infección de un injerto cuyo curso anatómico completo no es cavitario (p. ej., carótido-subclavia, axiloaxilar, axilofemoral, femorofemoral, femorodistal, injerto de puente de acceso para diálisis) |
| Infección del injerto P2: infección de la porción extracavitaria de un injerto cuyo origen es cavitario (p. ej., segmento inguinal infectado de un injerto aortofemoral o toracofemoral, infección cervical de un injerto aortocarotídeo) |
| Infección del injerto P3: infección que implica una angioplastia con parche protésico (p. ej., endarterectomía carotídea y femoral con cierre con parche protésico) |
| Erosión entérica del injerto |
| Fístula injerto-entérica |
| Sepsis del muñón aórtico después de la extirpación de un injerto aórtico infectado |
Múltiples factores de riesgo contribuyen a la IIV: hospitalización preoperatoria prolongada, infección en un sitio remoto o adyacente, acceso arterial percutáneo reciente en el lugar del implante, procedimiento de emergencia/urgencia, reintervención, infección de las extremidades inferiores, incisión en la ingle, incumplimiento de la técnica aséptica, tiempo de operación prolongado, procedimiento gastrointestinal o genitourinario concomitante, complicaciones postoperatorias de la herida y trombosis del injerto9,10.
Los patógenos responsables son las bacterias grampositivas hasta en el 58% de las IIV (incluidos los enterococos, Staphylococcus aureus y estafilococos coagulasa negativos); las bacterias gramnegativas (Escherichia coli, Pseudomonas aeruginosa, Proteus sp. y neumonía por Klebsiella) representan aproximadamente el 34% de las IIV y los anaerobios el 8%11. Aunque muchas arterias enfermas pueden albergar bacterias dentro de la placa aterosclerótica o trombo mural, el inóculo y la virulencia se consideran bajos12. La susceptibilidad de las bacterias a los pocos antibióticos que exhiben una actividad sostenida en el entorno de una biopelícula (p. ej., combinaciones con rifampicina para infecciones de implantes estafilocócicos) es otro elemento que puede conducir a una reinfección en pacientes tratados por IIV13.
De acuerdo con las guías actuales, para una profilaxis antibiótica eficaz se debe administrar una cefalosporina de primera o segunda generación (cefazolina, basada en el peso, por vía intravenosa [IV] antes del procedimiento, y repetida si el procedimiento dura más de 3 horas o si la pérdida de sangre es > 1,5 l; cefuroxima 1,5 g IV 60 minutos antes de la cirugía y cada 12 horas hasta un total de 6 g, sola o junto con un glucopéptido (vancomicina) o un lipopéptido (daptomicina)13. Se debe proporcionar profilaxis tanto para bacterias grampositivas como gramnegativas. No se recomienda el uso de daptomicina o vancomicina solas. Si el paciente es alérgico a las cefalosporinas, el aztreonam es un sustituto adecuado14.
La terapia antimicrobiana es una parte integral del tratamiento de las IIV. En la fase aguda está indicada la terapia antimicrobiana intensiva con antibióticos de amplio espectro. En la elección de la terapia antimicrobiana, se debe considerar el material del injerto que puede estar cubierto con una biopelícula y también la epidemiología local de los patrones de resistencia antimicrobiana15. No hay consenso sobre la duración óptima de la terapia antimicrobiana. Si se puede retirar el material protésico y realizar un desbridamiento completo de todo el tejido infectado, está indicado un mínimo de dos semanas de terapia intravenosa, si es posible, seguida de un régimen oral durante otras dos a cuatro semanas. Si el material infectado se reemplaza por un nuevo injerto vascular, se proponen de cuatro a seis semanas de terapia antimicrobiana intensiva16.
Dado que existe escasa información en México acerca de los microorganismos asociados con IIV, el objetivo de este trabajo fue caracterizar (de acuerdo con la frecuencia de grampositivos y gramnegativos) a los microorganismos asociados a infecciones de injerto vascular intervenidos en el Hospital de Especialidades Antonio Fraga Mouret (HECMNR) en el periodo comprendido de marzo de 2015 a febrero de 2021 con la finalidad de encontrar un patrón en las infecciones de injertos vasculares y, a partir de ello, poder proponer nuevos estudios prospectivos comparativos para determinar la mejor pauta para profilaxis en nuestro hospital.
Material y métodos
Se realizó un estudio observacional, transversal, retrolectivo, descriptivo que incluyó a todos los pacientes diagnosticados con infección de injerto vascular posterior a tratamiento de revascularización con material autólogo o protésico del Servicio de Angiología y Cirugía Vascular del HECMNR. Se incluyeron 47 pacientes que cumplieron los criterios de inclusión (pacientes mayores de 18 años de edad, diagnosticados con infección de injerto vascular posterior a tratamiento de revascularización con material autólogo o sintético, que fueron hospitalizados y con expediente médico localizable completo). Los criterios de exclusión incluyeron a pacientes con diagnóstico de infección de injerto vascular no hospitalizados, con infección activa en cualquier otro sitio al momento del procedimiento de revascularización y aquellos con diagnóstico de infección de cualquier etiología que se encontrara bajo tratamiento antibiótico. El criterio de eliminación correspondió a los pacientes que no contaban con cultivo de sitio de infección de injerto vascular. Se realizó una revisión de expedientes clínicos, se utilizó un instrumento de recolección de datos con el que se determinaron las características sociodemográficas y tipo de revascularización ya sea con injerto autólogo o sintético; microorganismo causante, antibiograma y tratamiento profiláctico otorgado.
Análisis estadístico
Para el análisis estadístico se utilizó el software Graph Pad Prism versión 7. Se realizó el análisis de frecuencias de todas las variables junto con las medidas de tendencia central y dispersión para las variables cuantitativas. Posteriormente se realizó el análisis inferencial con chi cuadrada o prueba exacta de Fisher según el caso, con el cálculo de los odds ratios (OR) respectivos. Se utilizó un intervalo de confianza del 95% (IC 95%) y se consideró el valor de p menor a 0.05 como estadísticamente significativo.
Resultados
Análisis demográfico
La media de edad de los pacientes incluidos en el estudio fue 59.09 ± 18.3, con rango de 12 a 87 años. El 53.19% de los pacientes fueron hombres y el 46.81% mujeres. La figura 1 muestra la distribución de los pacientes por edad.
Las infecciones de injerto vascular se asocian con microorganismos gramnegativos
En la tabla 2 se observa la distribución por frecuencias de los procedimientos que se encontraron asociados a IIV, tipos de injerto utilizados, microorganismos aislados, sensibilidad y resistencia antibiótica, tiempo de evolución de la infección y las clasificaciones de Szilagyi, Bunt y Samson.
Tabla 2 Análisis de frecuencias
| Procedimientos | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| FAVI AC | FAVI FEM | AORTOBIFEM | Aortoilíaco | AXILO BIFEM | Axilohumeral | FEM FEM | FEM POP | FEM TTP | HUM HUM | ILIO FEM | |
| Frecuencia | 8.5% | 6.4% | 10.6% | 6.4% | 8.5% | 2.13% | 8.5% | 36.2% | 2.12% | 4.25% | 6.4% |
| Tipo de injerto | |||||||||||
| Autólogo | Sintético | ||||||||||
| Frecuencia | 14.9% | 85.1% | |||||||||
| Clasificación de Szilagyi | |||||||||||
| Grado 1 | Grado 2 | Grado 3 | |||||||||
| Frecuencia | 2.13% | 34.04% | 63.83% | ||||||||
| Clasificación de Bunt | |||||||||||
| P0 | P1 | P2 | P3 | ||||||||
| Frecuencia | 4.25% | 76.6% | 19.15% | 0 | |||||||
| Clasificación de Samson | |||||||||||
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | ||||||||
| 2.13% | 31.91% | 48.93% | 17.03% | ||||||||
| Tiempo de evolución | |||||||||||
| Temprana | Tardía | ||||||||||
| Frecuencia | 89.3% | 10.7% | |||||||||
| Microorganismo aislado | |||||||||||
| Acinetobacter baumannii | Escherichia coli | Enterococcus faecalis | Klebsiella pneumoniae | Citrobacter freundii | Pseudomonas aeruginosa | Staphylococcus aureus | Staphylococcus epidermidis | Proteus mirabilis | Aeromonas caviae | ||
| Frecuencia | 2.13% | 42.55% | 8.5% | 34% | 2.13% | 17% | 12.7% | 2.13% | 2.13% | 2.13% | |
| Profilaxis antibiótica | |||||||||||
| Clindamicina 900 mg | Cefuroxima 1.5 g | ||||||||||
| Frecuencia | 8.5% | 91.5% | |||||||||
| Sensibilidad antibiótica | |||||||||||
| Ciprofloxacino | Gentamicina | Meropenem | Colistina | Imipenem | Levofloxacino | Vancomicina | Tigeciclina | ||||
| Frecuencia | 6.4% | 2.13% | 72.3% | 2.13% | 8.5% | 4.25% | 8.5% | 14.9% | |||
| Resistencia antibiótica | |||||||||||
| TMP/SMX | Nitrofurantoína | Ceftazidima | Ciprofloxacino | Ceftriaxona | Ampicilina | Gentamicina | Multirresistente | ||||
| Frecuencia | 55.3% | 23.4% | 6.4% | 10.6% | 8.5% | 8.5% | 2.13% | 2.13% | |||
FAVI AC: fístula arteriovenosa interna antecubital; FAVI FEM: fístula arteriovenosa interna femoral; AORTO BIFEM: aorto-bifemoral; AXILO BIFEM: axilo-bifemoral; FEM FEM: fémoro-femoral; FEM POP: fémoro-poplíteo; FEM TTP: fémoro-tronco tibio peroneo; HUM HUM: húmero-humeral; ILIO FEM: iliofemoral; TMP/SMX: trimetoprima/sulfametoxazol.
El procedimiento que se realizó con más frecuencia en estos pacientes fue la derivación femoropoplítea (36.2%), el tipo de injerto más utilizado fue el sintético (85.1%); en cuanto a la clasificación de Szilagyi, fue más frecuente encontrar pacientes en grado 3 (63.83%), y más frecuente P1 en la clasificación de Bunt (76.6%), así como el grado 3 en la clasificación de Samson (48.93%). Las IIV se presentaron de forma temprana en el 89.3%. Los microorganismos que se aislaron con más frecuencia fueron los gramnegativos: E. coli (42.55%) y Klebsiella pneumoniae (34%). La profilaxis antibiótica más utilizada fue cefuroxima 1.5 g, en el 91.5% de los pacientes. Los microorganismos aislados fueron más sensibles a meropenem en el 72.3% de los casos y resistentes a trimetoprima con sulfametoxazol (TMP/SMX) en un 55.3% de los pacientes.
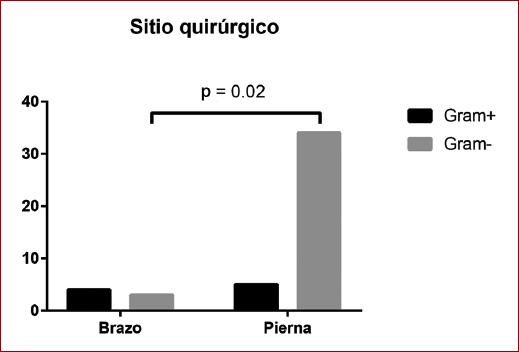
Los injertos vasculares colocados en extremidades pélvicas tienen mayor riesgo de infección por microorganismos gramnegativos
Para el análisis inferencial, se dicotomizó la variable «microorganismos» en grampositivos y gramnegativos y se realizó la asociación entre estos y el resto de las variables cualitativas dicotomizadas como se muestra en la tabla 3. De acuerdo con el análisis de chi cuadrada o prueba exacta de Fisher, se encontró una asociación significativa entre el sitio quirúrgico (brazo o pierna) y el microorganismo involucrado (OR: 9.07; IC 95%: 1.80-41.7; p = 0.02) (Fig. 2). No se encontró asociación significativa entre el tipo de microorganismo y el tiempo de evolución, el tipo de injerto utilizado, la clasificación de Bunt y la clasificación de Szilagyi (Tabla 3).
Tabla 3 Análisis inferencial
| Microorganismo (gram + o gram -) vs. | OR, IC 95% | p |
|---|---|---|
| Sitio quirúrgico (brazo o pierna) | 9.07, 1.8-41.7 | 0.02 |
| Tipo de injerto (autólogo o sintético) | 0.66, 0.052-6.001 | > 0.99 |
| Clasificación de Bunt (P0 o P1, P2, P3) | 0.35, 0.03-2.51 | 0.66 |
| Clasificación de Szilagyi (grados 1 y 2 o grado 3) | 0.86, 0.21-3.53 | > 0.99 |
OR: odds ratio; IC 95%: intervalo de confianza del 95%.
Discusión
Hasta donde conocemos, este es el primer estudio en un hospital mexicano en el que se caracterizaron y analizaron los microorganismos más frecuentemente asociados a infecciones de injerto vascular y su relación con el tipo de procedimiento, la gravedad de la infección y la sensibilidad antibiótica. El hallazgo más importante fue la alta frecuencia de IIV por microorganismos gramnegativos, que contrasta con los resultados de estudios previos realizados en Europa Occidental y EE.UU., donde la incidencia de IIV por grampositivos alcanza el 65% de los casos. Generalmente, estas infecciones por grampositivos se han asociado con microorganismos propios de la microbiota de la piel y cursan con mejor pronóstico. Por el contrario, en este estudio se encontró que las infecciones ocasionadas por microorganismos gramnegativos también tuvieron una mayor gravedad (Szilagyi II y III y Samson II y III), así como una alta tasa de resistencia y escasa sensibilidad a antibióticos que pueden administrarse por vía oral; lo que sugiere un incremento considerable en los días de estancia intrahospitalaria y en los costos para el tratamiento de estas infecciones.
En este estudio, la IIV puede deberse principalmente a factores preoperatorios y cuidados postoperatorios, sin dejar de recalcar que los patógenos responsables de estas infecciones presentan una variedad particular en cada unidad hospitalaria, con una diferente tasa de sensibilidad y resistencia a los antibióticos. Sin embargo, resalta el hallazgo del sitio quirúrgico (extremidades pélvicas) como factor de riesgo para infecciones por microorganismos gramnegativos. Es probable que los cuidados postoperatorios (higiene) sean deficientes en este sitio quirúrgico, lo que pudiera relacionarse con infecciones por este tipo de bacterias.
Igualmente, en contraste con la literatura, se encontró que el procedimiento con mayor frecuencia de IIV es la derivación femoropoplítea, en comparación con la derivación axilo-femoral, que es el primer procedimiento en el que se encuentra IIV de acuerdo con la literatura. Este hallazgo puede deberse a que la derivación femoropoplítea es uno de los procedimientos de revascularización que se realizan con mayor frecuencia en el centro hospitalario donde se llevó a cabo el estudio.
Cabe destacar que el tipo de injerto utilizado que presentó infección de forma más frecuente fue el sintético (politetrafluoroetileno y poliéster), lo que demuestra un beneficio más en el uso de injertos autólogos para disminuir la incidencia de infecciones de injerto vascular.
El estudio presenta limitaciones, como un posible sesgo de supervivencia debido a que a la mayoría de los pacientes incluidos se les administró profilaxis para grampositivos, con lo que puede prevenirse de forma efectiva la infección por ese tipo de microorganismos y por ello se identificaron en mayor proporción bacterias gramnegativas en la muestra. También hay que considerar un posible sesgo al haber incluido únicamente a pacientes con IIV hospitalizados, los cuales presentan infecciones más graves y es más frecuente que sean ocasionadas por bacterias gramnegativas.
A pesar de lo anterior, este estudio plantea nuevas posibilidades para la investigación en este campo, y, principalmente para el cambio de pautas de profilaxis antibiótica (ya que en este centro hospitalario solo se otorga profilaxis contra microorganismos grampositivos), que incluya protección contra gramnegativos y, de esta manera minimizar la morbilidad y los costos asociados al tratamiento de IIV.
Conclusiones
En este estudio se encontró que los microorganismos más frecuentemente asociados a IIV en pacientes sometidos a revascularización en miembros pélvicos son los gramnegativos, por lo que se sugiere la posibilidad de establecer nuevas pautas de profilaxis antibiótica contra estos patógenos con el fin de minimizar las complicaciones infecciosas, las estancias hospitalarias prolongadas y los costos asociados al tratamiento de estas.
Por otro lado, el riesgo de infección por microorganismos grampositivos es mayor en procedimientos realizados en miembros torácicos, lo que plantea la necesidad de mejorar la profilaxis que ya se lleva a cabo en estos pacientes para prevenir IIV por dichos microorganismos.











 nueva página del texto (beta)
nueva página del texto (beta)