Introducción
El brote de enfermedad por coronavirus (COVID-19) fue notificado por primera vez en Wuhan, China, el 31 de diciembre de 2019 y declarada por la Organización Mundial de la Salud (OMS) como pandemia el 11 de marzo de 2020. Desde entonces, los sistemas de salud han requerido adaptación para proveer atención a los pacientes infectados y continuar con el tratamiento de patologías endémicas en la población1-5.
Es altamente probable que los meses siguientes a este tercer brote por pandemia se tenga que vivir una época de «convivencia» más o menos prolongada con la COVID-19, generando el problema de la puesta en marcha de la actividad quirúrgica, teniendo un gran impacto en muchos pacientes, sobre todo los que sufren enfermedad tromboembólica venosa y enfermedad arterial periférica6-10.
La trombosis venosa profunda (TVP) es frecuente en pacientes con infección por coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2), causante de la COVID-19, y se caracteriza por una respuesta inflamatoria que puede conducir a manifestaciones graves10-12.
Múltiples marcadores de coagulación apoyan esto, la COVID-19 puede considerarse un factor de riesgo de trombosis; las alteraciones del endotelio, flujo y de la función plaquetaria nos conducen a trombosis venosas y arteriales12. Efectos semejantes a los de la influenza de 1918, una trombosis pulmonar generalizada, describiéndose la formación de trombos como la principal causa en estos casos13-15.
Métodos
Estudio retrospectivo, descriptivo y observacional, llevado a cabo en el Servicio de Angiología y Cirugía Vascular del Hospital General de México (HGM), de los pacientes atendidos por nuestro servicio con diagnóstico de TVP en un periodo comprendido entre el 1 de abril y el 31 agosto de 2020, a los cuales se les realizó ultrasonido en modo B, color y Doppler pulsado, en busca de ausencia de compresibilidad venosa, defectos intraluminales y ausencia de flujo fáscico. Se analizaron factores de riesgo de un total de 83 pacientes, 23 correspondieron a pacientes con trombosis COVID positiva y 60 con trombosis COVID negativa. Se incluyeron todos los pacientes, datos demográficos y los eventos de morbilidad, excluyéndose los pacientes con expedientes incompletos.
Una vez recabados los datos en Microsoft Excel se realizó un análisis de frecuencia y se graficó. Después de haber identificado a los pacientes COVID positivos y negativos en nuestro sistema de interconsultas, revisamos los expedientes clínicos y se analizaron variables como edad, sexo, comorbilidades, factores de riesgo, complicaciones, región y segmento anatómico. La mayoría de los pacientes por los que nos interconsultaron estaban siendo manejados por servicios de urgencias, medicina interna y cirugía general hasta su manejo definitivo, ya que no contaban con requisito de manejo específico por parte de nuestro servicio según el protocolo hospitalario.
Igualmente presentamos las complicaciones más graves en este grupo de pacientes, tromboembolia pulmonar (TEP) y flegmasías, que reflejan las condiciones de suma importancia en la enfermedad tromboembólica.
Una vez recopilada y organizada toda la información con formularios de Google forms, se realizó la suma de la base de datos y se reflejó en tablas de Microsoft Excel, presentando gráficas para su análisis.
Resultados
Podemos decir que la influencia del sexo femenino en este estudio es relevante, la mayoría de nuestros pacientes fueron mujeres (n = 51; 61.4%), un total de hombres de 32 (38.5%); edad media de 65 años; con un total de 23 (27.7%) para los pacientes COVID positivos y 60 (72.2%) COVID negativos.
De los 83 pacientes, 10 de los casos presentaron una TVP bilateral, en general 93 extremidades inferiores, fueron valoradas en este estudio para ambos grupos, 26 (27.9%) extremidades en paciente COVID positivos y 67 (72%) COVID negativos.
El miembro pélvico izquierdo y segmento iliofemoral representan la mayoría de los casos, 43 (51.8%) y 67 (87%) respectivamente. Con un total de 124 segmentos anatómicos, que corresponden a segmento iliofemoral 67 (54%), femoropoplíteo 41 (33%), vasos tibiales 13 (10.4%) y vena cava 3 (2.4%) (Figs. 1 y 2).
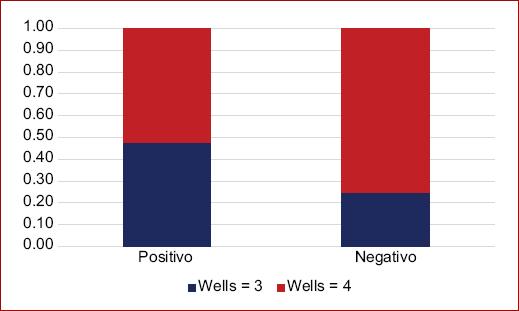
El puntaje de Wells más alto (> 4 puntos) para el grupo no COVID, reportando 45 (75%), y para el grupo COVID positivo 12 (52.1%) de los casos (Fig. 3, Tabla 1).
Tabla 1 Escala de probabilidad clínica de trombosis venosa profunda de Wells*
| Característica clínica | Puntos |
|---|---|
| Cáncer activo (tratamiento en curso o en los últimos seis meses, o paliativo) | 1 |
| Parálisis, paresia o reciente inmovilización de las extremidades inferiores | 1 |
| Reciente encamamiento > 3 días o cirugía mayor (último mes) | 1 |
| Hipersensibilidad localizada en la distribución de las venas profundas | 1 |
| Edema de una extremidad | 1 |
| Hinchazón de la pantorrilla > 3 cm respecto de la asintomática (medida 10 cm por debajo de la tuberosidad tibial) | 1 |
| Edema (con fóvea) en la pierna sintomática | 1 |
| Venas superficiales complementarias (no varicosas) | 1 |
| Diagnóstico alternativo verosímil | 2 |
*Alta probabilidad ≥ 3; moderada = 1-2; baja = 0.
En relación con comorbilidades en pacientes con diabetes mellitus, la frecuencia para COVID positivos 6 (0.19), neumopatías 1 (0.03), enfermedad venosa 2(0.06) e hipertensión arterial 3 (0.10), siendo la comorbilidad más frecuente en ambos grupos la diabetes mellitus (Fig. 4). En cuanto a los factores de riesgo para COVID positivo, la inmovilización durante la hospitalización y condiciones relacionadas con otra patología presenta una frecuencia de 15 casos (83%), hospitalización 16 (88.8%), historia de trombosis 8 (44.4%), obesidad 8 (44.4%) y tabaquismo 8 (44.4%); la frecuencia mayor para ambos grupos en relación con factores de riesgo fue la inmovilización, representando una frecuencia total COVID positiva y negativa 0.20 y 0.17 (Fig. 5).
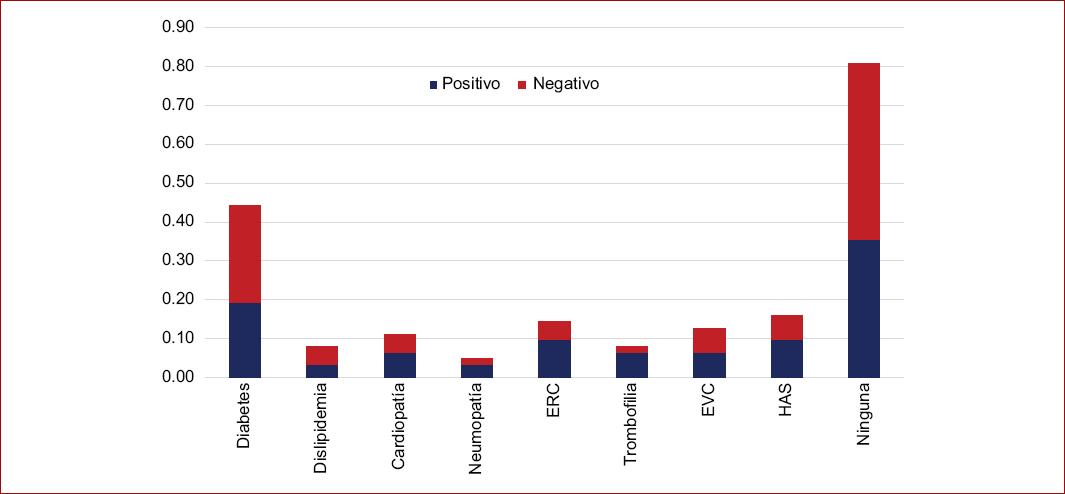
Figura 4 Frecuencia de comorbilidades en pacientes con y sin enfermedad por coronavirus 2019. ERC: enfermedad renal crónica; EVC: enfermedad cardiovascular; HAS: hipertensión arterial sistémica.
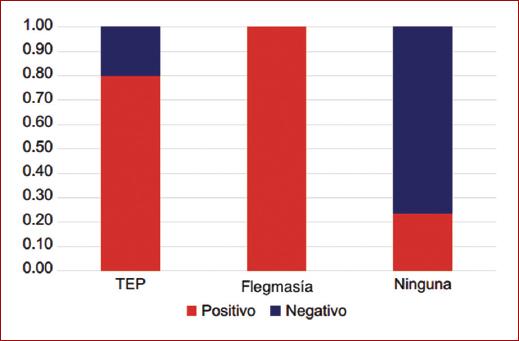
De los 83 pacientes estudiados se encontró que las complicaciones asociadas a la TVP fueron TEP 5 (6%) y para la flegmasía 2 (2.4%) (Fig. 6).
Discusión
Las infección por el SARS-CoV-2 (COVID-19) podría estar entre aquellas con mayor riesgo de sufrir complicaciones y agravamiento de enfermedades crónicas debido al extenso daño endotelial que produce estados de hipercoagulabilidad y sistema inmunitario atenuado16,17.
Un estudio anterior mostró que el 40% de los pacientes tenían un alto riesgo de desarrollar trombosis venosa, varios factores de riesgo de trombosis venosa como inmovilización, ventilación mecánica e infección podrían observarse en pacientes con COVID-19. Por lo tanto, el diagnóstico de TVP es imperativo para una clínica óptima18-20.
De acuerdo con los resultados obtenidos en nuestro estudio y comparados con lo descrito en la literatura, se presentó la frecuencia y factores de riesgo de trombosis venosa en pacientes con COVID-19. En nuestro servicio la ecografía con la utilización del Doppler demostró también que la ausencia de compresibilidad y la ausencia del flujo espontáneo era el hallazgo más fundamental para los residentes de angiología que practicaron el estudio y por el cual se guiaron esencialmente para llegar al diagnóstico, ya que los defectos intraluminales son difíciles de valorar en esta fase. En relación con los hallazgos ecográficos, los 83 pacientes tratados por TVP que se sometieron a rastreo Doppler venoso de miembros inferiores dieron positivo 78 (94.3%) en su primera valoración, mientras que en 5 (5.7%) de nuestros pacientes no fue posible realizar estudio por las condiciones hemodinámicas durante su visita inicial, posponiéndose su valoración a las 24 y 48 horas, donde confirmamos el diagnóstico. Es posible que ocurran más episodios de TVP durante toda la hospitalización, sin embargo nuestra valoración depende de la solicitud de interconsulta por parte del médico tratante. Aunque al menos el 87% de los pacientes necesitaba un examen ultrasonográfico en serie, no siempre estaba disponible debido a recursos médicos limitados21-23.
En particular, la ubicación de la trombosis venosa fue principalmente encontrada en las venas proximales (íleo femoral) de miembro pélvico izquierdo24,25.
Los análisis multivariantes mostraron que un alto nivel de dímero D se asocia como factor de riesgo para TVP, describiendo la fuerte asociación entre niveles altos de dímero D y TVP25-27. Esto puede haber sido atribuido a un síndrome de respuesta inflamatoria sistémica para la activación de coagulación sanguínea, detectada con alto contenido de fibrinógeno26,27.
En nuestro estudio incluimos casos confirmados a COVID-19, referidos de otra unidad hospitalaria, pacientes que habían recibido algún otro tipo de tratamiento por trombosis venosa, ya fuera médico o quirúrgico. Los pacientes incluidos fueron a solicitud de interconsulta de servicios como unidad de urgencias, triaje respiratorio, hospitalizados en unidades de cuidados intensivos (UCI) y diferentes servicios del HGM.
Los factores de riesgo de TVP pueden ser transitorios o persistentes, aumentando el riesgo de tromboembolia venosa al inducir hipercoagulabilidad, estasis, daño o disfunción de la pared vascular27,28. El diagnóstico se puede excluir con seguridad si los niveles de dímero D son normales.
Además, la inmovilización y el cáncer son factores de riesgo para comorbilidades. Sin embargo, la comorbilidad no se asoció con TVP como factor de riesgo en nuestro estudio.
Informes anteriores han revelado que los pacientes con COVID-19 pueden rápidamente desarrollar enfermedades críticas, causando un alto nivel de respuesta inflamatoria, insuficiencia renal, insuficiencia respiratoria y disfunción hepática28,29.
La malignidad es el factor desencadenante más común de las flegmasías y está presente en aproximadamente el 20 al 40% de los pacientes. Aunque es poco común, es importante identificar a los pacientes con TVP iliofemorales masivas acompañadas de trombosis venosa superficial, ya que puede producir flegmasía cerúlea dolens, aumentando la presión venosa hasta el punto en el que la perfusión arterial de las extremidades se ve afectada. La mayoría de los casos están precedidos por flegmasía alba dolens, con síntomas de edema, dolor y palidez (alba) sin cianosis. A medida que avanza, el secuestro masivo de líquido puede conducir a la formación de flictenas y ampollas y finalmente sobreviene cianosis (cerúlea) y gangrena venosa, de modo que con frecuencia se produce colapso circulatorio y shock29,30.
Nuestra preferencia por la heparina no fraccionada IV como anticoagulante inicial se basa en la experiencia clínica y la falta de datos que respalden la heparina de bajo peso molecular o los anticoagulantes orales directos en esta población, así como la posible necesidad de interrumpir de forma aguda la anticoagulación, cuando se toma la decisión de proceder con la trombólisis y/o trombectomía. La trombólisis dirigida por catéter o la eliminación rápida del trombo oclusivo mediante técnicas manuales (trombectomía quirúrgica o dirigida por catéter) debe considerarse seriamente en esta población de pacientes30,31a.
En nuestro estudio pudimos observar un alto porcentaje en sexo femenino, 61.4%, y el 6% de TEP en los pacientes incluidos en nuestro estudio permanecieron ingresados en UCI, asociado al deterioro de sus condiciones generales. Sin embargo, en este estudio los mecanismos que conducen a la TVP entre los pacientes con COVID-19 y la estancia en UCI pueden ser diferentes32.
Por tanto, se necesitan más estudios de tipo prospectivo en nuestra población, que nos permitan determinar los mecanismos involucrados en la enfermedad tromboembólica de utilidad para el manejo intrahospitalario y extrahospitalario de estos pacientes.
Conclusión
Los pacientes con COVID-19 presentan con frecuencia factores de riesgo trombótico, en su mayoría leucemias u otro tipo de cáncer; de igual forma la interacción de distintos factores de riesgo como la inmovilidad y obesidad predisponen a la estasis venosa e hipercoagulabilidad condicionando a TVP y/o TEP, por lo que debemos establecer una profilaxis antitrombótica temprana en este grupo de pacientes.
La tasa de complicaciones en este grupo de pacientes está asociada con las comorbilidades, factores de riesgo y síndrome de respuesta inflamatoria sistémica que presenta nuestra población.











 nueva página del texto (beta)
nueva página del texto (beta)