Introducción
La hiperplasia intimal es la respuesta celular y molecular caracterizada por una proliferación continua y anormal, predominantemente de células musculares lisas, tejido conectivo y matriz extracelular, que conduce a hiperplasia de la capa íntima del vaso y estenosis luminal1,2. Varios factores de crecimiento, que estimulan la proliferación celular, son las principales moléculas reguladoras del crecimiento para las células in vitro y probablemente también in vivo3. Estos factores de crecimiento se han identificado como precursores en la generación de hiperplasia intimal. Es de particular interés, que el factor de crecimiento derivado de plaquetas (PDGF) ha sido identificado como un marcador de hiperplasia intimal del endotelio vascular4. Es importante reconocer la expresión de mediadores durante la patogénesis de la hiperplasia intimal, los cuales incluso pueden ser potenciales blancos terapéuticos5. En las fases iniciales del desarrollo de hiperplasia intimal se ha demostrado que los factores de crecimiento constituyen importantes reguladores de migración y proliferación celular2. Los factores de crecimiento más importantes de proliferación y migración celular son péptidos que tienen la capacidad de unirse a receptores de tirosina cinasa6. Los dos factores de crecimiento más estudiados son PDGF y el factor de crecimiento de fibroblastos (FGF). Existe evidencia de liberación de PDGF durante los primeros minutos posteriores a la manipulación de células endoteliales. El FGF tiene una liberación en etapas más tardías7-9.
El PDGF fue originalmente descrito en sangre, pero también es producido por células musculares lisas y endoteliales. Se trata de una glicoproteína compuesta por dos cadenas de polipéptidos con peso de 27 a 31 kd. El PDGF está formado por moléculas diméricas que pueden existir como homodímeros o heterodímeros de dos cadenas peptídicas diferentes pero relacionadas, llamadas PDGF-A y PDGF-B (es decir, PDGF-AA, PDGF-BB y PDGF-AB). Las células endoteliales secretan de forma predominante, el homodímero PDGF-BB. El PDGF es un importante mitógeno y desempeña un papel importante en la migración de células musculares lisas desde la capa media a la capa íntima10-12.
La producción de este factor de crecimiento se ha evaluado experimentalmente. Los injertos venosos implantados en la circulación arterial aumentan de forma significativa la producción de PDGF. Cuando estos injertos son reimplantados en la circulación venosa, la producción disminuye13. La administración de antagonistas contra el PDGF en ratas sometidas a angioplastia arterial provocó una reducción del 40% de hiperplasia intimal14. El PDGF se libera durante los primeros minutos después de la manipulación del endotelio vascular15. Es un importante factor quimioatrayente que estimula la migración de las células musculares lisas hacia la capa íntima durante los primeros 7 días después del daño endotelial. Secundario a ello, las células musculares lisas cambian su fenotipo contráctil a uno proliferativo5. A partir de entonces, el posterior engrosamiento intimal depende casi exclusivamente de la deposición de matriz extracelular, sobre todo estimulada por el FGF16. Debido al importante papel del PDGF en la generación de hiperplasia intimal, la terapia antiplaquetaria se ha propuesto como un modulador en la respuesta endotelial, teniendo como objetivo terapéutico el bloqueo de la activación de las plaquetas17-19.
El objetivo de nuestro estudio fue evaluar la hiperplasia de la íntima y su asociación con el PDGF en un modelo experimental (conejo de raza Nueva Zelanda) de lesión tensional (barotrauma) en la vena femoral por medio de una lesión inducida por balón. De esta forma se puede desarrollar un modelo experimental para el estudio de nuevos objetivos terapéuticos en hiperplasia intimal venosa.
Material y métodos
Modelo experimental
Nuestro estudio incluyó 12 conejos de raza Nueva Zelanda, con un peso aproximado de 2.0 kg cada uno. Se rasuraron las partes laterales dorsales de las orejas y las regiones inguinales. El estudio fue realizado según la Normativa Oficial Mexicana 062-ZOO para el uso y cuidado de animales de laboratorio. Todos los animales fueron operados bajo anestesia general conforme al Comité institucional de cuidado y uso de animales de la Facultad de Medicina de Harvard. Los fármacos empleados fueron: Xilazina (6 mg/kg), un agonista alfa-adrenérgico A2; ketamina (50 mg/kg), un inhibidor de N-metil-D-aspartato, pentobarbital (Sagatal) (40 mg/kg), un anestésico, y paracetamol (100 mg/kg), un antipirético y analgésico.
Procedimiento experimental
Se realizó un estudio experimental, prospectivo, aleatorizado y controlado, basado en una lesión tensional por barotrauma en la vena femoral. Todos los experimentos se llevaron a cabo en el Departamento de Cirugía de la Universidad Nacional Autónoma de México.
Incluimos un total de 12 conejos machos de la especie Oryctolagus, Nueva Zelanda. Para el desarrollo del modelo incluimos 3 fases:
Fase I: Se tomó una muestra sanguínea (vena periférica en la oreja derecha). Se realizó una incisión inguinal izquierda (debajo del ligamento inguinal) hasta que se localizó el paquete neurovascular femoral. Se efectuó una punción directa de la vena femoral con un catéter del n.º 24 G, y se avanzó una guía hidrofílica de 0.14 hacia la vena cava inferior y la aurícula derecha bajo control fluoroscópico. Utilizando un sistema de rápido intercambio, se avanzó un balón de angioplastia de 20 x 4 mm. Bajo control fluoroscópico, el balón se colocó en la vena femoral ipsilateral. Se realizó una insuflación a 14 atm de presión (presión de ruptura), para realizar una lesión en la vena femoral secundaria a sobredistensión vascular durante 3 minutos. Mediante este método, se realizó una lesión aguda por barotrauma en el endotelio venoso. La vena femoral en el modelo experimental propuesto mide aproximadamente 1.5 mm, por lo que cuando se usa un balón de 4 mm se logra distender la vena tres veces su tamaño normal. Finalmente, al retirar el balón se realizó un control angiográfico para verificar la permeabilidad del sistema venoso profundo.
Fase II: 12 horas después del barotrauma venoso, se obtuvo la segunda muestra de sangre periférica.
Fase III: 7 días después del procedimiento se tomó la tercera muestra de sangre periférica. Finalmente, los animales fueron sacrificados para estudio histológico y cuantificación de PDGF por ensayo de inmunoabsorción ligado a enzimas (ELISA) (0 horas, 12 horas y 7 días). Para fines de control, se obtuvieron venas femorales contralaterales.
Análisis histopatológico
Medimos el desarrollo de hiperplasia intimal venosa mediante análisis histopatológico (7 días posteriores al barotrauma en el endotelio venoso). El modelo experimental de lesión por balón se comparó con el grupo control. Para este propósito, las muestras de tejido obtenidas se procesaron, se incluyeron en parafina y se seccionaron de acuerdo con métodos estándar usando Tissue-Tek TEC y Tissue-VIP (Sakura Finetek USA, Inc. Torrance, CA, EUA) con un agente de inclusión y un procesador de tejido, respectivamente.
Posteriormente se realizaron tinciones en muestras de 5 μm de espesor utilizando hematoxilina y eosina (Leica ST520, Wetzlar, Alemania). Se evaluó y registró la presencia de hiperplasia intimal. Para ello, el área total de las venas se evaluó microscópicamente (Nikon-eclipse 80i, Melville, NY, EE.UU.) utilizando la regla estándar en la platina del microscopio. Se realizaron microfotografías de manera sistemática a lo largo de toda la sección de tejido.
Ensayo de densitometría para la evaluación de hiperplasia intimal venosa
El análisis densitométrico de la hiperplasia intimal en las venas de conejo se evaluó para el grupo experimental (barotrauma) y control usando el software Image J.
Detección de PDGF-BB por ensayo de inmunoabsorción ligado a enzimas
Las muestras de sangre periférica se obtuvieron a las 0 horas, 12 horas y 7 días. La sangre se mantuvo durante 30 minutos a temperatura ambiente, seguido de 2 horas en hielo para inducir coagulación. Se centrifugaron las muestras a 3,000 revoluciones por minuto, durante 10 minutos para separar el suero, que luego se almacenó a −80 °C. Para la identificación de proteínas específicas de PDGF-BB a 0 horas, 12 horas y 7 días, utilizamos el kit ELISA RayGioR Rabbit PDFG-BB.
Resultados
El modelo experimental demostró generar hiperplasia intimal en el endotelio venoso. Este modelo piloto fue factible y reproducible. El conejo de raza Nueva Zelanda como modelo experimental para la hiperplasia intimal cumplió las expectativas técnicas sin complicaciones (0% de mortalidad, 0% de morbilidad). La hiperplasia intimal producida por el modelo se demostró con el análisis histopatológico.
La medición de la capa íntima en el grupo de venas de control fue 126.12 mm2 ± 10.8, y en el grupo experimental, 232 mm2 ± 22.7. La diferencia entre el grupo control y el grupo experimental fue de 106 mm2 ± 11,9. Al comparar el grupo experimental frente al grupo control, se observó una diferencia estadísticamente significativa (Fig. 1).
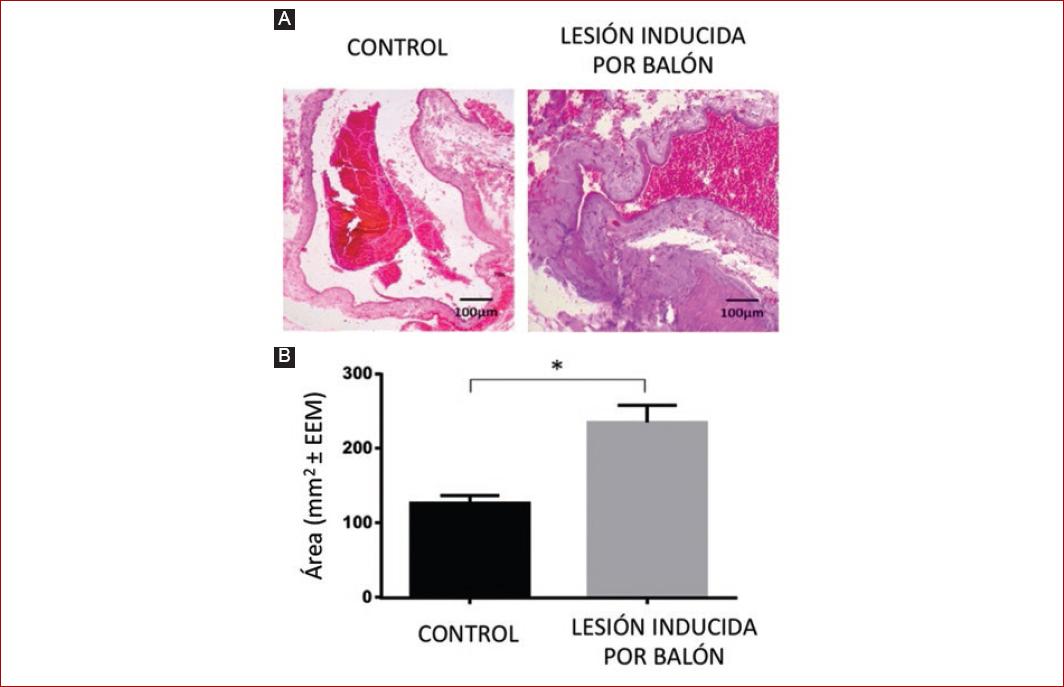
Figura 1 Histoquímica transversal. A: vena control (sin manipulación) y vena con lesión inducida por balón, al séptimo día en cada caso. Escala (barra) = 100 μm. B: grupo control vs. grupo con lesión inducida por balón, al séptimo día (área mm2 ± SEM). Para el análisis histológico se utilizó imagen de microscopia óptica AXIOVERT. El análisis de densitometría se realizó con el software Image J versión 1.x. Se utilizó una prueba ANOVA de una vía seguida de una prueba post-hoc de Tukey para comparación de las medias. Nivel de significancia *p ≤ 0.05. SEM: standard error of the mean.
En la medición de las concentraciones séricas de PDGF-BB en el grupo experimental, los niveles a las 0 horas fueron de 0.22 pg/ml ± 0.04. Se observó un pico a las 12 horas de 0,42 pg/ml ± 0,20, que disminuyó hacia el séptimo día a 0,17 pg/ml ± 0,09 (Fig. 2).
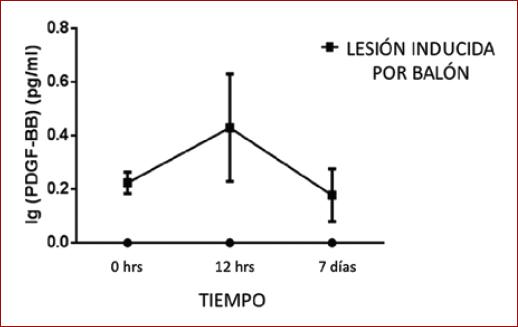
Figura 2 Niveles séricos PDGF-BB dependientes del tiempo después de una lesión inducida por balón. En el suero del grupo experimental, se analizó PDGF-BB (pg/ml) al tiempo 0.12 horas y 7 días. El análisis se realizó en un espectrofotómetro de microplacas Sky Multiscan. Grupo experimental n = 6 por grupo.
Discusión
Este trabajo de investigación evalúa los primeros eventos de hiperplasia intimal, centrados en las señales fisiopatológicas secundarias a una lesión vascular por barotrauma sobre un endotelio venoso. Para este fin, hemos desarrollado un nuevo modelo experimental para la evaluación de los cambios histopatológicos de la hiperplasia de la íntima asociada al PDGF como un efector principal. Se evaluó la variante PDGF-BB, ya que es la más específica en el endotelio vascular9,20.
Se ha demostrado que uno de los eventos que regulan las fases iniciales de la proliferación de células musculares lisas en la capa media, y su migración a la capa íntima es detonada por el PDGF, el cual se libera de plaquetas y células endoteliales21-23.
Durante los últimos años se han desarrollado modelos animales para el estudio de la biología vascular. La hiperplasia intimal venosa se ha identificado como una de las principales causas de falla para reconstrucciones vasculares y fístulas arteriovenosas, por lo cual con estos modelos experimentales no solo se ha estudiado la fisiopatología vascular, sino que se han propuesto estrategias terapéuticas para disminuir estas complicaciones en cirugía vascular24. Los modelos porcinos, unos de los más utilizados, tienen la ventaja de tener vasos de mayor calibre, accesibles y apegados a la anatomía de un ser humano, sin embargo, su manejo y costo hace que sea difícil su uso cotidiano24,25. Los modelos murinos han surgido como un excelente modelo para el estudio de la biología vascular, con el mayor potencial para obtener más información sobre los mecanismos moleculares subyacentes debido a la disponibilidad de tener ratones transgénicos. La principal limitación de este tipo de modelos es el tamaño de los vasos, debido a que se requiere una curva de aprendizaje en técnicas de microcirugía avanzada26,27. En rata se desarrolló un modelo de fístula aortocava para estudiar la patogénesis de la hipertrofia cardíaca y el efecto cardiovascular de la insuficiencia cardíaca congestiva. Se ha utilizado, también, para estudiar la fisiopatología de fístulas arteriovenosas25,28. Además de compartir limitaciones similares con los ratones, una desventaja de este modelo es que el desarrollo de lesiones estenóticas hemodinámicamente significativas en fístulas arteriovenosas es mucho más lento en ratas que en modelos murinos. Las ratas (sobre todo Wistar) también han demostrado ser un adecuado modelo para estudiar la fisiopatología en la falla de reconstrucciones vasculares29,30. Finalmente hay modelos experimentales que, aunque menos frecuentemente usados, también han demostrado su efectividad. Tal es el caso de perros, primates, ovejas y cabras31,32. Nosotros elegimos el modelo de conejo para estudiar las alteraciones histopatológicas y sistémicas de la influencia del PDGF en el endotelio venoso posterior a una lesión vascular por barotrauma. Se han descrito algunos experimentos en arterias de conejos, pero esta es la primera descripción de experimentos en venas, específicamente enfocados a hiperplasia intimal. Este modelo experimental demostró generar hiperplasia intimal en el endotelio venoso además de ser reproducible.
Por otro lado, la validez del estudio de alteraciones vasculares en animales ha sido un tema de debate poniendo sobre la mesa las similitudes con pacientes humanos, como por ejemplo estados de insuficiencia renal crónica terminal. Este escepticismo se relaciona principalmente con el uso de modelos animales relativamente sanos que podrían mostrar una respuesta diferente a alteraciones vasculares24. Debido a este concepto hay grupos de investigadores que han creado modelos biológicos urémicos con la finalidad de poder replicar las fases más avanzadas de la enfermedad renal crónica terminal y su efecto en fístulas arteriovenosas y reconstrucciones vasculares33.
Finalmente, se debe tener en cuenta que la generación de hiperplasia intimal tiene fases y mecanismos fisiopatológicos diferentes, cuyo estudio se debe realizar por separado y el modelo experimental debe ser reproducible en estos escenarios en específico1,2. Los cambios hemodinámicos presentes en una anastomosis arteriovenosa son muy complejos y existen diferencias significativas dependiendo del momento y mecanismo de acción de estos eventos fisiológicos y fisiopatológicos6.
El paso de sangre a través de un sistema vascular genera dos fuerzas hemodinámicas principalmente: fuerzas de cizallamiento (shear stress), que están directamente relacionadas con la velocidad de flujo, la viscosidad de la sangre y el diámetro del vaso sanguíneo, y las fuerzas de tensión radial, que dependen de la presión de la sangre sobre las dimensiones (diámetro y grosor) del vaso sanguíneo34,35. Para estudiar los cambios hemodinámicos en una anastomosis arteriovenosa es muy importante separar ambos mecanismos hemodinámicos debido a que son muy diferentes en cuanto a cronología, vías de señalización y fisiopatología. El presente trabajo evalúa las alteraciones más tempranas, enfocadas en el mecanismo fisiopatológico generado por fuerza tensional radial5,16,36.
En estudios experimentales se ha demostrado que las fuerzas tensionales sobre el endotelio venoso en una anastomosis arteriovenosa se elevan más de 10 veces, comparado con el nivel basal. Estos cambios moleculares se pueden detectar de una forma tan temprana como 8 minutos después de la lesión vascular15,37. Posterior a una angioplastia con balón en el endotelio venoso se crea una obvia lesión vascular. Esta lesión genera denudación de las células endoteliales. Inmediatamente después de la lesión se adhieren y se granulan plaquetas dentro del vaso afectado. Las células musculares lisas inician su proliferación en la capa media aproximadamente en las primeras 12 horas después de la lesión. Durante los 4 días siguientes, las células musculares lisas migran hacia la capa íntima, donde algunas de ellas continúan proliferando generando estenosis del lumen del vaso36,38,39. Posteriormente existe deposición de matriz extracelular alrededor de la capa íntima, lo cual agrava la estenosis. Se ha demostrado que uno de los eventos que regula las fases iniciales de proliferación de células musculares lisas en la capa media y su migración a la capa íntima es detonado por el factor de crecimiento derivado de plaquetas, el cual es liberado de plaquetas y células endoteliales40,41. Después de una lesión vascular secundaria a fuerzas de tensión radial, la matriz extracelular se encuentra desorganizada, las células pierden contacto entre ellas y entran en apoptosis. Para compensar aquellas células que sobreviven a la lesión inicial, los factores de crecimiento facilitan el engrosamiento de la capa íntima. Las fuerzas de tensión radial en las etapas más tempranas activan receptores de tirosina cinasa, en donde el PDGF juega un papel fundamental9,20,21,42,43., Estos conceptos se demostraron en nuestro modelo experimental.
Conclusiones
En este trabajo, proponemos un modelo experimental que simula los eventos desencadenantes de la hiperplasia de la íntima, centrado en el PDGF como el principal efector. El modelo experimental fue capaz de generar eventos que detonaron la expresión de PDGF evaluados por ELISA, e hiperplasia de la íntima analizado por histopatología. Por lo tanto, constituye un modelo adecuado para caracterizar vías moleculares centradas en el PDGF e hiperplasia intimal en el endotelio venoso. Es importante reconocer la expresión de mediadores durante la patogénesis de la hiperplasia intimal, los cuales incluso pueden ser potenciales blancos terapéuticos. En las fases iniciales del desarrollo de hiperplasia intimal se ha demostrado que los factores de crecimiento constituyen importantes reguladores de la migración y proliferación celular.
Declaración de ética en animales
El estudio realizado según la Normativa Oficial Mexicana 062-ZOO para el uso y cuidado de animales de laboratorio. Todos los animales fueron operados bajo anestesia general utilizando el Comité institucional de cuidado y uso de animales de la Facultad de Medicina de Harvard.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del Comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)


