Introducción
El cuerpo carotídeo (CC) está compuesto por células neuroendocrinas, localizadas en la bifurcación de dicha arteria y con sensibilidad a ciertos estímulos como hipoxia, hipercapnia y acidosis, y produce hiperventilación y disminución de la frecuencia cardiaca, sin embargo, el aumento del volumen y número de sus células puede dar como resultado el desarrollo de un tumor.
Estos tumores denominados glomus o también conocidos como paragangliomas o quimodectomas conforman una gran variedad de neoplasias, para diferenciarlas y nombrarlas se utiliza como referencia el lugar donde se originan los tumores. Aquellos tumores que se desarrollan en la bifurcación de las arterias carótidas, se denominan, por ende, tumores del cuerpo carotídeo (TCC)1.
El CC fue descrito por primera vez en 1743 por Albrecht Von Haller, un médico, anatomista y botánico suizo2,3. Embriológicamente, el CC deriva de la cresta neural, específicamente de células provenientes del ectodermo y del tercer arco branquial mesodérmico4.
La incidencia de los TCC se ha descrito aproximadamente en 1 de cada 30,000-100,000 habitantes, por lo que las neoplasias son poco comunes, sin embargo, representan más de la mitad de los paragangliomas que corresponden a la zona de cabeza y cuello2. Nueve de cada diez casos ocurren esporádicamente, el resto son hereditarios, en donde se han reportado cerca de 1/3 de TCC bilaterales (menos del 5% del total de casos)5,6. Se han identificado alrededor de seis genes asociados al posible desarrollo de feocromocitomas/paragangliomas4. Comúnmente este tipo de tumores son de carácter benigno, la malignidad se ha reportado entre el 5 y el 12.5% de los casos7, afectan predominantemente al sexo femenino en relación 9:1, esto se ha asociado principalmente a factores genéticos y hormonales, aunque existen reportes de centros asiáticos donde la incidencia es más común en hombres4. El pico etario en que se detectan en la mayoría de pacientes se sitúa entre los 40 y 50 años2,4. A pesar de todos los descubrimientos en torno al TCC, su etiología permanece aún incierta. Desde 1930 se ha aceptado que estar formado por células quimiorreceptoras2 y recibir una gran cantidad de flujo sanguíneo permite al CC tener la propiedad de responder a estímulos hipóxicos, como la concentración de CO2 u O2, e inclusive a la hipoglicemia y la acidosis extracelular, induciendo la hiperventilación7-10. Todo ello se manifiesta mediante hipertrofia e hiperplasia celular, así como angiogénesis. Esto explica por qué su prevalencia se eleva circunstancialmente en poblaciones que se encuentren en zonas de gran altura (mayor a 2,000 m sobre el nivel del mar) o en individuos expuestos a hipoxia crónica, como es el caso de personas que padecen enfermedades cardiopulmonares11. Característicamente, los TCC son neoplasias de crecimiento lento, muy vascularizados, irrigados por las arterias glómicas y ramas de la arteria carótida externa12,13. El flujo sanguíneo que reciben los CC se ha estimado en 0.2 l/g/min, aún más que órganos vitales como el cerebro y el corazón, lo que les convierte en el tejido más vascularizado del cuerpo humano5. Están inervados por ramas aferentes del nervio glosofaríngeo (par craneal IX)4. Estas neoplasias no cromafines poseen una forma esférica, ovalada o irregular bien delimitada y no encapsulada13,14, histológicamente se pueden diferenciar tres tipos celulares, las células tipo I (células chief o glómicas, dispuestas en nidos llamados Zellballen) células tipo II (sustentaculares) y las tipo III originadas del PC IX9. Aunque raro, se han reportado metástasis a distancia de estos tumores a órganos como el páncreas, el hígado y los riñones, entre otros11.
En la mayoría de los casos, los pacientes con un TCC o glomus carotídeo se presentan en la consulta por aumento de volumen en la región cervical. Es ahí cuando el médico de primer contacto debe conocer los diagnósticos diferenciales de las masas cervicales y, entre ellas, el TCC, sobre todo en zonas de alta incidencia como México.
Existe actualmente la clasificación de Shamblin, la cual refleja el grado de dificultad técnica para la resección del tumor, incluyendo tres tipos. El tratamiento de estos tumores, es la resección quirúrgica por medio de una incisión cervical, tratando de preservar la integridad de los nervios craneales que rodean al tumor.
Sin embargo, al ser un tumor altamente vascularizado, el volumen del tumor puede ser un predictor de sangrado durante la resección quirúrgica. Actualmente no se cuenta con ningún estudio prospectivo que demuestre la asociación entre el volumen de estos tumores y el sangrado transoperatorio.
Métodos
Se realizó un estudio prospectivo en el Servicio de Angiología y Cirugía Vascular y Endovascular del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán con diagnóstico de TCC durante el periodo de marzo de 2017 a marzo de 2019. Los criterios de inclusión del estudio fueron pacientes mayores de 18 años de edad con diagnóstico de TCC con angiotomografía cervical disponible para el cálculo de la volumetría prequirúrgica. Se incluyeron 29 pacientes que cumplieron con los criterios de inclusión, los cuales fueron llevados a resección quirúrgica. Se recopilaron los datos demográficos de cada paciente, incluyendo edad, sexo, lateralidad, Shamblin, volumen, sangrado, tiempo quirúrgico, diabetes, hipertensión. Se realizó la medición de la volumetría en la angiotomografía más reciente a la cirugía utilizando el sistema Carestream Vue, Picture Archiving and Communications System (PACS) Siemens, USA. Durante el procedimiento quirúrgico, el volumen de sangrado fue calculado en conjunto con el Servicio de Anestesiología del instituto. Para el análisis estadístico se utilizó el programa SPSS para Macintosh versión 25.0, y se consideró como estadísticamente significativa una p < 0.05.
Se realizaron pruebas de normalidad para cada variable cuantitativa con el test de Shapiro-Wilks, y por medio del test de Spearman se determinó la asociación entre el volumen del tumor y el riesgo de sangrado transoperatorio.
Resultados
Nuestra población consistió en 86% mujeres y 14% hombres. Dentro de los antecedentes patológicos, 8 pacientes tuvieron historia de diabetes mellitus, 10 pacientes contaban con diagnóstico de hipertensión arterial sistémica, 6 con hipotiroidismo, 9 con dislipidemia y 1 con antecedente de cardiopatía isquémica. En cuanto a la lateralidad de los tumores, se identificaron 15 (52%) del lado derecho, 10 (34%), izquierdos y 4 (14%) bilaterales. Al analizar los estudios de imagen, 3 pacientes (10%) fueron Shamblin I, 16 (55%), Samblin II y 10 (35%), Shamblin III. La volumetría se determinó en cada tumor resecado, y la mediana fue de 17 cm3. Las medianas de sangrado transoperatorio, tiempo transoperatorio y días de estancia hospitalaria fueron de 300 ml, 218 minutos y 4 días, respectivamente (Tabla 1).
Tabla 1 Variables de los pacientes operados de TCC de marzo 2017 a marzo 2019
| Variables demográficas | |
|---|---|
| Variable | n = 29(%) |
| Sexo | H: 4 (14) |
| M: 25 (86) | |
| Edad (años) | 55 ± 13 |
| Lateralidad del TCC | Derecho = 15 (52) |
| Izquierdo = 10 (34) | |
| Bilateral = 4 (14) | |
| Shamblin | 1 = 3 (10) |
| 2 = 16 (55) | |
| 3 = 10 (35) | |
| Volumen (cm3) | 17 (5-99) |
| Sangrado (ml) | 300 (30-2400) |
| Tiempo quirúrgico (min) | 218 (80-390) |
| Días de estancia hospitalaria | 4 (2-12) |
| DM | 8 (27) |
| HTA | 10 (34) |
| Hipotiroidismo | 6 (20) |
| DLP | 9 (31) |
| Cardiopatía isquémica | 1 (3) |
DLP: dislipemia; DM: diabetes mellitus; HTA: hipertensión arterial; TCC: tumor del cuerpo carotídeo.
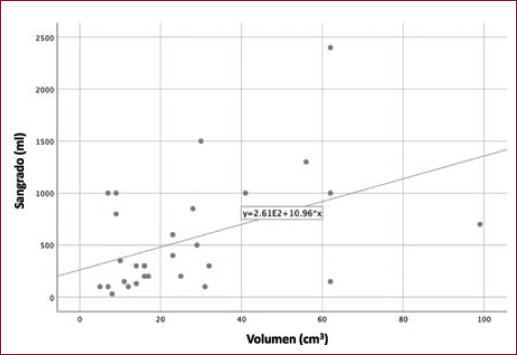
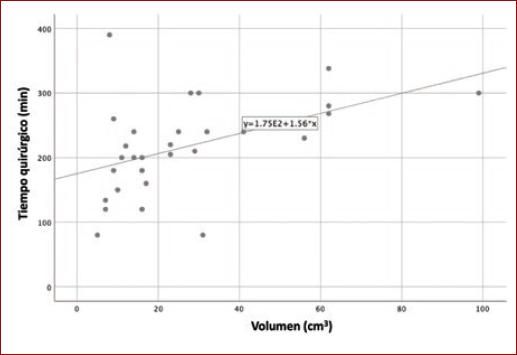
Se calculó el coeficiente de correlación de Spearman entre la volumetría de los tumores y sangrado transoperatorio, y se obtuvo una correlación moderada (r = 0.426; p = 0.021). De igual forma, se obtuvo el coeficiente de correlación entre la volumetría de los tumores y tiempo quirúrgico (r = 0.471; p = 0.010) (Figs. 1 y 2).
Discusión
La resección quirúrgica de estos tumores se ha establecido como tratamiento de elección. Recientemente, el abordaje estándar de disección caudocraneal ha sido desplazado por técnicas más eficaces tanto en la duración del procedimiento, pérdida de sangre y tiempo de hospitalización, como es el caso del abordaje de disección retro carotídea8.
En la actualidad no hay modelos para predecir la evolución de los pacientes sometidos a estas cirugías; como ya se ha comentado existe la clasificación Shamblin para estimar la dificultad quirúrgica y el riesgo de lesiones de estructuras adyacentes, pero no predice complicaciones como sangrado, tiempo quirúrgico o evolución posquirúrgica de los pacientes, así como la calidad de vida que puedan tener posterior a la resección quirúrgica15.
En el pasado, Kim, et al. propusieron una medición para predecir la lesión de nervios craneales transoperatorios16. Nuestro grupo previamente ha propuesto la medición de la volumetría de los TCC para predecir el sangrado quirúrgico durante el procedimiento. En este estudio prospectivo hemos encontrado una asociación estadísticamente significativa entre la volumetría obtenida de los TCC y el sangrado quirúrgico, así como también una asociación estadísticamente significativa a un mayor tiempo quirúrgico, lo cual puede traducirse en un probable aumento en la tasa de complicaciones en tumores con mayor volumen.
En 1971 fue propuesta una clasificación para el abordaje quirúrgico, conocida hoy en día como clasificación de Shamblin, la cual divide en tres grupos los TCC: el grupo 1 corresponde a tumores de pequeño tamaño que no se encuentran adheridos a los vasos carotídeos y pueden ser disecados sin dañar a las estructuras vecinas; el grupo 2, de un mayor tamaño, presenta adherencia mínima y más dificultades para su disección; finalmente, el grupo 3 se distingue por ser de gran extensión y tamaño, y presentar infiltración vascular en donde la revascularización con injertos es necesaria tras su resección en algunos de los casos4. A pesar de esto no se ha podido demostrar su utilidad para predecir complicaciones17. No se ha establecido una clasificación o método que prediga el sangrado, tiempo quirúrgico o complicaciones. Lozano-Corona, et al. determinaron en 2018, con 57 pacientes, que la volumetría 3D de los tumores carotídeos predice el sangrado transoperatorio, pero no se asocia a mayor tiempo quirúrgico. El grupo enfatiza que las mediciones deberán ser en 3D (como se realizó en este estudio), ya que por otros métodos pueden infra o sobreestimarse las volumetrías18-20.
Cabe mencionar que en el caso de este artículo, se trata de un estudio prospectivo y que, al igual que el estudio antes mencionado de Lozano-Corona, et al., encontramos una asociación positiva entre la volumetría de los tumores y el sangrado trans operatorio. Así como también la volumetría de los tumores y el tiempo quirúrgico. Esto quiere decir que, a mayor volumen del tumor, puede presentarse un mayor sangrado transoperatorio y un mayor tiempo quirúrgico.
Una limitante importante de nuestro estudio es el tamaño de la muestra con la que contamos (n = 29 pacientes), sin embargo, a pesar de esto se obtuvo una diferencia estadísticamente significativa (p < 0.05) para el sangrado y el tiempo quirúrgico.
Conclusión
En conclusión, los TCC son un patología poco común, donde cada vez se tienen más datos para su manejo eficaz, las diferentes técnicas quirúrgicas y estandarización respecto al manejo adyuvante. Hemos correlacionado la volumetría con sangrado y tiempo quirúrgico, lo cual se podrá usar en un futuro como predictor de complicaciones. Más estudios prospectivos son necesarios, así como con mayor número de pacientes para la implementación de la volumetría en la práctica clínica habitual.











 nueva página del texto (beta)
nueva página del texto (beta)