Introducción
El melanoma uveal es un tumor maligno que se origina en las células melanocíticas y se suele localizar en la coroides (90%), el cuerpo ciliar (6%) o el iris (4%)1. Se diagnostica con mayor frecuencia en los caucásicos (98%), seguidos de los hispanos (1%)2. Otros factores que predisponen a esta patología son un tono de piel y de ojos claro, dificultad para broncearse, presencia de melanocitosis ocular, nevus coroideos, cutáneos o en el iris, mutaciones del gen BAP1 y exposición a la luz ultravioleta artifical1,3,4. En ocasiones se aprecia infiltración simultánea del melanoma en estructuras uveales adyacentes: melanoma iridociliar (iris y cuerpo ciliar), ciliocoroideo (cuerpo ciliar y coroides) e iridociliocoroideo (iris, cuerpo ciliar y coroides), que suele estar asociada a un diagnóstico tardío5. La consecuencia es que el melanoma de cuerpo ciliar y coroides (MCC-C) puede permanecer oculto durante mucho tiempo detrás el iris y cursar con síntomas solo cuando es lo bastante grande, lo cual se asocia a una incidencia más alta de extensión extraocular, tumores metastásicos y mortalidad3,6-11.
En la actualidad, los tratamientos que tenemos a nuestra disposición para luchar contra el MCC-C son la enucleación primaria, la braquiterapia, la radiación con rayos de protones y la radiocirugía estereotáctica, incluido el sistema CyberKnife® (CK®) Robotic Radiosurgery System (Accuray Inc, Sunnyvale, CA, Estados Unidos)12-15. La enucleación primaria del melanoma uveal no aumenta los índices de supervivencia por encima de la radioterapia16-18. Además, los índices de supervivencia de las distintas radioterapias disponibles son parecidos13,19-22. La equivalencia de los índices de supervivencia entre las diferentes alternativas terapéuticas permite a los médicos optar por el mejor tratamiento y respetar las preferencias y las expectativas de los pacientes con cada opción terapéutica. En nuestro conocimiento, este es el primer estudio que analiza el perfil de seguridad y eficacia del sistema CK® en el manejo del MCC-C en población mexicana.
Método
Se realizó una revisión retrospectiva de las historias clínicas de los pacientes para analizar el perfil de seguridad y eficacia del sistema CK® (Accuray Inc, Sunnyvale, CA, Estados Unidos) en el manejo del MCC-C en nuestra unidad de oncología ocular. Tras obtener los correspondientes consentimientos informados por escrito y de acuerdo con los principios establecidos en la Declaración de Helsinki, los MCC-C de cuatro pacientes fueron tratados con el sistema CK® en la unidad de oncología ocular del Tecnológico de Monterrey (México) en el año 2020.
Antes del tratamiento, todos los pacientes fueron sometidos a un examen oftalmológico integral que incluyó estudio de la agudeza visual, tonometría, biomicroscopia ocular del segmento anterior, estudio del fondo de ojo, gonioscopia, biopsia transescleral y análisis citopatológico (si era necesario) en la misma semana de tratamiento (Fig. 1). Se emplearon ecografías A y B estandarizadas para valorar las verdaderas dimensiones de los tumores en todos los pacientes (Fig. 2). Se propuso el sistema CK® como opción terapéutica porque las dimensiones tumorales excedían las posibilidades de emplear la braquiterapia con rutenio-106 y yodo-125, y porque quisieron respetarse las preferencias de los pacientes de evitar procedimientos de enucleación primaria. A pesar de que en nuestro centro no disponíamos de yodo-125, se informó a todos los pacientes de la posibilidad de emplear placas de yodo-12 en un centro de tratamiento de la Ciudad de México (México). No obstante, se desaconsejó el tratamiento con placas de yodo-125 en todos los casos debido al tamaño de los tumores, optando por el uso de radiocirugía para intentar salvar el globo ocular. El sistema CK® incorpora un acelerador lineal compacto montado sobre un manipulador robótico multieje. Se trata de un sistema de tratamiento radioguiado que libera, de forma precisa, rayos no isocéntricos y no coplanares23. Se realizaron evaluaciones completas y estudios de imágenes adicionales para descartar la presencia de enfermedad metastásica en todos los casos.
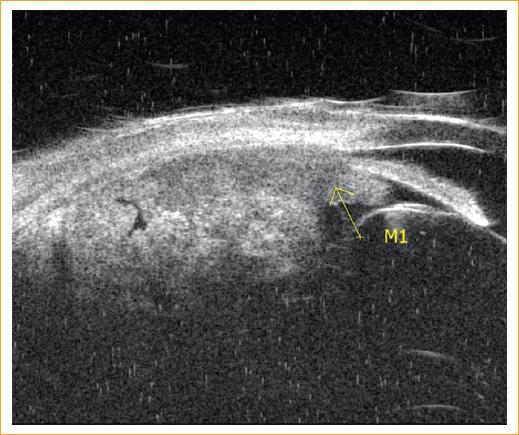
Figura 1 A: el sistema de planificación de tratamiento inverso integrado (Accuray Inc, Sunnyvale, CA, Estados Unidos) en el paciente 1 posibilitó la creación de mapas radioquirúrgicos con una excelente conformidad y cobertura, y marcados gradientes de dosis. B: la imagen fusionada sirvió para determinar tanto el volumen tumoral grueso como los órganos en riesgo de acuerdo con las definiciones establecidas por los oncólogos oftalmológico y radioterapeuta.
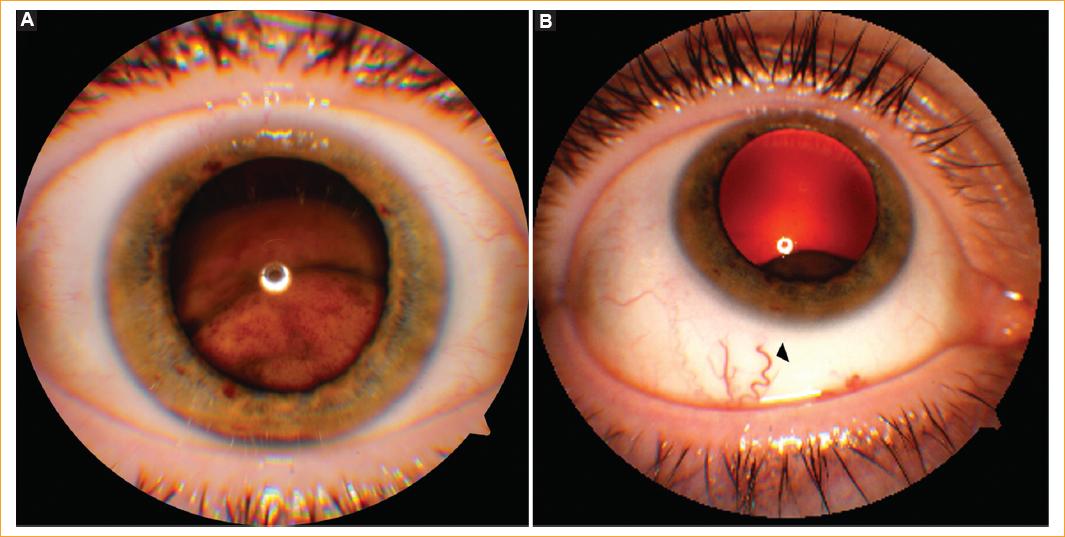
Figura 2 Biomicroscopia ultrasónica del paciente 4 con presencia confirmada de una masa vascularizada (flecha marcada M1) y compromiso simultáneo de cuerpo ciliar y coroides.
Previo a la radiocirugía se empleó una máscara termoplástica a medida (Orfit Industries, Bélgica) para inmovilizar al paciente durante la radioterapia. El día de la cirugía, se alcanzó la acinesia global mediante bloqueo retrobulbar con 2 ml de bupivacaína al 0.75% y 2 ml de lidocaína al 2% en dos momentos distintos el mismo día del tratamiento. El primer bloqueo retrobulbar se administró justo antes de la resonancia magnética cerebral con contraste de gadolinio (secuencias T1 y T2) y después se realizó una tomografía computarizada de alta definición (grosor de 1 mm). Las imágenes obtenidas en la resonancia magnética y en la tomografía computarizada fueron fusionadas por el médico, el oncólogo radioterapeuta (EPR) y el oncólogo oftalmólogo (DAL). Las imágenes finales se marcaron para señalar el volumen tumoral grueso y los órganos en riesgo según las definiciones dadas por el oncólogo radioterapeuta y el oncólogo oftalmólogo a efectos de optimización. La planificación del volumen diana se elaboró añadiendo un margen de 1 mm usando un sistema de planificación de tratamiento inverso integrado (MultiPlan, Accuray Inc, Sunnyvale, CA, Estados Unidos) (Fig. 3). Como parte del tratamiento multidisciplinario, los pacientes recibieron acompañamiento durante toda su experiencia terapéutica para reducir sus niveles de ansiedad y mejorar la adherencia. El oncólogo oftalmólogo aplicó el segundo bloqueo retrobulbar antes de iniciar el tratamiento. La radiación se administró en una única fracción con una dosis media de 27 Gy al 90% de la línea de isodosis prescrita. Al finalizar la sesión de radiocirugía, todos los pacientes fueron dados de alta del hospital.
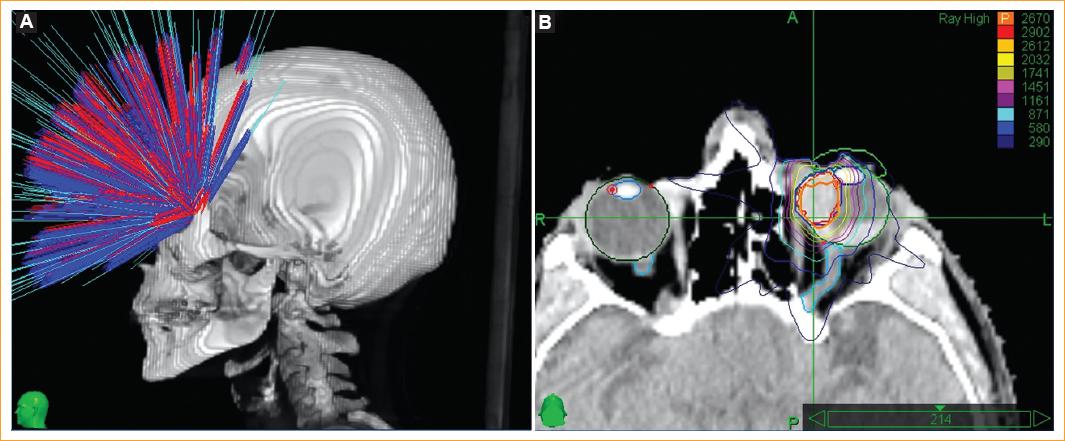
Figura 3 A: fotografías del segmento anterior del paciente 4 con presencia de un MCC-C grande a través de una pupila dilatada. B: vaso centinela (punta de flecha) visible en posición de la mirada hacia arriba por debajo del párpado inferior.
Las consultas clínicas y de seguimiento se realizaron el primer día y luego 1 semana y 1, 3, 6 y 12 meses después de la radiocirugía. El control local del tumor se definió como una reducción del tamaño del tumor o un avance ecográfico ausente. Todos los pacientes fueron sometidos a un abordaje multidisciplinario por médicos, psicólogos clínicos, genetistas, oncólogos médicos, oncólogos radioterapeutas y oncólogos oftalmólogos especializados.
Resultados
Se revisaron las historias clínicas de 4 pacientes (3 hombres y 1 mujer), con una media de edad de 53.2 ± 5.3 años (rango: 47-60) con MCC-C unilateral (Tabla 1). La mediana de seguimiento fueron 9.5 ± 3.1 meses (rango: 4-12). La agudeza visual inicial estaba por debajo de 20/400 (1.3 LogMAR) en todos los pacientes. En la presentación, el diámetro medio fue de 13.49 ± 2.74 mm y el grosor medio fue de 11.74 ± 2.13 mm. El volumen tumoral grueso medio fue de 1251.97 mm3. Los MCC-C tenían configuración de domo en 2 (50%) pacientes y de seta en otros 2 (50%). Tres pacientes presentaban tumores T3b y un paciente un tumor T4d en la estadificación inicial según el American Joint Committee on Cancer (AJCC). En el diagnóstico inicial, un paciente presentaba extensión extraescleral. La presentación inicial evidenció la presencia de hemorragias vítreas densas en 3 (75%) pacientes. Dos pacientes (50%), además, presentaban desprendimiento de retina exudativo extenso. El estudio citopatológico vino a confirmar todos los diagnósticos. Se observaron diferentes tipos de células tumorales: mixtas (50%), fusiformes (25%) y epitelioides (25%) (Fig. 4). El análisis citogenético para estratificar el riesgo de metástasis se ofreció a todos los pacientes, pero solo aceptaron los pacientes 2 y 4, y los resultados se clasificaron según el Atlas del Genoma del Cáncer24 como tumores de clase B y C, respectivamente. En los pacientes 2, 3 y 4 se llevó a cabo un análisis de las mutaciones germinales. El paciente 2 presentaba disomía del cromosoma 3, amplificación y duplicación en la banda cromosómica 6p, monosomía 6q y amplificación 8q. El paciente 4 presentaba deleción 1p, monosomía del cromosoma 3, amplificación 8q y deleción del cromosoma X. Se administró una dosis media de 2763.27 ± 181.3 cGy (rango: 26.3-30.3) al 90% de la línea de isodosis. De media, la altura tumoral se redujo un 23.6% (rango: 10-31.2) 1 mes después de la radiocirugía. Un paciente (25%) sufrió un desprendimiento de retina exudativo en el seguimiento debido a una vasculopatía tumoral asociada a la radiación 3 meses después de la radiocirugía, que se resolvió con tratamiento antiangiogénico. El control local del tumor se alcanzó durante el seguimiento en todos los pacientes que siguieron viviendo sin signos de enfermedad metastásica. Ningún paciente requirió enucleación secundaria durante el seguimiento.
Tabla 1 Resumen de las características de los pacientes con MCC-C tratados con el sistema de radiocirugía robótica estereotáctica CyberKnife®
| Paciente | Edad (años) | Sexo | Estadio tumoral25 | Tipo de células tumorales | Altura inicial del tumor (mm) | Reducción de la altura al cabo de 1 mes (%)* | Seguimiento (meses) | PVD (mm3) | Dosis media (cGy)** |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 47 | Hombre | T3bN0M0 | Fusiformes | 9.51 | 31.2% | 12 | 1920.46 | 2713.94 |
| 2 | 54 | Hombre | T3bN0M0 | Mixtas | 9.3 | 10% | 5 | 1275.25 | 3030.89 |
| 3 | 60 | Hombre | T4dN0M0 | Mixtas | 12.21 | 26.7% | 11 | 2279.28 | 2673.81 |
| 4 | 52 | Mujer | T3bN0M0 | Epitelioides | 13.29 | 26.7% | 10 | 1364.73 | 2634.46 |
AJCC: American Joint Committee on Cancer; MCC-C: melanoma de cuerpo ciliar y coroides; PVD: planificación del volumen diana.
*Reducción del tamaño calculada como altura tumoral inmediatamente antes del tratamiento menos altura tumoral calculada 1 mes después del tratamiento.
**Dosis media a la planificación del volumen diana.

Figura 4 A: la biopsia por aspiración con aguja fina del MCC-C intraocular que se realizó en el paciente 1 reveló la presencia de células fusiformes con núcleos atípicos e hipercromáticos, y abundante citoplasma eosinófilo y pigmentación melánica intracelular. B: la biopsia del paciente 4 confirmó la presencia de células epitelioides con nucleótidos grandes, abundante citoplasma eosinófilo y abundante espacio extracelular intercelular.
Discusión
El uso del sistema CK® para el manejo del melanoma uveal fue propuesto, por primera vez, por Muacevic et al.26 en 2008. Las ventajas de esta intervención incluyen un excelente control local del tumor13,19,20,26-30, la evitación de la enucleación primaria, así como la posibilidad de preservar la visión funcional. También posibilita el tratamiento ambulatorio, reduce la carga de cuidados y mejora la calidad de vida31.
En su estudio pionero, Muacevic et al.26 analizaron a 20 pacientes con un índice de control local del tumor del 100%, sin complicaciones ni enucleación secundaria con una mediana de seguimiento de 13 meses. Los resultados a largo plazo del grupo de Munich en 217 pacientes confirmaron un índice de control local del tumor del 87.4 y el 70.8%, con índices globales de supervivencia del 84.8 y el 78.4%, al cabo de 3 y 5 años, respectivamente19. Veintiséis pacientes (11.9%) precisaron enucleación. Resulta interesante ver que el índice de retención ocular alcanzado fue similar al índice de control local del tumor (86,7 y 73% al cabo de 3 y 5 años, respectivamente)19. Krema et al.13 estudiaron el perfil de eficacia de la radiocirugía estereotáctica en el tratamiento del melanoma coroideo yuxtapapilar en 94 pacientes y observaron recidivas en el 7% de los tumores, el 21% de los cuales precisaron enucleación secundaria. El 16% desarrollaron metástasis sistémicas en una mediana de seguimiento de 50 meses. Özcan et al.29, en 36 pacientes, hallaron índices de control local del tumor y retención ocular del 84 y el 83.3%, respectivamente, con una mediana de seguimiento de 17.2 meses. En este estudio, los cuatro pacientes con compromiso simultáneo de dos estructuras uveales adyacentes lograron el control local del tumor y ninguno precisó enucleación secundaria. No obstante, un seguimiento a más largo plazo podría arrojar resultados similares a los de otros estudios.
El sistema CK® reduce los efectos secundarios de la radiación mediante múltiples haces de radiación, administrando de forma precisa la dosis y usando la colimación de rayos23. Las principales desventajas son los efectos secundarios de la radiación y la posibilidad de enucleación secundaria. La retinopatía inducida por radiación (RIR) se caracteriza por una vasculopatía progresiva de los capilares retinianos debido al daño ocasionado por la radiación ionizante sobre el endotelio vascular32. La toxicidad secundaria a la radiación parece ser un fenómeno más habitual en tumores grandes, como los que se observan en los MCC-C, por la necesidad que hay de administrar dosis más altas de radiación26,33-35. Además, las dosis de radiación (25-35 Gy) que suele emplear el sistema CK® para el tratamiento de los melanomas uveales es inferior a los límites conocidos para la RIR (de 35 a 45 Gy), lo cual podría traducirse en una menor toxicidad asociada a la radiación36,37. Por otro lado, las diferentes toxicidades deberían analizarse en estudios comparativos más amplios.
Eibl-Lindner et al.19 (dosis media de radiación: 20.3 Gy) publicaron los resultados clínicos de 217 pacientes tratados con radiocirugía robótica con el sistema CK®. De toda la cohorte, 29 pacientes (13.4%) desarrollaron RIR, 33 (15.2%) glaucoma inducido por el tratamiento, 26 (11.9%) hemorragias vítreas y 7 (3.2%) edemas maculares.
Özcan et al.29 (dosis media de radiación: 24.5 Gy) reportaron que 10 de los 36 pacientes de su estudio (27.7%) desarrollaron RIR. El tiempo medio de aparición fue de 12 meses. No obstante, la RIR no mantuvo una relación significativa con la dosis media de radiación (p = 0.53). Dunavoelgyi et al.21 (dosis media de radiación: 50 Gy, fraccionada en 5) confirmaron que, tras 60 meses de seguimiento, solo 24 de 91 pacientes (26%) permanecieron libres de RIR. Yazici et al.30 (dosis media de radiación: 54 Gy, fraccionada en 3) encontraron que 76 de 181 ojos (42%) desarrollaron RIR, con un tiempo medio de aparición de 12 meses. La dosis media de radiación fue mucho más alta en los pacientes con RIR que en aquellos sin RIR (63 frente a 52 Gy; p = 0.04). Como el periodo de seguimiento fue corto (mediana de seguimiento: 9.5 meses), tanto la morbilidad a largo plazo como la supervivencia de los pacientes podrían no haberse reflejado en su totalidad en nuestra serie.
En esta serie de casos sorprendió que, de cuatro pacientes, tres sufrieran hemorragias vítreas. Eskelin y Kivelä38 han estudiado este modo de presentación del melanoma uveal. De sus 104 pacientes incluidos, solo uno sufrió una hemorragia vítrea como signo de presentación. Shields et al.1 describieron 8033 casos de melanoma uveal (el 98% en pacientes caucásicos), de los cuales 821 pacientes (10%) de todas las edades presentaron algún tipo de hemorragia intraocular durante la exploración inicial. Otros estudios realizados en población asiática concluyen que el desprendimiento de retina, el glaucoma agudo, la uveítis, las cataratas y las hemorragias vítreas podrían ser signos de presentación del melanoma uveal. No obstante, los autores no facilitan el índice exacto de ocurrencia de hemorragias vítreas39. La incidencia más alta de hemorragias vítreas descrita en esta corta serie de casos podría deberse a la diversidad clínica de las distintas etnias2,40, al diagnóstico tardío del melanoma uveal en nuestro país o al índice algo más alto de hemorragias intraoculares descrito en una serie de casos grande en población hispana2.
Las cataratas, las deficiencias de las células madre limbares y el glaucoma son otros efectos secundarios de la radiación41,42. La incidencia de cataratas como complicación asociada a la radioterapia está entre el 43 y el 64%41. La incidencia de deficiencias de las células madre limbares se sitúa en torno al 2%, y al 33% en los pacientes que reciben radioterapia en el segmento anterior43,44. El glaucoma es también prevalente tras la radioterapia, con una tasa de incidencia que se sitúa entre el 3 y el 9%. Esta variación depende de la siembra tumoral dentro del ángulo de la cámara anterior41. Son varios los estudios que hablan de una baja incidencia de complicaciones corneales (entre el 3 y el 9%). No obstante, la aparición de ojo seco tras la radioterapia sí es altamente prevalente45.
Además, aunque la radioterapia está cubierta por el actual sistema nacional de salud, México solo cuenta con tres equipos CK®, y los gastos derivados de los viajes y del alojamiento han de ser costeados por los propios pacientes, lo cual limita las opciones de tratamiento y aumenta el gasto para muchos pacientes46,47. Esto puede acarrear retrasos en el diagnóstico y en el tratamiento, elevando las tasas de morbilidad y mortalidad. La braquiterapia con placas tampoco está disponible en todo el país, razón por la cual se deben explorar concienzudamente todas las opciones a nuestra disposición para obtener los mejores resultados, evitando en la medida de lo posible la realización de enucleaciones primarias. También podría ser útil realizar estudios que valoren la rentabilidad del sistema CK® comparado con otras opciones de radioterapia en un contexto del mundo real. Aunque los marcadores fiduciarios de carbón o los anillos de tantalio optimizan las imágenes en 3D de tumores intraoculares y posibilitan mejores planes de radiación48, estos todavía no están disponibles en México.
Por último, cabe señalar que entre el 15 y el 26% de los supervivientes oncológicos experimentan niveles significativos de depresión y ansiedad entre 2 y 5 años después de recibir el tratamiento médico, lo cual influye negativamente en la adherencia a este, así como en la recuperación y la calidad de vida49. Tratar los síntomas psicopatológicos de estos supervivientes como parte de un abordaje multidisciplinario puede ayudar a evitarlos, detectarlos y realizar intervenciones rápidas en pacientes de riesgo.
Las limitaciones de este estudio son el corto tiempo de seguimiento, el pequeño número de pacientes incluidos y su naturaleza retrospectiva. El seguimiento fue muy corto como para observar buena parte de la toxicidad asociada a la radioterapia. Series de casos más extensas con seguimientos más prolongados podrían avalar el perfil de seguridad a largo plazo del sistema CK®.
Tal como revelan nuestros resultados preliminares50, el sistema CK® es una alternativa terapéutica efectiva para el tratamiento de los MCC-C de tamaño medio a grande. Además, este tratamiento ambulatorio podría contribuir a reducir el uso de servicios hospitalarios en el marco actual de la pandemia de COVID-19, cuando menos hospitalizaciones contribuyen a aliviar la ya de por sí elevada demanda de atención sanitaria49,51-53.
Conclusiones
Este estudio retrospectivo preliminar sugiere que el sistema CK® es una opción viable y efectiva en el arsenal terapéutico para el manejo del MCC-C, puesto que logra un adecuado control tumoral. Además, el sistema CK® ofrece una opción directa para la preservación del globo ocular y la evitación de procedimientos de enucleación. El pequeño porcentaje de eventos adversos secundarios al tratamiento inicial se gestionó con opciones terapéuticas conocidas, tales como esteroides y agentes antiangiogénicos. Necesitamos estudios comparativos prospectivos más extensos y con seguimientos más largos para poder avalar el perfil de seguridad y eficacia del sistema CK®. Como ya se ha explicado, la participación de un equipo multidisciplinario también es de una importancia capital en lo que a la atención del paciente se refiere en una unidad de radiocirugía.











 nueva página del texto (beta)
nueva página del texto (beta)


