Introducción
El síndrome de Aicardi (SA) fue descrito en 1965 por Jean Aicardi y se caracteriza por una tríada de anormalidades que incluye agenesia total o parcial del cuerpo calloso, lagunas coriorretinianas y espasmos infantiles1,2.
El SA se estima que tiene una incidencia de 1:100,000 en los Estados Unidos de América y de 1:93,000 en Holanda. Hasta el momento solo se han descrito 4,000 casos en la literatura médica mundial3,4.
El diagnóstico de SA sigue basándose en la presencia de la tríada clínica; sin embargo, los nuevos estudios de imagen permiten diagnosticar casos atípicos o incompletos. Los espasmos infantiles son el tipo de epilepsia más común del SA y la mayoría de las veces aparecen en edades tempranas (3-4 meses)1,3.
Una característica distintiva del SA, además de los hallazgos cerebrales, son las manifestaciones oftalmológicas. Las lagunas coriorretinianas son patognomónicas del SA. Otras alteraciones oculares que se pueden encontrar son microftalmia, persistencia de la membrana iridopupilar, coloboma coriorretiniano, neovascularización coroidea, anormalidades del nervio óptico incluyendo hipoplasia, coloboma, anomalía de Morning Glory, desprendimiento de retina seroso y extensión de tejido glial al disco óptico5-9.
Entre las alteraciones no neurológicas se encuentran anormalidades vertebrales, anormalidades costales, como ausencia o bifurcación de las costillas, y escoliosis, que se presentan en la mitad de los casos1,3.
La importancia del presente reporte de caso radica en que se trata de una paciente que inició con manifestaciones neurológicas, por lo cual se decidió su valoración por los servicios de genética y oftalmología.
El objetivo es dar a conocer a la comunidad oftalmológica mexicana la importancia de un abordaje interdisciplinario y multidisciplinario para los síndromes genéticos raros que manifiestan signos oftalmológicos clave y permiten un diagnóstico sindrómico certero.
Caso clínico
Paciente de sexo femenino de 1 mes de edad que se presenta al departamento de genética con antecedentes de epilepsia, agenesia total del cuerpo calloso y disgenesia vertebral con escoliosis, los cuales fueron identificados durante la evaluación neurológica previa (Fig. 1). Fue producto de tercera gesta de padres no consanguíneos y nació por cesárea con embarazo de término sin complicaciones. No requirió maniobras de reanimación cardiopulmonar avanzada, el peso al nacer fue de 2,900 g y la talla fue de 49 cm; se desconocen las puntuaciones en las escalas de Apgar y Silverman-Anderson.
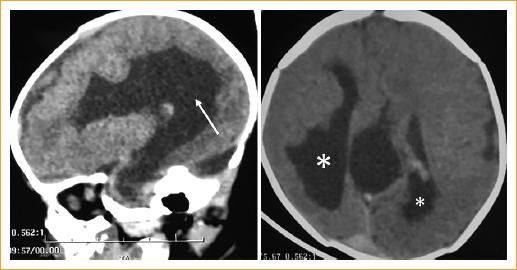
Figura 1 Imágenes de tomografía que muestran agenesia total de cuerpo calloso (flecha) y heterotopia cortical (asteriscos).
En la exploración física al mes de edad, la paciente presentaba hipotonía generalizada sin organomegalias. En el examen oftalmológico mostró acortamiento de los fondos de saco de ambos ojos, y en el ojo derecho microftalmia, con el resto de las estructuras no valorables. En el ojo izquierdo se halló microcórnea y el resto del segmento anterior sin alteraciones. La fundoscopia del ojo izquierdo mostró el nervio óptico con excavación asimétrica con un remanente escaso nasal, pigmento peripapilar mínimo y vasculatura anormal con emergencia central que corresponde a un coloboma. Además, presenta múltiples lesiones coriorretinianas de aproximadamente un área de disco, de coloración amarillenta, ovoideas, con pigmento variable en sus bordes y distribuidas en el área peripapilar confinadas en el polo posterior, las cuales son sugestivas de lagunas coriorretinianas (Fig. 2). En la ecografía ocular se observó una longitud axial del ojo derecho de 14.94 mm, con lo que confirmamos el diagnóstico de microftalmia. Como parte del abordaje, el departamento de genética solicitó cariotipo, que reportó 46, XX. El departamento de neurología indicó manejo terapéutico con ácido valproico (250 mg/5 ml) cada 8 horas por vía enteral, clonazepam (0.48 mg) cada 24 horas por vía oral, vigabatrina (500 mg) cada 12 horas por vía oral y levetiracetam (100 mg/2.2 ml) cada 12 horas por vía intravascular. El departamento de oftalmología integral indicó valoración por parte de los servicios de glaucoma, retina, oculoplástica y visión baja del Instituto de Oftalmología, que decidieron un abordaje en conjunto para ambliopía de origen mixto y elaboración de prótesis ocular para el ojo derecho, así como explicación del pronóstico visual reservado para ambos ojos por la patología de base.
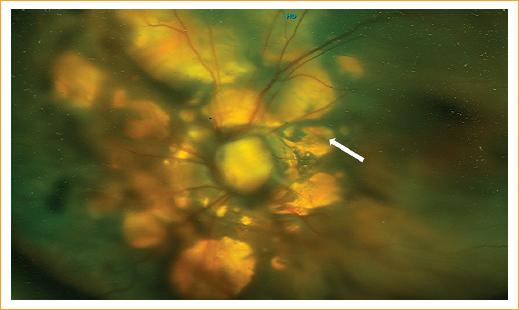
Figura 2 Fundoscopia del ojo izquierdo que muestra coloboma del nervio óptico y múltiples lesiones planas coriorretinianas de distribución peripapilar con pigmento variable en sus bordes, que son sugestivas de lagunas coriorretinianas (flecha).
Desafortunadamente, la paciente falleció por complicaciones de una neumonía adquirida en la comunidad que cursó con síndrome de dificultad respiratoria, choque séptico y finalmente paro cardiorrespiratorio con 1 año y 7 meses de edad.
Discusión
Para establecer el diagnóstico de SA se necesita la presencia de la tríada clásica o la presencia de dos componentes de la tríada clásica y al menos dos criterios mayores o de soporte1,3 (Tabla 1). Nuestra paciente presentó la tríada clásica, y además dos criterios de apoyo, por lo cual se llegó al diagnóstico de SA.
Tabla 1 Criterios diagnósticos modificados para el síndrome de Aicardi
| Criterios mayores: |
| Espasmos infantiles*: 95% (tríada clásica) |
| Lagunas coriorretinianas†: 100% (tríada clásica) |
| Agenesia del cuerpo calloso (total o parcial): 100% (tríada clásica) |
| Coloboma o hipoplasia del disco óptico (nervio óptico) unilateral: 39-92% |
| Malformaciones corticales (principalmente polimicrogiria): 53% |
| Heterotopia periventricular y subcortical: 55% |
| Quistes intracraneales (probablemente ependimal) interhemisféricos o alrededor del tercer ventrículo: 66% |
| Papilomas del plexo coroideo: 66% |
| Criterios de apoyo: |
| Anormalidades vertebrales o costales: 56% |
| Microftalmia u otras anormalidades oculares: 36% |
| Electroencefalograma de cerebro dividido (supresión disociado - rastreo en ráfagas): 86% |
| Asimetría hemisférica cerebral gruesa: 58% |
*Puede ser reemplazado por otros tipos de epilepsia (usualmente focal).
†Presente (o probablemente presente) en todos los casos.
El examen oftalmológico es clave en el diagnóstico y debe ser realizado por un oftalmólogo con entrenamiento en oftalmología pediátrica o por un genetista con alta especialidad en padecimientos oftalmológicos7. Dentro de los casos reportados en la literatura destaca el hallazgo de lagunas coriorretinianas hasta en el 100% de los casos, y son consideradas patognomónicas en el SA5-9; se caracterizan por ser lesiones amarillas o blanco-amarillentas, redondeadas, de tamaño variable y de localización peripapilar en el polo posterior. Histopatológicamente corresponden a epitelio pigmentado retiniano hipopigmentado con desorganización de la retina. Las anomalías del nervio óptico son frecuentes y los colobomas son la presentación más común, hasta en el 39% de los casos. Sin embargo, también se han descrito otras alteraciones, ocupando el segundo lugar la anomalía de Morning Glory, en el 21-86% de los casos. También se han descrito la presencia de microftalmia, más habitual del lado derecho, y de otras alteraciones tales como anormalidades de los vasos retinianos5-9.
Aunque los genes causantes de SA no han sido reconocidos hasta la fecha, se sospecha que el origen es una mutación genética ligada al X, ya que los casos reportados son exclusivos en pacientes de sexo femenino, tal como nuestro caso. Los pocos casos en varones fueron con cariotipo 47, XXY y uno con 46, XY. Algunos autores sugieren que el proceso de inactivación del cromosoma X puede explicar la variabilidad y la asimetría observadas en la enfermedad, y esto se ve respaldado por una prevalencia más alta de lo normal de inactivación cromosómica X sesgada en los linfocitos periféricos en el SA, sobre todo en aquellos pacientes con involucro neurológico10.
El neurólogo pediatra con experiencia en el manejo de espasmos infantiles es esencial para el tratamiento a largo plazo de los pacientes con SA, quienes con frecuencia requieren varios antiepilépticos para el control adecuado de las convulsiones, como en nuestro caso. En las series de casos se encuentran como características principales la agenesia total o parcial del cuerpo calloso (100%) y los espasmos infantiles (95%), signos que pertenecen a la tríada clásica. Entre otros datos se pueden encontrar heterotopía cortical (55%), polimicrogiria (53%), quistes intracraneales (66%) y papilomas de los plexos coroideos (66%)1,4,6.
Las intervenciones adicionales incluyen terapia física, terapia ocupacional, terapia del habla y terapia visual, las cuales deben iniciarse tan pronto como sea posible para asegurar el mejor desarrollo y la funcionalidad de los diferentes órganos de los sentidos. Los defectos costovertebrales pueden llevar a escoliosis, como en nuestro caso. El adecuado apoyo musculoesquelético y el tratamiento para la prevención de complicaciones relacionadas se encuentran indicados3.
La tasa de supervivencia es del 76% hasta a los 6 años y del 40% hasta los 14 años de edad. La mayoría de los pacientes tienen deterioro en los primeros 5-6 años de vida y es complicado determinar las complicaciones de las malformaciones y las consecuencias de una epilepsia no controlada. La mayoría de los pacientes permanecen con estatura baja como consecuencia de la escoliosis1.
Como limitaciones del presente caso tenemos el pobre seguimiento de la paciente por parte del departamento de oftalmología, debido a numerosos ingresos al servicio de urgencias pediátricas por cuadros repetitivos de infección de vías respiratorias bajas, donde no solicitaron interconsultas de seguimiento. Esto llevo a dificultades en el seguimiento externo de la paciente. Finalmente, no se pudo valorar su evolución debido a que la paciente falleció con 1 año y 7 meses de edad.
En conclusión, debemos enfatizar que es necesario el examen oftalmológico completo y que este permite individualizar el plan terapéutico. En cuanto a la terapia visual, recomendamos una implantación temprana de prótesis en casos de acortamiento de los fondos de saco, y lograr un aspecto estético y anatómico adecuado. En caso de que exista integridad de las vías visuales, hay que realizar estímulo visual (apoyándonos de oftalmólogos con alta especialidad en visión baja) y consejo psicológico para el paciente y los familiares.











 nueva página del texto (beta)
nueva página del texto (beta)


