Introducción
La vitrectomía vía pars plana en diabéticos presenta una alta tasa de complicaciones corneales, incluyendo defectos epiteliales y edema estromal, que a menudo son resistentes al tratamiento convencional1. La influencia de las condiciones sistémicas (valores de hemoglobina A1c, nefropatía o neuropatía diabética) en su desarrollo aún no está bien establecida1.
La diabetes mellitus es un factor de riesgo para presentar defectos epiteliales corneales persistentes luego de una vitrectomía2, los cuales pueden ocasionar queratitis infecciosa, endoftalmitis, cicatrización, lisis o perforación corneal, generando malestar, retraso en la recuperación visual e incluso pérdida visual independientemente del diagnóstico vitreorretiniano por el cual fue realizada la vitrectomía3. El mecanismo fisiopatológico de los defectos epiteliales corneales en diabéticos incluyen cambios en la composición de la membrana basal epitelial, depósitos de productos de glicación, daño en las terminaciones de los nervios corneales, reducción en la secreción de lágrimas y estrés oxidativo en condiciones de hiperglucemia4; también se han demostrado concentraciones más altas de metaloproteinasas de matriz 10 en pacientes con diabetes y alteraciones del epitelio corneal posvitrectomía5.
En el 17.4% de las vitrectomías vía pars plana en diabéticos es necesario realizar un desbridamiento corneal para mejorar la visibilidad de los cirujanos cuando la córnea se ha vuelto edematosa, en especial durante una cirugía compleja o prolongada6,7.
Zagon, et al.8 reportaron el beneficio del uso de insulina tópica en el cierre de defectos epiteliales corneales inducidos en ratas diabéticas, sin efecto en ratas no diabéticas ni en los valores sanguíneos de glucosa y la presión ocular. Estudios posteriores en humanos voluntarios mostraron que la insulina tópica diluida en solución salina en dosis de hasta 100 UI/ml no presentó signos de toxicidad ocular ni de absorción sistémica, y tampoco cambios en los valores sanguíneos de glucosa9,10. Wang, et al.11 mostraron el beneficio del uso de insulina tópica en el tratamiento de úlceras corneales neurotróficas refractarias al tratamiento convencional. Bastion y Ling12 reportaron una mejoría en el defecto epitelial corneal posterior a vitrectomía al usar insulina tópica 1 UI/gota en diabéticos, sin diferencias estadísticamente significativas al compararlos con ojos de pacientes no diabéticos. Fai, et al.7 corroboraron estos hallazgos en un ensayo clínico aleatorizado con varias dosis de insulina tópica, demostrando la superioridad de la dosis de insulina de 0.5 UI/gota, con un 100% de curación a las 72 horas de iniciado el tratamiento.
El objetivo del presente estudio fue comparar el efecto de la insulina, el hialuronato sódico y el tratamiento combinado en el tiempo hasta el cierre completo del defecto epitelial producido por el desbridamiento corneal transquirúrgico durante una vitrectomía vía pars plana en diabéticos.
Método
Diseño del estudio
Fue un ensayo clínico, controlado, realizado en pacientes diabéticos del Departamento de Retina y Vítreo del Instituto Mexicano de Oftalmología I.A.P., en Querétaro, México. Los datos del estudio fueron recolectados de agosto de 2019 a febrero de 2020, cumpliendo con la Declaración de Helsinki y tras la aprobación por el Comité de Ética en Investigación del Instituto Mexicano de Oftalmología I.A.P. (registro CONBIOETICA 22-CEI-003-2016215, folio CEI/020-2/2019). Todos los participantes dieron su consentimiento informado por escrito antes del procedimiento.
Criterios de inclusión y seguimiento
Los criterios de elegibilidad incluyeron ojos de pacientes con diagnóstico de diabetes mellitus tipo 1 o 2, mayores de 18 años, sometidos a vitrectomía vía pars plana por cualquier diagnóstico y en los cuales fue necesario el desbridamiento corneal transquirúrgico. El desbridamiento epitelial solo se realizó cuando hubo edema epitelial corneal transoperatorio que producía opacidad corneal y limitaba la visibilidad durante la cirugía. Se excluyeron pacientes con enfermedad de la superficie ocular previa (ojo seco grave, deficiencia de células limbares o antecedente de trauma ocular químico), usuarios de fármacos antiglaucomatosos y usuarios de lentes de contacto. Fueron eliminados del estudio los pacientes que abandonaron el tratamiento o decidieron retirarse del estudio, los que no completaron los controles de seguimiento, aquellos que desarrollaron endoftalmitis posterior al procedimiento y los que requirieron alguna reintervención quirúrgica durante el periodo de seguimiento. La gravedad del ojo seco se determinó mediante la revisión del historial clínico, en el cual se usó el OSDI (Ocular Surface Disease Index), definiendo como enfermedad grave una puntuación final > 33.
En el día 0 (posterior a la cirugía) se registró el defecto epitelial corneal basal usando tinción con fluoresceína tópica en el fondo de saco conjuntival del ojo operado y se tomaron fotografías clínicas con una cámara fotográfica de segmento anterior (Color Camera HV-D30, Hitachi Kokusai Electric, Japón) adaptada a la lámpara de hendidura bajo iluminación con luz azul de cobalto. La evaluación clínica del defecto epitelial y las fotografías se repitieron cada 24 horas hasta el cierre del defecto epitelial.
Aleatorización
Los ojos de los participantes fueron aleatorizados en una proporción de 1:1:1 para ser tratados con hialuronato sódico tópico al 0.15% (grupo I), insulina tópica 0.5 UI (grupo II) o tratamiento combinado con insulina tópica 0.5 UI y hialuronato sódico tópico al 0.15% (grupo III). En el estudio solo se incluyó un ojo por paciente y este fue seleccionado considerando los criterios de inclusión. No se consideró un grupo que recibiera placebo por consideraciones éticas. Los ojos de los pacientes inscritos fueron asignados aleatoriamente a uno de los tres grupos del estudio mediante un sistema generado por computadora (random.org), el cual se realizó por el médico investigador (J.Q.M) a través de la opción true random number generator, la cual era configurada para generar aleatoriamente un número del 1 al 3 para incluir al participante en uno de los tres grupos. Esto se realizaba hasta que los grupos completaran el tamaño muestral establecido; la selección se centraba en los grupos restantes si algún grupo completaba antes su tamaño establecido. El proceso de aleatorización se realizó el día que el paciente iniciaba el tratamiento. El tipo de intervención se determinó mediante este método y los pacientes fueron aleatorizados después de obtener su consentimiento y antes de iniciar el tratamiento posoperatorio. Una vez designados a uno de los tres grupos no se les permitió cambiar de grupo en ningún momento del estudio. Los pacientes estaban enmascarados para el tratamiento, pero no el médico investigador (J.Q.M). Otro investigador (D.V.C) se encargó de la preparación de la insulina tópica de acuerdo con un protocolo escrito. Se entregó a los participantes un gotero oftalmológico blanco, sin etiquetar, que contenía el mismo volumen de insulina tópica o de hialuronato de sodio para los grupos I y II, respectivamente; a los pacientes del grupo de tratamiento combinado se les entregó dos frascos blancos, uno que contenía insulina y el otro hialuronato sódico, con una etiqueta pegada que indicaba su frecuencia de uso. Todos los pacientes fueron operados por cirujanos expertos, los cuales no tuvieron un proceso de selección ni aleatorización. Se utilizó el sistema de visualización de no contacto EiBOS 2 (Haag Streit, EE.UU.) para todas las cirugías vitreorretinianas.
Intervención
Todos los pacientes recibieron un régimen posquirúrgico similar de esteroides tópicos (acetato de prednisolona al 1%) cada 4 horas y antibiótico tópico cada 4 horas (gatifloxacino al 0.3%) en el ojo operado, que se redujo gradualmente después de 1 semana. Adicional a esto se usó el tratamiento de insulina, hialuronato sódico o combinado.
Intervención activa: insulina y tratamiento combinado
La insulina a dosis de 0.5 UI/gota fue preparada bajo condiciones de asepsia usando insulina humana recombinante 100 UI/ml (Humulin® R, Eli Lilly and Company, Indiana, EE.UU.). Se tomaron 1.25 ml de insulina (125 UI) en un gotero oftalmológico estéril sin etiquetar y se adicionaron 3.75 ml de solución salina estéril al 0.9%, alcanzando una concentración de 25 UI/ml, equivalente a 0.5 UI/gota, para ser usada7. Los pacientes recibieron una gota 4 veces al día, a una dosis de 0.5 UI/gota de insulina tópica, adicional al tratamiento posoperatorio. El frasco fue mantenido en refrigeración por el paciente y cambiado por una nueva preparación cuando la duración del tratamiento era mayor de 3 días. Las gotas de insulina se suspendían una vez que el defecto epitelial corneal había cerrado por completo. No se realizó ninguna técnica de verificación para corroborar el apego al tratamiento, el cual se verificó mediante confirmación verbal.
En el caso del tratamiento combinado, los compuestos fueron administrados en frascos blancos separados, con una etiqueta cada uno que indicaba la frecuencia de uso (la insulina «una gota 4 veces/día» y el hialuronato «una gota 6 veces/día»), y se instruyó al paciente para que esperara al menos 15 minutos entre la aplicación tópica de cada compuesto cuando ambos coincidieran; también se explicó que la aplicación debería ser con el párpado inferior traccionado hacia abajo durante su instilación para facilitar el procedimiento. Las gotas se suspendían cuando el defecto epitelial corneal cerraba por completo.
Intervención de control: hialuronato sódico
Los pacientes recibieron, además del tratamiento posquirúrgico descrito, una gota 6 veces al día de hialuronato sódico tópico al 0.15% (Hyabak®, Laboratorios Théa® México), que les era entregado en un frasco blanco sin etiquetar. Las gotas se suspendían una vez que el defecto epitelial corneal había cerrado por completo.
Tamaño de la muestra
Se consideró un valor de a = 0.05 y una potencia del 80%. Se hizo uso de datos previos de un estudio que usó la tasa de reepitelización (mm2/h)8, con lo cual se determinó un tamaño de muestra de 9.73, es decir, un mínimo de 10 pacientes para cada grupo de comparación usando el cálculo de tamaño muestral para comparación de medias. Además, se consideró un ajuste por posibles pérdidas usando la fórmula [muestra ajustada a las pérdidas = n (1 / 1 R)], donde n es el número de sujetos sin pérdidas y R es la proporción esperada de pérdidas. En el presente estudio se esperó tener un 15% de pérdidas, por lo que el tamaño muestral necesario fue de 9.73 (1 / 1-0.15) = 11.44 (12 pacientes en cada grupo).
Análisis de las imágenes
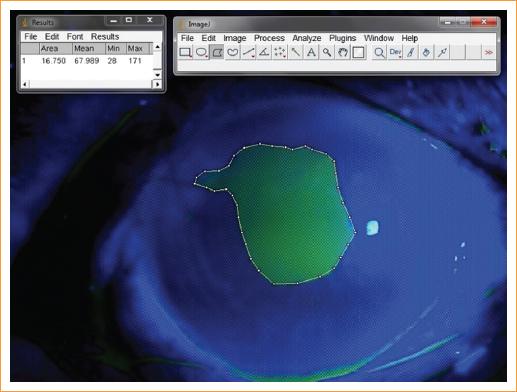
Un mismo investigador (J.Q.M.) analizó todas las imágenes, delineando manualmente el defecto epitelial en las fotografías del segmento anterior teñidas con fluoresceína utilizando el programa de análisis de imagen ImageJ, un programa de procesamiento de imagen digital de dominio público desarrollado en el National Institute of Health (Fig. 1). Este programa permite establecer una escala de la imagen a una distancia seleccionada y convertir los píxeles de la distancia seleccionada a una unidad deseada, calculando así una unidad preestablecida. Para el estudio se marcó en la computadora una línea horizontal desde el limbo nasal de la córnea hasta el limbo temporal contrario en el diámetro corneal horizontal máximo, permitiendo correlacionar los píxeles de la distancia seleccionada a milímetros (el diámetro horizontal corneal en milímetros fue medido con lámpara de hendidura para cada paciente). Posteriormente se delineó el defecto epitelial para calcular su área en milímetros cuadrados. La reepitelización se definió como el defecto epitelial basal menos el defecto actual dividido entre el defecto basal multiplicado por 100.
Desenlace primario
El objetivo principal fue evaluar el tiempo (días) que el defecto epitelial corneal demoraba en cerrar en todos los grupos. El cierre del defecto epitelial se definió como la ausencia de cualquier lesión corneal después de la administración tópica de fluoresceína o la presencia de una tinción de fluoresceína residual mínima aislada con síntomas leves o nulos. Los objetivos secundarios fueron medir el área del defecto epitelial corneal y determinar la tasa de reepitelización corneal y el porcentaje de reducción del área del defecto epitelial diario, además de la aparición de eventos adversos como persistencia del defecto epitelial, infección, lisis corneal o perforación corneal.
Estadística
Se realizó estadística descriptiva, presentando las variables con medidas de resumen de tendencia central y de dispersión para las variables cuantitativas, y con frecuencias absolutas y relativas para las variables cualitativas. Se evaluó la normalidad de las variables cuantitativas con la prueba de Shapiro-Wilk, con un nivel de significancia de 0.05. En la estadística inferencial se emplearon las pruebas de ji al cuadrado y de Kruskal-Wallis con el paquete estadístico Stata® versión 15.1 (StataCorp. 2015, Stata Statistical Software: Release 15. College Station, Texas, US: StataCorp LP.), con un nivel de significancia de 0.05.
Resultados
Se incluyeron 36 ojos de 36 pacientes diabéticos a quienes se realizó desbridamiento del epitelio corneal durante una vitrectomía vía pars plana, atendidos en el Departamento de Retina y Vítreo del Instituto Mexicano de Oftalmología I.A.P. Estos pacientes representan el 13.3% del total de las vitrectomías vía pars plana en pacientes diabéticos realizadas en la institución durante el periodo de estudio. En cada grupo de tratamiento se incluyeron 12 ojos. No hubo diferencias estadísticamente significativas entre los grupos en cuanto a sus características basales (Tabla 1). En relación con el objetivo principal, el tiempo necesario hasta el cierre del defecto epitelial fue de 4.25 ± 0.62 (rango: 3-5), 3.0 ± 0.85 (rango: 2-4) y 3.33 ± 0.98 (rango: 2-5) días en los grupos I, II y III, respectivamente. En todos los grupos hubo una reducción del área del defecto epitelial a partir del día 1, notándose una menor área en el grupo II al día 3; sin embargo, esta diferencia no fue estadísticamente significativa en comparación con los otros grupos (Tabla 2 y Fig. 2). Todos los grupos tuvieron una reducción estadísticamente significativa (p < 0.05) del porcentaje del área del defecto epitelial a partir del día 1, con una reducción del 100% desde el día 4 en el grupo II y desde el día 5 en los grupos I y III. Se observó una diferencia estadísticamente significativa (p < 0.05) en el porcentaje de reducción del área del defecto epitelial en el día 3 entre el grupo I (89.3 ± 8.3%) y el grupo II (97.3 ± 4.5%). La tasa de reepitelización fue significativamente mayor en el grupo que recibió insulina, en comparación con los pacientes que recibieron hialuronato, y mayor en los que recibieron tratamiento combinado en comparación con los tratados solo con hialuronato. El porcentaje de reepitelización fue significativamente mayor en el grupo que recibió insulina que en el que recibió hialuronato (Tabla 3). No se reportaron efectos adversos de la medicación recibida en ninguno de los grupos y ningún paciente fue eliminado del estudio ni requirió terapia de rescate.
Tabla 1 Características demográficas y clínicas basales (n = 36)
| Variable | Grupo I (n = 12) | Grupo II (n = 12) | Grupo III (n = 12) | p* |
|---|---|---|---|---|
| Edad en años, mediana (RIC) | 56 (53.5-60) | 51.5 (47-55) | 55 (50.5-64) | 0.14 |
| Sexo, n (%) | ||||
| Femenino | 7 (58.3) | 7 (58.3) | 7 (58.3) | 1.0 |
| Lateralidad, n (%) | ||||
| Ojo derecho | 7 (58.3) | 6 (50) | 7 (58.3) | 0.81 |
| Área basal (mm2) | 58.1 ± 8.9 | 56.4 ± 9.5 | 57.2 ± 8.9 | 0.90 |
| Hemoglobina A1c (%), mediana (RIC) | 7.8 (6.3-8.3) | 8.5 (6.5-9.7) | 6.7 (6.7-6.7) | 0.66 |
| Creatinina (mg/dl), mediana (RIC) | 1.15 (0.9-3.3) | 0.8 (0.7-1.7) | 0.8 (0.6-1.7) | 0.35 |
| Diagnóstico, n (%) | 0.73 | |||
| Hemovítreo | 2 (16.7) | 1 (8.3) | 2 (16.7) | |
| Desprendimiento de retina traccional | 8 (66.7) | 10 (83.3) | 8 (66.7) | |
| Desprendimiento de retina mixto | 2 (16.7) | 1 (8.3) | 2(16.7) | |
| Cirugía combinada, n (%) | 9 (75) | 10 (83.3) | 10 (83.3) | 0.55 |
| Uso de silicón, n (%) | 11(91.7) | 10 (83.3) | 11 (91.7) | 0.71 |
RIC: rango intercuartílico.
*Kruskal-Walis para variables cuantitativas y ji al cuadrado para variables cualitativas.
Tabla 2 Cambio diario en el área del defecto epitelial en los tres grupos de estudio
| Área en mm2, mediana (RIC) | Basal | Día 1 | Día 2 | Día 3 | Día 4 | Día 5 | Día 6 | Día 7 |
|---|---|---|---|---|---|---|---|---|
| Grupo I | 56.1 (51.5-67.5) | 36.3 (31.2-44.5) | 17.1 (15.7-20.5) | 3.9 (2.5-10.5) | 0 (0-1.1) | 0 | 0 | 0 |
| Grupo II | 51.8 (49.9-65.9) | 32.1 (24.4-43) | 12.8 (0-19.3) | 0 (0-3.5) | 0 | 0 | 0 | 0 |
| Grupo III | 56.2 (48.9-66.5) | 32.2 (20.2-46) | 9.8 (2.6-22.8) | 1.5 (0-7.1) | 0 | 0 | 0 | 0 |
| p* | 0.9326 | 0.4435 | 0.2053 | 0.0530 | 0.3768 | NA | NA | NA |
NA: no aplicable; RIC: rango intercuartílico.
*Kruskal-Walis: comparación de las medias de los diferentes grupos en los diferentes días.
Tabla 3 Reepitelización comparativa y eventos adversos en los tres grupos de estudio
| Grupo I | Grupo II | Grupo III | p* | |
|---|---|---|---|---|
| Tasa de reepitelización (mm2/día), mediana (RIC) | 13.6 (12.1-15.8) | 18.8 (16.5-24.7) | 17.5 (16.5-21.3) | 0.004† |
| Porcentaje de reepitelización (%/día), mediana (RIC) | 25 (20-25) | 33.3 (25-50) | 29.2 (25-41.7) | 0.008‡ |
| Efectos adversos | 0 | 0 | 0 |
RIC: rango intercuartílico.
*Kruskal-Wallis: comparación de medianas en los diferentes grupos.
†En el análisis post-hoc se encontró una diferencia estadísticamente significativa entre los grupos I y II, y entre los grupos I y III.
‡En el análisis post-hoc se encontró una diferencia estadísticamente significativa entre los grupos I y II.
Discusión
La insulina es un péptido estrechamente relacionado con el factor de crecimiento insulinoide (IGF, insulin-like growth factor). En la diabetes mellitus hay una disrupción en la vía de señalización de la insulina, lo que genera un retraso en la cicatrización de las heridas corneales y los defectos epiteliales13,14. La disfunción celular de la córnea de un paciente diabético, junto con la falla en los mecanismos de reparación tisular, generan erosiones recurrentes, retraso en la cicatrización de defectos corneales y úlceras15,16. La fragilidad y la inadecuada adherencia epitelial, acompañada de la pérdida de los plexos nerviosos y la disminución de la sensibilidad corneal, forman parte de la fisiopatología para el desarrollo de queratopatía diabética17,18. Adicionalmente, la pérdida del factor trófico derivado de los nervios también desempeña un papel importante en la proliferación y la migración epitelial19. Se ha reportado que tanto el IGF como la sustancia P aceleran la cicatrización de las heridas del epitelio corneal en animales diabéticos20. La insulina se ha hallado en las lágrimas humanas, y la presencia de insulina y del receptor de IGF-1 ha sido demostrada en la superficie ocular21. El IGF-1 tópico ha mostrado mejorar los defectos epiteliales corneales, probablemente al promover la migración celular del epitelio corneal y la diferenciación de células madre del limbo corneal22. Además, el uso de insulina en células de epitelio corneal in vitro ha mostrado facilitar el cierre de pequeñas heridas corneales a través de una optimización en la migración celular23. Pese a estos hallazgos, el mecanismo exacto por el cual la insulina acelera la reepitelización corneal en los diabéticos aún no se conoce por completo.
En el presente estudio, los valores séricos de hemoglobina A1c y de creatinina no influyeron en la reepitelización corneal, conforme a lo reportado previamente1. La mayoría de nuestros pacientes fueron sometidos a cirugías combinadas de facovitrectomía (75-83%); asimismo, el 67-83% presentó desprendimiento de retina traccional y en el 83-92% se empleó aceite de silicón como endotampón. Todo ello implica mayor complejidad, tiempo quirúrgico prolongado y mayor probabilidad de realizar un desbridamiento corneal para completar la cirugía.
El cambio diario en el área del defecto epitelial mostró una mejoría significativa en los tres grupos de estudio, con una menor área y tendencia hacia una diferencia estadísticamente significativa al tercer día a favor del grupo con insulina tópica (p = 0.0673), mientras que el porcentaje de reducción del defecto epitelial sí mostró diferencia estadísticamente significativa en el día 3 en dicho grupo. Esto es similar a lo reportado por Fai, et al.7, quienes encontraron una mayor diferencia a las 12 y 60 horas al comparar la insulina 0.5 UI/gota contra placebo. Tanto el grupo II (insulina tópica) como el grupo III (tratamiento combinado) presentaron una mayor tasa de reepitelización corneal estadísticamente significativa en comparación con el grupo I (hialuronato sódico), y el porcentaje de reepitelización fue significativamente mayor en el grupo de insulina tópica que en el de hialuronato sódico.
Ling y Bastion24 hallaron un cierre completo del defecto epitelial corneal inducido durante la vitrectomía en diabéticos a las 64.8 horas (equivalente a 2.7 días) usando hialuronato sódico al 0.18%, frente a 87.6 horas (equivalente a 3.65 días) en diabéticos sin ningún tratamiento tópico; asimismo, demostraron una mayor demora hasta la reepitelización completa en los pacientes diabéticos comparados con los no diabéticos (hasta 4 días en diabéticos vs. 2.3 días en no diabéticos, ambos sin tratamiento tópico). Creemos que las diferencias respecto a lo hallado por nosotros se deben al número pequeño de pacientes en ambos estudios, y al seguimiento cada 24 horas en el nuestro (manejo ambulatorio) en lugar de cada 12 horas en el de ellos, lo que podría reflejar cierto sesgo. De igual forma, Schulze, et al.25 reportaron tiempos más prolongados hasta el cierre completo del defecto epitelial corneal al usar otros tratamientos tópicos en 23 pacientes diabéticos con desbridamiento epitelial corneal durante la vitrectomía: 4.3 días usando suero autólogo y 7.1 días usando hialuronato sódico.
La insulina que se utilizó en este estudio fue Humulin® R, una insulina de acción rápida que contiene insulina humana recombinante 100 UI con excipientes como metacresol, glicerol, fenol, sulfato de protamina, óxido de zinc, ácido clorhídrico e hidróxido de sodio26. A pesar de que muchos de estos excipientes no están relacionados con la cicatrización corneal, está reportado que el zinc interviene en la cicatrización de las heridas de la piel27. El zinc desempeña un papel importante en la regulación de cada fase del proceso de curación de heridas, desde la reparación de membranas hasta la formación de cicatrices, y su deficiencia sistémica se ha relacionado con defectos corneales refractarios28.
La ausencia de toxicidad de la insulina sobre la superficie ocular en humanos fue reportada desde los estudios de Bartlett, et al.9,10, que mostraron que la insulina a concentraciones de hasta 100 U/ml (aproximadamente 2.5 UI/gota) en solución salina no mostraba toxicidad clínica detectable. Su inocuidad sobre la superficie ocular también está reportada con dosis menores (0.5-2 UI/gota)7,12. Nuestros resultados son concordantes con los mencionados anteriormente en relación a su inocuidad a dosis de 0.5 UI/gota; sin embargo, la presencia de excipientes como el hidróxido de sodio y el ácido clorhídrico como estabilizadores del pH en Humulin® R podría generar cambios en la superficie ocular que merecen ser estudiados.
Deben mencionarse diversas limitaciones de este estudio, como el tamaño de muestra pequeño y el plazo de la evaluación durante el seguimiento (cada 24 horas), que no permitió hacer un análisis para evaluar la tasa de curación exacta (en mm/h) del defecto al no estar los pacientes hospitalizados. No se realizó ningún proceso para verificar el apego al tratamiento, que confirmó verbalmente el paciente, lo cual debilita el estudio porque no permite verificar si en realidad el tratamiento se completó o no. Otra limitación importante es el enmascaramiento incompleto del tratamiento, pues solo los participantes desconocían el tratamiento y no los investigadores, lo cual genera un sesgo que podría influir en los resultados de la investigación. Adicionalmente, por consideraciones éticas no hubo grupo control tratado con placebo.
Nuestros hallazgos, junto con lo reportado en estudios previos en humanos7-12, demuestran que la insulina tópica es una terapia efectiva, segura y fácil de preparar para el tratamiento del desbridamiento corneal transquirúrgico en pacientes diabéticos.
Conclusiones
El tratamiento con insulina tópica 0.5 UI/gota en monoterapia y el tratamiento combinado de insulina con hialuronato sódico al 0.15% son efectivos para el cierre de defectos epiteliales después del desbridamiento corneal transquirúrgico en pacientes diabéticos. La terapia es segura y no se presentaron eventos adversos.











 text new page (beta)
text new page (beta)