Introducción
La Organización Mundial de la Salud estimó que, en 2018, cerca de 1,300 millones de personas presentaban alguna forma de deficiencia visual, y las principales causas eran los errores de refracción no corregidos y la catarata. Aproximadamente existen 36 millones de ciegos debido a catarata, tracoma, cicatrices corneales, glaucoma, retinopatía diabética, degeneración macular relacionada con la edad y anomalías congénitas. Se estima que el 80% de estos casos podrían haberse evitado1.
El ojo se divide en segmento anterior y segmento posterior. El segmento anterior incluye la córnea, la conjuntiva, la cámara anterior, el iris, el cuerpo ciliar y el cristalino. La instilación de colirios oftálmicos se usa comúnmente para el tratamiento de enfermedades del segmento anterior por su fácil accesibilidad; sin embargo, las gotas oculares tópicas tienen una biodisponibilidad ocular deficiente debido a la barrera corneal, a la rápida filtración de la lágrima. El segmento posterior está compuesto por la coroides, el cuerpo vítreo y la retina. Los colirios oftálmicos deben viajar una gran distancia y atravesar varias barreras oculares para llegar al polo posterior del ojo, lo que conlleva a una baja biodisponibilidad del medicamento al llegar a su sitio de acción2.
La nanotecnología es una disciplina que se centra en el estudio, el diseño, la síntesis, la manipulación y la aplicación de diversos materiales, aparatos y sistemas funcionales, y controla la materia a nanoescala (1 a 100 nanómetros). De acuerdo con la National Nanotechnology Initiative, «la esencia de la nanotecnología es la capacidad de trabajar a un nivel molecular, átomo por átomo, para crear una gran estructura, con una organización molecular fundamentalmente nueva. El objetivo es explotar estas propiedades mediante el control de estructuras y dispositivos a niveles atómicos, moleculares y supramoleculares, y aprender a fabricar y usar estos dispositivos de manera eficiente»3. Permite aplicaciones para el diagnóstico, tratamiento, prevención y seguimiento de diferentes enfermedades.
Las aplicaciones de la nanotecnología son amplias, ejemplo de ello ocurre en el campo de la biología molecular para desarrollar métodos de biodetección de secuenciación de ADN a través de secuenciadores de nanoporos4,5. En farmacología clínica, para la creación de nanomedicinas6; recientemente, la Food and Drug Administration ha aprobado algunas nanomedicinas, entre las que se mencionan según el tipo de material, nanopartículas poliméricas, categorizadas como conjugados de polímero-fármaco y arquitectura de polímeros degradables, cuyas funciones son favorecer la difusión del medicamento a través de barreras anatómicas, aumentar la biodisponibilidad y vida media del fármaco, así como favorecer mecanismos de liberación controlada. También tiene aplicación en la optimización de imágenes diagnósticas, utilizando nanopartículas inorgánicas de óxido de hierro como reactivo para mejorar el contraste de las imágenes7, entre otras.
La aplicación de tratamientos basados en la nanotecnología en enfermedades oftalmológicas es la esperanza para millones de pacientes que padecen patologías oculares. Es el caso de los nanotransportadores y las nanosuspensiones. Estos tienen la capacidad de liberar medicamentos en sitios específicos, lo cual resulta en el uso de una menor dosis de medicamento, lo que minimiza el riesgo de efectos secundarios8. La brimonidina, ciclosporina, corticoides, implantes intravítreos de liberación sostenida, etc. son algunos ejemplos. A nivel de diagnóstico y seguimiento, la medición no invasiva de la presión intraocular (PIO), utilizada para detectar los niveles elevados de PIO, y la monitorización remota por medio de dispositivos a escala nano serán de gran beneficio para el diagnóstico precoz de la atrofia progresiva del nervio óptico y la vigilancia clínica de los pacientes con neuropatía óptica glaucomatosa9,10.
En esta revisión nos hemos centrado en los sistemas terapéuticos para enfermedades oculares basados en nanotecnología. Primero se hace una breve descripción de la anatomía ocular y las barreras que intervienen en la administración del fármaco; posteriormente se revisan las enfermedades oculares y los nanosistemas utilizados para su manejo; y finalmente se resume la perspectiva de la nanotecnología y los desafíos existentes en la terapia y el diagnóstico de las enfermedades oculares. Esta revisión proporcionará información y nuevas ideas para implementar tratamientos y desarrollar sistemas de manejo de enfermedades oculares frecuentes.
Anatomía del ojo y barreras oculares
En la tabla 1 se presentan las diferentes estructuras anatómicas oculares (Fig. 1), y se destaca su grosor, funciones y fisiología, así como su constitución. Estas características especiales pueden facilitar o impedir la acción de medicamentos tópicos oculares. Así mismo, se da un panorama general de las posibles dianas de acción, lo que permite comprender la implementación de los avances de la nanotecnología en oftalmología.
Tabla 1 Diferentes estructuras oculares y posibles dianas terapéuticas
| Barrera | Grosor de la barrera | Funciones | Fisiología | Constitución | Otros componentes |
|---|---|---|---|---|---|
| Película lagrimal | 3 μm de espesor y 3 μl de volumen11 | Lubricación, eliminación de detritos, protección antimicrobiana, nutrición de células madre, mantenimiento de la transparencia corneal; ello influye en el poder de refracción del sistema visual12. | Unidad funcional dinámica: tres compartimientos (fornical, menisco lagrimal y película lagrimal preocular). Propiedades tensioactivas y de estabilización de película lagrimal13. | Componente lipídico, componente acuoso y componente mucinoso12. | Inmunoglobulinas, lisozimas, lactoferrina, a y b14. |
| Córnea | 540-600 μm | Barrera contra infecciones y lesiones mecánicas del globo ocular. Dos tercios del poder refractivo del ojo (percepción de imágenes)15. | Epitelio corneal: 5-7 capas de epitelio escamoso no estratificado, unidas entre sí por desmosomas, y comunicadas por uniones gap que permiten la difusión de pequeñas moléculas < 1,000 Daltons. En contacto directo con el humor acuoso a través de acuaporinas y las bombas Na+K+ ATPasa presentes en células endoteliales16. | Lente avascular. Estructura viscoelástica rica en glucosaminoglicanos y proteoglicanos17. Seis capas: Bowman, estroma, capa de Dua, Descemet, capa de células endoteliales y epitelio corneal15,18. | Colágeno I, III, V y VIII. Proteoglicanos (decorin, lumican, queratocan, mimecan, biglycan y fibromodulina) y glicoproteínas15,17. |
| Conjuntiva | 44.9 ± 3.4 μm | A través de la mucina favorece la difusión de la lágrima y mantiene la estabilidad de la película lagrimal, previene las infecciones y la adhesión entre mucosas19. Cicatrización del epitelio corneal20. | Capa más externa del globo ocular. Conjuntiva bulbar, palpebral y fórnix. Células caliciformes productoras de mucina21. | Epitelio columnar estratificado no queratinizado (células caliciformes) en contacto con la lámina propia (tejido conectivo muy vascularizado)21. | Las proteínas TFF1 y TFF3 intervienen en el proceso cicatricial del tejido corneal19. |
| Esclerótica | 0.53 ± 0.14 mm | Propiedades viscoelásticas que otorgan fuerza y resistencia al globo ocular en el caso de elevaciones de la presión intraocular14. | Estroma formado por proteoglicanos, elastina y fibras de colágeno de amplias dimensiones. Se nutre indirectamente por la epiesclera, irrigada por los vasos ciliares posteriores largos y cortos, y la coroides. El drenaje venoso ocurre a través de las venas vorticosas22. | Cinco sextos de la túnica externa del ojo. Capa más interna (lámina Fusca)14 | |
| Úvea | Iris y cuerpo ciliar: 1-2 mm | Iris, regulador de la entrada de luz. Cuerpo ciliar: control de la acomodación, producción (acuaporinas) y regulación (gradientes electroquímicos) del flujo de humor acuoso y secreción de ácido hialurónico hacia el vítreo. Humor acuoso: nutrición de estructuras oculares avasculares, homeostasis de tejidos oculares, eliminación de productos del metabolismo, transporte de neurotransmisores y estabilización de la estructura ocular23. | Unión del cuerpo ciliar-córnea-esclera (ángulo iridocorneal): espacio por donde fluye el humor acuoso de la cámara posterior a la cámara anterior. El humor acuoso facilita la circulación de células y mediadores inflamatorios en condiciones patológicas, así como la difusión de los medicamentos hacia los diferentes tejidos24. | Parte intermedia del globo ocular conformada por: iris, cuerpo ciliar y coroides. Iris (tres capas): posterior (epitelio pigmentario), anterior músculo iridiano (circular o constrictor y radial o dilatador de la pupila) y estroma (tejido conectivo vascularizado). Cuerpo ciliar (pars plana y pars plicata)24. | Humor acuoso formado por iones orgánicos e inorgánicos, carbohidratos, glutatión, urea, aminoácidos, proteínas (colagenasas, inmunoglobulinas), oxígeno, dióxido de carbono y agua23. |
| Cristalino | 3.5-5 mm | Poder dióptrico (20% del total del globo ocular). Enfocar en la retina las imágenes provenientes del exterior. Mecanismo de defensa contra agentes oxidantes mediado por enzimas (glutatión reductasa y catalasa)25. | Se nutre a partir del humor acuoso. Metabólicamente activo, participa en el intercambio iónico a través de canales de Na+, K+, Ca++ y Cl-, también glucosa, aminoácidos y antioxidantes (glutatión)26. | Estructura avascular, transparente. Se divide en cápsula, epitelio cristaliniano, córtex y núcleo. El 60% proteínas (cristalinas a, b, g). Rodeado por una cápsula de colágeno (principalmente tipo IV y XVIII), así como por laminina, entactina, proteoglicanos (heparán sulfato), perlecan y fibronectina. En la región zonular, la composición predominante está dada por la presencia de fibrilina y elastina25,26. | Proteínas de membrana (diferentes uniones celulares de las células epiteliales cristalinianas): N-cadherinas, calpactinas, moléculas de adhesión neuronales tipo II, proteína mayor intrínseca (hidrofóbica), y acuaporina 0, enzimas (gliceraldehído 3 fosfato deshidrogenasa). El citoesqueleto contiene actina, a-actinina, anquirina, trompomudulina, miosina, espectrina25,26. |
| Coroides | 220-350 μm | Irrigar la retina, supliéndola de oxígeno y nutrientes. Absorción de luz, termorregulación y modulación de la presión intraocular, mediante el control del flujo sanguíneo27. | Drenaje de humor acuoso desde la cámara anterior, por la vía uveoescleral (35% de su drenaje)27. | Vasos sanguíneos, melanocitos, fibroblastos, células inmunocompetentes y estructura de soporte (colágeno y tejido conectivo elástico). Cuatro capas: membrana de Bruch, coriocapilar, dos capas vasculares y la supracoroides27. | |
| Humor vítreo | 4 cc | Su transparencia permite el paso de la luz hasta la retina y confiere estructura al globo ocular. Se constituye como una barrera y reto para medicamentos que actúen a nivel del polo posterior dadas sus propiedades físico-químicas, así como su carga iónica28. | Gel viscoelástico ubicado entre el cristalino y la retina, agua (98%), fibras de colágeno (II, V, IX y XI), ácido polihialurónico, electrolitos (sodio, potasio, calcio, cloro), prealbúmina, transferrina. Corresponde al 80% (4 cc) del volumen ocular29,30. | Más de 1,205 proteínas30. | |
| Epitelio pigmentario de la retina (EPR) | 0.4-1 mm31 | Mejorar la calidad de la visión a partir de la absorción de la energía lumínica concentrada en la mácula a través de los sistemas de refracción del globo ocular (córnea y cristalino). | Mecanismos propios celulares de reparación de ADN involucrados como mecanismos de defensa ante las especies reactivas de oxígeno33. Alta perfusión sanguínea de la coriocapilar (1,400 cc/min/100 g de tejido)34. | Agentes antioxidantes: superóxido dismutasa y catalasa. | |
| Epitelio pigmentario de la retina (EPR) | 0.4-1 mm31 | Evitar la foto-oxidación y el daño oxidativo a través del mecanismo de absorción de luz por medio de la melanina contenida en los melanosomas del EPR, los carotenoides (luteína y zeaxantina), y ascorbato contenido en los fotorreceptores32. | Transporta iones y agua del espacio subretinal hacia la coriocapilar a través de bombas Na+K+ATPasa y con transportadores K+/Cl-, manteniendo en cierta medida las presiones intraoculares33,35 | El mantenimiento del pH intracelular se encuentra mediado por los intercambiadores cloro-bicarbonato presentes en la membrana basolateral del EPR33. | |
| Retina neurosensorial | Fototransducción de las imágenes provenientes del exterior36. | Está irrigada por la arteria central de la retina y recibe aporte metabólico a través de la coroides31. La autorregulación de la presión retiniana está principalmente mediada por el incremento en la resistencia vascular de los vasos de la retina37. | Membrana limitante externa (cuerpo de fotorreceptores y células de Müller), capa nuclear externa (núcleos de los fotorreceptores), capa plexiforme externa (axones de fotorreceptores), capa nuclear interna (células bipolares), capa plexiforme interna (células bipolares y amacrinas), capa de células ganglionares, capa de fibras nerviosas, membrana limitante interna (membrana basal formada por las prolongaciones de las células de Müller)31,36. |
Conceptos de nanotecnología
La nanotecnología es la disciplina centrada en el estudio, diseño, síntesis, manipulación y aplicación de materiales, aparatos y sistemas funcionales, mediante el control de la materia a nanoescala (1-100 nanómetros)38.
Rápidamente se ha implementado el uso de la nanotecnología para el diagnóstico, tratamiento y control de diferentes enfermedades. Esta nueva rama científica se denomina nanomedicina. La evolución del conocimiento de la nanotecnología en áreas médico-quirúrgicas ha permitido el progreso de las aplicaciones en la oftalmología. Es así como se han diseñado novedosos nanosistemas oculares de diferentes formas y con características específicas para optimizar la biodisponibilidad de los medicamentos, al mejorar el tiempo de contacto y disminuir el proceso de eliminación del ojo39.
Existen muchos nanosistemas. Entre otros, los lentes de contacto cargados con nanopartículas para administrar acetazolamida en el tratamiento del glaucoma40, los implantes subconjuntivales biodegradables para administrar ciclosporina A para el tratamiento del síndrome del ojo seco41,42, el desarrollo de sistemas de nanocoloidales basados en hidrogeles para la liberación ocular de diclofenaco43,44, los sistemas nanomicelares poliméricos para enfermedades inflamatorias45,46, y los transportadores de lípidos nanoestructurados para el suministro controlado de medicamentos oculares para infecciones47,48.
Liposomas
Los liposomas son vesículas de lípidos, con una o más bicapas de fosfolípidos, y encierran un núcleo acuoso. En función de su tamaño y el número de bicapas de fosfolípidos, los liposomas pueden clasificarse en vesículas unilamelares pequeñas (10 y 100 nm), vesículas unilamelares grandes (100 y 300 nm) y vesículas multilamelares, que contienen más de una sola bicapa de fosfolípido49. Los liposomas son ideales porque encapsulan fármacos tanto hidrofílicos como hidrofóbicos y demuestran una muy buena compatibilidad con los tejidos oculares50,51. Ejemplo del uso de este tipo de nanopartículas son las nanosuspensiones de prednisolona e infliximab intravítreo con nanotransportador liposomal52,53.
Nanopartículas poliméricas
Las micelas poliméricas son nanopartículas estructuradas en núcleo/cubierta formados por el autoensamblaje de copolímeros anfifílicos. La estructura núcleo/cubierta permite la encapsulación de fármacos hidrófobos en su núcleo hidrófobo. Debido a que el núcleo está protegido por la corona hidrófila, la biodisponibilidad del fármaco se prolonga significativamente al ser administrado por vía tópica en los tejidos oculares54,55. Un estudio experimental desarrollado por Mittal, et al. con timolol maleato tópico en conejos evidenció biocompatibilidad con la córnea y disminución de la PIO por tiempos más prolongados56.
Nanosuspensiones
Son dispersiones coloidales en las cuales los fármacos hidrófobos se dispersan uniformemente en un medio acuoso con la ayuda de surfactantes9. La prednisona, dexametasona, hidrocortisona y otros corticosteroides, por ejemplo, se han administrado a través de nanosuspensiones para el tratamiento de la inflamación del segmento anterior, sin los efectos secundarios esperados de aplicaciones de dosis grandes, como en el caso de catarata y neuropatía óptica glaucomatosa.
Dendrímeros
Los dendrímeros son macromoléculas monodispersas, con varios grupos finales reactivos que rodean una molécula pequeña y forman una cavidad interna. Su arquitectura ramificada en forma de árbol presenta una variedad de grupos terminales repetitivos. Especialmente los dendrímeros de baja generación pueden encapsular moléculas de fármacos hidrófobos en sus cavidades internas. Debido a esta estructura única, los dendrímeros permiten la solublilización de medicamentos poco solubles en agua. Además, los dendrímeros se pueden considerar como una imitación real de las proteínas globulares. Se les conoce como «proteínas artificiales», en función de sus propiedades sistemáticas, electroforéticas, de escala dimensional, y otras propiedades biomiméticas57,58.
Los medicamentos desarrollados con esta tecnología incluyen acetónido de fluocinolona intravítreo para el tratamiento de la retinitis pigmentosa, y el carboplatino subconjuntival para el manejo del retinoblastoma59,60.
Nanomicelas
Son sistemas de administración de fármacos compuestos de un núcleo hidrófobo y una cubierta hidrófila, los cuales permiten la disolución de fármacos hidrófobos, con la generación de una formulación acuosa transparente en la preparación para la administración de medicamentos en el segmento anterior del globo ocular. Uno de los medicamentos en los que se ha aplicado este tipo de nanotecnología es la ciclosporina. Un ensayo clínico de fase III demostró su efectividad, seguridad y rápida acción en el tratamiento de queratoconjuntivitis sicca61.
Niosomas
Los niosomas son vesículas tensioactivas no iónicas de dos capas, que pueden atrapar fármacos hidrófilos y lipófilos. Los niosomas son químicamente estables y su naturaleza no iónica hace que tengan una baja toxicidad62. Gracias a su superficie hidrófila, los niosomas interactúan y atraviesan fácilmente la barrera de la película lagrimal, como resultado pueden alcanzar el tejido corneal/conjuntival63. Los niosomas se han evaluado como anticolinérgicos, antiglaucomatosos y antibióticos62,64,65. Las características más determinantes para su uso como vehículos para la administración de fármacos oculares son: tamaño de la vesícula, lo suficientemente grande como para resistir el drenaje mediante lagrimeo reflejo y el parpadeo; presentar formas con irregularidades que permitan encajar correctamente en el fondo de saco y alojarse en la superficie ocular; ser idealmente sensibles al calor para liberar el contenido del fármaco de manera controlada, pero a la vez, antes de removerse con el parpadeo y drenaje nasolagrimal66,67.
Cubosomas
La estructura del cubosoma consiste en una bicapa lipídica continua muy retorcida, con dos canales de agua congruentes que no se cruzan. En comparación con la estructura bicapa simple de los liposomas, los cubosomas tienen un área de superficie aumentada y una gran capacidad para encapsular diversas moléculas de sustancias hidrófilas, hidrófobas y anfifílicas. Los cubosomas poseen una estabilidad físico-química más alta que los liposomas, debido a la fuerte repulsión eléctrica y una gran proporción de bicapa lipídica68-70. El uso de dexametasona en colirios, asociada a este tipo de nanopartícula, evidencia una mayor disponibilidad del medicamento en el humor acuoso71.
Hidrogeles
Son una red de monómeros y retransmisores multifuncionales que reaccionan para formar una estructura flexible cargada de agua. Las redes de hidrogel se han estudiado exhaustivamente como un sistema de administración de fármacos controlado y sostenido, ya que la porosidad de su matriz se puede adaptar modificando la densidad del reticulado. Esta capacidad de cambio en función del entorno circundante tiene importantes implicaciones para los hidrogeles de formación in situ, aquellos que se reticulan cuando la temperatura aumenta desde la temperatura ambiente a la temperatura corporal, así como la liberación controlada de fármacos como resultado del pH o la fotoestimulación72,73. Los lentes de contacto de silicona e hidrogel con contenido de timolol de liberación controlada son una nueva tecnología desarrollada recientemente74, y resulta prometedora.
Nanofibras poliméricas
Las nanofibras son fibras sólidas de materiales que tienen diámetros por debajo del rango de micras, con una estructura porosa y un área de superficie muy alta.
Las nanofibras son estructuras fibrosas no tejidas, similares a la matriz extracelular, que consisten en un compuesto acuoso de fibrillas poliméricas altamente organizadas y proteoglicanos para apoyar la formación de tejido. Por esta razón, una de sus principales aplicaciones es la ingeniería de tejidos. Los dispositivos en los que se han desarrollado estudios son las queratoprótesis; esto, con el objetivo de salvaguardar la biocompatibilidad, fisiología y, por ende, la propiedad más importante de la córnea, su transparencia75,76.
Adicionalmente, gracias al diámetro tan pequeño y a un área de superficie excepcionalmente alta de las nanofibras, se puede cargar un contenido de fármaco significativamente mayor en una porción muy pequeña del parche77,78.
Nanoformulaciones para el tratamiento de enfermedades oculares
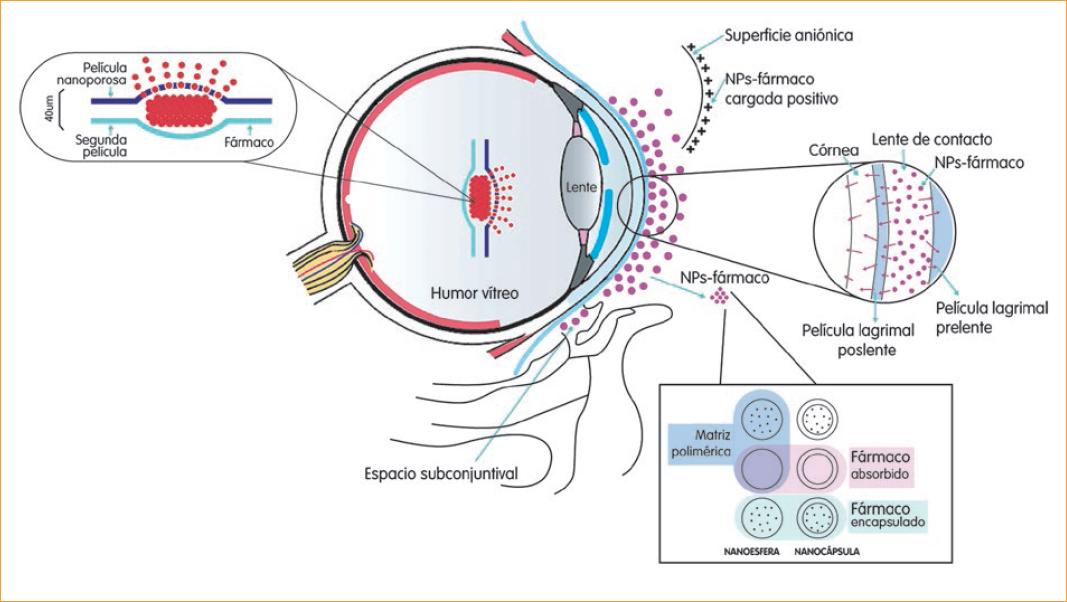
Gran parte de los productos oftálmicos del mercado son formulaciones tópicas para la administración de fármacos al segmento anterior. La mayor desventaja es que solo el 5% de la dosis instilada alcanza la cámara anterior, pero la que penetra en el segmento posterior es más pequeña, debido a las múltiples y complejas barreras anatómicas del globo ocular. La administración de fármacos oftálmicos de tamaño nano (Fig. 1) representa ventajas por su mayor solubilidad, mayor superficie disponible para disolución, mayor velocidad de disolución, mayor bioadhesión y penetración corneal. Se ha recomendado que las partículas midan menos de 10 μm para minimizar la irritación de las estructuras oculares, disminuir el lagrimeo y el drenaje de la dosis instilada y, por lo tanto, aumentar la eficacia de un tratamiento ocular.
Nanosuspensiones
Las nanosuspensiones son dispersiones coloidales submicrométricas de partículas de fármacos puros en una fase líquida externa. Una característica importante de la nanosuspensión es el aumento de la solubilidad de saturación y, en consecuencia, un aumento en la velocidad de disolución del compuesto. En este sistema, los fármacos se cargan mediante la unión a la matriz o disueltos dentro, encapsulados o atrapados dentro de la estructura, y se genera un sistema versátil de suministro de fármacos, entre los cuales se incluyen las microemulsiones, liposomas, niosomas, dendrímeros y ciclodextrinas79,80.
Las ventajas del uso de nanopartículas incluyen el paso tópico mejorado de moléculas grandes y poco solubles en agua, como es el caso de los glucocorticoides o la ciclosporina para tratar las enfermedades inmunológicas que afectan la visión81. Otras moléculas grandes e inestables, como los ácidos nucleicos, administradas mediante nanopartículas, ofrecen resultados prometedores para la terapia de transferencia génica en el tratamiento de retinopatías82,83. La administración de medicamentos mediada por nanopartículas aumenta el tiempo de contacto del medicamento administrado con su tejido objetivo, como ocurre con la brimonidina, uno de los tratamientos tradicionales para el glaucoma, o los corticosteroides utilizados para tratar la uveítis autoinmune78,84. Algunas nanoformulaciones han permitido que el medicamento antiinflamatorio no esteroideo, indometacina, llegue a las estructuras internas posteriores del ojo utilizando la ruta transmucosa85. Entre las nuevas aplicaciones se mencionan el uso de las nanopartículas de oro que permiten la posibilidad de entrega dirigida para alcanzar tipos específicos de cáncer, como el melanoma coroideo, dejando intactas las células normales86.
Lentes de contacto
Los lentes de contacto son dispositivos poliméricos duros o blandos diseñados para adaptarse directamente a la córnea para corregir anomalías de refracción. Wichterle, et al., en 1965, patentaron la idea de usar lentes de contacto de hidrogel como dispositivos de suministro de medicamentos. En la patente se menciona la inclusión de medicamentos en la hidratación de lentes para ofrecer una mayor disponibilidad del fármaco durante su uso87.
La inclusión de nanopartículas cargadas de medicamentos dentro de la matriz polimérica del lente de contacto es una estrategia efectiva para la administración prolongada de fármacos. La incorporación del medicamento se logra con métodos como la impresión, el remojo simple y las nanopartículas coloidales88-90. El diámetro de la nanopartícula debe ser extremadamente pequeño para su uso en lentes de contacto para evitar que las partículas obstaculicen la visión del usuario. Por lo tanto, es necesario retrasar la liberación del medicamento a través de otros medios. Esto se puede lograr uniendo el fármaco con la partícula a través de un enlace químico escindible o diseñando una partícula de modo que el fármaco tenga una mayor afinidad por la partícula que por el material del lente circundante89. Este enfoque permite la liberación sostenida, que puede ajustarse a las necesidades del paciente, desde unas pocas horas hasta varias semanas, y permite el tratamiento de patologías del segmento anterior.
Se han patentado diferentes nanopartículas, liderando los liposomas y microemulsiones que contienen el producto farmacéutico y luego son cargadas en los lentes de contacto. Los liposomas se han utilizado en varias aplicaciones de administración de fármacos debido a su alta biocompatibilidad, los lentes permanecen transparentes y liberan el medicamento durante unos días, con una liberación inicial que se atribuye al medicamento no encapsulado presente en el lente. Los lentes de contacto cargados con microemulsiones liberarán el fármaco durante 4 a 8 días, con un pico inicial que se le atribuya al fármaco sin encapsular89.
Jung, et al., en 2013, dispersaron las nanopartículas de timolol de PGT (triacrilato de glicerilo propoxilado) en lentes de contacto de silicona para administrar el medicamento durante 30 días. Los estudios preliminares en perros Beagle mostraron resultados prometedores para el glaucoma. La incorporación de nanopartículas en los hidrogeles de silicona provocó la reducción en las permeabilidades de iones y oxígeno, y un aumento en el módulo, y el impacto en cada una de estas propiedades era proporcional a la carga de partículas74. Maulvi, et al., en 2018, incorporaron nanopartículas de oro en los lentes de contacto y mejoraron la absorción de timolol de la solución disolvente del fármaco junto con resultados cinéticos y dinámicos satisfactorios in vivo, sin alterar las propiedades del lente91. Los dispositivos estudiados han presentado excelentes propiedades mecánicas, y los investigadores proponen que el material es adecuado para el suministro de medicamentos a partir de lentes de contacto reutilizables de uso diario.
Implantes intraoculares
Los implantes oculares son los nuevos tratamientos que buscan la liberación controlada de fármacos, al trabajar dosificaciones y cargas mayores de fármaco. Además, se presenta menor efecto secundario sistémico y mayor proximidad al sitio blanco, el segmento posterior del ojo. Se pueden emplear polímeros biodegradables o no biodegradables en los sistemas implantables oculares. Si bien los implantes biodegradables no necesitan ser removidos después de la inserción en el ojo, los no biodegradables requieren una intervención adicional para remover o rellenar los implantes, lo que conlleva costos adicionales y riesgos quirúrgicos intra o postoperatorios. Los desarrollos más recientes en sistemas implantables biodegradables son el implante ENV705 de Envisia Therapeutics y el dispositivo de película nanoporosa de Zordera92.
El dispositivo de película nanoporosa de Zordera consiste en una pastilla de medicamento intercalada entre dos capas delgadas de membrana biodegradable impermeable. Un lado tiene nanoporos del mismo diámetro que el activo, lo que permite que solo una molécula de fármaco salga del reservorio de cada poro a la vez. El dispositivo se inyecta en el vítreo; es muy delgado, con un diámetro de solo 40 μm y una liberación sostenida de fármaco de orden casi 0. Las capas de polímero se degradan en un momento posterior cuando se libera la mayor parte del medicamento, lo que elimina la necesidad de retirar el dispositivo. Este implante ofrece control sobre la velocidad de liberación al ajustar el tamaño de poro, y ha demostrado que administra ranibizumab durante cuatro meses de manera sostenida. Por lo tanto, puede convertirse en el mejor implante biodegradable para tratar afecciones retinianas crónicas93. Caso similar ocurre con la liberación de sirolimus en el polo posterior a través de este mismo dispositivo94.
Aplicaciones clínicas
Teniendo claridad de la anatomía, histología y fisiología de las diferentes barreras oculares, así como de las principales nanopartículas que se han desarrollado en el ámbito de la investigación, en la tabla 2 se mencionan las patologías oculares más frecuentes y con mayor impacto negativo en la agudeza visual en las que se ha involucrado la nanotecnología para su manejo en los diferentes sitios de acción de los tejidos del globo ocular (Fig. 1).
Tabla 2 Patologías oculares frecuentes y aplicaciones terapéuticas
| Patología | Medicamento/dispositivo | Diana terapéutica | Nanopartícula asociada | Mecanismo de acción de la NP |
|---|---|---|---|---|
| Queratitis | Ofloxacino, colirios95 Aciclovir95 | Fluoroquinolona. Inhibición de la topoisomerasa II y IV. Inhibidor de la ADN polimerasa del virus herpes | Óxido de polietileno y Eudragit® en forma de microesferas Profármacos de aciclovir encapsulados en microesferas de ácido poliláctico-coglicólico) | Aumento de la biodisponibilidad y liberación controlada del antibiótico Retrasa la degradación de los profármacos de aciclovir |
| Conjuntivitis | Tobramicina, colirios96 | Inhibición de la síntesis y unión de los polipéptidos en el ribosoma | NP de lípidos sólidos | Aumentan la biodisponibilidad en la superficie corneal y favorecen su retención en el saco conjuntival |
| Queratoconjuntivitis sicca | Ciclosporina A, colirios97 | Inmunomodulador que previene la activación de linfocitos T | Chitosán | Vehículo de liberación sostenida |
| Uveítis | Nanosuspensiones de prednisolona52 Inyección subconjuntival de prednisolona52 Infliximab intravítreo53 | Inhibidor de la síntesis de prostaglandinas y leucotrienos Anticuerpo monoclonal que inhibe la actividad del TNF-a | Vehículo coloidal submicrométrico para fármacos hidrofóbicos en un medio estabilizado por agentes tensioactivos Formulación liposomal pegilada Transportador liposomal | Liberación prolongada y controlada del medicamento, así como mayor biodisponibilidad y menor toxicidad |
| Catarata | LIO con actividad metabólica98 | Inhibir la actividad de ROS y regular los niveles de H2O2 e hidroperóxidos lipídicos en el medio circundante | Nanorrevestimiento de platino depositado por un pulverizador de magnetrón | Antioxidante inorgánico catalítico |
| Glaucoma | Nanotransportadores de: pilocarpina, timolol, inhibidores de anhidrasa carbónica, acetazolamida, dorzolamida, brinzolamida, brimonidina99 Lentes de contacto de silicona e hidrogel con contenido de timolol74 Lentes de contacto con timolol91 Sensores inalámbricos95 | Fármacos empleados en tratamiento tradicional del glaucoma b-Bloqueador no selectivo que disminuye la producción de humor acuoso Monitorización continua de PIO | Dendrímeros, liposomas, nanocápsulas, nanoesferas, hidrogeles PGT (triacilato de glicerilo propoxilado) NP de oro | Liberación prolongada del medicamento Liberación prolongada del medicamento Aumentar la carga y absorción del timolol |
| DMRE húmeda | Implante de ácido hialurónico: bevacizumab100 Dispositivo de película nanoporosa biodegradable: ranibizumab92 | Anticuerpo monoclonal humanizado contra el factor de crecimiento vascular endotelial | Chitosán NA | Vehículo de liberación sostenida Liberación del fármaco a través de nanoporos |
| Retinopatía diabética | Dispositivo de reservorio respondedor a estímulo: nintedanib101 | Inhibidor de la angiocinasa, bloqueando los receptores VEGF, receptores del factor de crecimiento derivado de plaquetas y receptores del factor de crecimiento de fibroblastos | Microesferas de ácido poli(láctico-coglicólico) y monómeros de onitrobenzilo | Liberación del fármaco a partir de la estimulación por luz ultravioleta |
| Retinitis pigmentosa | Fluocinolona acetónido intravítreo59 | Atenuación de la actividad de la microglía | Dendrímeros de poliamidoamina | Liberación sostenida del medicamento |
| Retinoblastoma | Carboplatino subconjuntival60 Terapia fotodinámica con verteporfina102 | Agente alquilante, inhibe la replicación del ADN, transcripción del ARN y la síntesis de proteínas Daño selectivo de las células endoteliales de neovasos, inductor de apoptosis y autofagia | NP dendriméricas de poliamidoamina Activación de la verteporfina liposomal por un láser no térmico | Liberación prolongada y controlada del medicamento Producción de ROS y muerte celular sobre las células tumorales |
| Retinopatía del prematuro | NP de oro intravítreas103 | NA | NP de oro | Supresión de la vía de señalización del VEGFR-2 por autofosforilación y bloqueo de la activación de ERK1 y 2 |
| Neuromielitis óptica | Biosensor104 | NA | Nanotubos de carbono | Detección de anticuerpos AQP4 |
| Endoftalmitis | Daptomicina, colirios105 | Antibiótico lipopéptido natural contra grampositivos, incluyendo SAMR | Chitosán | Favorece la penetración del antibiótico mediante la apertura de las uniones intercelulares de la córnea |
AQP4: antiacuaporina 4; DMRE: degeneración macular relacionada con la edad; ERK: quinasa regulada por señal extracelular; LIO: lente intraocular; NA: no aplica; NP: nanopartículas; PIO: presión intraocular, ROS: especies reactivas de oxígeno; SAMR: Staphylococcus aureus meticilinorresistente; VEGFR-2: receptor 2 del factor de crecimiento vascular endotelial.
Perspectivas
Es amplia la gama de aplicaciones de la nanotecnología y la nanomedicina en el ámbito de la oftalmología. De diversas maneras, el uso de estos dispositivos y nanoformulaciones favorece la biodisponibilidad de los medicamentos, permite la difusión a través de las barreras anatómicas y podría disminuir los efectos adversos adjudicados al uso de los medicamentos oculares tópicos de manera convencional, y muy posiblemente disminuya, en alguna medida, intervenciones invasivas en el polo posterior, así como complicaciones secundarias al uso de ciertos medicamentos que requieran procedimientos quirúrgicos para su utilización. En últimas se optimizan los beneficios de los medicamentos y se disminuyen los impactos negativos, y se abre una gran ventana dentro del espectro de la llamada medicina personalizada, que muy probablemente requerirá nuevos estudios con diseños particulares para poblaciones con características individuales, así como el constante estudio en diversos modelos animales y de laboratorio.











 nova página do texto(beta)
nova página do texto(beta)