Introducción
El edema macular diabético (EMD) es la principal causa de baja visual en el paciente diabético1-3. Constituye una de las alteraciones presentes en la retinopatía diabética, y es causa importante de discapacidad visual en México y el mundo4.
La evaluación integral del EMD, sobre todo en la era del paradigma multimodal diagnóstico de la patología vitreorretiniana, incluye la evaluación de la función visual, la biomicroscopía del segmento posterior, la angiografía con fluoresceína (FA) y la tomografía de coherencia óptica (OCT)5,6.
Un estudio de más reciente advenimiento y aplicación en la evaluación del EMD es la autofluorescencia (AF) de retina. La AF, empero, ha sido relativamente poco explorada en el EMD, tanto en el diagnóstico como en el seguimiento de los pacientes tratados con esta entidad, sobre todo con los sistemas de obtención de imágenes de AF con cámara de flash. Los sistemas de cámara de flash tienen la ventaja de ser más accesibles por su costo, comparados con los sistemas de láser de barrido confocal5-16. Varios autores han explorado la utilidad de la AF en la evaluación y respuesta a tratamientos del EMD6. Vujosevic, et al.13 encontraron una correlación entre la AF, empleando un sistema de obtención de imágenes mediante láser de barrido confocal, y variables funcionales como la sensibilidad obtenida mediante microperimetría. Existe, por ende, la necesidad de evaluar la asociación entre la AF con los sistemas basados en cámara de flash y parámetros existentes en otras modalidades de imagen como la OCT, así como variables para evaluar a la función retiniana, con la finalidad de poder determinar su papel en la evaluación del EMD.
Objetivo
El propósito de este estudio fue el de evaluar la asociación entre las imágenes de AF obtenidas mediante un sistema de cámara de flash y las variables estructurales obtenidas mediante OCT de dominio espectral (OCT-DE), pruebas funcionales y de FA retinianas, en pacientes con EMD.
Métodos
El diseño del estudio fue observacional, prospectivo, transversal y analítico. Todos los pacientes fueron reclutados del Servicio de Retina de la Clínica David, Unidad Oftalmológica de la Ciudad de Morelia, Michoacán, México, de octubre de 2017 a mayo de 2018. Se incluyeron pacientes con presencia de EMD detectado clínicamente o por OCT.
Se excluyeron pacientes con presencia de catarata significativa (determinada por la presencia de la calidad de la imagen de la OCT con una fuerza de la señal menor de 6), componente traccional del edema determinado mediante la OCT, otras patologías maculares (incluida la degeneración macular relacionada a la edad y datos de oclusión venosa retiniana), tratamiento previo con terapia antiangiogénica intravítrea, tratamiento previo con láser selectivo macular.
A todos los pacientes se les realizó un examen oftalmológico completo que incluyó determinación de la agudeza visual mejor corregida (AVMC), sensibilidad al contraste (SC) y examen biomicroscópico del segmento anterior y posterior. Se les realizaron también estudios de AF con cámara de flash, FA, OCT-DS y fotografía clínica del segmento posterior.
Se obtuvo consentimiento informado de todos los pacientes incluidos y el estudio fue aprobado por el Comité de ética de la Clínica David, Unidad Oftalmológica. Se acató el reglamento de la Ley General de Salud en Materia de Investigación para la Salud en lo referente a los aspectos éticos de la investigación en seres humanos.
El estudio se realizó también de acuerdo con el código de Nuremberg y a los principios de la Declaración de Helsinki y siguiendo los lineamientos establecidos por las normas oficiales mexicanas NOM 04 y NOM 012 de la Secretaría de Salud.
Procedimientos realizados en los pacientes
Agudeza visual mejor corregida (AVMC). La AVMC lejana para cada ojo se midió utilizando el protocolo estándar del Early Treatment Diabetic Retinopathy Study (ETDRS) a una distancia de 4 metros con la cartilla modificada ETDRS (Precision Vision, La Salle, IL, EE. UU.). La AVMC se registró como el número total de letras leídas correctamente en cada ojo por separado.
Sensibilidad al contraste (SC). La SC se midió en todos los pacientes empleando la cartilla de SC de Hamilton-Veale (Hamilton Veale, Canterbury, Nueva Zelanda). Se registró la SC como el número total de pares de letras leídas correctamente a 1 metro de distancia en cada ojo por separado.
Análisis cualitativo de la AF. La imágenes de AF se obtuvieron con una cámara de fondo (cámara de fondo modelo Visucam NM/FA, Carl Zeiss Meditec, Oberkochen, Alemania). Se empleó una longitud de onda de 510-580 nm para la excitación, mientras que la luz emitida se detectó por encima de 640 nm debido a un filtro de barrera. Se tomaron varias imágenes y se descartaron las que tenían artefactos, como la presencia de sombras o visualización deficiente. Las imágenes digitales seleccionadas se guardaron en la computadora para su posterior análisis, clasificación y procesamiento. Las tomas fueron mejoradas con el editor automático del software de la cámara Visucam. Se diseñó una clasificación para los patrones de AF, modificando a la publicada por Vujosevic, et al.13. De esta manera, las imágenes de AF se clasificaron de acuerdo con diferentes patrones de AF en el área foveal: AF disminuida, AF normal, AF aumentada unifocal y AF aumentada multifocal (Fig. 1). La clasificación de las imágenes de AF se realizó de forma independiente por dos evaluadores expertos de manera enmascarada.

Figura 1 Patrones de autofluorescencia (AF) en el área foveal. A: AF disminuida; B: AF normal; C: AF aumentada unifocal; D: AF aumentada multifocal. La imagen de cada patrón va acompañada en la parte inferior por su correspondiente imagen clínica.
Fotografía de fondo y FA. En todos los pacientes, después de la dilatación de la pupila, un fotógrafo entrenado con la misma cámara de fondo (equipo modelo Visucam NM/FA fundus camera, Carl Zeiss Meditec, Oberkochen, Alemania) tomó fotografías del polo posterior a color y de FA. Las imágenes de FA de la mácula se clasificaron en función de la presencia o ausencia de isquemia y fuga del colorante. Las tomas fotográficas de la AF se realizaron primero que los otros estudios de imagen.
Tomografía de coherencia óptica (OCT). Se realizó un escaneo o barrido de OCT-DE (equipo modelo Cirrus 5000 OCT-DE; Carl Zeiss Meditec, Oberkochen, Alemania) del área macular. El protocolo de barrido empleado para este estudio fue el grosor macular, calculado de acuerdo con el programa de cubo macular 512 x 128. Se realizó el análisis de la imagen estructural del reporte PDF. Para este estudio, el grosor de la retina en el milímetro central se usó como medida de la OCT del grosor foveal central (GFC). Se midieron el volumen macular (VM) en mm3 y el grosor promedio macular (GPM) en micras (μm). Estas imágenes se guardaron también en el disco duro para su análisis ulterior. Se clasificó el EMD en cuatro patrones de acuerdo con la clasificación descrita por Otani, et al.17: focal, difuso quístico, difuso espongiforme (no quístico) y difuso con desprendimiento neurorretiniano seroso subfoveal.
Análisis estadístico. Se realizó estadística de tipo descriptivo y posteriormente se aplicó la prueba de normalidad de Kolmogorov-Smirnov para evaluar la normalidad en la distribución de los datos. Se empleó la prueba de Kruskall-Wallis para comparar grupos y la U de Mann-Whitney como prueba post hoc. Se empleó la prueba exacta de Fisher para comparar frecuencias esperadas pequeñas. Se determinó el coeficiente κ para evaluar variabilidad interobservador. El nivel mínimo de significancia que se consideró fue de p < 0.05. Se empleó como software estadístico el programa SPSS para Mac (IBM Corp. Released 2012. IBM SPSS Statistics for Mac, Version 21.0. Armonk, NY: IBM Corp).
Resultados
En este estudio se incluyeron 37 ojos de 20 pacientes. Las edades de los pacientes tuvieron un rango de entre 53 y 79 años (promedio, 62.8 ± 7.2). Fueron de sexo masculino 12 pacientes y del femenino 8 pacientes. Las medias de la AVMC y de la SC fueron de 31.5 ± 16 letras y 7.04 ± 3.5 pares de letras, respectivamente.
Las medias del GFC, VM y GPM de los pacientes fue de 356.3 μm ± 123.5, 10.9 mm3 ± 3 y 363.9 μm ± 93.9, respectivamente. Los patrones de AF fueron: disminuida (13%), normal (40%), aumentada unifocal (17%) y aumentada multifocal (30%) (Fig. 1).
Se observaron los siguientes patrones de edema por OCT: focal (17.9%), difuso quístico (15.4%), difuso no quístico o espongiforme (51.3%) y difuso con desprendimiento neurorretiniano seroso subfoveal (15.4%) (Tabla 1).
Tabla 1 Características de los pacientes incluidos en el estudio
| Sexo de los pacientes, n (%) | Patrón de AF, n (%) [IC 95]* | ||
|---|---|---|---|
| Masculino | 12 (60) | Disminuido | 5 (13) [3-27] |
| Femenino | 8 (40) | Normal | 15 (40) [23-59] |
| Edad, años | Aumentado unifocal | 6 (17) [3-30] | |
| Promedio ± DE | 62.8 ± 7.2 | Aumentado multifocal | 11 (30) [13-47] |
| Rango (años) | 53-79 | Presencia de fuga de la red capilar por FA, n (%)* | |
| Tiempo de evolución de la DM (años) | 11 ± 5.6 | ||
| HAS asociada (% de pacientes) | 80 | ||
| AVMC, número de letras | 31.5 ± 16 | Ausente | 8 (30.8) |
| SC, número de pares de letras | 7 ± 3.5 | Presente | 19 (69.2) |
| Patrones de EMD por OCT, n (%)* | |||
| Focal | 7 (17.9) | ||
| Difuso quístico | 6 (15.4) | ||
| Difuso no quístico (espongiforme) | 20 (51.3) | ||
| Difuso con desprendimiento neurorretiniano seroso subfoveal | 6 (15.4) | ||
AF: autofluorescencia de retina; AVMC: agudeza visual mejor corregida; FA: angiografía con fluoresceína; EMD: edema macular diabético; HAS: hipertensión arterial sistémica; OCT: tomografía de coherencia óptica; SC: sensibilidad al contraste.
La confiabilidad interobservador entre los dos investigadores para la clasificación de la AF (grados 1 a 4) se evaluó con un coeficiente κ de 0.906 (p = 0.000).
El análisis con ANOVA no paramétrico o prueba de Kruskall-Wallis mostró una diferencia estadísticamente significativa entre los cuatro patrones de AF en el caso del VM (p = 0.03) y del GPM (p = 0.014) (Tabla 2).
Tabla 2 Diferencias entre las variables evaluadas de tomografía de coherencia óptica (OCT) (grosor foveal central [GFC], volumen promedio macular [VM], grosor promedio macular [GPM]) entre los cuatro patrones de autofluorescencia de retina (AF) encontrados. Se comparan también variables funcionales (agudeza visual mejor corregida [AVMC] y sensibilidad al contraste [SC])
| Patrón AF foveal | |||||
|---|---|---|---|---|---|
| AF disminuida | AF normal | AF aumentada unifocal | AF aumentada multifocal | p (Kruskall-Wallis) | |
| AVMC (n de letras) | 25 ± 13.2 | 28.4 ± 17.3 | 20 ± 14.1 | 25.6 ± 18.4 | 0.70 |
| SC (n de pares de letras) | 6 ± 3.1 | 7.2 ± 3.5 | 5.5 ± 6.3 | 5.8 ± 3 | 0.70 |
| GFC (μ) | 474 ± 144.2 | 385.2 ± 159.7 | 463.5 ± 177.5 | 400 ± 142 | 0.31 |
| VM (mm3) | 8.8 ± 2.2 | 10.9 ± 2.7 | 13.6 ± 0.7 | 13.5 ± 2.62 | 0.03 |
| GPM (μ) | 437 ± 35.3 | 341.8 ± 29.5 | 378.5 ± 21.9 | 374.1 ± 73.8 | 0.01 |
Por otro lado, el análisis post hoc con la prueba U de Mann Whitney, en el caso del VM, mostró que hubo diferencias estadísticamente significativas entre el grupo de AF disminuida y el de AF normal (p = 0.024) y entre el de AF disminuida y el de AF aumentada multifocal (p = 0.022).
En el caso del GPM, se encontró diferencia estadísticamente significativa entre el patrón de AF disminuida y el de AF normal (p = 0.012), así como entre el patrón de AF disminuida y el de AF aumentada multifocal (p = 0.003).
No hubo diferencias estadísticamente significativa entre los patrones de AF y los patrones de EMD por OCT (p = 0.21).
Por el contrario, la fuga de la red capilar perifoveal por FA se presentó en mayor proporción en los patrones de AF aumentada tanto uni como multifocal (p = 0.032) (Tabla 3). La figura 2 muestra un caso de AF aumentada unifocal y muestra la correlación con sus imágenes multimodales: clínica, de OCT-DE y de FA.
Tabla 3 Diferencias entre los diferentes patrones de EMD por OCT y presencia o ausencia de fuga de red capilar perifoveal evaluada mediante el estudio de FA (angiografía con fluoresceína)
| Pa trón AF foveal | |||||
|---|---|---|---|---|---|
| AF disminuida n (%) | AF normal n (%) | AF aumentada unifocal n (%) | AF aumentada multifocal n (%) | p (prueba exacta de Fisher) | |
| Patrón de OCT | p = 0.21 | ||||
| Focal | - | 6 (85.7) | 1 (14.3) | - | |
| Quístico | 2 (33.3) | 1 (16.6) | 2 (33.3) | 1 (16.6) | |
| Espongiforme | 3 (16.6) | 6 (33.3) | 2 (11.1) | 7 (38.8) | |
| DSRNS | 1 (16.6) | 1 (16.6) | - | 4 (66.6) | |
| Presencia de fuga | |||||
| por FA | 3 (17.6) | 5 (29.4) | 4 (23.5) | 5 (29.4) | p = 0.034 |
| Fuga red capilar perifoveal | 1 (12.5) | 6 (75) | - | 1 (12.5) | |
| No fuga red capilar perifoveal | |||||
AF: autofluorescencia de retina; DSRNS: desprendimiento seroso de retina neurosensorial; FA: angiografía con fluoresceína; OCT: tomografía de coherencia óptica.
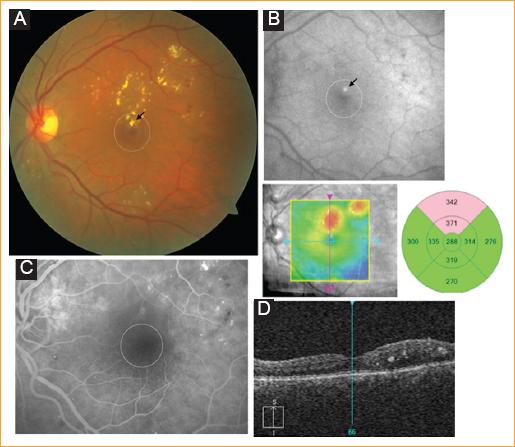
Figura 2 Edema macular diabético con presencia de patrón foveal de autofluorescencia (AF) aumentada unifocal. A: Fotografía clínica del polo posterior (la flecha señala exudado duro de aspecto más refringente). B: Imagen de AF (la flecha indica la AF aumentada unifocal que se corresponde con el exudado de aspecto refringente de la foto clínica). C: Imagen de FA. D: Imagen infrarroja con montaje de grosor en color de la tomografía de coherencia óptica. Se aprecia zona focal de engrosamiento macular que se corresponde con el foco de AF aumentada de la imagen B.
Discusión
Las imágenes de AF son una herramienta de gran utilidad en el diagnóstico y en el seguimiento de diferentes enfermedades retinianas, como los trastornos retinianos hereditarios como la enfermedad de Stargardt, la degeneración macular relacionada a la edad y el EMD8.
En el EMD, si bien la AF ha demostrado beneficio, su uso ha estado más limitado y ha sido poco difundido en la comunidad de médicos dedicados al tratamiento de la patología macular5,6,10-16,18,19.
Diversos autores11,13,16 han descrito diferentes patrones de cambios en la AF en los pacientes que padecen de EMD. Pece, et al.16 describieron dos tipos de patrones de AF en el EMD: el tipo 1, al que denominaron multilobulado, caracterizado por la presencia de múltiples áreas de AF aumentada, similar al de AF aumentada multifocal de nuestra clasificación; el tipo 2, también llamado unilobulado, que se corresponde con la presencia de un gran quiste en la imagen de OCT, y el tipo 3 o mixto, con características combinadas de los tipos 1 y 2.
Vujosevic, et al.13 describieron una clasificación con los siguientes patrones de AF dentro del área foveal: normal, AF aumentada unifocal y AF aumentada multifocal.
Para la obtención de las imágenes de AF emplearon un sistema de láser de barrido confocal. Los casos de imágenes que se apreciaron con AF disminuida los consideraron como producto del bloqueo que producen los pigmentos maculares sobre la AF y los clasificaron como parte del patrón normal de AF.
En la AF obtenida mediante los sistemas de cámara de flash, como el empleado en nuestro estudio, tanto la excitación como la emisión de la señal de AF ocurren en una longitud de onda mayor, lo que se traduce en un aspecto de menor densidad de los pigmentos maculares en la imagen obtenida.
Hubo casos en nuestro estudio, donde apreciamos AF más disminuida, sobre todo en la periferia de la fóvea y en la zona limítrofe entre la fóvea y la parafóvea, que no consideramos como parte del patrón de AF normal.
Las características de aspecto irregular, paracentral, que se correspondían con zonas de engrosamiento focal en la OCT, en estos casos de AF disminuida, nos hicieron pensar que probablemente no estaban dados por la presencia de pigmentos maculares. Por esta razón, decidimos modificar la clasificación descrita por Vujosevic, et al.13 y agregamos un nuevo patrón: el de AF disminuida. Hipotetizamos que una AF más reducida en este patrón podría deberse no a los pigmentos maculares, sino a la presencia de un aumento del grosor en la periferia del área foveal, debiéndose considerar como una categoría o patrón separado de la AF foveal.
Debido a que la AF disminuida está relacionada con el aumento del grosor de la retina en el área parafoveal, Yoshitake, et al.18 plantearon la hipótesis de que la AF disminuida en estos ojos refleja la autofluorescencia del epitelio pigmentario de la retina (EPR) bloqueada por el parénquima retiniano edematoso, principalmente en el patrón espongiforme del EMD. Lo anteriormente expuesto, pudiera explicar el hecho de que el GPM se encontró mayor en el grupo de AF disminuida que en el resto de los grupos.
Por el contrario, en el patrón quístico del EMD, los quistes que se ubican en las capas plexiforme externa y nuclear interna en el área foveal, sobre todo en el centro de la fóvea (zona que es de menor grosor comparada con la retina circundante), donde hay un acúmulo máximo de pigmento lúteo y en donde producen una imagen de AF aumentada. Los quistes desplazan al pigmento lúteo y evitan el bloqueo normal de la señal de AF foveal a nivel de cada uno de ellos, dando los patrones de AF aumentada uni y multifocal.
Chung, et al.11 describieron otro sistema de clasificación de la AF, pero a nivel foveolar exclusivamente: los ojos sin AF aumentada en la foveola fueron clasificados como de grado 1, los ojos con AF aumentada de menos de la mitad del área foveolar, como de grado 2, los ojos con AF aumentada entre la mitad y tres cuartos del área foveolar, como de grado 3, y, por último, cuando la AF aumentada ocupaba la totalidad del área foveolar, como de grado 4.
Estas clasificaciones de los diferentes patrones de AF, sobre todo con los sistemas confocales, han servido para el diseño de estudios en los cuales se ha evaluado la correlación entre AF y variables anatomofuncionales retinianas10-16,18.
Reznicek, et al.15, por ejemplo, evaluaron el papel de la AF de longitud de onda verde en el EMD. Sus resultados indicaron una débil correlación de la intensidad de la AF con el GFC, la integridad de la capa elipsoide retiniana y el grosor de la capa-complejo EPR-elipsoide en pacientes diabéticos con o sin EMD. En nuestro estudio no encontramos asociación con el GFC, pero sí con el VM y el GPM.
Pece, et al.16 evaluaron las imágenes de AF en pacientes con retinopatía diabética y EMD de aspecto quístico y su correlación con los hallazgos de FA y OCT. Encontraron que los hallazgos de la FA y el OCT tuvieron una correlación positiva con el aumento quístico de AF. En nuestro estudio, encontramos también una mayor proporción de casos con fuga de red capilar perifoveal en los ojos con patrones de AF aumentada, tanto uni como multifocal.
Chung, et al.11 describieron que la AF se correlacionó bien con datos cuantitativos. Evaluaron la capacidad visual y las imágenes de AF y de OCT-DE que se obtuvieron antes y después de la inyección de bevacizumab intravítreo para el tratamiento del EMD. Describieron que el EMD mostró una correlación significativa con el aumento de AF de la foveola, sobre todo en lo referente a biomarcadores de imagen, como disrupción de las capas externas de la retina como la membrana limitante externa. Al igual que Reznicek, et al. y a diferencia también de nuestro estudio, encontraron una correlación positiva entre el GFC y el grado de AF retiniana.
Chung, et al.11 también encontraron que la AF foveolar fue 4.2 veces más probable que ocurriera en EMD con presencia de quistes intrarretinianos. Llegaron a la conclusión de que la asociación entre los parámetros de AF y OCT-DE, así como la visión en pacientes con EMD, podría predecir el restablecimiento de la integridad del fotorreceptor y la posterior recuperación visual, especialmente en casos de EMD grave en los que la integridad del fotorreceptor antes del tratamiento no puede evaluarse adecuadamente empleando la OCT-DE.
Vujosevic, et al.13, al evaluar el papel de la imagen macular estructural y funcional en la caracterización de los patrones EMD, correlacionaron mejor la AF con la microperimetría del campo central y los patrones de OCT que con la agudeza visual. Hubo una diferencia significativa en el promedio de AVMC entre tres diferentes grupos de patrones de AF (normal, unifocal y mutifocal).
En ese mismo estudio de Vujosevic, et al.13, las variables que tenían que ver con el grosor macular no fueron significativamente diferentes entre los grupos de AF. Por el contrario, en nuestro estudio, encontramos una asociación entre los diferentes patrones de AF en el caso del VM y el GPM, principalmente entre el patrón con AF disminuida y el patrón con AF normal, así como entre el patrón con AF disminuida y el patrón con AF aumentada multifocal.
En otro estudio, Vujosevic, et al.10 evaluaron los cambios de biomarcadores de imagen retinianos específicos, como los puntos hiperreflécticos intrarretinianos, el desprendimiento neurorretiniano subfoveal y el aumento de la autofluorescencia foveal después del tratamiento con dexametasona intravítrea o ranibizumab en EMD, como posibles indicadores de la condición inflamatoria de la retina. Encontraron que el área media de AF aumentada disminuyó en ambos grupos, tanto en el de dexametasona como en el de ranibizumab.
En los ojos tratados con ranibizumab encontraron una correlación inversa significativa entre el área de AF aumentada basal y la AVMC. Después de ambos tratamientos, dexametasona y ranibizumab, el área media de AF aumentada disminuyó significativamente10.
En lo referente a las limitaciones de nuestro estudio, está el aspecto que tiene que ver con el uso de una cámara flash para obtener imágenes de AF. Las cámaras de fondo captan más luz reflejada y dispersa en comparación con los sistemas confocales. La luz dispersada desde estructuras fuera del plano retiniano puede aumentar falsamente la señal de AF, un fenómeno denominado pseudoautofluorescencia8. Por otro lado, existe un problema de variabilidad en la obtención de la señal de AF, por lo que es posible que algunos casos que por lo regular se aprecian con AF aumentada pudieran salir como de AF disminuida y viceversa. De acuerdo a Frampton, et al.20, la sensibilidad y la especificidad del sistema basado en cámara de flash para la obtención de imágenes de AF en el EMD es variable (sensibilidad del 43 al 67% y especificidad del 86 al 99%).
Las cámaras de fondo también producen imágenes con bajo contraste, lo que puede llevar a una inadecuada interpretación de las imágenes debido a la posible confusión de los patrones de AF foveal. En este sentido, sería interesante evaluar el papel de los métodos cuantitativos de AF.
El análisis de la OCT estructural que se realizó para definir la clasificación del EMD por OCT fue solo con la valoración de la imagen del reporte en PDF del equipo que solo muestra dos cortes estructurales. Lo anterior se pudo traducir en un sesgo al clasificar de forma imprecisa los casos y, por lo tanto, la correlación se pudo ver afectada.
Se han intentado métodos para cuantificar la AF. Yoshitake, et al.18 describieron un método para cuantificar los niveles relativos de intensidad de la AF en subcampos individuales de la cuadrícula del ETDRS en EMD y evaluaron la relevancia clínica en comparación con los hallazgos del OCT. Empero, este método no es un método para el análisis cuantitativo de la AF.
Delori, et al.21 desarrollaron y probaron otro método para realizar mediciones cuantitativas estandarizadas de AF que se ha utilizado en varias patologías de la retina21-24. Esta técnica es aplicable al escaneo de oftalmoscopia láser y, probablemente, también a cámaras de fondo de ojo.
El principio básico de este método consiste en que cuando la AF del fondo de ojo se normaliza a la fluorescencia de un estándar montado dentro del dispositivo de imagen, los efectos de la variación en la ganancia del detector y la potencia del láser se pueden compensar. Por lo tanto, la AF puede compararse longitudinalmente, entre ojos y entre imágenes obtenidas con diferentes dispositivos.
Finalmente, debido a la falta de estandarización en el equipo (principalmente por diferentes calidades de adquisición de imagen) y la falta de una base de datos normativa estandarizada para AF, la AF no es actualmente un método de examen de mucha difusión para enfermedades de la retina y del EPR.
En ninguno de los estudios sobre AF se ha examinado sistemáticamente la reproducibilidad y la consistencia de las mediciones de AF. Sin embargo, la AF tiene un potencial significativo como herramienta para proporcionar soluciones a muchos cuestionamientos en el área de las enfermedades maculares.
Conclusiones
En pacientes con EMD, se presentan diferentes patrones de AF con los sistemas de cámara de flash, los cuales se asocian con variables estructurales de la OCT-DE y de la FA, principalmente con el VM y GPM, así como la fuga perifoveal. En este sentido, por lo general, a mayor AF, mayor grosor promedio macular y fuga de la red capilar perifoveal por FA. Por otro lado, una clasificación fenotípica más precisa podría ayudar a determinar factores pronóstico de pérdida visual o al diseño de otros ensayos clínicos para el EMD.
La AF se erige como un estudio con importante potencial para la evaluación del EPR y más integral de la función retiniana en la era actual en donde está tan prevalente el paradigma del diagnóstico con base en la imagenología retiniana multimodal.
Por último, se requieren estudios a más largo plazo, con mayor cantidad de unidades de observación para determinar el papel más preciso de la AF en pacientes con EMD.











 nueva página del texto (beta)
nueva página del texto (beta)


