Introducción
El pénfigo es una enfermedad dermatológica ampollosa rara caracterizada por ampollas cutáneas fláccidas y/o ulceraciones de las membranas mucosas causadas por una reacción autoinmune dirigida contra la familia de proteínas desmogleína presente en los desmosomas de las uniones celulares epiteliales1,2. Los tres tipos principales de pénfigo incluyen el pénfigo vulgar (PV), el pénfigo foliáceo (PF) y el pénfigo paraneoplásico (PPN). Cada subtipo de pénfigo tiene una presentación clínica única que corresponde con su perfil específico de autoanticuerpos. El pénfigo vulgar es, con mucho, el subtipo más común de pénfigo y es causado por los autoanticuerpos contra desmogleína 1 (DSG1) y desmogleína 3 (DSG3)2. La mayoría de los individuos con PV muestran afectación tanto mucosa como cutánea, pero se puede observar una enfermedad aislada de la mucosa. El pénfigo foliáceo tiene un curso de la enfermedad más leve que el PV, con ampollas limitadas a la piel, y se asocia con autoanticuerpos solamente contra DSG13,4. El pénfigo paraneoplásico generalmente se presenta con hallazgos cutáneos variables, afectación grave de las mucosas y una neoplasia maligna interna asociada, en la mayoría de los casos con linfoma no Hodgkin. Los autoanticuerpos del PPN se unen a DSG1, DSG3 y a las proteínas hemidesmosomales de la unión dermoepidérmica5,6. El PPN se puede distinguir del PV mediante inmunofluorescencia directa e indirecta, que muestra anticuerpos localizados tanto en los desmosomas epidérmicos como en los hemidesmosomas de la unión dermoepidérmica5.
La afectación ocular es una manifestación infrecuente del PV, reportada en solo 7-26% de los casos2,7,8. Cuando se manifiesta, el hallazgo ocular más común es una conjuntivitis bilateral no cicatricial2,7,9-11. La afectación corneal se ha descrito como extremadamente rara, con solo 3 casos identificados en la literatura revisada por pares antes de 201412-14. En 2014, Chirinos-Saldana y colaboradores publicaron una serie de 15 casos de PV que demostraron cambios en la córnea15. Sin embargo, se debe tomar en cuenta que este grupo fue inusual, ya que solo dos pacientes tenían manifestaciones extraoculares de PV, y muchos tenían condiciones sistémicas generadoras de confusión o estaban recibiendo medicamentos potencialmente asociados con cambios en la córnea15. Además, ninguno de los informes previos de afectación ocular en el PV confirmó la afectación directa de la córnea al intentar identificar a DSG1 o DSG3 en el epitelio corneal, o la presencia de autoanticuerpos corneales contra estas desmogleínas12-15. Por lo tanto, informamos el involucro primario de la córnea en el PV, confirmado mediante la demostración de una colocalización aparente de DSG3 e inmunoglobulina G4 en el epitelio corneal de un individuo afectado.
Propósito
Informar nuevos hallazgos corneales en un individuo diagnosticado con PV y describir un posible papel de los autoanticuerpos anti-desmogleína 3 (DSG3) en la patología asociada con PV del epitelio corneal. Estos hallazgos pueden proporcionar un mecanismo fisiopatológico para la presentación clínica distintiva que se manifiesta en este caso. Además, informamos la expresión de genes y proteínas de las desmogleínas (DSG1-4) en el epitelio corneal.
Métodos
Se cumplieron los principios de la Declaración de Helsinki para el tratamiento del individuo informado en este estudio. La aprobación del estudio se obtuvo de la Universidad de California, Los Ángeles (UCLA IRB #11-000020).
Exploración clínica
Una mujer afroamericana de 35 años de edad se presentó en la clínica de dermatología del Centro Médico Regional del Condado de Riverside (RCRMC, Riverside County Regional Medical Center). Uno de los autores (S.L.) realizó un examen cutáneo estándar. Posteriormente, el paciente fue remitido a la Clínica de Ojos de la Universidad de Loma Linda, donde dos de los autores (J.J. y J.A.) realizaron un examen biomicroscópico con lámpara de hendidura.
Pruebas diagnósticas de laboratorio
Después de obtener el consentimiento informado, se extrajo una muestra de sangre periférica y una biopsia de la lesión de la mucosa. Se aisló el suero del plasma y se envió al Laboratorio diagnóstico del RCRMC, donde se realizó un ensayo inmunoabsorbente ligado a enzimas (ELISA) para la detección de autoanticuerpos anti-DSG3. Para descartar pénfigo paraneoplásico, el suero también se sometió a inmunofluorescencia indirecta (IFI) utilizando epitelio de vejiga de rata como sustrato6. También se realizó inmunofluorescencia directa (IFD) utilizando anticuerpos contra los isotipos de inmunoglobulinas en la muestra de la biopsia de mucosa oral.
Histopatología
Después de realizar una queratoplastia penetrante en el paciente, el botón corneal se fijó en formalina tamponada al 10% y se envió al Laboratorio de Patología del Centro Médico de la Universidad de Loma Linda para su procesamiento. Posteriormente, el tejido se incluyó en parafina, se seccionó y se tiñó con hematoxilina y eosina utilizando un protocolo de tinción histológica estándar.
Aislamiento de ARN total y síntesis de ADN complementario
Se obtuvieron catorce córneas de nueve donantes de bancos de ojos asociados con el consorcio Vision Share de bancos de ojos. Para las córneas del banco de ojos de donantes con una historia ocular sin complicaciones confirmada, se disoció el epitelio corneal enzimáticamente (Dispasa II, Roche, Basilea, Suiza) y se separó la membrana de Descemet. Las córneas sin epitelio y endotelio fueron procesadas para fibroblastos estromales. Las tres capas corneales se homogeneizaron en TriReagent (Life Technologies, Carlsbad, CA), que es una solución que contiene tiocianato de guanidina/fenol, y se aisló el ARN total según las instrucciones del fabricante. Brevemente, después de la homogeneización del tejido en TriReagent, se realizó la separación de fases mediante la adición de cloroformo y centrifugación. La fase acuosa superior que contenía ARN se separó de la fase orgánica inferior que contenía proteínas y ADN, y posteriormente el ARN se precipitó y se purificó utilizando alcoholes. La preparación del ADN complementario con poli(A)+ a partir de 100 ng de ARN total, se realizó utilizando cebadores oligo(dT)20 y el sistema de síntesis de primera hebra SuperScript® III (Life Technologies, Carlsbad, CA) según las instrucciones del fabricante.
Reacción en cadena de la polimerasa (PCR) cuantitativa
Para determinar los niveles del transcrito de desmogleínas 1-4 en los tres tipos principales de células (epiteliales, fibroblastos y endoteliales) de la córnea, se realizó una PCR cuantitativa utilizando oligonucleótidos específicos para el transcrito cuyas secuencias se obtuvieron de la base de datos del Harvard Primer Bank (Tabla 1); http://pga.mgh.harvard.edu/primerbank/index.html)16-18. La PCR cuantitativa se realizó utilizando el Master Mix 2x KAPA SYBR FAST qPCR (KAPA Biosystems, Boston, MA) en un volumen de reacción de 10 µL colocado en una microplaca de 384 pocillos. Las reacciones se procesaron en el sistema en tiempo real LightCycler 480 (Roche, Basilea, Suiza). Las condiciones de la reacción y el análisis de datos se realizaron según lo descrito previamente19. Se calculó la expresión relativa utilizando los niveles de ARNm del gen constitutivo GAPDH y utilizando el método comparativo de CT (2-ΔΔCT). Los niveles de expresión relativa se representaron como los valores de 2-ΔCT. Todos los experimentos de qPCR se realizaron en cuatro réplicas biológicas independientes (n = 4).
Tabla 1 Cebadores (primers) utilizados en reacción en cadena de la polimerasa (PCR) cuantitativa
| Gen | ID del banco de cebadores | Forward (5 - 3) | Reverse (5 - 3) |
|---|---|---|---|
| DSG1 | 119703743c2 | AACCCAATCGCCAAAATTCACT | ACCTCTCGATCAACTATGGATGT |
| DSG2 | 189181754c2 | TTGTTGGGTCTGTTGAAGAGTTG | TTCAGGGTATTGGGCTCATCT |
| DSG3 | 119964717c1 | GCAAAAACGTGAATGGGTGAAA | TCCAGAGATTCGGTAGGTGATT |
| DSG4 | 197313786c1 | CAGCCTGTCGAGAAGGAGAG | CCCTACTCCAGAAATCCGGTAT |
| GAPDH | N/A | CGACCACTTTGTCAAGCTCA | AGGGGTCTACATGGCAACTG |
Detección mediante inmunohistoquímica con fluorescencia de las DSG
La inmunodetección se realizó utilizando anticuerpos (Tabla 2) dirigidos contra las cuatro DSG, IgG1, IgG4 y KRT12 (biomarcador del epitelio corneal), utilizando un protocolo estándar de inmunohistoquímica. Brevemente, las secciones de muestras control y del paciente fijadas con formalina e incluidas en parafina se desparafinaron y rehidrataron en alcohol, y posteriormente se realizó recuperación enzimática del antígeno (Proteinase K, Sigma Aldrich, St. Louis, MO). Posteriormente, las secciones se bloquearon en PBS + Tween 20 al 0.5% suplementado con BSA (albumina de suero bovino, por sus siglas en inglés) al 1% y suero de caballo al 10%. Posteriormente, se incubaron toda la noche con el anticuerpo primario diluido a 5 µg/ml en 125 µL de tampón de bloqueo, se lavaron 3x en PBS + Tween 20 al 0.5% y después se incubaron con el anticuerpo secundario conjugado con fluorescencia (Tabla 2) diluido 1: 500 en tampón de bloqueo; se lavaron 3x en PBS + Tween 20 al 0.5% seguido de un lavado con PBS, y se montaron con medio de montaje acuoso Vectashield (Vector Laboratories, Inc., Burlingame, CA) que contiene 40, 6-diamidino-2-fenilindol (DAPI). Las imágenes de fluorescencia fueron adquiridas mediante microscopía confocal.
Tabla 2 Anticuerpos utilizados en inmunohistoquímica
| Proteína objetivo | Isotipo | Especie de inmunógeno | Clonalidad | Dilución | Proveedor | Numero de catálogo |
|---|---|---|---|---|---|---|
| Anticuerpos primarios | ||||||
| DSG1 | IgG de ratón | humano | monoclonal | 1:200 | Millipore | MABT118 |
| DSG2 | IgG1 de ratón | humano | monoclonal | 1:100 | Life Technologies | 32 -6100 |
| DSG3 | IgG de cabra | humano | policlonal | 1:100 | R&D Systems | AF1720 |
| DSG4 | IgG de cabra | Humano | Policlonal | 1:33 | Santa Cruz Biotechnology | sc -28067 |
| KRT12 | IgG de conejo | Humano | Policlonal | 1:33 | Santa Cruz Biotechnology | sc -25722 |
| IgG1 | IgG2aK de ratón | humano | Monoclonal | 1:200 | Thermo Scientific | MH1013 |
| IgG4 | IgG3 de ratón | humano | monoclonal | 1:100 | Thermo Scientific | MA5 -16716 |
| Anticuerpos secundarios conjugados con fluorescencia | ||||||
| Rb -IgG | IgG de burro (A488) | Conejo | Policlonal | 1:500 | Life Technologies | A -21206 |
| Ms -IgG | IgG de burro (A594) | Ratón | Policlonal | 1:500 | Life Technologies | A -21203 |
| Gt -IgG | IgG de burro (A594) | cabra | policlonal | 1:500 | Life Technologies | A -21207 |
Análisis estadístico
Se utilizó una prueba t no pareada de dos colas para identificar una diferencia significativa en las medias de los niveles de expresión relativa de ARNm de DSG1-4 en el epitelio en comparación con los niveles presentes en el estroma y el endotelio. Las diferencias en las medias de la expresión génica entre el estroma y el endotelio corneal se consideraron significativas con una p ≤ 0.05.
Resultados
Descripción clínica
Una mujer afroamericana de 35 años se presentó en la clínica oftalmológica del Centro Médico Regional del Condado de Riverside (RCRMC) en 2010, refiriendo ojos rojos con dolor de intensidad variable durante toda su vida, de forma bilateral, asociados con visión borrosa. Se le diagnosticó conjuntivitis alérgica y se trató con éxito (aunque temporalmente) con esteroides tópicos. Desarrolló una dermatitis ampollosa difusa que afectó tanto la piel como la mucosa oral, y fue diagnosticada con PV, que luego se confirmó por la presencia de depósitos de inmunoglobulinas en la mucosa oral y autoanticuerpos anti-DSG3 en el suero. Además, la IFI del suero fue negativa y se excluyó PPN. La administración oral de prednisona y azatioprina eliminó las lesiones ampollosas. Posteriormente, experimentó inyección conjuntival variable pero persistente y recurrencias periódicas de las erosiones de la mucosa oral. En última instancia, sufrió una exacerbación aguda de la inflamación ocular y pérdida visual, que no respondió al aumento de la inmunosupresión sistémica. En este momento, fue remitida a la clínica de córnea del RCRMC, donde fue evaluada por uno de los autores (J.A.).
En la presentación, la agudeza visual no corregida era de cuenta dedos a nueve pies en el ojo derecho y 20/100 en el ojo izquierdo, mejorando con estenopeico a 20/70 en ambos ojos. El examen con lámpara de hendidura reveló inyección conjuntival bilateral 3+, sin evidencia de erosiones o formación de simbléfaron (Figura 1). Las córneas de ambos ojos mostraban una cicatrización periférica de 360 grados y formación de pannus que se extendía ~2-3 mm desde el centro (Figura 1A y 1B). En el ojo derecho, se identificó un defecto epitelial paracentral de ~2 mm x 3 mm (fotos anteriores tomadas después de que se resolvió el defecto epitelial). La córnea derecha también demostró una lesión discreta, inferior, elevada, con bordes, gelatinosa, con vasos en sacacorchos, que parecía cubrir el tejido cicatricial periférico (Figuras 1A, 1C y 1D). Una biopsia descartó extensión corneal de una neoplasia intraepitelial conjuntival, y se inició un esteroide tópico en ambos ojos. Se logró resolución completa en el ojo derecho, con control de la inflamación en ambos ojos (Figura 2).

Figura 1 Cambios corneales periféricos en un individuo con pénfigo vulgar. A. Se observó formación de pannus inferior y opacificación corneal periférica 360 grados en el ojo derecho. B. Se observó opacificación corneal periférica sin formación significativa de pannus en el ojo izquierdo. C. Luego de la tinción con rosa de bengala, se visualizaron claramente los bordes del pannus inflamatorio en el ojo derecho. D. La vista a mayor aumento de la región limbal inferior en el ojo derecho, demostró engrosamiento y vascularización prominente del pannus inflamatorio.
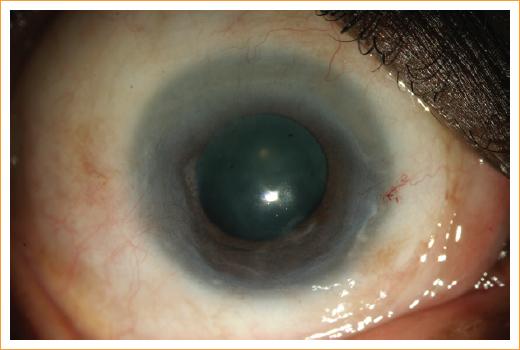
Figura 2 Dos meses después de iniciar el tratamiento con esteroides tópicos, el ojo derecho del individuo con PV mostrado en la Figura 1, demostró resolución del pannus inflamatorio pero persistencia de la cicatrización corneal anterior.
La videoqueratografía reveló un astigmatismo irregular significativo de cada córnea, que se supone fue inducido por la cicatrización corneal periférica superficial. Por lo tanto, se realizó una queratectomía superficial en el ojo derecho. Cinco días después del procedimiento, la paciente desarrolló necrosis del estroma corneal que progresó a un gran descemetocele central, que posteriormente se perforó. Cabe destacar que la paciente reveló que había estado usando Ilevro tópico (suspensión de nepafenaco al 0.3%) hasta cinco veces al día desde el momento del raspado de córnea hasta la visita de seguimiento 5 días después, lo que probablemente contribuyó a la necrosis del estroma. Dada la incapacidad de mantener cerrada la perforación durante un período de 15 semanas a pesar de aplicaciones seriadas (5) de cianoacrilato, y con control de las manifestaciones oculares y dermatológicas del PV con esteroides tópicos e inmunosupresión sistémica, se realizó una queratoplastia penetrante de 8 mm de diámetro. Seis meses después de la cirugía, la visión no corregida era de 20/150, y no se observaba evidencia de necrosis estromal recurrente.
Análisis histopatológico de la córnea extirpada
El examen histopatológico de la córnea extirpada demostró ulceración corneal anterior, inflamación estromal crónica, vascularización estromal y tejido fibroso retrocorneal con atrofia de células endoteliales (Figura 3).

Figura 3 El examen histopatológico de la muestra corneal del individuo con PV, reveló ulceración corneal anterior con infiltrado celular inflamatorio crónico, adelgazamiento estromal y vascularización marcados, y una membrana retrocorneal fibrosa delgada debajo de la membrana de Descemet (tinción con hematoxilina y eosina; aumento 10x) (A). La vista a mayor aumento demostró vasos en el estroma anterior e infiltración de células inflamatorias crónicas (aumento 20x) (B).
Expresión de los genes de DSG en la córnea
Se determinó la expresión de los genes de DSG en los tres tipos de células predominantes de la córnea mediante qPCR (Figura 4). Las cuatro DSG se expresaron en el epitelio corneal, con una expresión estadísticamente significativamente mayor que en los queratocitos y en las células endoteliales. Se observó una expresión débil de DSG1-3 en queratocitos y de DSG2 en células endoteliales, aunque la detección de cada una estaba en un nivel cercano al límite de detección de la qPCR.

Figura 4 Medición de los niveles de transcritos de DSG en la córnea utilizando qPCR. Los transcritos para DSG 1-4 se expresaron en el epitelio a niveles significativamente más altos que en el estroma y el endotelio. La expresión relativa se representó como 2-ΔCT, con el transcrito de GAPDH como gen de referencia para calcular la expresión relativa. El análisis estadístico se realizó utilizando una prueba t no pareada (n = 4). **p ≤ 0.01; ***p ≤ 0.001; ****p ≤ 0.0001 (barras de error = SEM). N.D.: no detectado.
Alteración de la expresión de las proteínas DSG3 y DSG4 en la córnea con PV
Las cuatro proteínas DSG se detectaron en la córnea de donante sano mediante F-IHQ, demostrando localización en los bordes de las células epiteliales (Figura 5). Mientras que DSG1-3 se detectó en todas las capas del epitelio, DSG4 se localizó en las capas de células epiteliales superficiales. Aunque la expresión de DSG1 y DSG2 no se observó significativamente alterada en el epitelio corneal con PV en comparación con la córnea donante sana, DSG3 y DSG4 demostraron una marcada alteración en su expresión y localización dentro del epitelio corneal con PV. En contraste con el epitelio corneal del donante sano, DSG3 se localizó principalmente en las capas de células epiteliales más superficiales en el caso con PV, y demostró una reducción marcada de su expresión en el resto del epitelio. En comparación con el epitelio corneal donante, la expresión de DSG4 en el epitelio con PV fue difusa y se localizó exclusivamente en el citoplasma de las células epiteliales de la córnea. Si bien se detectó DSG4 en el epitelio corneal donante normal (capas superficiales), es razonable especular que los resultados obtenidos para el epitelio con PV pueden ser un artefacto. No se detectó ninguna de las proteínas DSG en el estroma corneal o el endotelio (datos no mostrados), de acuerdo con los resultados de qPCR. El epitelio corneal también fue positivo para el biomarcador epitelial corneal KRT12, un componente de los filamentos intermedios de tipo I presentes en el citoplasma.
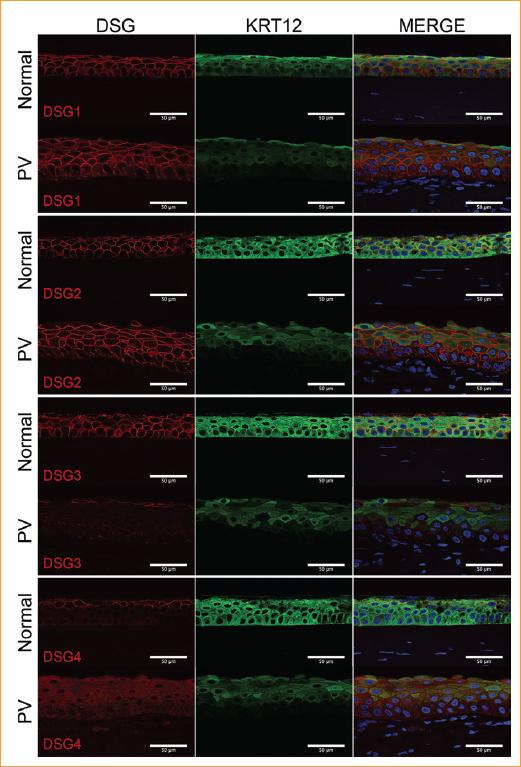
Figura 5 Evaluación de la expresión de proteínas DSG1-4 en el tejido corneal donante y con PV mediante inmunohistoquímica con fluorescencia. Primera columna: en el epitelio corneal del donante (normal), se detectaron las cuatro proteínas DSG (rojas) en los contactos célula-célula; en el epitelio corneal con PV, DSG1 y 2 demostraron una expresión similar a la del control, pero la expresión de DSG3 y DSG4 estaba disminuida. Segunda columna: la expresión epitelial corneal de KRT12 (verde), un biomarcador específico del epitelio corneal, se utilizó como control positivo. Tercera columna: se aplicó contra tinción de las secciones de tejido con DAPI (azul; núcleo celular). Barra de escala = 50 mm. PV: pénfigo vulgar.
Localización diferencial de las inmunoglobulinas G1 y G4 en la córnea con PV
Para determinar el tipo de inmunoglobulinas anti-DSG3 que potencialmente median la reducción de la proteína DSG3 en el epitelio corneal con PV, realizamos F-IHQ para los dos tipos de IgG (IgG1 e IgG4) que se asocian más comúnmente con el PV (Figura 6). IgG1 e IgG4 no se detectaron en el epitelio corneal del donante normal. Sin embargo, ambas inmunoglobulinas se detectaron en el epitelio y el estroma de la córnea con PV. Además, estas inmunoglobulinas se detectaron de forma difusa y/o como focos puntiformes dentro del estroma anterior, donde se asociaron con la neovasculatura, e IgG4 mostró focos fluorescentes más numerosos. Aunque ambas inmunoglobulinas se detectaron en el estroma, solo la IgG4 se localizó en los contactos célula-célula en el epitelio, reflejando el patrón de expresión observado para las DSG y asociada con la reducción marcada en los niveles de DSG3.
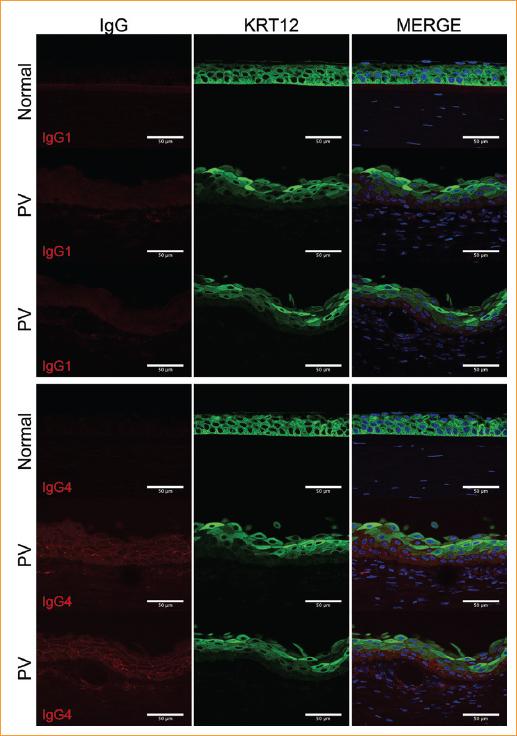
Figura 6 La localización de las inmunoglobulinas G1 y G4 en la córnea con PV se determinó mediante F-IHQ. Primera columna: en el epitelio corneal del donante (normal), no se detectaron IgG1 ni IgG4 (rojo); en el epitelio corneal con PV, no se visualizó IgG1, mientras que IgG4 se localizó en los contactos célula-célula. Segunda columna: la expresión epitelial corneal de KRT12 (verde), un biomarcador específico del epitelio corneal, se utilizó como control positivo. Tercera columna: se aplicó contra tinción de las secciones de tejido con DAPI (azul; núcleo celular). Barra de escala = 50 mm. PV: pénfigo vulgar.
Discusión
Las desmogleínas son un pequeño grupo de proteínas que son miembros de la superfamilia de las cadherinas, y junto con las desmocolinas, son un componente importante de los desmosomas, que están involucrados en la adhesión celular20. La expresión corneal de las desmogleínas se ha examinado previamente, principalmente en modelos animales, y los estudios iniciales se han limitado a estudiar principalmente a DSG12121-28. Investigaciones más recientes han descrito la expresión de proteínas DSG en el tejido corneal humano, pero a menudo solo han investigado la expresión de una proteína DSG29-33. En conjunto, estos estudios han proporcionado evidencia de la expresión de DSG3 en el epitelio corneal humano, sin evaluación específica de la expresión de DSG1, DSG2 y DSG429,33. Demostramos que DSG1-4 se expresan en el epitelio corneal humano, que DSG1-3 están presentes en la mayoría de las capas de células epiteliales, y que DSG4 se expresa solamente en las capas de células epiteliales superficiales.
Está bien documentado en la literatura que DSG3 es la principal cadherina desmosomal involucrada en el PV34. La demostración de los niveles de DSG3 marcadamente reducidos en el epitelio corneal en el PV en comparación con la córnea normal, así como la identificación de autoanticuerpos contra IgG4 en el epitelio corneal, indican que el involucro corneal en el PV está mediado en parte o en su totalidad por autoanticuerpos contra DSG3. Esto está en línea con la presencia de autoanticuerpos anti-DSG3 circulantes en pacientes con PV35.
Algunos han sugerido que la baja incidencia de hallazgos oculares asociados con el PV se debe a la capacidad de las proteínas que no son desmogleínas para compensar la pérdida de la función de DSG3 causada por los autoanticuerpos anti-DSG en el PV 9.La expresión de varias proteínas DSG también puede disminuir la probabilidad de desarrollar patología corneal mediada por anti-DSG, ya que se espera que las DSG no afectadas mantengan la integridad del epitelio y, por lo tanto, compensen la pérdida de cualquier DSG individual36,37. La llamada teoría de la compensación de las desmogleínas puede explicar la incidencia extremadamente baja de afectación corneal en el PV y en otras enfermedades mediadas por anti-DSG. Aunque demostramos que las cuatro proteínas DSG están presentes en el epitelio corneal, describimos un fenotipo corneal pronunciado en el caso que presentamos. Estos datos sugieren que el mecanismo que resulta en la fisiopatología en el paciente que describimos, es más complejo y puede incluir un componente que supere el presunto efecto protector de la expresión de varias DSG. Si bien la baja incidencia de hallazgos corneales en el PV puede apoyar indirectamente la teoría de la compensación de las desmogleínas, el caso que presentamos puede ser un ejemplo que refuta la teoría, o al menos una excepción.
Una segunda barrera para el involucro corneal es que la córnea es normalmente avascular, lo que limita la capacidad de las células inmunes y las inmunoglobulinas para infiltrarse en la córnea. El paciente que informamos tenía ojos rojos crónicos desde la infancia (según los antecedentes), lo que posiblemente resultó en la neovascularización corneal evidente en el momento de la presentación. La pérdida de la avascularidad corneal permitiría que las inmunoglobulinas se localicen en el epitelio corneal y superen el efecto protector de otras DSG presentes.
Conclusiones
Aunque el PV afecta principalmente la piel y la mucosa oral, el epitelio corneal también puede verse afectado. Aquí demostramos la expresión de DSG alterada en el epitelio corneal con PV y la localización de IgG4 en los contactos célula-célula en el epitelio corneal con PV, proporcionando un mecanismo fisiopatológico para estas características corneales inusuales pero prominentes. Por lo tanto, en ausencia de cualquier causa secundaria identificable, la patología corneal asociada con el PV probablemente está mediada por autoanticuerpos dirigidos contra DSG3 en el epitelio corneal. También demostramos la expresión corneal de los cuatro genes de DSG y proporcionamos una visión general integral de la expresión de DSG en el epitelio corneal.











 text new page (beta)
text new page (beta)


