Introducción
Los anfibios constituyen un grupo taxonómico por el que existe una preocupación de larga data debido a que se consideran los vertebrados más amenazados a nivel mundial (Angulo, 2002; Lips et al., 2004; Hayes et al., 2010; Bishop et al., 2012; Whittaker et al., 2013; Loyola et al., 2015). El grupo atraviesa una situación alarmante en la cual cerca del 41% de sus especies se encuentran incluidas en alguna categoría de amenaza (IUCN, 2022). En particular, en el Cono Sur de Sudamérica, recientemente se informó que al menos el 44% de las poblaciones de anfibios en Chile y Argentina están disminuyendo (Kacoliris et al., 2022). Frente a este escenario, los estudios de diversidad de anuros aportan información valiosa que puede ser utilizada como insumo para la elaboración de estrategias de conservación de especies (Vaira et al., 2018; Boullhesen et al., 2021). No obstante, debemos tener en cuenta que el éxito de una investigación sobre biodiversidad en un área depende en gran medida de la elección de las técnicas de muestreo (Ribeiro-Junior et al., 2008). Esta situación ha alentado la estandarización de dichas técnicas, a los fines de garantizar la comparabilidad entre diferentes estudios y mejorar el poder predictivo de los mismos, todo lo cual permite a los investigadores y conservacionistas alrededor del mundo implementar programas más efectivos de monitoreo (Rödel & Ernst, 2004; Hsu et al., 2005; Boullhesen et al., 2021). Como consecuencia, se han desarrollado varios manuales que detallan técnicas de muestreo adecuadas para anfibios (e.g., Heyer et al., 1994; Lips et al., 2001; Angulo et al., 2006; Pereyra et al., 2021), y múltiples trabajos que se enfocan en comparar las distintas técnicas en hábitats específicos (e.g., Crosswhite et al., 1999; Pearman et al., 1995; Parris et al., 1999; Rocha et al., 2004; Rödel & Ernst, 2004; Hsu et al., 2005; Ribeiro-Junior et al., 2008; Madalozzo et al., 2017; Boullhesen et al., 2021).
Sin embargo, la alta diversidad que presentan los anfibios como grupo, dificulta lograr muestreos efectivos. La variabilidad existente en tamaño corporal y formas de vida afectan el éxito de registro de las distintas especies (Crosswhite et al., 1999). Debemos considerar también la variación en cuanto a patrones de actividad diarios y estacionales, los cuales a su vez son influenciados por condiciones abióticas como la temperatura, la humedad, el fotoperíodo, la intensidad de la luz, la velocidad del viento y la lluvia (Crosswhite et al., 1999; Hatano et al., 2002; Almeida-Gomes et al., 2007; Sanchez et al., 2007; Canavero et al., 2008; Van Sluys et al., 2012; Madalozzo et al., 2017). A su vez, las distintas técnicas poseen debilidades y fortalezas. En este sentido, Ribeiro-Junior et al. (2008) señalan que, probablemente, la efectividad de las técnicas de muestreo “activas”, como las inspecciones visuales o las auditivas, esté influida por el tipo de hábitat (lo cual afecta la tasa de detección), mientras que las técnicas “pasivas” no suelen ser eficaces para la comunidad de anfibios en su conjunto (e.g., las trampas de caída registran taxones terrestres y fosoriales), pero tienen la ventaja de reducir el sesgo introducido habitualmente por el investigador. Consecuentemente, varios autores recomiendan utilizar distintas técnicas de muestreo, ya que la combinación de éstas aumenta la probabilidad de obtener una representación precisa de los anfibios presentes (Parris, 1999; Lajmanovich & Peltzer, 2001; U.S. EPA, 2002; Ribeiro-Junior et al., 2008).
Entre las técnicas más frecuentemente utilizadas para muestrear a este grupo taxonómico se hallan el inventario completo de especies, la inspección de encuentro visual, la transecta auditiva, el muestreo por cuadrantes, las trampas de caída y el muestreo cuantitativo de larvas (Heyer et al., 1994). Recientemente, y ligado al desarrollo tecnológico de unidades de grabación autónomas, el monitoreo acústico pasivo comenzó a incorporarse en los estudios de biodiversidad. El mismo permite monitorear las poblaciones de anfibios durante un período de tiempo continuo y sin la presencia física de los investigadores en el campo (Sugai et al., 2019; Boullhesen et al., 2021). Sin embargo, los precios de las grabadoras aún son un factor limitante cuando no se cuenta con una financiación amplia. Consecuentemente, es importante a la hora de decidir qué técnicas usar en un área en particular, considerar los recursos económicos, el personal disponible y el tiempo requerido por cada técnica; así como resulta crucial tener en cuenta los hábitos de las especies de presencia potencial en el sitio (ej., acuáticas, arbóreas, terrestres), el tamaño del área abordada por nuestro estudio y la complejidad del hábitat. Al respecto, la eficiencia de la técnica puede variar mucho y depende del ambiente (Rocha et al., 2004), por lo que varios autores resaltan la necesidad de trabajos que evalúen la eficiencia de las técnicas de muestreo aplicadas a ensambles de especies y regiones específicas (Parris, 1999; Hsu et al., 2005; Madalozzo et al., 2017). Sin embargo, en el continente americano, la mayoría de las investigaciones que evalúan diferentes técnicas de muestreo en anfibios se han realizado en América del Norte (e.g., Bury & Corn, 1987; Corn & Bury, 1990; Greenberg et al., 1994; Heyer et al., 1994; Crosswhite et al., 1999; Corn et al., 2000; Guzy et al., 2014). Algunos estudios se han desarrollado en Sudamérica (Pearman et al., 1995; Doan, 2003) y particularmente en Brasil (Rocha et al., 2004; Ribeiro-Junior et al., 2008; Madalozzo et al., 2017), pero se ha prestado mucha menos atención a otras áreas, especialmente a las regiones templadas húmedas de Sudamérica. Debido a que las comunidades de anuros y su hábitat físico circundante varían entre regiones, se torna necesario evaluar la eficacia de las técnicas de muestreo también en estos ambientes (Hsu et al., 2005).
En Argentina se cuenta con escasos trabajos que comparan la eficacia relativa de diferentes técnicas de muestreo para anfibios (e.g., Boullhesen et al., 2021). Ninguno se ha centrado en la Ecoregión Espinal. Como parte de un estudio más amplio que investiga la fauna de tetrápodos presente en la Reserva de Uso Múltiple “Escuela Juan Bautista Alberdi”, evaluamos la efectividad relativa de cuatro técnicas de registro ampliamente utilizadas en anuros. Nuestro objetivo fue identificar cuál de ellas es más apropiada para el registro de anfibios en este humedal lacustre templado del centro-este de Argentina.
Materiales y métodos
Área de estudio. La Reserva de Uso Múltiple “Escuela Juan Bautista Alberdi” (RJBA) se localiza en el km 10.5 de la Ruta Provincial Nº 11, Oro Verde, Entre Ríos (Fig. 1; 31°50'12” S; 60°31'25” O; 94.78 m s.n.m). Se emplaza dentro de la Ecoregión Espinal (Burkart et al., 1999), en el centro-este de Argentina, y posee una superficie de 20 ha. Fue creada en 1992 con el objetivo de conservar un sector de monte nativo deteriorado por acción antrópica (Muzzachiodi, 2002). Al respecto, la RJBA posee una zona de monte cerrado interno dominado por especies nativas (Geoffrea decorticans, Myrcianthescis platensis, Eugenia spp., Prosopis alba); un monte abierto más invadido y dominado por especies exóticas (Ligustrum lucidum, Morus spp., Melia azedarach); y un área de pastizal lindante al monte nativo (Cortaderia selloana, Geoffreade corticans, Baccharis spp., Sapium haematospermum).
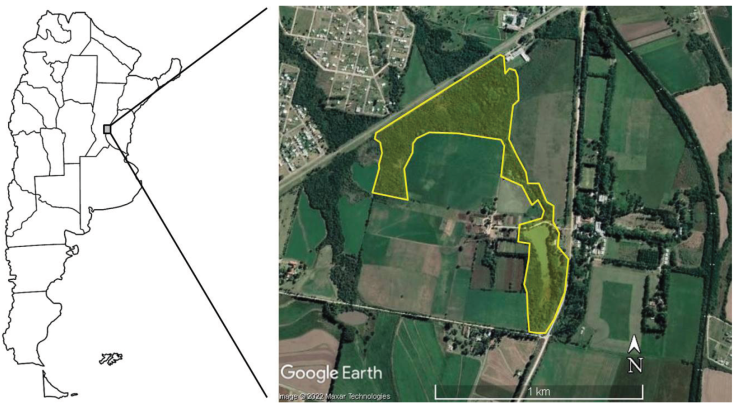
Figura 1 Localización de la Reserva de Uso Múltiple Escuela Juan Bautista Alberdi (Entre Ríos, Argentina) en el centro-este de Argentina. / Figure 1. Location of the Juan Bautista Alberdi School Multiple Use Reserve (Entre Ríos, Argentina) in central-east Argentina.
Asimismo, cuenta con una laguna permanente, la cual posee una superficie de 2.6 ha y una profundidad no superior a los 1.6 m. La misma recibe aportes de agua de la capa freática y por escorrentía superficial de las áreas lindantes durante las precipitaciones (Cacciabue & Savino, 2019). Su zona litoral presenta una cobertura vegetal compuesta principalmente por pasto miel o pata de gallina (Paspalum dilatatum), caña común (Arundo donax), juncos (Thypa latifolia), uña de gato (Uncaria tomentosa), guayabo (Psidium guayaba), ombú (Phytolacca dioica), ligustro (Ligustrum lucidum) y palmeras (Butia yatay) (Cacciabue & Savino, 2019). La región se encuentra comprendida dentro del clima templado húmedo de llanura. La temperatura media anual ronda los 18.4 °C y las precipitaciones presentan una media anual de alrededor de 1,100-1,200 mm (Pausich et al., 2013).
Técnicas de muestreo
Los muestreos se efectuaron con frecuencia mensual de diciembre de 2021 a marzo de 2022 (temporada de verano en el hemisferio sur), sumándose un muestreo de otoño (mayo de 2022), y totalizando cinco relevamientos en el área. Se utilizaron cuatro técnicas para registrar anfibios: trampas de caída, muestreo de larvas con red, transectas de prospección auditiva y transectas de prospección visual (Greenberg et al., 1994; Heyer et al., 1994; Parris, 1999; U.S. EPA, 2002).
Trampas de caída. Se ubicaron en un arreglo de dos transectas bordeando el cuerpo de agua, cada una de las cuales contó con tres trampas de caída (Fig. 2). La distancia entre trampas continuas fue de 10 m (siguiendo a Sanchez et al., 2013). Cada una de ellas consistió en un recipiente plástico de 20 l de capacidad que contuvo 200 cm³ de agua y una esponja de gomaespuma de 5x10 cm en el fondo a fin de proveer humedad a los animales capturados en el caso de que el agua se secase (Greenberg et al., 1994; Sanchez et al., 2020). Las transectas se separaron una de otra por una distancia de 150 m. Las trampas se habilitaron una vez al mes y se revisaron luego de dejarlas actuar durante 72 h (Sanchez et al., 2020).

Figura 2 Técnica de muestreo con trampas de caída. A) Trampa de 20 l de capacidad; B) Laguna de la Reserva de Uso Múltiple Escuela Juan Bautista Alberdi, alrededor de la cual se establecieron las transectas de trampas de caída. / Figure 2. Sampling technique with pitfall traps. A) Trap with a 20-l capacity; B) Lagoon of the Juan Bautista Alberdi School Multiple Use Reserve, around which the pitfall trap transects were established.
Muestreo de larvas con red. Se realizaron inspecciones diurnas recorriendo la orilla de la laguna de la RJBA con el fin de buscar larvas. Se utilizó un método de barrido con red para recolectar las muestras (U.S. EPA, 2002). El tamaño de la red fue de 30 × 32 cm, con poros de 1 mm2 en su malla. Se implementó un diseño con tres transectas de 50 m cada una. En ellas, se localizaron puntos de inspección cada 10 m, en los cuales se realizaron cinco barridos con red girando en el lugar (Sanchez et al., 2013; 2020). Aquellas larvas que no pudieron ser identificadas en el campo fueron sacrificadas y fijadas, acorde a las directrices de ASIH et al. (2004) para su posterior determinación taxonómica, la cual se realizó bajo lupa binocular, siguiendo las descripciones proporcionadas por diversos autores para las especies de la región (e.g., Kehr & Williams, 1990; Vera-Candioti, 2007; Kolenc et al., 2008).
Transectas de prospección auditiva y de prospección visual. Los machos sexualmente maduros de la mayoría de las especies de anuros vocalizan en cuerpos de agua o sus alrededores. Lo hacen para atraer a las hembras y establecer territorios, y cada especie posee una vocalización distintiva, lo cual permite identificarlas (Straneck et al., 1993; Wells, 2007). En este contexto, con el objetivo de registrar especies a través del canto, cada mes se realizó una búsqueda recorriendo la orilla de la laguna en la franja horaria comprendida entre las 20:30 h y las 22:30 h. Para ello se dispuso una transecta de 100 m con puntos de prospección auditiva localizados sobre la misma cada 10 m. El registro dentro de cada punto se circunscribió a un diámetro fijo de 3.5 m de radio (7 m de diámetro), lo cual permite una cobertura detallada del mismo y acceder a los focos concretos de emisión de canto dentro de su superficie, corroborando así la correcta inclusión en el punto de escucha y evitando registrar dos veces al mismo individuo (Sanchez, 2011). El mismo diseño fue empleado para el caso de la prospección visual, ubicando estaciones de inspección visual de anfibios cada 10 m a lo largo de una transecta de 100 m (Sanchez et al., 2013; 2020).
En todas las técnicas activas se tomó registro del tiempo total, en minutos, dedicado a buscar anuros. En el caso del muestreo pasivo se cuantificó el tiempo que estuvieron abiertas las trampas. Asimismo, se identificaron las especies encontradas y la cantidad de individuos por especie. Dado que el tiempo requerido varió entre las técnicas de muestreo implementadas, para hacer comparables las eficiencias de registro, se estandarizó la abundancia registrada con cada técnica relativizando los individuos encontrados de cada especie al esfuerzo de muestreo medido en minutos (modificado de Rocha et al., 2004). Esto dio como resultado la efectividad relativa de registro (ERR).
ERR = (abundancia de anfibios registrada/minutos de muestreo) x 100
El tiempo dedicado a cada técnica de muestreo fue de 24480 min de actividad de las trampas de caída (4080 min/trampa), 189 min de búsqueda de larvas, y 266 min tanto en las transectas de prospección auditiva como en las prospecciones visuales. Asimismo, se estimó el tiempo necesario para que un observador encuentre un anuro individual o TE (modificado de Rocha et al., 2004).
TE = (minutos de muestreo/individuos registrados)
Análisis estadístico
Se trabajó con un data.frame, es decir, una tabla en R que puede almacenar diferentes tipos de datos. En él se ingresó para cada técnica de muestreo las especies que fueron halladas con sus respectivas ERR. A los fines de analizar el efecto de la técnica de muestreo (variable predictora) sobre la ERR (variable respuesta), sin discriminar entre especies, se empleó un modelo lineal randomizado mediante un test de permutación (Manly, 2007; Faraway, 2009). Este método se eligió debido a que los diagnósticos numéricos previos (test de Shapiro y test de Bartlett) revelaron que no se cumplían los supuestos de normalidad y homocedasticidad de la variable respuesta.
Se realizó un ANOVA Tipo 2 y se extrajo el F observado. El estadístico F es una buena medida de la asociación entre la variable predictora y la respuesta, donde los valores más grandes indican asociaciones más fuertes. Se puede romper la correspondencia entre ambas variables permutando los valores de una de ellas, luego de lo cual se recalcula F (Faraway, 2009). Nosotros estimamos F para 1000 permutaciones aleatorias de la variable respuesta y obtuvimos una distribución de pseudo F. A continuación cotejamos el F observado con la distribución de pseudo F creada en el modelo de permutación. Calculamos el valor de p analizando qué proporción de la distribución de pseudo F excede al F observado. Si dicha proporción es pequeña debemos rechazar la afirmación de que la variable respuesta no está relacionada con la predictora (Faraway, 2009). El nivel de significancia considerado fue de 0.05. Las pruebas estadísticas se realizaron mediante el software R versión 4.2.0 (R Core Team, 2022). Se utilizaron las librerías car (Fox & Weisberg, 2019) y sciplot (Morales et al., 2020).
Resultados
Se halló un total de 11 especies de anfibios distribuidas en cinco géneros y tres familias (Fig. 3; Tabla 1) en la RJBA. Boana pulchella, Scinax nasicus y Rhinella dorbignyi fueron las especies más detectadas representando, respectivamente, el 44.3%, 14.8% y 12.5% de todos los registros. El resto de las especies presentaron una frecuencia de observación baja, la cual rondó entre el 1.1% y el 6.8%.

Figura 3 Especies de anuros registradas en la Reserva de Uso Múltiple Escuela Juan Bautista Alberdi con las técnicas de muestreo testeadas. A) Rhinella diptycha; B) R. dorbignyi; C) Boana pulchella; D) Dendropsophus nanus; E) D.sanborni; F) Scinax acuminatus; G) S. nasicus; H) Leptodactylus gracilis; I) L. latinasus; J) L. macrosternum; K) L. mystacinus. / Figure 3. Anuran species recorded in the Juan Bautista Alberdi School Multiple Use Reserve with the sampling techniques tested. A) Rhinella diptycha; B) R. dorbignyi; C) Boana pulchella; D) Dendropsophus nanus; E) D. sanborni; F) Scinax acuminatus; G) S. nasicus; H) Leptodactylus gracilis; I) L. latinasus; J) L. macrosternum; K) L. mystacinus.
Tabla 1 Número de registros, riqueza (S), especies encontradas, efectividad relativa de registro (ERR) y tiempo de encuentro en minutos (TE), usando cuatro técnicas de muestreo en la Reserva de Uso Múltiple Escuela Juan Bautista Alberdi (Entre Ríos, Argentina). RDI, Rhinella diptycha; RDO, R. dorbignyi; BP, Boana pulchella; DN, Dendropsophus nanus; DS, D. sanborni; SA, Scinax acuminatus; SN, S. nasicus; LG, Leptodactylus gracilis; LL, L. latinasus; LMA, L. macrosternum; LMY, L. mystacinus. / Table 1. Number of records, richness (S), species observed, relative registration effectiveness (ERR), and encounter time in minutes (TE), by using four sampling techniques in the Juan Bautista Alberdi School Multiple Use Reserve (Entre Ríos, Argentina). RDI, Rhinella diptycha; RDO, R. dorbignyi; BP, Boana pulchella; DN, Dendropsophus nanus; DS, D. sanborni; SA, Scinax acuminatus; SN, S. nasicus; LG, Leptodactylus gracilis; LL, L. latinasus; LMA, L. macrosternum; LMY, L. mystacinus.
| Técnica de muestreo | Número de registros | S | Especies | ERR | TE |
|---|---|---|---|---|---|
| Trampas de caída | 0 | 0 | - | 0.00 | - |
| Muestreo de larvas con red | 7 | 2 | RDO, BP | 3.70 | 27 |
| Transectas de prospección auditiva | 65 | 8 | BP, DN, DS, SA, SN, LG, LL, LMY | 24.44 | 4.09 |
| Transectas de prospección visual | 9 | 5 | RDI, BP, SA, SN, LMA | 3.38 | 29.6 |
La técnica de muestreo utilizada influyó en la ERR de los anfibios (Fig. 4; P = 0.001). Un análisis detallado de los resultados obtenidos con cada técnica, revela que la mayor riqueza de especies (N = 8) y cantidad de registros (abundancia total de 65 individuos; 80.25% del total) se obtuvo al emplear transectas de prospección auditiva. Este método presentó una ERR global del 24.44% y con él se necesitó un promedio de solo 4.09 minutos para encontrar un anuro (Tabla 1). Los muestreos de larvas con red permitieron detectar dos especies, una representada por cuatro individuos y la otra por tres, para lo cual se necesitó un promedio de 27 minutos para hallar un renacuajo. Esta metodología abarcó el 8.64% de los registros totales con una ERR del 3.70%. Por su parte, mediante las transectas de prospección visual, se identificaron cinco especies, B. pulchella con cinco observaciones y el resto con una sola, conformando el 11.1% de los registros y con una ERR del 3.38%. En este caso, el tiempo requerido para que un observador encuentre un individuo de cualquier especie fue de 29.6 minutos. Llamativamente, las trampas de caída no produjeron capturas en ningún mes, a pesar de la cantidad considerable de tiempo invertido en ellas (4080 min/trampa) (Tabla 1; Fig. 5).

Figura 4 Histograma de la distribución de valores de pseudo F obtenidos luego de 1000 permutaciones aleatorias para la variable respuesta efectividad relativa de registro (ERR) de anuros en la Reserva de Uso Múltiple Escuela Juan Bautista Alberdi (Entre Ríos, Argentina). Se marca el valor del F observado (Fobs) en rojo. / Figure 4. Pseudo F value distribution obtained after 1000 random permutations for the relative registration effectiveness (ERR) response variable of anurans in the Juan Bautista Alberdi School Multiple Use Reserve (Entre Ríos, Argentina). The observed F value (Fobs) is marked in red.
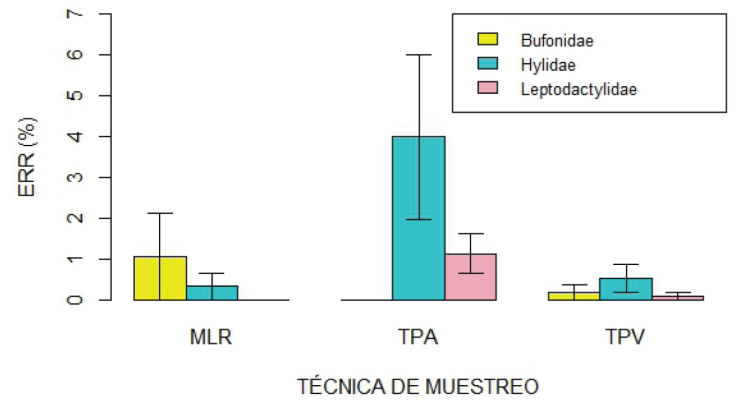
Figura 5 Media y error estándar de la efectividad relativa de registro (ERR) para cada técnica de muestreo utilizada en la Reserva de Uso Múltiple Escuela Juan Bautista Alberdi (Entre Ríos, Argentina), discriminada por familia de anuro. MLR, Muestreo de larvas con red; TPA, Transectas de prospección auditiva; TPV, Transectas de prospección visual. / Figure 5. Mean and standard error of the relative registration effectiveness (ERR) for each sampling technique used in the Juan Bautista Alberdi School Multiple Use Reserve (Entre Ríos, Argentina), separated by anuran family. MLR, larvae sampling with net; TPA, Acoustic survey transects; TPV, Visual survey transects.
Discusión
Existen varios estudios que evalúan la efectividad relativa de diferentes técnicas de muestreo para anfibios (e.g., Parris et al., 1999; Rocha et al., 2004; Guzy et al., 2014; Madalozzo et al., 2017), pero ninguno de ellos se enfoca en humedales templados del Hemisferio Sur. Con las técnicas empleadas registramos una riqueza de anuros para la RJBA de N=11 especies, lo cual representa el 37.9% de las 29 especies citadas para la región (Lajmanovich & Peltzer, 2001; Aceñolaza et al., 2008; Sanchez et al., 2008, 2013). Dado que el período de muestreo se acotó casi exclusivamente a una única estación y con frecuencia mensual, consideramos exitosa la detección de especies en el área. Las técnicas analizadas para muestrear anuros expusieron una notable variación en cuanto a su efectividad de registro. A excepción de las trampas de caída, las técnicas usadas fueron adecuadas para el programa de monitoreo en la RJBA y es probable que también sean útiles en otros ecosistemas lénticos templados.
Las trampas de caída fueron la técnica menos efectiva de las cuatro analizadas, sin arrojar registro alguno. Si bien varios trabajos recomiendan su utilización (e.g., Crosswhite et al., 1999; Ribeiro-Junior et al., 2008), también hay experiencias previas en donde se halló una baja eficiencia comparativa de las trampas en relación a otras técnicas de muestreo, como es el caso de Rödel & Ernst (2004) investigando la diversidad de anfibios en bosques tropicales. En la misma línea, de un total de 22 especies de anfibios detectadas, Hsu et al. (2005) lograron recolectar 11 con trampas de caída en un bosque subtropical de China, constituyendo nuevamente la técnica menos eficiente de las testeadas por los investigadores.
Por su parte, Rocha et al. (2004), en un ambiente de Restinga brasilera, y con un esfuerzo de 5220 min/observador, no lograron capturar anfibios empleando trampas de caída. Esta técnica es reconocida por muestrear eficientemente a los anuros que se mueven en el suelo, entre la hojarasca (Ribeiro-Junior et al., 2008). Además, el éxito de la captura depende en gran medida de las condiciones climáticas predominantes, aumentando la eficacia de la misma luego de fuertes lluvias (Branch & Rödel, 2003). Por lo tanto, es probable que el verano particularmente seco que atravesamos en la región centro-este de Argentina durante la temporada 2021-2022 (Wingeyer et al., 2022), haya condicionado los movimientos de los individuos y reducido la probabilidad de interceptarlos. Consideramos que implementar un diseño de trampas con cercas formando una Y (e.g., Sanchez et al., 2020), sería una buena opción para intentar aumentar la eficiencia de la técnica en el lugar. No obstante, hasta la fecha, y con el diseño en transectas y sin barreras empleado, no puede recomendarse el uso de trampas de caída para el registro de anuros en la RJBA.
La técnica de muestreo de larvas con red permitió registrar dos especies; las nueve restantes, detectadas mediante transectas de prospección auditiva y de prospección visual, no fueron captadas con este método. Dado que los muestreos se efectuaron en verano, las especies que se reproducen tempranamente en primavera, o bien aquellas de reproducción explosiva y esporádica, pudieron ya haber completado la metamorfosis, dificultando su observación con esta técnica. Tales son los casos de Rhinella diptycha, Leptodactylus mystacinus, L. latinasus y Scinax acuminatus (Sanchez et al., 2009). En el caso de las ranas cavadoras del género Leptodactylus, con su modo reproductivo particular que implica la puesta de huevos en nidos de espuma dentro de cuevas y en áreas anegadizas o próximas a cuerpos de agua, las primeras etapas del desarrollo larval pueden llevarse a cabo en la misma cueva o en el agua, dependiendo del momento en que las lluvias inunden el nido y lo arrastren hacia el cuerpo de agua cercano (Lavilla & Rougés, 1992; Haddad & Prado, 2005). Esta característica de las especies, sumado a una situación de estrés por sequía y bajas precipitaciones, extendida desde 2020 en la región (Wingeyer et al., 2022), podría ayudar a explicar por qué no fueron registrados los renacuajos de estos taxones. Los resultados coinciden con los informados por Madalozzo et al. (2017) en pastizales tropicales de Brasil para especies cavadoras de Leptodactylus. No obstante, los autores recomiendan el uso de esta técnica como metodología complementaria, debido a la ventaja que le otorga el poder detectar especies que ya han terminado su actividad reproductiva y aún permanecen en el agua como larvas (Madalozzo et al., 2017).
Las transectas de prospección auditiva resultaron el método más efectivo para muestrear anuros en el área de estudio, no sólo en términos de riqueza, detectando el 72.7% de las especies registradas en la RJBA, sino también en cuanto a abundancia de anuros. Este resultado coincide con estudios previos en diferentes regiones del mundo (Hsu et al., 1995; Rödel & Ernst, 2004; Guzy et al., 2014). La técnica es útil para detectar especies cuyos machos se congregan a vocalizar en cuerpos de agua permanentes o temporales, atrayendo a las hembras al lugar (Madalozzo et al., 2017). Al ser ambientes abiertos, se reduce la interferencia causada por la vegetación y la propagación del sonido es mayor, facilitando la identificación de especies mediante sus cantos nupciales, incluso a grandes distancias (Silva Gómez & Eliosa León, 2013; Madalozzo et al., 2017). Asimismo, es una técnica adecuada para las especies cavadoras del género Leptodactylus. En Leptodactylus gracilis, L. latinasus y L. mystacinus, el macho construye cuevas en la tierra húmeda cerca de cuerpos de agua. En ellas vocaliza para atraer a la hembra, y se produce el amplexo y la puesta de huevos contenidos por nidos de espuma (Fernández & Fernández, 1921; Lavilla & Rougés, 1992). Consecuentemente, la observación directa de estas especies es menos frecuente que el registro a través del canto. Lo mismo sucede con la mayoría de las especies arbóreas pertenecientes a la familia Hylidae, en concordancia con lo informado por Rödel & Ernst (2004), transformando al muestreo acústico en una herramienta esencial. El tiempo que requirió esta técnica fue idéntico al de las transectas de prospección visual, y apenas superior al de los muestreos de larvas con red, las cuales resultaron sensiblemente menos efectivas.
Sin embargo, para aquellas especies cuyas vocalizaciones son difíciles de escuchar, o bien exhiben períodos de reproducción explosivos o de corta duración, como es el caso de Leptodactylus macrosternum y de R. diptycha (Peltzer & Lajmanovich, 2007), las transectas de prospección auditiva no son el método ideal, y complementarlo con transectas visuales puede ser de gran ayuda (Guzy et al., 2014). Estas especies en particular, poseen además elevadas probabilidades de detección visual debido a su gran tamaño, haciéndolas conspicuas. La primera posee una longitud hocico-cloaca de entre 67.5 y 83 mm en machos, y 78 a 80 mm en hembras (Gallardo, 1964), mientras que las hembras de R. diptycha alcanzan los 210 mm, siendo los machos levemente más pequeños (Cei, 1980). Asimismo, se facilita su observación dado que se mantienen activas durante la temporada reproductiva. A L. macrosternum es común registrarla en los márgenes de hábitats acuáticos depredando una amplia variedad de taxones, generalmente invertebrados, pero también otras especies de anuros (Heyer & Giaretta, 2009; Costa-Pereira et al., 2015; Oda et al., 2016). Por su parte, R. diptycha explota ambientes relacionados con la actividad humana, aprovechando las luces artificiales para alimentarse de los insectos atraídos por ella (Duré et al., 2009), siendo frecuente también en los alrededores de cuerpos de agua permanentes y temporales (Batista et al., 2011).
Debemos tener en cuenta, especialmente en estudios de corta duración como el presente, que combinar diferentes técnicas ayuda a que las muestras sean representativas de sus respectivas comunidades de origen, al aumentar la posibilidad de registrar especies con una amplia variedad de hábitos (Crosswhite et al., 1999; Ribeiro-Junior et al., 2008). Asimismo, tal como informan Ribeiro-Junior et al. (2008), permite fortalecer la validez de las investigaciones frente a las críticas de sesgos de detección asociados con técnicas particulares. Nuestros hallazgos van en esta línea. Si bien las transectas de prospección auditiva resultaron ser más eficientes para el muestreo de anfibios en la RJBA, las de prospección visual y los muestreos de larvas con red permitieron encontrar especies no detectadas con las transectas auditivas (R. diptycha y L. macrosternum en el primer caso, y R. dorbignyi en el segundo). Estos resultados sugieren que un diseño de muestreo integrando diferentes técnicas es necesario para estudiar adecuadamente las comunidades de anfibios en este humedal templado.
Por último, cuando nos encontramos en situaciones donde la asignación de recursos monetarios y logísticos son limitados para la conservación, la selección de las técnicas de muestreo en estudios de biodiversidad debe hacerse con mucho cuidado, teniendo en cuenta el costo, el tiempo requerido y la efectividad de las mismas (Ribeiro-Junior et al., 2008; Madalozzo et al., 2017). En el presente estudio contamos con un financiamiento reducido y seleccionamos cuatro técnicas que resultaban factibles de implementar con el presupuesto disponible. De ellas, los muestreos de larvas con red, las transectas de prospección auditiva y las de prospección visual constituyen opciones económicas en comparación con el empleo de trampas de caída que implican la compra de baldes, goma espuma y, en el caso de utilizarse, también barreras. En cuanto al tiempo invertido, este fue mayor en las trampas de caída, ya que se debe ir a habilitarlas 72 h antes y luego revisarlas, preferentemente, con frecuencia diaria (Pereyra et al., 2021).
Por su parte, los muestreos de larvas demandan importantes asignaciones de tiempo si consideramos no sólo las horas dedicadas efectivamente a la búsqueda con red, sino también los grandes esfuerzos en laboratorio, bajo lupa binocular, requeridos para identificar a los individuos. En contraste, los relevamientos mediante transectas auditivas y visuales solo consumen el tiempo empleado durante la actividad de campo propiamente dicha. Las ventajas de las trampas y los muestreos de larvas radican en que son técnicas que se ejecutan habitualmente durante el día, evitando los peligros potenciales asociados al trabajo nocturno en lugares que, muchas veces, se encuentran alejados (Madalozzo et al., 2017). Poniendo en la balanza no solo la ERR medida sino también el costo y el tiempo insumido, nuevamente las trampas de caída constituyen la técnica menos recomendable para muestrear anfibios en este humedal templado del centro-este de Argentina.
Conclusión
Recomendamos el uso de transectas de prospección auditiva combinando las mismas con transectas de prospección visual y muestreos de larvas con red como técnicas complementarias. Las transectas auditivas son adecuadas para registrar anfibios con cantos notorios y períodos de vocalización prolongados, las transectas visuales para anuros con cantos poco perceptibles o acotados en el tiempo, y los muestreos de larvas permiten detectar especies fuera de su período de actividad reproductiva (Guzy et al., 2014; Madalozzo et al., 2017). En futuras investigaciones, provistas de un mayor financiamiento, sería óptimo incorporar al análisis el monitoreo acústico pasivo, cuya utilización en los inventarios herpetológicos va cobrando cada vez más impulso (e.g., Boullhesen et al., 2021). Se espera que la información suministrada sobre la efectividad relativa de las técnicas de muestreo estudiadas sea de ayuda para otros herpetólogos de humedales lacustres templados del Hemisferio Sur. Mejorar la eficiencia de los muestreos permitirá fortalecer nuestra comprensión sobre la biodiversidad de este grupo taxonómico, tan necesario en el contexto de declinación global actual de los anfibios (Bishop et al., 2012; IUCN, 2022; Kacoliris et al., 2022).











 nueva página del texto (beta)
nueva página del texto (beta)


