Introducción
Los anfibios y reptiles (herpetofauna), son organismos abundantes y diversos en los ecosistemas tropicales donde tienen roles ecológicos importantes como depredadores y presas en las redes tróficas, participan en la dispersión de semillas, la polinización, y en el ciclo de nutrientes de ambientes acuáticos y terrestres (Böhm et al., 2013; Cortés-Gómez et al., 2015). México se posiciona como el segundo país con mayor riqueza de reptiles a nivel mundial con 1001 especies (Uetz et al., 2022) y quinto lugar en anfibios con alrededor de 425 (Amphibiaweb, 2022; Frost, 2022), destacando que más del 60% del total de la herpetofauna es endémica del país (Johnson et al., 2017). Esta riqueza de especies para México sigue en aumento debido a que se siguen descubriendo nuevos taxones para la ciencia, como anfibios (Sandoval-Comte et al., 2017; Palacios-Aguilar et al., 2020; Parra-Olea et al., 2020; Grünwald et al., 2021a), tortugas (López-Luna et al., 2018; Loc-Barragán et al., 2020), lagartijas (e.g., Nieto-Montes de Oca et al., 2018; Clause et al., 2020; García-Vázquez et al., 2021; Lara-Tufiño & Nieto-Montes de Oca, 2021) y serpientes (e.g., Grünwald et al., 2021b; Flores-Villela et al., 2022).
Aún con esta riqueza y considerando el incremento de estudios de los anfibios y reptiles en los últimos años (Colston et al., 2015; Johnson et al., 2015; Cisneros-Bernal et al., 2020; Ortiz-Medina et al., 2020; Torres-Hernández et al., 2021; Cruz-Elizalde et al., 2022; Smith & Lemos-Espinal, 2022), muchas áreas del país todavía necesitan ser bien muestreadas para comprender mejor los patrones de diversidad y composición de especies que albergan (Flores-Villela et al., 2004; Ochoa-Ochoa et al., 2014; García-Bañuelos et al., 2019; Quintero-Vallejo & Ochoa-Ochoa, 2022), incluyendo a varias Áreas Naturales Protegidas (ANPs). Las ANPs representan una de las estrategias más importantes para la conservación de la biodiversidad a nivel mundial (Rodrigues et al., 2004; Pimm et al., 2014; Nori et al., 2015), y México cuenta con 182 ANPs en diferentes categorías (CONANP, 2021). Sin embargo, uno de los problemas es que muchas fueron decretadas de manera “ad hoc”, es decir, involucraron áreas seleccionadas con criterios como el valor escénico del paisaje o por disponibilidad del terreno (Cantú et al., 2004; Figueroa & Sánchez-Cordero, 2008; Sánchez-Cordero et al., 2008). Como consecuencia, en muchos casos no se realizaron trabajos sobre la biodiversidad de los sitios antes de ser decretados como ANPs. Esto hace que gran parte de la información biológica plasmada en los programas de manejo de las ANPs resulte poco útil. Por ello, es necesario contar con información biológica detallada de cada ANP para tomar decisiones adecuadas en la aplicación de medidas de conservación, monitorear el efecto de las perturbaciones, y emitir recomendaciones adecuadas sobre el manejo de éstas áreas (Santos-Barrera et al., 2004; Sánchez-Cordero et al., 2008).
En años recientes se han desarrollado varios trabajos sobre las comunidades de anfibios y reptiles en diferentes ANPs del país. Gran parte de ellos se han realizado en ANPs de la zona centro (e.g., Vite-Silva et al., 2010; Cruz-Elizalde et al., 2015, 2018; Díaz De La Vega-Pérez et al., 2019; Leyte-Manrique et al., 2018), occidente (e.g., Suazo-Ortuño et al., 2015; Luja et al., 2017), norte (e.g., Lazcano et al., 2009; Cruz-Elizalde et al., 2014; García-Vázquez et al., 2019), algunos en el sur (e.g., Hernández-Ordoñez et al., 2015; Juárez-Ramírez et al., 2016; Aguilar-López et al., 2020; González-Fernández et al., 2022), y existen muy pocos trabajos en ANPs de la Península de Yucatán (e.g., Calderón-Mandujano et al., 2008; Padilla & Perera-Trejo, 2009; Charruau et al., 2015; Colston et al., 2015; Badillo-Saldaña et al., 2020).
La Reserva de la Biosfera Ría Lagartos (RBRL) se considera entre las tres ANPs de mayor importancia para la conservación de la herpetofauna en la Península de Yucatán (González-Sánchez et al., 2017) y, una de las diez más importantes para estos vertebrados a nivel nacional (Santos-Barrera et al., 2004). Sin embargo, a 43 años de su decreto como ANP (DOF, 1979) y a 22 años de haberse presentado el primer listado potencial de su herpetofauna (SEMARNAP, 2000), no existen trabajos de campo que generen información cuantitativa sobre la composición taxonómica de las comunidades y la distribución de los anfibios y reptiles en los distintos ambientes de la reserva. Por lo tanto, en este trabajo analizamos las comunidades de anfibios y reptiles en términos de su diversidad, estructura y composición de especies, así como sus patrones de abundancia, en los tipos de vegetación más representativos de la RBRL, con la finalidad de generar información más detallada de la diversidad herpetofaunística que alberga.
Materiales y métodos
Área de estudio
La RBRL se localiza en el extremo oriente de la franja litoral del estado de Yucatán, México (21º38’08’’ - 21º20’25” N, 88º15’00” - 87º30’00” W; WGS 84; Fig. 1) (SEMARNAP, 2000). La topografía en la zona es uniforme y se caracteriza por relieves planos y ligeras pendientes. El clima en el lado oeste de la RBRL es semiárido BS o (h‘) w (x’) iw’’ y en el lado este es cálido-subhúmedo Ax’ (wo) iw (García, 1964). La temperatura media anual es mayor a 22ºC y la precipitación varía de 500 mm a 1,300 mm (SEMARNAP, 2000). En la región existen tres temporadas climáticas: temporada seca (de marzo a principios de junio), temporada de lluvias (de junio a octubre), y temporada de frentes fríos conocida como "nortes" (de noviembre a febrero) (Enriquez et al., 2013).
La vegetación de la RBRL está conformada como un mosaico de diversas comunidades vegetales de tipo tropical y zonas con modificación antrópica como vegetación secundaria y pastizales inducidos para la ganadería. Nuestro estudio se realizó en vegetación de duna costera (DUN), petenes (PET), selva baja inundable (SBI) y, selva mediana subperennifolia (SMS), considerados de mayor importancia para la conservación desde el punto de vista florístico y con amplia representatividad dentro de la RBRL (descripción detallada en Durán et al., 1999).
Colecta de datos
Realizamos un muestreo longitudinal de septiembre de 2004 a julio de 2005. Seleccionamos dos sitios por cada tipo de vegetación y ubicamos transectos en banda (uno en cada sitio) de 1,000 m. de largo, 4 m. de ancho, y altura de 3 m. Una vez cada dos meses, tres personas recorrimos en horario diurno (9:00 - 15:00 h) y nocturno (19:00 - 24:00 h) realizando búsquedas directas por encuentros visuales (Crump & Scott, 1994), completando un esfuerzo de muestreo total de 864 horas hombre. Revisamos minuciosamente múltiples microhábitats donde pudieran encontrarse anfibios y reptiles, incluyendo madrigueras, debajo de rocas, troncos secos en pie o derribados, árboles vivos, entre la hojarasca, oquedades y plantas epífitas. También revisamos los cuerpos de agua y vegetación acuática presente dentro del ancho de los transectos. Registramos todos los individuos observados dentro de los transectos. Adicionalmente registramos los encuentros fuera de transectos (excluyendo tortugas marinas en las playas), para obtener un listado más completo de la herpetofauna verificada en la RBRL pero no los incluimos en los análisis. Varios de estos registros fueron ejemplares muertos en carreteras.
Identificamos a cada individuo a nivel de especie utilizando claves y literatura especializada (Campbell, 1998; Lee, 1996), y seguimos la nomenclatura taxonómica más actualizada (Frost, 2022; Uetz et al., 2022). Usamos el género Rana en lugar de Lithobates siguiendo a Yuan et al. (2016). Algunos ejemplares de referencia fueron colectados con el permiso de colecta SGPA/DGVS/06980 otorgado a JCS por la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT), y se prepararon utilizando las técnicas descritas por Casas-Andreu et al. (1991), McDiarmid (2001), y Simmons (2002). Todo el material de referencia colectado se ingresó a la colección herpetológica de la Universidad Autónoma de Yucatán (YUC-CC-250-11/HER/).
Análisis de datos
Completitud del inventario. Para estimar la completitud del inventario de anfibios y reptiles en los tipos de vegetación, calculamos el porcentaje representado por las especies observadas en relación con el número esperado de especies (Soberon & Llorente, 1993), predicho por el estimador de riqueza no-paramétrico Chao1 con los datos de abundancia de las especies y las visitas de muestreo como unidad de esfuerzo, usando el programa EstimateS 9.1.0 (Colwell, 2013).
Diversidad de especies. Calculamos la cobertura de la muestra (que mide la proporción que representan los individuos de cada especie en la muestra con respecto al número total de individuos; Chao & Jost, 2012) en los cuatro tipos de vegetación. Usamos los datos extrapolados con una cobertura de la muestra ≥ 0.90 para estandarizar las muestras y validar las comparaciones de diversidad (López-Mejía et al., 2017).
La diversidad se analizó con el número efectivo de especies de los primeros tres órdenes de q (0, 1, 2) de la serie de números de Hill (Hill, 1973) de acuerdo con Jost (2006), donde: q = 0 equivale a la riqueza de especies, q = 1 es el exponencial del índice de Shannon (q1 = exp [H']) que representa el número de especies comunes en la comunidad, y q = 2, es el inverso del índice de Simpson (q2 = 1 / λ) que representa las especies muy abundantes o dominantes en la comunidad (Jost, 2006; Tuomisto, 2010). Determinamos las diferencias significativas para los números de Hill entre tipos de vegetación por medio de intervalos de confianza (IC) del 95% construidos mediante el método bootstrap, utilizando 999 remuestreos (cuando los IC del 95% no se sobrelapan, indican una diferencia significativa) (Chao & Jost, 2012), usando el programa iNEXT Online (Chao et al., 2016).
Estructura de comunidades. Analizamos visualmente la estructura de las comunidades para registrar la identidad, dominancia o rareza de las especies (Magurran, 2004) y construimos curvas de rango/abundancia de anfibios y reptiles por tipo de vegetación. Para elaborar las curvas, ordenamos las especies de forma jerárquica de la más abundante a la menos abundante y graficamos el logaritmo base 10 (Log10) de la abundancia relativa de cada especie.
Composición de especies. Analizamos el grado de semejanza entre los tipos de vegetación en términos de la composición de especies de anfibios y reptiles, utilizando el índice de similitud de Jaccard (J), cuya fórmula se representa por: J = c / a + b - c, donde a es el número de especies presentes en el sitio A, b el número de especies presentes en el sitio B, y c el número de especies presentes en ambos sitios. Este índice genera un intervalo de valores que va de 0, cuando no existen especies compartidas entre ambos sitios, hasta 1, cuando los dos sitios tienen la misma composición de especies (Moreno, 2001). Para este análisis utilizamos el programa PAST 3.26 (Hammer et al., 2001).
Patrones de abundancia temporal. Para analizar visualmente los patrones temporales de abundancia de anfibios y reptiles, graficamos el número de individuos registrados en los tipos de vegetación en relación con los meses de muestreo.
Estado de conservación. Identificamos el estado de conservación de las especies de anfibios y reptiles considerando: (i) la normatividad mexicana (NOM-059-SEMARNAT-2010; DOF, 2010), (ii) la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (IUCN, por sus siglas en inglés) (IUCN, 2021), y (iii) el uso del algoritmo de Puntuación de Vulnerabilidad Ambiental (EVS, por sus siglas en inglés) para los anfibios y reptiles de México propuesto por Wilson et al. (2013a; 2013b). Consideramos como especies endémicas aquellas con distribución restringida a la Península de Yucatán sensuLee (1980, 1996, 2000), y como especies introducidas aquellas que no se distribuyen de manera natural en la región.
Resultados
Registramos un total de 1,401 individuos distribuidos en 14 especies de anfibios y 33 de reptiles en los cuatro tipos de vegetación muestreados en transectos (Tabla 1). Adicionalmente, tres especies de serpientes atropelladas en carreteras aledañas a los sitios de muestreo fueron incluidas en el inventario general para un total de 50 especies de la herpetofauna dentro de la RBRL (Tabla 1).
Tabla 1 Listado taxonómico, abundancia y estado de conservación de los anfibios y reptiles verificados en diferentes tipos de vegetación de la Reserva de la Biosfera Ría Lagartos. DUN = duna costera, PET = petenes, SBI = selva baja inundable, y SMS = selva mediana subperennifolia. NOM-059-SEMARNAT-2010 (NOM-059; Pr = Sujeta a protección especial, A = Amenazada). Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN; LC = Least Concern o Preocupación Menor, VU = Vulnerable o Vulnerable, NT = Near Threatened o Casi Amenazada, NE = No evaluada). Algoritmo de Puntuación de Vulnerabilidad Ambiental (EVS; L = Low o Baja, M = Medium o Media, H = High o Alta). * = Especie endémica de la Península de Yucatán, ** = Especie introducida, + = Especie encontrada fuera de los transectos, ++ = Nuevo registro para la RBRL.
Table 1 Taxonomic list, abundance and conservation status of amphibians and reptiles verified in different types of vegetation of the Ría Lagartos Biosphere Reserve. DUN = coastal dune, PET = petenes, SBI = lowland floodable forest, and SMS = medium sub-evergreen forest. NOM-059-SEMARNAT-2010 (NOM-059; Pr = Subject to special protection, A = Threatened). Red List of the International Union for Conservation of Nature (IUCN; LC = Least Concern, VU = Vulnerable, NT = Near Threatened, NE = Not Evaluated). Environmental Vulnerability Score Algorithm (EVS; L = Low, M = Medium, H = High). * = Endemic species of the Yucatan Peninsula, ** = Introduced species, + = Species found outside the transects, ++ = New record for the RBRL.
| Clase | Familia | Especie | Abundancia | NOM-059 | IUCN | EVS | |||
|---|---|---|---|---|---|---|---|---|---|
| DUN | PET | SBI | SMS | ||||||
| Orden / Suborden Amphibia / Anura |
Bufonidae | Incilius valliceps | 0 | 0 | 16 | 11 | L (6) | ||
| Rhinella horribilis++ | 0 | 0 | 2 | 1 | NE | L (3) | |||
| Hylidae | Dendropsophus microcephalus | 0 | 0 | 17 | 0 | LC | L (7) | ||
| Scinax staufferi | 0 | 0 | 75 | 8 | LC | L (4) | |||
| Smilisca baudinii | 1 | 1 | 7 | 6 | LC | L (3) | |||
| Tlalocohyla loquax | 0 | 0 | 15 | 0 | LC | L (7) | |||
| Tlalocohyla picta++ | 0 | 0 | 5 | 0 | LC | L (8) | |||
| Trachycephalus vermiculatus | 0 | 0 | 14 | 8 | LC | L (4) | |||
| Triprion petasatus* | 1 | 0 | 0 | 4 | Pr | LC | M (10) | ||
| Leptodactylidae | Leptodactylus melanonotus | 0 | 190 | 91 | 0 | LC | L (6) | ||
| Microhylidae | Hypopachus variolosus | 0 | 0 | 1 | 7 | LC | L (4) | ||
| Phyllomedusidae | Agalychnis taylori++ | 0 | 0 | 0 | 2 | LC | M (11) | ||
| Ranidae | Rana brownorum | 0 | 145 | 53 | 0 | Pr | NE | L (8) | |
| Caudata | Plethodontidae | Bolitoglossa yucatana*++ | 0 | 0 | 2 | 1 | Pr | LC | H (15) |
| Reptilia / Crocodylia | Crocodylidae | Crocodylus moreletii | 0 | 23 | 20 | 0 | Pr | LC | M (13) |
| Testudines | Geoemydidae | Rhinoclemmys areolata | 0 | 0 | 1 | 0 | A | NT | M (13) |
| Emydidae | Trachemys venusta | 0 | 3 | 0 | 1 | Pr | VU | H (19) | |
| Kinosternidae | Kinosternon creaseri* | 0 | 0 | 9 | 0 | LC | H (15) | ||
| Kinosternon scorpioides | 0 | 0 | 2 | 0 | Pr | NE | M (10) | ||
| Squamata / Lacertilia | Corytophanidae | Basiliscus vittatus | 0 | 9 | 23 | 4 | LC | L (7) | |
| Dactyloidae | Anolis rodriguezii | 0 | 7 | 24 | 38 | NE | M (10) | ||
| Anolis sagrei** | 0 | 0 | 5 | 0 | |||||
| Anolis ustus* | 0 | 0 | 3 | 1 | NE | L (8) | |||
| Eublepharidae | Coleonyx elegans | 0 | 1 | 0 | A | LC | L (9) | ||
| Gekkonidae | Hemidactylus frenatus** | 40 | 5 | 2 | 0 | ||||
| Iguanidae | Ctenosaura similis | 30 | 14 | 40 | 0 | A | LC | L (8) | |
| Mabuyidae | Marisora lineola* | 4 | 6 | 3 | 1 | LC | L (6) | ||
| Phrynosomatidae | Sceloporus chrysostictus* | 28 | 2 | 44 | 16 | LC | M (13) | ||
| Sceloporus cozumelae* | 169 | 0 | 0 | 0 | Pr | LC | H (15) | ||
| Sceloporus lundelli* | 0 | 1 | 1 | 0 | LC | H (14) | |||
| Sceloporus serrifer | 0 | 0 | 1 | 0 | LC | L (6) | |||
| Sphaerodactylidae | Sphaerodactylus glaucus | 2 | 14 | 0 | 1 | Pr | LC | M (12) | |
| Teiidae | Aspidoscelis angusticeps* | 49 | 1 | 16 | 0 | LC | M (13) | ||
| Holcosus gaigeae* | 8 | 8 | 3 | 1 | NE | H (15) | |||
| Serpentes | Boidae | Boa imperator | 1 | 0 | 0 | 0 | A | NE | M (10) |
| Colubridae | Drymarchon melanurus+ | - | - | - | - | LC | L (6) | ||
| Drymobius margaritiferus | 0 | 1 | 1 | 0 | NE | L (6) | |||
| Lampropeltis abnorma | 0 | 0 | 1 | 0 | A | NE | L (9) | ||
| Leptophis mexicanus | 1 | 0 | 1 | 2 | A | LC | L (6) | ||
| Masticophis mentovarius+ | - | - | - | - | A | LC | L (6) | ||
| Pseudelaphe phaescens* | 0 | 1 | 1 | 0 | Pr | NE | H (16) | ||
| Dipsadidae | Coniophanes imperialis | 0 | 0 | 2 | 2 | LC | L (8) | ||
| Coniophanes meridanus* | 1 | 1 | 0 | 0 | LC | H (15) | |||
| Conophis lineatus | 3 | 0 | 0 | 0 | LC | L (9) | |||
| Leptodeira frenata | 0 | 0 | 0 | 2 | LC | M (12) | |||
| Leptodeira polysticta | 0 | 0 | 2 | 1 | NE | L (8) | |||
| Ninia sebae | 0 | 0 | 1 | 0 | LC | L (5) | |||
| Natricidae | Thamnophis proximus | 0 | 0 | 5 | 0 | A | LC | L (7) | |
| Elapidae | Micrurus apiatus+ | - | - | - | - | Pr | LC | L (8) | |
| Viperidae | Crotalus tzabcan* | 0 | 0 | 0 | 2 | Pr | LC | H (16) | |
Completitud del inventario. La completitud del inventario en los diferentes tipos de vegetación mostró una variación del 80 al 100% para anfibios, y del 75.22 al 88.95% para reptiles (Tabla 2).
Tabla 2 Número de especies y completitud del inventario de anfibios y reptiles en diferentes tipos de vegetación de la Reserva de la Biosfera Ría Lagartos. DUN = duna costera, PET = petenes, SBI = selva baja inundable, y SMS = selva mediana subperennifolia.
Table 2 Number of species and completeness of the inventory of amphibians and reptiles in different types of vegetation of the Ría Lagartos Biosphere Reserve. DUN = coastal dune, PET = petenes, SBI = lowland floodable forest, and SMS = medium sub-evergreen forest.
| Tipo de vegetación |
Especies observadas |
Especies exclusivas |
Especies estimadas (Chao1) |
Completitud (%) |
|---|---|---|---|---|
| Anfibios | ||||
| DUN | 2 | 0 | 2.5 | 80 |
| PET | 3 | 0 | 3 | 100 |
| SBI | 12 | 3 | 12 | 100 |
| SMS | 9 | 1 | 9.48 | 94.93 |
| Reptiles | ||||
| DUN | 12 | 3 | 13.49 | 88.95 |
| PET | 15 | 0 | 19.94 | 75.22 |
| SBI | 25 | 9 | 32.16 | 77.73 |
| SMS | 13 | 2 | 15.95 | 81.5 |
Diversidad de especies. En el caso de los anfibios, se encontró una diversidad similar entre SBI (q0 = 12, q1 = 6.51, q2 = 5) y SMS (q0 = 9, q1 = 7.22, q2 = 6.47) en los tres órdenes de q; ambos tipos de vegetación fueron más diversos que DUN (q0 = 2.5, q1 = 2, q2 = 2) y PET (q0 = 3, q1 = 2.02, q2 = 1.98). En los reptiles, la riqueza fue mayor en SBI (q0 = 25) que en PET (q0 = 15), SMS (q0 = 13) y DUN (q0 = 12). Los números efectivos de especies comunes y dominantes de reptiles en SBI (q1 = 11.49, q2 = 8.2) y PET (q1 = 9.75, q2 = 7.72) fueron similares, pero ambos valores fueron más altos que en SMS (q1 = 4.89, q2 = 2.98) y DUN (q1 = 4.8, q2 = 3.29) (ver IC 95% para diferencias significativas en Fig. 2).
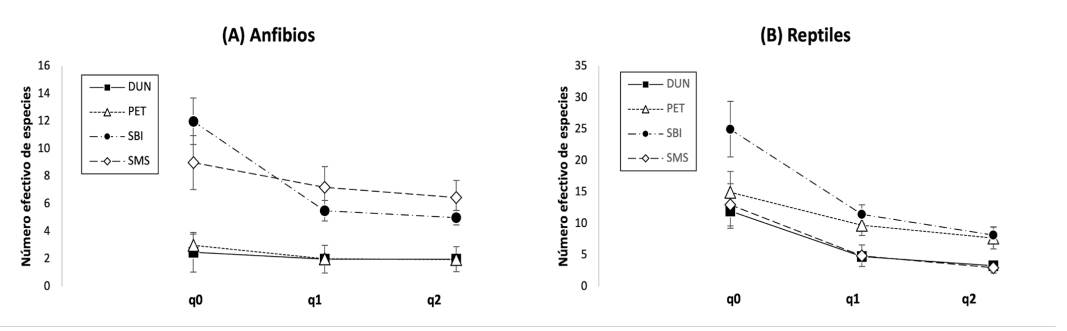
Figura 2 Diversidad de especies de anfibios y reptiles en diferentes tipos de vegetación de la Reserva de la Biosfera Ría Lagartos: duna costera (DUN), petenes (PET), selva baja inundable (SBI) y selva mediana subperennifolia (SMS). Riqueza de especies (q0), especies comunes (q1) y especies dominantes (q2). Los bigotes representan los intervalos de confianza del 95% construidos mediante el método bootstrap.
Figure 2 Species diversity of amphibians and reptiles in different types of vegetation of the Ría Lagartos Biosphere Reserve: coastal dune (DUN), petenes (PET), lowland floodable forest (SBI) and medium sub-evergreen forest (SMS). Species richness (q0), common species (q1) and dominant species (q2). The whiskers represent the 95% confidence intervals constructed using the bootstrap method.
Estructura de comunidades. Las curvas de rango/abundancia mostraron diferencias en la estructura de las comunidades de anfibios y reptiles entre los tipos de vegetación. En DUN los anfibios tuvieron poca representatividad con dos especies (Smilisca baudinii y Triprion petasatus) con un individuo cada una (50% cada una, de la abundancia total). Las especies más abundantes en PET fueron Leptodactylus melanonotus (190, 56.5%) y Rana brownorum (145, 43.1%), en SBI fue L. melanonotus (91, 30.5%), mientras en SMS fue Incilius valliceps (11, 23%). Las especies menos abundantes fueron S. baudinii (un individuo, 0.3%) en PET, Hypopachus variolosus en SBI (un individuo, 0.3%), y en SMS fueron Bolitoglossa yucatana y Rhinella horribilis (un individuo, 2%, cada una) (Fig. 3A). En reptiles, especies diferentes para cada tipo de vegetación tuvieron mayores abundancias: la especie más abundante en DUN fue Sceloporus cozumelae (169, 50.3%), Crocodylus moreletii (23, 24%) en PET, Sceloporus chrysostictus (44, 20.7%) en SBI, y Anolis rodriguezii (38, 52.7%) en SMS. En la parte inferior de las curvas se destaca la presencia de varias especies poco abundantes (i.e., con uno o dos individuos), principalmente serpientes (Fig. 3B).

Figura 3 Curvas de rango/abundancia de anfibios (A) y reptiles (B) en diferentes tipos de vegetación de la Reserva de la Biosfera Ría Lagartos: duna costera (DUN), petenes (PET), selva baja inundable (SBI) y selva mediana subperennifolia (SMS). Anfibios: Incilius valliceps (Ival), Rhinella horribilis (Rhor), Dendropsophus microcephalus (Dmic), Scinax staufferi (Ssta), Smilisca baudinii (Sbau), Tlalocohyla loquax (Tloq), Tlalocohyla picta (Tpic), Trachycephalus vermiculatus (Tver), Triprion petasatus (Tpet), Leptodactylus melanonotus (Lmel), Hypopachus variolosus (Hvar), Agalychnis taylori (Atay), Rana brownorum (Rbro), Bolitoglossa yucatana (Byuc). Reptiles: Crocodylus moreletii (Cmor), Rhinoclemmys areolata (Rare), Trachemys venusta (Tven), Kinosternon creaseri (Kcre), Kinosternon scorpioides (Ksco), Basiliscus vittatus (Bvit), Anolis rodriguezii (Arod), Anolis sagrei (Asag), Anolis ustus (Aust), Coleonyx elegans (Cele), Hemidactylus frenatus (Hfre), Ctenosaura similis (Csim), Marisora lineola (Mlin), Sceloporus chrysostictus (Schr), Sceloporus cozumelae (Scoz), Sceloporus lundelli (Slun), Sceloporus serrifer (Sser), Sphaerodactylus glaucus (Sgla), Aspidoscelis angusticeps (Aang), Holcosus gaigeae (Hgai), Boa imperator (Bimp), Drymobius margaritiferus (Dmar), Lampropeltis abnorma (Labn), Leptophis mexicanus (Lmex), Pseudelaphe phaescens (Ppha), Coniophanes imperialis (Cimp), Coniophanes meridanus (Cmer), Conophis lineatus (Clin), Leptodeira frenata (Lfre), Leptodeira polysticta (Lpol), Ninia sebae (Nseb), Thamnophis proximus (Tpro), Crotalus tzabcan (Ctza).
Figura 3 Range/abundance curves of amphibians (A) and reptiles (B) in different types of vegetation in the Ría Lagartos Biosphere Reserve: coastal dune (DUN), petenes (PET), lowland floodable forest (SBI) and medium sub-evergreen forest (SMS). Amphibians: Incilius valliceps (Ival), Rhinella horribilis (Rhor), Dendropsophus microcephalus (Dmic), Scinax staufferi (Ssta), Smilisca baudinii (Sbau), Tlalocohyla loquax (Tloq), Tlalocohyla picta (Tpic), Trachycephalus vermiculatus (Tver), Triprion petasatus (Tpet), Leptodactylus melanonotus (Lmel), Hypopachus variolosus (Hvar), Agalychnis taylori (Atay), Rana brownorum (Rbro), Bolitoglossa yucatana (Byuc). Reptiles: Crocodylus moreletii (Cmor), Rhinoclemmys areolata (Rare), Trachemys venusta (Tven), Kinosternon creaseri (Kcre), Kinosternon scorpioides (Ksco), Basiliscus vittatus (Bvit), Anolis rodriguezii (Arod), Anolis sagrei (Asag), Anolis ustus (Aust), Coleonyx elegans (Cele), Hemidactylus frenatus (Hfre), Ctenosaura similis (Csim), Marisora lineola (Mlin), Sceloporus chrysostictus (Schr), Sceloporus cozumelae (Scoz), Sceloporus lundelli (Slun), Sceloporus serrifer (Sser), Sphaerodactylus glaucus (Sgla), Aspidoscelis angusticeps (Aang), Holcosus gaigeae (Hgai), Boa imperator (Bimp), Drymobius margaritiferus (Dmar), Lampropeltis abnorma (Labn), Leptophis mexicanus (Lmex), Pseudelaphe phaescens (Ppha), Coniophanes imperialis (Cimp), Coniophanes meridanus (Cmer), Conophis lineatus (Clin), Leptodeira frenata (Lfre), Leptodeira polysticta (Lpol), Ninia sebae (Nseb), Thamnophis proximus (Tpro), Crotalus tzabcan (Ctza).
Composición de especies. El tipo de vegetación con mayor número de especies exclusivas de anfibios y reptiles, fue SBI con 12 (tres de anfibios y nueve de reptiles), seguido por SMS con tres (una de anfibio y dos de reptiles) y DUN igualmente con tres (todas de reptiles), mientras que PET no presentó especies exclusivas. Cuatro especies estuvieron presentes en todos los tipos de vegetación, una de anfibios (S. baudinii) y tres de reptiles (S. chrysostictus, Marisora lineola y Holcosus gaigeae). Los análisis indicaron bajos valores similitud en composición de especies entre tipos de vegetación. Las comunidades más semejantes en composición de especies de anfibios fueron SBI-SMS (J = 0.5, equivalente a 50% de similitud). Para los reptiles, el índice mostró mayor similitud entre PET-SBI (J = 0.43; 43%) y PET-DUN (J = 0.42; 42%) (Tabla 3).
Tabla 3 Valores de similitud de composición de especies de acuerdo al índice de Jaccard (J) de anfibios y reptiles entre tipos de vegetación de la Reserva de la Biosfera Ría Lagartos. DUN = duna costera, PET = petenes, SBI = selva baja inundable, y SMS = selva mediana subperennifolia.
Table 3 Similarity species composition values according to the Jaccard index (J) of amphibians and reptiles between types of vegetation in the Ría Lagartos Biosphere Reserve. DUN = coastal dune, PET = petenes, SBI = lowland floodable forest, and SMS = medium subevergreen forest.
| Tipos de vegetación | Anfibios | Reptiles |
|---|---|---|
| DUN-PET | 0.25 | 0.42 |
| DUN-SBI | 0.07 | 0.23 |
| DUN-SMS | 0.22 | 0.25 |
| PET-SBI | 0.25 | 0.43 |
| PET-SMS | 0.09 | 0.33 |
| SBI-SMS | 0.5 | 0.31 |
Patrones de abundancia temporal. La abundancia de anfibios se incrementó en el mes de julio en SBI y SMS. En PET las mayores abundancias se observaron en los meses de enero y marzo; mientras que en DUN, los únicos dos anfibios se presentaron en marzo y julio. Las abundancias máximas de reptiles en SBI y SMS fueron en el mes de mayo; PET conservó una tendencia de abundancia relativamente similar durante todos los meses. En DUN el patrón mostró dos picos de mayor abundancia, en septiembre y enero (Fig. 4).

Estado de conservación. Del total de especies (50) de anfibios y reptiles que verificamos para la RBRL, 19 (38%) se encuentran listadas bajo alguna categoría de protección de acuerdo con la NOM-059-SEMARNAT-2010. De acuerdo con la IUCN, una especie de reptil se encuentra vulnerable (VU) y una casi amenazada (NT), doce especies de anfibios y 23 de reptiles son de preocupación menor (LC), y dos especies de anfibios y nueve de reptiles no han sido evaluadas (NE) (Tabla 1). Con respecto a la Puntuación de Vulnerabilidad Ambiental (EVS), una especie de anfibio y ocho de reptiles se encuentran en la categoría de alta vulnerabilidad (H), dos de anfibios y nueve de reptiles en vulnerabilidad media (M), y once de anfibios y 17 de reptiles en baja vulnerabilidad (L). Dos especies de anfibios y diez de reptiles son endémicas de la Península de Yucatán, mientras que dos especies de reptiles son introducidas (Tabla 1).
Discusión
Este es el primer estudio en campo sobre herpetofauna en la RBRL desde su decreto hace 43 años. Registramos un total de 50 de las 96 especies listadas para la RBRL de acuerdo a datos bibliográficos (SEMARNAP, 2000; González-Sánchez et al., 2017). Esto indica que los cuatro tipos de vegetación muestreados albergan al menos el 52% de las especies de anfibios y reptiles de la RBRL; así como el 46% de la herpetofauna reportada para el estado de Yucatán (Lee, 1996; González-Sánchez et al., 2017). Por tanto, estos tipos de vegetación son importantes en términos de conservación considerando lo reducido del área muestreada, ya que la RBRL tiene una superficie de 603.47 km2 que representa el 1.5% de los 39,524.4 km2 de extensión territorial de Yucatán; estado que a su vez comprende el 2.0% de la superficie del país (SEMARNAP, 2000; INEGI, 2020). Cabe destacar que en este trabajo se corrobora la presencia de algunas especies de anfibios (B. yucatana, Agalychnis taylori, R. horribilis y Tlalocohyla picta) previamente mencionadas como de posible distribución en la RBRL de acuerdo al Plan de Manejo (SEMARNAP, 2000).
Los valores de completitud obtenidos indican que el esfuerzo de muestreo no fue suficiente para completar los inventarios estimados en la mayoría de los tipos de vegetación, principalmente para el grupo de los reptiles. Esto sugiere que se podrían registrar más especies incrementando el muestreo. Sin embargo, todos los valores de completitud estuvieron por arriba del 75%. Así que, aún y cuando pudieran encontrarse más especies, éstas serían relativamente raras. Por tanto, nuestros datos nos permiten inferir de manera confiable los patrones generales de las comunidades de anfibios y reptiles en los tipos de vegetación. Sin dejar de lado que se requiere más muestreos para tener un inventario más completo.
Nuestros resultados muestran que en SBI y SMS se encuentran las comunidades más diversas de anfibios (i.e., en términos de riqueza, especies comunes y dominantes). Esto podría explicarse en función de la heterogeneidad y complejidad estructural de los hábitats (MacArthur & MacArthur, 1961; Ramírez-Bautista & Cruz-Elizalde, 2013; Cruz-Elizalde et al., 2014), que promueven una gran variedad de recursos y condiciones microambientales (e.g., estratos verticales, gradientes térmicos, charcas temporales de diferentes características, refugios), permitiendo la coexistencia de una mayor diversidad de especies de anfibios como ya se ha reportado en otras zonas tropicales (Duellman & Trueb, 1994; Araújo et al., 2018; de Andrade et al., 2019). Por otro lado, la aridez y poca capacidad de retención de humedad del suelo de DUN (Flores Guido & Espejel Carbajal, 1994; Chiriguchi-Murayama & Salinas-Peba, 2017), y a la salinidad del agua de la vegetación de PET (Febles-Patrón & Batllori-Sampedro, 1995; Schmitter-Soto et al., 2002; Perry et al., 2003), podrían ser factores limitantes a nivel local para el uso de estos hábitats por los anfibios, ocasionando la baja diversidad de estos organismos (Balinsky, 1981; Boutilier et al., 1992; Duellman & Trueb, 1994; Cruz-Sáenz et al., 2013). Sin embargo, algunos anfibios, como L. melanonotus y R. brownorum, son especies tolerantes a la salinidad en hábitats costeros con influencia marina (McCoid, 2005; Sasa et al., 2009; Hopkins & Brodie, 2015), lo que explicaría la presencia en abundancia de estas especies en PET.
En reptiles, SBI mostró la mayor riqueza de especies, probablemente debido a la disponibilidad de microhábitats tanto para especies terrestres (e.g., Ctenosaura similis, S. chrysostictus, Crotalus tzabcan) como de hábitos acuáticos (e.g., Kinosternon creaseri, C. moreletii, Thamnophis proximus) (Lee, 1996). Sin embargo, el número de especies comunes (q1) y abundantes (q2) en SBI fue similar que en PET, que tuvo menor riqueza. Esto indica una distribución más equitativa de la abundancia entre las especies en PET, ya que SBI tuvo un mayor número de especies raras (Fig. 3). Tales diferencias en la equidad de la abundancia entre comunidades, pueden atribuirse a que en los tipos de vegetación existe diferente disponibilidad de recursos (e.g., espacio, alimento, refugio), que ocasiona que la repartición de los mismos entre los individuos y especies no sea homogénea (e.g., Vite-Silva et al., 2010).
Obtuvimos bajos valores de similitud tanto de anfibios como de reptiles entre tipos de vegetación, que indican alta complementariedad entre ambientes. Principalmente, dichos valores fueron dados por la exclusividad de algunas especies a cierto tipo de vegetación. Por ejemplo, aunque SBI y SMS tienen una diversidad de anfibios similar, sólo comparten el 50% de sus especies. En cuestión de los reptiles, también se observó un recambio importante de especies entre los cuatro hábitats. La baja similitud en ambos grupos, puede deberse a las preferencias, requerimientos ecológicos, y/o tolerancia fisiológica de las especies particulares que componen las comunidades. Por tanto, las condiciones ambientales que imperan en los diferentes tipos de vegetación favorecerían en mayor medida a aquellas especies con más afinidad ecológica a dichas características (Cruz-Elizalde & Ramírez-Bautista, 2012; Ramírez-Bautista & Cruz-Elizalde, 2013).
Los patrones de abundancia de la herpetofauna en la RBRL varían entre ambientes y durante el año. Los picos de alta abundancia de anfibios en julio en SBI y SMS, coinciden con la temporada de lluvias en la región, cuando la disponibilidad de agua brinda las condiciones necesarias para la actividad y reproducción de estos organismos (Duellman & Trueb, 1994). Por otro lado, las mayores abundancias de anfibios en PET sucedieron en los meses más secos (enero y marzo). Esto se debió a la agregación de individuos alrededor de los cuerpos de agua permanentes, posiblemente como refugio de la sequía, que permitió detectar y contabilizar a los individuos con mayor facilidad.
Los picos de mayor abundancia de reptiles en SBI y SMS fueron registrados en Mayo (uno de los meses más cálidos en la región), principalmente por el incremento en la abundancia de lagartijas. Posiblemente las condiciones climáticas beneficiaron la actividad de ciertas especies para termorregular y alimentarse. Los picos de abundancia de reptiles en DUN fueron dados por S. cozumelae, uno de ellos septiembre, mes que coincide con la época reproductiva de la especie (Ramírez-Bautista et al., 2020). Sin embargo, considerando las limitaciones y vacíos de información de la biología de S. cozumelae, recomendamos estudios de dicha especie para comprender mejor sus patrones de abundancia.
Nuestros resultados indican que los tipos de vegetación estudiados albergan un considerable número de especies de reptiles endémicos y en riesgo. Por otro lado, pocas especies de anfibios se encuentran en alguna categoría de riesgo y/o son endémicas, posiblemente debido a que la mayoría presentes en la zona tienen amplia distribución (Köhler, 2011). Cabe destacar que el método EVS fue el más informativo sobre el estado de conservación de los anfibios y reptiles; ya que muchas de las especies aquí registradas no se encuentran en la NOM-059 o no están evaluadas de acuerdo a la IUCN, principalmente por datos insuficientes. Esto sugiere que las categorías de conservación de acuerdo a las dos últimas herramientas mencionadas, pudieran ser deficientes o estar subestimadas para algunas especies; lo cual también se ha observado en otros estudios en el país (e.g., Gutiérrez-Suárez et al., 2022).
Las dos especies introducidas (Anolis sagrei y Hemidactylus frenatus) están bien establecidas y distribuidas en la mayoría de los tipos de vegetación. Éstas podrían ocasionar daños ecológicos en la RBRL (e.g., competencia y depredación de especies nativas; Kraus, 2009), por lo que consideramos importante plantear estudios para determinar sus posibles impactos negativos en la Reserva.
Finalmente, cabe recalcar que nuestros datos de campo fueron recolectados hace 17 años. Por lo tanto, nuestros resultados deben interpretarse en el contexto del tiempo en que fueron obtenidos, ya que los posibles cambios ocurridos en la cobertura vegetal de la RBRL desde entonces a la fecha (ver Chiriguchi-Murayama & Salinas-Peba, 2017), pudieran tener un efecto en los patrones actuales de la estructura de las comunidades de anfibios y reptiles. No obstante, la información presentada en esta investigación puede servir como punto de referencia para estudios herpetológicos futuros en la zona.
Conclusiones
Esta contribución ofrece un conocimiento más profundo sobre los patrones de diversidad de los anfibios y reptiles en la RBRL, resaltando la importancia de los cuatro ecosistemas más representativos de la Reserva para la conservación de estos grupos en la región.
Nuestros hallazgos sugieren que SBI y SMS, son los ambientes más ricos y abundantes en especies para la conservación de anfibios, al albergar la mayor diversidad de especies. Sin embargo, para poder mantener la mayor diversidad de reptiles, es necesario considerar como complementarios los cuatro tipos de vegetación. La heterogeneidad ambiental que produce el mosaico de asociaciones vegetales en la RBRL, ofrece una amplia variación de microhábitats con características particulares en cada tipo de vegetación que satisfacen los requerimientos de diferentes especies de anfibios y reptiles; por lo que la diversidad, estructura de las comunidades y composición de especies de estos organismos no son homogéneas entre los tipos de vegetación estudiados.
El método EVS fue la herramienta más informativa para la evaluación del estado de conservación de las especies, por lo que debería ser tomado en cuenta por los tomadores de decisiones como método complementario para diagnosticar objetivamente el estado de las demás especies que habitan en la RBRL, así como en otras reservas del país.
Resaltamos la importancia de realizar más estudios para la conservación de anfibios y reptiles en la RBRL, especialmente sobre aquellas especies poco estudiadas, y los posibles impactos negativos de la herpetofauna introducida sobre la fauna nativa de la región.











 nueva página del texto (beta)
nueva página del texto (beta)



