Introducción
Desde tiempos remotos, la humanidad ha considerado a los hongos silvestres una valiosa fuente de alimento y medicina. Antiguos pobladores reconocían las propiedades nutricionales y funcionales de los hongos, mismas que han sido comprobadas por diversas investigaciones científicas que han demostrado que su composición nutricional consiste en un alto contenido de proteínas, vitaminas, fibra y bajos niveles de grasa (Chaturvedi et al. 2018). Adicional a su valor nutrimental, muchos hongos silvestres presentan compuestos biológicamente activos tales como los compuestos fenólicos con propiedades antioxidantes, antimicrobianas, antivirales, anticancerosas, entre otras (Golak-Siwulska et al. 2018; Gebreyohannes et al. 2019). También se sabe que la composición química de los hongos varia de una especie a otra, así como del sustrato donde crecen, de su estadio de desarrollo, temperatura, humedad, entre otras variables geográficas y ambientales e incluso de la forma en que se preparan para su consumo (Guillamón et al. 2010; Sánchez 2017). Se estima que en el mundo hay 2300 especies de hongos silvestres comestibles y medicinales (Islam et al. 2019; Martínez-Medina et al. 2021). En México 450 especies son consumidas (Pérez-Moreno et al. 2020) y 350 son usadas en la medicina tradicional de los diferentes grupos originarios que habitan el país, quienes las utilizan para el tratamiento de más de 150 enfermedades (Bautista-González y Herrera-Campos 2019).
De entre toda la gama de compuestos bioactivos que producen los hongos se destacan los fenoles, reconocidos por su remarcada capacidad antioxidante (Barros et al. 2007; Yahia et al. 2017; Novaković et al. 2020), importante para combatir enfermedades producidas por el estrés oxidativo (Valencia-Avilés et al. 2017) como cáncer, enfermedades cardiovasculares y neurodegenerativas, deterioro del sistema inmunológico, enfermedades hepáticas, diabetes mellitus, inflamación, entre otras (Halliwell 1994; Sánchez 2017; Islam et al. 2019).
Debido al gran potencial antioxidante que tienen muchos hongos comestibles silvestres, puedenrepresentar una alternativa natural para prevenir y/o tratar daños causados por el estrés oxidativo, por lo que llevar a cabo investigaciones que ayuden a conocer la concentración y composición de compuestos fenólicos, así como la evaluación de su actividad antioxidante cobra cada día más relevancia. No obstante, a pesar de que México es un país con gran tendencia micófaga, los estudios realizados sobre la composición química y actividad biológica de hongos comestibles silvestres aún son escasos. Al respecto se ha determinado la concentración de compuestos fenólicos totales y se ha evaluado la actividad antioxidante de los hongos comestibles silvestres: Agaricus sp., Boletus sp., Macrolepiota sp. (Alvarez-Parrilla et al. 2007), Amanita caesarea, Cantharellus cibarius, Ramaria sp. (López-Vázquez et al. 2017), Hygrophorus sordidus, Agaricus arvensis, Boletus frostii, Ramaria flava, Lycoperdon perlatum, Boletus luridus, Hypomyces lactiflorum (Yahia et al. 2017), Boletus edulis, Lactarius indigo (López-Vázquez et al. 2017; Yahia et al. 2017) y Morchella vulgaris (Moctezuma-Pérez et al. 2017), lo que significa que de las 450 especies de hongos consumidas solo el 3.5 % han sido estudiadas.
El objetivo de este estudio fue determinar la composición química, cuantificar el contenido de fenoles totales y evaluar la actividad antioxidante de seis especies de hongos comestibles silvestres que crecen en el Área de Protección de Flora y Fauna Nevado de Toluca. Este estudio compara la presencia de compuestos bioactivos y la actividad antioxidante en extractos obtenidos con solventes de diferente polaridad.
Materiales y métodos
Material biológico
Las especies de hongos comestibles silvestres seleccionadas para llevar a cabo este estudio fueron Amanita rubescens, Flammulina mexicana, Floccularia aff. luteovirens, Gyromitra sp., Morchella sp., y Turbinellus floccosus, obtenidos del Área de Protección de Flora y Fauna Nevado de Toluca, localizado en la porción centro sur del Estado de México, dentro de la Faja Volcánica Transmexicana (19° 06´ 06´´ N 99° 46´ 03´´ W). Para esta región se han reportado 77 especies de hongos comestibles silvestres, utilizadas localmente para autoconsumo y venta en mercados regionales (Franco-Maass et al., 2012).
Los esporomas fueron recolectados de junio a septiembre de 2017 y 2018 a partir de un muestreo dirigido con la información obtenida de pobladores locales. Los esporomas recolectados fueron llevados al Laboratorio de Micología del Centro de Investigación en Recursos Bióticos de la Universidad Autónoma del Estado de México, donde se realizó la identificación taxonómica de las especies mediante la caracterización macro y micromorfológica con ayuda de las aportaciones de Franco-Maass et al. (2012). Los ejemplares caracterizados fueron depositados en el herbario del mismo laboratorio. Posteriormente se deshidrataron a 65 °C por 72 h (Medinilla et al. 2010), y se molieron en un procesador de alimentos Magic Bullet Deluxe® para la obtención de extractos.
Obtención de extractos
Para la obtención de extractos se utilizaron cuatro solventes de diferente polaridad (agua destilada estéril, metanol, acetato de etilo y hexano), siguiendo el método propuesto por Barros et al. (2007). Se maceraron 10 g de hongo deshidratado y molido con 100 mL de cada solvente y se incubaron durante 24 h con agitación a 25 °C y 150 rpm. Posteriormente, los extractos se filtraron con papel Whatman No. 4 y los residuos se volvieron a extraer dos veces más siguiendo el mismo procedimiento. Finalmente, los extractos de cada especie fúngica se combinaron y se concentraron en rotavapor a 50 ºC, a excepción de los extractos acuosos que fueron liofilizados.
A cada uno de los extractos se les practicó un análisis preliminar micoquímico siguiendo el método de Domínguez (1988) para determinar la presencia de flavonoides, saponinas, taninos, quinonas, cumarinas y azucares reductores.
Determinación de compuestos fenólicos totales
La concentración de compuestos fenólicos totales de los extractos fúngicos se determinó por espectrofotometría, de acuerdo con lo propuesto por Turkoglu et al. (2007), con algunas modificaciones. Se añadió 1 mL de extracto fúngico (200 µg/mL) a 46 mL de agua destilada y se le adicionó 1 mL de reactivo de Folin-Ciocalteu, después de tres minutos de agitación en vortex se adicionaron 3 mL de Na2CO3 al 2% y se incubó en agitación a temperatura ambiente por 90 min para después medir la absorbancia en un espetrofotómetro a 760 nm (BOECO S-20 Vis, Germany). Todos los ensayos se realizaron por triplicado. La concentración de compuestos fenólicos totales se calculó mediante la ecuación generada por la regresión lineal de la curva de calibración de una solución estándar de ácido gálico (Sigma®) de 100 µg/mL. Los resultados fueron expresados en mg de ácido gálico equivalentes por 100 gramos de hongo seco (mg AGE/100 g hs).
Evaluación de la actividad antioxidante
La actividad antioxidante se evaluó por el método de captación de la actividad de radicales libres en DPPH (2,2-difenil-1-picrilhidrazil), siguiendo el método de Devi et al. (2008), con algunas modificaciones. Se mezclaron 100 µL de cada uno de los extractos fúngicos a diferentes concentraciones (50, 100, 150, 200, 250 y 500 µg/mL) con un mL de DPPH (Sigma®) 6x10-5 M disuelto en metanol, cada reacción se mezcló en vortex y se incubó por 30 min en oscuridad a temperatura ambiente. Posteriormente se midió la absorbancia a 517 nm en un espectrofotómetro (BOECO S-20 Vis, Germany), utilizando metanol como blanco. Se utilizaron las mismas concentraciones de terbutil hidroquinona (TBHQ) y α-tocoferol como controles positivos. La actividad antioxidante se expresó como porcentaje de inhibición lo cual corresponde a la cantidad de radical DPPH neutralizado por el extracto a una determinada concentración, de acuerdo a la ecuación:
Donde A = Absorbancia del blanco y A1 = Absorbancia de la muestra.
Los porcentajes de inhibición obtenidos se graficaron contra la concentración de extracto y se calculó la concentración inhibitoria media (IC50) a partir de la ecuación generada por la regresión logarítmica en el gráfico.
Finalmente, se calculó el coeficiente de correlación (r) entre la concentración de compuestos fenólicos totales y la actividad antioxidante.
Análisis estadístico
Para detectar diferencias entre variables, los datos de concentración de compuestos fenólicos fueron analizados con un ANOVA de una vía y los datos obtenidos de la actividad antioxidante se analizaron con un ANOVA de dos vías, seguido de una prueba a posteriori de comparación de medias de Tukey, utilizando el software Statgraphics® Centurion XVIII (Statpoint Technologies, Inc., 2018).
Análisis preliminar micoquímico
En la Tabla 1 se muestran los resultados del análisis preliminar micoquímico, el cual permitió conocer los metabolitos secundarios presentes en las seis especies de hongos comestibles silvestres investigadas. En extractos acuosos y metanólicos se encontraron la mayoría de los grupos químicos buscados. Al respecto, estudios han reportado que el solvente utilizado para la obtención de extractos tiene un efecto importante en la detección y cuantificación de compuestos bioactivos en hongos (Wang y Xu 2014; Pumtes et al. 2016; Yahia et al. 2017). Se ha encontrado que solventes polares tienen mayor eficiencia de extracción, sugiriendo que la mayoría de los compuestos bioactivos presentes en los hongos tienen polaridad alta (Boonsong et al. 2016).
Tabla 1 Análisis preliminar micoquímico de extractos de seis especies de hongos comestibles silvestres
| Especie | Grupo químico 1 | |||||
| Flavonoides | Saponinas | Taninos | Quinonas | Cumarinas | Azúcares reductores | |
| Amanita rubescens | Ac | Ac/M/AE/H | nd | Ac/M/H | Ac/M/AE/H | Ac/M/H |
| Flammulina mexicana | M | M/AE/H | Ac | Ac/M/H | M/AE | Ac/M/H |
| Floccularia aff. luteovirens | nd | AE | nd | Ac/M/H | AE | Ac/M |
| Gyromitra sp. | Ac | Ac/M/AE/H | Ac/M/AE | H | Ac/M/AE/H | Ac/M/H |
| Morchella sp. | nd | AE | nd | Ac/H | Ac/AE | nd |
| Turbinellus floccosus | Ac/M | Ac/M/AE/H | Ac/M/AE | Ac/M/H | Ac/M/AE/H | nd |
1Grupo químico detectado (Ac=agua, M=metanol, AE=acetato de etilo, H=hexano) o no detectado (nd).
Como se observa en la Tabla 1, en los diferentes extractos fúngicos existe presencia de saponinas, quinonas y cumarinas. En extractos de F. mexicana y Gyromitra sp., se encontró además la presencia de flavonoides, taninos y azúcares reductores. En algunas especies como A. rubescens, F. aff. luteovirens y Morchella sp. no se detectaron taninos y en las últimas dos especies mencionadas tampoco se encontraron flavonoides. Lo encontrado en este trabajo es el primer reporte de la composición química de las especies de hongos comestibles estudiadas.
Compuestos fenólicos totales
Los compuestos fenólicos son considerados los principales compuestos antioxidantes en hongos comestibles silvestres (Choi y Sapers 1994; Athanasakis et al. 2013; Wang y Xu 2014), razón por la cual seha estudiado su presencia y concentración en diversos hongos, con la finalidad de encontrar fuentes naturales de antioxidantes o compuestos que puedan ser utilizados como blancos farmacéuticos (Elmastas et al. 2007; Soares et al. 2009; Kozarski et al. 2015; Yahia et al. 2017; Islam et al. 2019).
Para todos los hongos comestibles silvestres estudiados, los extractos obtenidos con agua y metanol exhiben concentraciones de fenoles totales significativamente más altas que los extractos obtenidos con acetato de etilo y hexano. Los resultados presentados en la Tabla 2 muestran que la mayor concentración de compuestos fenólicos se encuentra en extractos acuosos de Morchella sp. (19.86 mg AGE/100g hs), Gyromitra sp. (18.65 mg AGE/100g hs) y F. aff. luteovirens (17.84 mg AGE/100g hs), con diferencias estadísticas significativas (p<0.05) con el resto de los extractos, mientras que la menor concentración se encuentra en extractos acetílicos de T. floccosus (3.20 mg AGE/100g hs) (F27,83=220.69, p< 0.0000). Al respecto, Wang y Xu (2014), encontraron que extractos acuosos de 20 hongos comestibles de China tienen valores significativamente más altos de fenoles totales que otros solventes como acetona y etanol.
Tabla 2 Concentración de compuestos fenólicos totales de seis especies de hongos comestibles silvestres
| Especie | Compuestos fenólicos totales (mg AGE/100g hs) 1 | |||
| Agua | Metanol | Acetato de etilo | Hexano | |
| Amanita rubescens | 11.82 ± 1.00 A,d | 10.54 ± 0.77 A,def | 4.32 ± 0.55 B,bc | 4.36 ± 0.55 B,d |
| Flammulina mexicana | 16.64 ± 0.45 A,bc | 12.78 ± 0.51 B,bc | 4.73± 0.35 D,bc | 8.13 ± 0.41 C,b |
| Floccularia aff. luteovirens | 17.84 ± 0.40 A,b | 14.87 ± 0.30 B,a | 3.6 ± 0.68 D,c | 7.97 ± 0.20 C,b |
| Gyromitra sp. | 18.65 ± 0.45 A,ab | 11.98 ± 0.36 B,cd | 5.77± 0.56 C,ab | 6.61 ± 0.61 C,bc |
| Morchella sp. | 19.86 ± 1.00 A,a | 13.59 ± 0.75 B,ab | 6.89 ± 1.17 D,a | 8.85 ± 1.04 C,a |
| Turbinellus floccosus | 9.25 ± 0.55 B,e | 11.34 ± 0.35 A,cde | 3.20 ± 0.20 D,c | 5.96 ± 0.35 C,cd |
1Datos expresados como medias ± SD de tres repeticiones. Medias con diferente letra mayúscula (A-D) en la misma fila son significativamente diferentes (p < 0.05, ANOVA, Tukey-HSD). Medias con diferente letra minúscula (a-f) en la misma columna son significativamente diferentes (p < 0.05, ANOVA, Tukey-HSD).
En este trabajo se presenta por primera vez la cuantificación de fenoles totales para las seis especies de hongos comestibles de estudio en el Estado de México. Al respecto, Kouassi et al. (2016), estudiaron el contenido de compuestos fenólicos de A. rubescens en Costa de Marfil, encontrando una concentración de fenoles totales de 139.80 mg AGE/100g hs en extractos metanólicos, mientras que en este estudio en la misma especie se encontraron 10.54 mg AGE/100g hs en extractos obtenidos con el mismo solvente. Estudios sugieren que la biogénesis de metabolitos secundarios en hongos está condicionada principalmente por el tipo de nutrientes que conforman el sustrato y las condiciones climáticas que los rodean, por lo que la región y los diferentes sustratos donde crecen y se desarrollan los hongos pueden alterar y cambiar su metabolismo, generando diferencias en la presencia de compuestos bioactivos y su concentración (Jong y Birmingham 1992; Sánchez 2017)
A pesar de que en el análisis micoquímico de Morchella sp. sólo se detectaron tres grupos químicos, en el ensayo de Folin-Ciocalteu este hongo tiene las concentraciones más altas de fenoles totales en tres de los cuatro solventes utilizados con 19.86, 6.89 y 8.85 mg AGE/100g hs en extractos en agua, acetato de etilo y hexano respectivamente. Esto es importante si se considera que el género Morchella es uno de los más apreciados por su alta demanda en el mercado internacional tanto por su sabor, como por sus propiedades nutricionales y funcionales (Moctezuma-Pérez et al. 2017), lo cual resalta con los resultados obtenidos en este estudio. Gursoy et al. (2009), estudiaron el contenido de fenoles totales de siete especies del género Morchella en Turquía, encontrando la mayor concentración en extractos metanólicos de M. conica (25.38 μg AGE/mg extracto) y la menor concentración en M. deliciosa (12.36 μg AGE/mg extracto). Para el resto de las especies no se reportan valores, por lo que el presente estudio es el primer reporte sobre concentración de compuestos fenólicos totales.
Actividad antioxidante
Los antioxidantes son compuestos capaces de inhibir la iniciación y/o propagación de las reacciones en cadena de los radicales libres, causantes de daño oxidativo que juegan un papel importante en diversas enfermedades como el cáncer, además de estar asociados al proceso de envejecimiento (Valko et al. 2007; Athanasakis et al. 2013; Islam et al. 2019). Los antioxidantes presentes en la dieta tienen gran relevancia al considerarse elementos benéficos e indispensables para la salud. Es así como los hongos cobran importancia y han sido objeto de numerosas investigaciones que correlacionan la concentración de compuestos fenólicos con la actividad antioxidante in vitro (Cheung et al. 2003; Athanasakis et al. 2013; Sánchez y Liedo 2017). De la diversidad de métodos para evaluar la actividad antioxidante, el más empleado en hongos ha sido el de captación de radicales libres DPPH, que con diversas modificaciones ha demostrado que los hongos son excelentes antioxidantes (Sánchez y Liedo 2017).
En este trabajo se midió la actividad antioxidante de los extractos fúngicos y dos controles (TBHQ y α-tocoferol) a seis diferentes concentraciones de 50 a 500 µg/ mL. En la Figura 1 se observa que los porcentajes de inhibición aumentan a medida que aumenta la concentración de extracto. La mayor actividad antioxidante se encontró en extractos acuosos y metanólicos con porcentajes de inhibición mayores al control TBHQ pero menores al control α-tocoferol. Extractos hexánicos y en acetato de etilo mostraron la menor actividad antioxidante con porcentajes de inhibición menores que ambos controles.
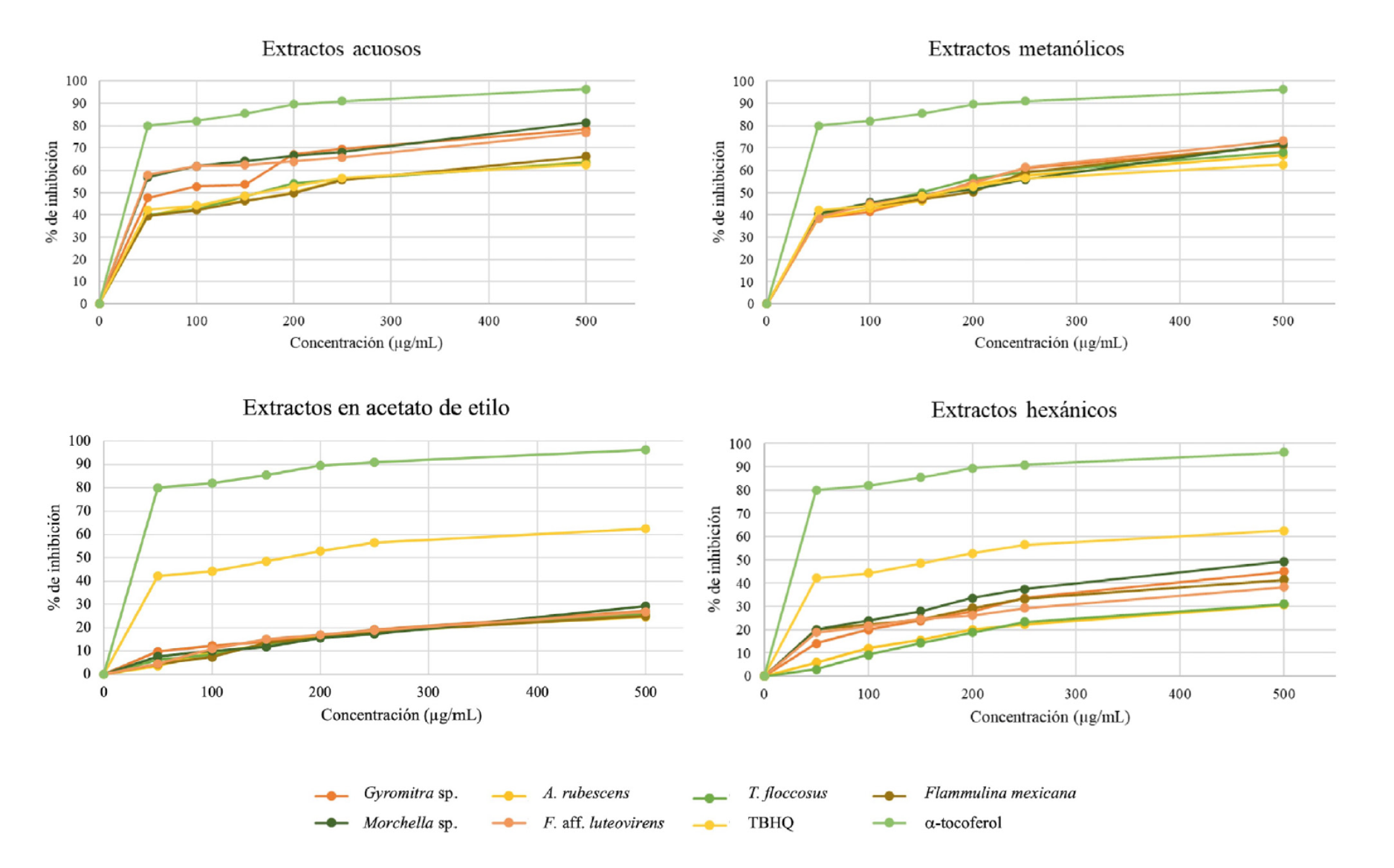
Figura 1 Evaluación de la actividad antioxidante por el método DPPH. Porcentaje de inhibición de seis concentraciones (50-500 µg/mL) de extracto fúngico, terbutil hidroquinona (TBHQ) y α-tocoferol.
En la Tabla 3 se muestran los resultados expresados como porcentaje de inhibición en la concentración más alta de extracto (500 µg/mL). En extractos acuosos, Morchella sp. (81.3 %), Gyromitra sp. (78.2 %) y F. aff. luteovirens (76.8 %) tienen la mayor actividad antioxidante. En extractos metanólicos, F. aff. luteovirens (73.3 %) tuvo el mayor porcentaje de inhibición, seguido de Morchella sp. (72 %) y F. mexicana (71.5 %). El porcentaje de inhibición del resto de las especies es comparable estadísticamente con la del control TBHQ (62.5 %).
Tabla 3 Actividad antioxidante de seis especies de hongos comestibles silvestres
| Especie | Actividad antioxidante (% de inhibición) 1 | |||
| Agua | Metanol | Acetato de etilo | Hexano | |
| Amanita rubescens | 63.7± 0.00 B,de | 66.8± 0.00 A,bc | 24.7± 0.00 D,de | 30.7± 0.00 C,g |
| Flammulina mexicana | 66.1± 0.00 B,d | 71.5± 0.00 A,b | 25.0± 0.00 D,de | 41.5± 0.00 C,de |
| Floccularia aff. luteovirens | 76.8± 0.00 A,bc | 73.3± 0.00 B,b | 26.8± 0.00 D,cd | 38.3± 0.00 C,ef |
| Gyromitra sp. | 78.2 ± 0.00 A,bc | 71.0± 0.00 B,b | 27.2± 0.00 D,cd | 45.0± 0.00 C,d |
| Morchella sp. | 81.3± 0.00 A,b | 72.0± 0.00 B,b | 29.2± 0.00 D,c | 49.3± 0.00 C,c |
| Turbinellus floccosus | 63.1± 0.00 B,de | 68.2± 0.00 B,bc | 25.8± 0.00 D,de | 31.0± 0.00 C,g |
| TBHQ | 62.5± 0.00 de | 62.5± 0.00 de | 62.5± 0.00 b | 62.5± 0.00 b |
| α-tocoferol | 96.3± 0.00 a | 96.3± 0.00 a | 96.3± 0.00 a | 96.3± 0.00 a |
1Datos expresados como medias ± SD de tres repeticiones a una concentración de 500 μg/mL. Medias con diferente letra mayúscula (A-D) en la misma fila son significativamente diferentes (p < 0.05, ANOVA, Tukey-HSD). Medias con diferente letra minúscula (a-g) en la misma columna son significativamente diferentes (p < 0.05, ANOVA, Tukey-HSD). Terbutil hidroquinona (TBHQ) y α-tocoferol como controles.
Extractos en acetato de etilo y hexano presentaron porcentajes de inhibición menores a ambos controles. Sin embargo, los extractos hexánicos tuvieron mayor actividad antioxidante que los acetílicos con diferencias estadísticamente significativas (p<0.05). Morchella sp. tuvo la mayor actividad antioxidante con porcentajes de inhibición de 49.3 % en hexano y 29.2 % en acetato de etilo, mientras que A. rubescens tuvo los porcentajes de inhibición más bajos para extractos hexánicos (30.7 %) y acetílicos (24.7 %) (F167,503=315.98, p< 0.0000).
Existe una correlación positiva (r=0.925) entre la concentración de fenoles totales y la actividad antioxidante, al ser los extractos acuosos de Morchella sp., Gyromitra sp. y F. aff. luteovirens los que presentaron la mayor concentración de compuestos fenólicos totales y los mayores porcentajes de inhibición en el ensayo de actividad antioxidante in vitro DPPH, mientras que los extractos de hexano y acetato de etilo de A. rubescens presentan las concentraciones más bajas de fenoles totales y actividad antioxidante.
En la Tabla 4 se compara la concentración inhibitoria media (IC50), que corresponde a la concentración de extracto necesaria para inhibir el 50 % del radical DPPH. Los extractos acuosos y metanólicos presentan valores de IC50 menores o iguales a 200 µg/mL, por el contrario, los valores de IC50 de extractos en acetato de etilo y hexano exceden los 500 µg/mL. Extractos acuosos de T. floccosus (160 µg/mL) y extractos metanólicos de T. floccosus (150 µg/mL), Morchella sp. (160 µg/mL) y F. aff. luteovirens (162 µg/mL), presentan valores de IC50 iguales o cercanos a los del control TBHQ (160 µg/mL). Los extractos acuosos de Morchella sp., F. aff. luteovirens y Gyromitra sp., con IC50 de 41 µg/mL, 42 µg/mL y 78 µg/mL respectivamente resultan ser los más promisorios desde el punto de vista de su actividad antioxidante al tener los IC50 más bajos.
Tabla 4 Concentración Inhibitoria media (IC50) obtenida para cada extracto evaluado por el método de captación de radicales libres DPPH
| Especie | IC50 (μg/mL)1 | |||
| Agua | Metanol | Acetato de etilo | Hexano | |
| Amanita rubescens | 200 | 180 | 7332 | 3181 |
| Flammulina mexicana | 200 | 200 | 7332 | 1517 |
| Floccularia aff. luteovirens | 42 | 162 | 6003 | 2728 |
| Gyromitra sp. | 78 | 175 | 14765 | 871 |
| Morchella sp. | 41 | 160 | 7332 | 650 |
| Turbinellus floccosus | 160 | 150 | 9897 | 2301 |
| TBHQ | 160 | 160 | 160 | 160 |
| α-tocoferol | 25 | 25 | 25 | 25 |
1Valores obtenidos a partir de la ecuación generada por la regresión logarítmica en el gráfico de porcentaje de inhibición contra concentración de extracto del ensayo DPPH (R2=0.98). Terbutil hidroquinona (TBHQ) y α-tocoferol como controles.
Sobresale el potencial antioxidante de Morchella sp., que tuvo la mayor concentración de fenoles totales, el porcentaje de inhibición más alto por medio de la reacción de DPPH y el menor IC50 en tres de los cuatro solventes utilizados, siendo el agua, el solvente de extracción más eficiente para este ensayo. Al respecto, Moctezuma-Pérez et al. (2017) evaluaron las propiedades nutracéuticas incluyendo la actividad antioxidante de extractos acuosos y metanólicos de la especie mexicana Morchella vulgaris encontrando mayor actividad antioxidante en extractos acuosos con un porcentaje de 43.23 %, por lo que el porcentaje de 81.3 % encontrado en este trabajo es significativamente mayor.
Para A. rubescens se han encontrado porcentajes de inhibición de 67.17 % (Kouassi et al. 2016) y de 91.31 %(Keles et al. 2011) en extractos metanólicos, mientras que en el presente, el porcentaje para la misma especie en extractos metanólicos es de 66.8 %. Para el resto de las especies, no se reportan estudios previos, ya que la mayoría de los trabajos están enfocados en conocer y evaluar la actividad antioxidante y otras propiedades medicinales y nutricionales de los principales hongos comestibles y medicinales cultivados, dejando de lado el estudio de las especies silvestres a pesar de que en el centro de México son utilizadas tradicionalmente como alimento y medicina, o bien, como una fuente de ingresos en la temporada de lluvias.
Especies como A. rubescens, T. floccosus, Gyromitra sp., y Morchella sp. forman parte de la dieta y del conocimiento micológico tradicional de los habitantes de diferentes municipios de los Estados de México (Mariaca et al. 2001; Estrada-Martínez et al. 2009; Aguilar-Cruz y Villegas 2010; Burrola-Aguilar et al. 2012), Oaxaca (Garibay-Orijel et al. 2009; Zamora-Martínez et al. 2014) y Tlaxcala (Montoya et al. 2019) por mencionar algunos, lo que evidencia la necesidad de continuar con estudios más profundos de la composición química de estas especies, que permitan encontrar moléculas con posibles propiedades medicinales y funcionales.
Es de interés mencionar al género Gyromitra, cuya comestibilidad ha causado controversia. Algunas especies son consideradas tóxicas, por la producción del compuesto giromitrina y debido a su difícil identificación, muchas veces son mezcladas las especies tóxicas y no tóxicas (Lima et al. 2012). No obstante, evidencia reciente cataloga a las especies de este género como comestibles bajo ciertas condiciones (Li et al. 2021), ya que la giromitrina es una molécula soluble en agua y volátil, los hongos pueden ser consumidos sin riesgo de intoxicación al ser hervidos en agua durante mucho tiempo y permitiendo su secado (Lima et al. 2012), técnica que forma parte del conocimiento tradicional de las personas que consumen este hongo. Por lo que la alta actividad antioxidante que presentó esta especie puede ser aprovechada.
Adicionalmente, las especies de hongos comestibles silvestres Flammulina mexicana y Floccularia aff. luteovirens del Área de Protección de Flora y Fauna Nevado de Toluca, han sido estudiadas con fines de cultivo experimental (Arana-Gabriel et al. 2014, 2019, 2020), con la obtención de fructificaciones de F. mexicana (Arana-Gabriel et al. 2020), por lo que el conocimiento de sus propiedades antioxidantes da un valor agregado al consumo de estas especies y permite ampliar el número de hongos comestibles cultivados para una futura comercialización y contar con nuevas alternativas que permitan promover el consumo de hongos.
Conclusión
Químicamente, los hongos comestibles silvestres estudiados: Amanita rubescens, Flammulina mexicana, Floccularia aff. luteovirens, Gyromitra sp., Morchella sp., y Turbinellus floccosus presentan flavonoides, saponinas, quinonas, cumarinas y azucares reductores.
Solventes de elevada polaridad como el agua y el metanol resultan ser más eficientes que el hexano y el acetato de etilo para la extracción de compuestos bioactivos polares en hongos. Ya que es en este tipo de solventes donde se encuentran las concentraciones más altas de compuestos fenólicos totales y la mayor actividad antioxidante.
Los extractos acuosos de Morchella sp., Gyromitra sp. y Floccularia aff. luteovirens resultaron ser los más promisorios al presentar las mayores concentraciones de compuestos fenólicos totales, la mayor actividad antioxidante in vitro y los valores más bajos de IC50 por lo que pueden ser considerados como una potencial fuente de antioxidantes naturales.
En México, los estudios sobre la composición química y las propiedades antioxidantes de hongos comestibles silvestres aún son muy escasos y los resultados de este trabajo contribuyen al conocimiento de la actividad biológica de los compuestos bioactivos presentes en hongos silvestres. Tomando en cuenta los resultados obtenidos, estos hongos pueden ser considerados como complemento de la dieta, ya que al tener importantes propiedades antioxidantes pueden presentar beneficios en la salud de quien los consume.











 nueva página del texto (beta)
nueva página del texto (beta)



